Фармацевтическая композиция и способ стимулирования иммунного ответа к мусоbacterium avium подвида paratuberculosis
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической композиции и способа стимулирования иммунного ответа против Mycobacterium avium подвида paratuberculosis (MAP) у млекопитающего. Композиция включает рекомбинантный полипептид, содержащий, от N-конца к С-концу: С-концевой фрагмент белка МАР_3527, аминокислотную последовательность белка МАР_1519, а затем N-концевой участок белка МАР_3527. Способ включает введение фармацевтической композиции животным в количествах, достаточных для стимулирования иммунного ответа против MAP. Группа изобретений обеспечивает ликвидацию, либо замедление пролиферации MAP в течение периода инфекции. 2 н. и 16 з.п. ф-лы, 3 пр., 31 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к стимулированию иммунологических ответов, в частности, к фармацевтическим композициям и способам для стимулирования профилактического и/или терапевтического иммунного ответа против Mycobacterium avium подвида paratuberculosis.
Уровень техники
Mycobacterium avium подвида paratuberculosis (далее MAP) является этиологическим фактором болезни Джона, болезни которую первым исследовал и описал (в 1907 г.) немецкий этимолог Хайнрих Йоне), которая вызывает хронический гранулематозный энтерит крупного рогатого скота. У животных с клиническими проявлениями заболевания развивается хроническая диарея и прогрессирующая потеря веса, которая в конечном итоге приводит к смерти, в то время как субклинически инфицированные животные производят меньше молока. Болезнь Джона имеет огромное экономическое значение для мировой молочной промышленности, являясь причиной основных потерь из-за пониженной продукции и ранней выбраковки животных, по оценкам около 20% молочного стада поражено заболеванием, что приносит убыток молочной промышленности 220 миллионов долларов в год (Wells, и соавт. 2000. J. Am. Vet. Med. Assoc.216: 1450-1457). Крупный рогатый скот наиболее восприимчив к инфекции этим организмом в первые 6 месяцев жизни, но заболевание обычно не проявляется раньше возраста 3 или 5 лет. Инфицирование происходит при проглатывании зараженного навоза, молозива или молока от инфицированных коров (Sweeney, 1996. Vet. Clin. N. Am. Food Anim. Pract. 12:305-312). Также происходит внутриутробное заражение, особенно у беременных коров, имеющих прогрессирующее заболевание (Sweeney, и соавт. 1992. Am. J. Vet. Res. 53: 477-480). Более того, важность MAP значительно возрастает из-за их потенциальной роли в качестве этиологического фактора при болезни Крона у людей (Chamberlin, и соавт. Aliment Pharmacol Ther 2001; 15(3): 337-46; Naser SA, и соавт. Mol Cell Probes 2002; 16(1): 41-8).
Одобренная в настоящее время вакцина против болезни Джона для применения в этой области представляет собой масляную суспензию убитого штамма MAP, которая имеет значительные ограничения. В первую очередь, эффективность этой вакцина является спорной, с переменными результатами в различных исследованиях вакцинации. Другая проблема представляет собой взаимное влияние всей клеточной бактериальной вакцины и диагностической пробы, поскольку вакцинированные животные проявляли ложноположительную реакцию на туберкулез и туберкулид. Таким образом, возникает необходимость в улучшенной вакцине, но она должна быть действенной и в то же время не должна мешать диагностике туберкулеза и болезни Джона. Для достижения этой цели были опробованы несколько подходов, которые включают рекомбинантные вакцины, ДНК вакцины и вакцины субъединицы 13 (Shin SJ, и соавт. Infect Immun 2005; 73(8): 5074-85). Однако, сохраняется потребность в разработке улучшенных MAP вакцин.
Раскрытие изобретения
Настоящее изобретение предлагает фармацевтические композиции и способы стимулирования иммунного ответа против MAP у млекопитающих. Композиции включают новый рекомбинантный полипептид с массой 79 кДа, обозначенный в заявке как “Map74F”. Map74F был получен сшиванием C-концевого фрагмента белка MAP_3527 с массой около 17,6 кДа с фрагментом белка MAP_1519, за которым на C-конце следует N-концевой участок белка MAP_3527 весом 14,6 кДа.
Кроме Map74F, композиции изобретения также могут включать белки MAP, такие как антигены 85A, 85B, 85C, белок с массой 35 кДа, суперокиддисмутазу (далее СОД), белки MptC, MptD и ESAT-6 подобный белок или их комбинации.
Способ включает введение композиции млекопитающим в количестве, достаточном для стимулировании иммунного ответа против MAP. Ожидается, что способ будет благоприятным для любого животного, восприимчивого к инфекции MAP, но особенно благоприятным для жвачных животных.
Фармацевтические композиции могут включать в состав стандартные фармацевтические наполнители и могут вводиться любым традиционным способом. Композиции могут назначаться в любое время животному, восприимчивому к заражению инфекцией MAP, или животному, инфицированному MAP. Однако, предпочтительно вводить композиции по изобретению до инфицирования MAP, например, введение беременным животным, которые могут доставить профилактические иммунологические компоненты своим новорожденным детям с помощью молозива, или введение в период от одной до пяти недель после рождения.
Настоящее изобретение предлагает фармацевтические композиции и способы для стимулирования иммунного ответа против MAP у животных. Композиции включают рекомбинантный полипептид, упоминаемый в заявке как Map74F. Открытая рамка считывания (ОРС), кодирующая Map74F, представляет собой 2397-членный нуклеотид и кодирует полипептид, содержащий 799 аминокислот. Последовательность полипептида Map74F приведена в SEQ ID NO: 1. Молекулярная масса Map74F, рассчитанная на основе его аминокислотного состава составляет 79 кДа, хотя реальная молекулярная масса, определенная методом SDS-PAGE анализа составляет 74 кДа. Последовательность, показанная в SEQ ID NO: 1, дается без необязательных меток для очистки, таких как гистидиновая метка.
Map74F был создан посредством сшивания, по направлению от N-конца к C-концу, C-концевого фрагмента белка MAP_3527 с массой около 17,6 кДа, фрагмента белка MAP_1519 с массой 46,8 кДа, а затем N-концевого фрагмента белка MAP_3527 с массой около 14,6 кДа. Схематическое изображение Map74F дано на Фиг.1. Полные аминокислотные последовательности MAP_3527 и MAP_1519 представлены, соответственно, как SEQ ID NO: 2 и SEQ ID NO: 3. C-концевой фрагмент белка MAP_3527 с массой 17,6 кДа, присутствующий в Map74F, представлен аминокислотами 183-361 последовательности SEQ ID NO: 2. Фрагмент MAP_1519 с массой 46,8 кДа, присутствующий в Map74F, представлен аминокислотами 1-460 последовательности SEQ ID NO: 3. N-концевой фрагмент белка MAP_3527 с массой 14,6 кДа, присутствующий в Map74F, представлен аминокислотами 33-180 последовательности SEQ ID NO: 2. Ожидается, что более длинные фрагменты MAP_1519 и N- и C-концы MAP_3527 могут быть включены в рекомбинантный белок, который мог бы применяться в способе изобретения. Помимо Map74F, фармацевтические композиции изобретения могут включать другие вещества, которые могут стимулировать иммунный ответ против MAP_бактерий. Например, композиции могут включать один или более других белков MAP, таких как антигены 85A, 85B, 85C, белок массой 35 кДа, супероксиддисмутазу (СОД), белок MptC, MptD и ESAT-6 подобный белок и их комбинации. Такие белки описаны в заявке США №11/816,365, и описание этих белков и ДНК последовательностей, кодирующих их, и способы применения белков и кодирующих их ДНК в фармацевтических композициях для стимулирования иммунного ответа против MAP включены в заявку посредством ссылки.
В одном варианте осуществления фармацевтическая композиция включает Map74F и один или более из белков MAP антигены 85A, 85B или СОД. ДНК последовательность, кодирующая ген MAP антигена 85A, и аминокислотная последовательность, соответствующая гену MAP антигена 85A, дана в GenBank, номер доступа AF280067 (запись от 10 октября, 2003). ДНК последовательность, кодирующая ген MAP антигена 85B, и аминокислотная последовательность, соответствующая гену MAP антигена 85B, дана в GenBank, номер доступа AF219121 (запись от 21 ноября, 2002). ДНК последовательность, кодирующая ген MAP антигена 85C, и аминокислотная последовательность, соответствующая гену MAP антигена 85C, дана в GenBank, номер доступа AF280068 (запись от 21 ноября, 2002). ДНК последовательность, кодирующая ген супероксиддисмутазы MAP, и аминокислотная последовательность, соответствующая гену супероксиддисмутазы MAP, дана в GenBank, номер доступа AF 180816 (запись от 30 ноября 2001).
Способ изобретения включает введение фармацевтической композиции, включающей Map74F, млекопитающим в количестве, достаточном для стимулирования иммунного ответа против MAP. Стимулированный иммунный ответ может включать стимулирование любого компонента иммунной системы, включая, но не ограничиваясь, выработку антител, реактивных к антигенам MAP, стимулирование пролиферации лимфоцитов, выработку Th 1-ассоциированных цитокинов, таких как гамма-интерферон, и комбинацию изложенного выше.
Map74F может вводиться животным в форме вектора. Например, последовательность нуклеиновых кислот, кодирующая Map74F, может быть клонирована в геном бактерии (например, Salmonella) или вируса (например, вирус бычьего герпеса - 1 (BHV-I)), и полученная рекомбинантная бактерия или вирус может вводиться животным. Таким образом, настоящее изобретение также включает бактериальные или вирусные векторы, экспрессирующие Map74F. Также в охват данного изобретения входят методологии ДНК вакцин, в которых молекулы нуклеиновой кислоты, кодирующей Map74F, вводятся непосредственно животным либо в чистом виде, либо в комбинации с вспомогательным веществом или веществом, облегчающим трансфекцию.
Способ согласно изобретению может быть благоприятным для любого животного, восприимчивого к MAP инфекции. Фармацевтические композиции и способы особенно хорошо подходят для профилактики или лечения инфекции MAP у жвачных животных, включая крупный рогатый скот, овец, коз, оленей и лосей, антилоп и буйволов, но не ограничиваясь ими. В одном варианте осуществления способ может применяться для профилактики или лечения болезни Джона.
Фармацевтические композиции могут вводиться любым инфицированным или неинфицированным MAP животным. Считается, что введение композиций инфицированным животным в соответствии со способом изобретения, стимулирует терапевтический иммунный ответ. Однако, изобретение также включает введение фармацевтических композиций изобретения до инфицирования MAP для стимулирования профилактического ответа. Например, композиции могут вводиться беременным животным, которые могут передать профилактические иммунологические компоненты своим неинфицированным новорожденным детям через молозиво или молоко во время лактации. Альтернативно, композиции могут вводиться на протяжении периода от одной до пяти недель после рождения для обеспечения профилактического эффекта, который может предотвратить инфицирование MAP или уменьшить тяжесть заболевания, если инфицирование произойдет.
Таким образом, в одном варианте осуществления способ изобретения представляет собой профилактику инфекции MAP, в то время как в другом варианте осуществления способ представляет собой лечение инфекции MAP.
Фармацевтические композиции могут формироваться вместе со стандартными фармацевтическими наполнителями и могут вводиться с помощью любого из разнообразных обычных путей введения. Некоторые примеры приемлемых фармацевтических наполнителей для применения с белками описаны в Remington's Pharmaceutical Sciences (18-е издание, A.R. Gennaro et al. Eds., Mack Publishing Co., Easton, Pa., 1990).
Фармацевтические композиции, применяемые в способе изобретения, могут также включать вспомогательные вещества. Может применяться любое стандартное вспомогательное вещество.
В одном варианте осуществления вспомогательное вещество может представлять собой монофосфорил липид A (МФЛ), который может предусматриваться в комбинации с синтетическим дикориномиколатом трегалозы. В другом варианте осуществления вспомогательное вещество можетпредставлять собой диметилдиоктадециламмонийбромид (далее ДДА). Фармацевтические композиции изобретения могут вводиться любым приемлемым способом. Подходящие способы введения включают пероральный, мукозальный и парентеральный (например, интраваскулярные, внутримышечные и подкожные инъекции). Композиции могут вводиться в любое время любому животному, восприимчивому к заражению инфекцией MAP или животному, инфицированному MAP.
Специалисту в данной области очевидно, что количество Map74F и любого другого антигенного вещества в фармацевтической композиции, вводимой конкретному животному, будет зависеть от ряда факторов, таких как способ введения, и размер, физическое состояние и статус MAP животного, и может подбираться специалистами в данной области для достижения желаемого результата. Композиции могут применяться путем одного введения или сериями введений для стимулирования иммунного ответа. В целом, может вводиться общая доза в количестве 10-200 мкг белка.
Краткое описание чертежей
Фиг.1 представляет схематическое изображение конструкции Map74F. Map74F был получен последовательным сшиванием в направлении от N к С концу открытых рамок считывания, кодирующих C-концевой фрагмент белка MAP_3527, сшитых с открытой рамкой считывания, кодирующей аминокислоты 1-460 белка MAP_1519, и терминирован открытой рамкой считывания, кодирующей N-концевой фрагмент MAP_3527. ОРС, кодирующая Map74F представляет собой 2397-членный нуклеотид, который кодирует 799-аминокислотный полипептид с предсказанной молекулярной массой около 79 кДа.
Фиг.2 представляет собой фотографию окрашенного кумасси голубым 10% SDS-PAGE электрофореза лизатов E.coli из штамма E.coli (BL21/pLysE), трансформированного экспрессирующим вектором, кодирующим Map74F. Клетки были выращены и индуцированы 1 мМ ИПТГ (изопропилтиогалактозид). Линии отображают лизаты до (линия UI) или спустя 3 часа после (линия I) индукции ИПТГ. Очищенные рекомбинанты Map74F показаны на линии Р вместе с маркером молекулярных весов (линия М).
На Фиг.3-6 показаны графические изображения данных, полученных на мышах, убитых через 3 недели после вторичной вакцинации. Клетки селезенки мышей, получавших Мар74Р + МФЛ или только МФЛ были стимулированы в течении 2 дней 10 мг/мл Map74F, КонА (конканавалин А) и средой.
На Фиг.3 представлены данные, которые показывают уровень ИФН-γ в супернатантах культур, измеренный методом твердофазного иммуноферментного анализа (ИФА).
На Фиг.4 представлены данные, которые показывают определенный методом ELIspot (иммуноферментный спот-анализ) относительный уровень ИФН-γ-экспрессирующих клеток в суспензии моноклеток селезенки иммунизированных и контрольных мышей с или без стимуляции антигеном.
На Фиг.5 представлены данные FACS (флуоресцентная сортировка клеток) анализа популяции лимфоцитов селезенки, полученные от вакцинированных (Map74F + МФЛ) и контрольных животных (МФЛ, КонА-МФЛ) после стимуляции рекомбинантными и контрольными антигенами.
На Фиг.6, представлены данные экспрессии мРНК цитокинов в ответ на Map74F, нормализованный относительно “гена домашнего хозяйства” ГАФД. Представлены данные трех независимых экспериментов.
На Фиг.7 и 8 представлены данные, полученные из сыворотки вакцинированных и контрольных животных, собранные в разное время (превакцинация/ первичная вакцинация (PV), вторичная вакцинация (В), до заражения (ВС), и 4, 8, 12, и 16 недель после заражения) и проверенные на ответ к антителам.
На Фиг.7 показаны данные для сыворотки, протестированной на присутствие специфических антител к Map74F.
На Фиг.8 показано отношение lgGl/lgG2, полученное методом ИФА. Данные отражают три независимых эксперимента.
Фиг.9-11 отражают данные экспрессии защитного иммунитета селезенки (Фиг.9), печени (Фиг.10) и мезентеричного лимфатического узла (далее МЛУ) (Фиг.11), вызванной вакцинацией Map74F + МФЛ. Map74F значительно уменьшает действие MAP в селезенке (на 8-16 неделях после заражения), печени (на 12-16 неделях после заражеия) и МЛУ (на 8-16 неделях после заражения). Представлены данные трех независимых экспериментов.
На Фиг.12-15 представлены фотографии гистопатологического исследования тканей вакцинированных и невакцинированных мышей.
На Фиг.12 показана печень невакцинированной контрольной мыши. Многочисленные большие гранулемы распределены случайно по всей печени. Гематоксилин и эозин. Толщина 100 мкм. Вставка: Большее увеличение гранулемы, демонстрирующее многочисленных кислотоустойчивых бацилл. Окрашивание по Циль-Нильсену.
На Фиг.13 показана печень мыши, вакцинированной Map74F. Видны только единичные маленькие лимфоидные комплексы, окруженные несколькими макрофагами.
На Фиг.14 показана селезенка из невакцинированной контрольной мыши, с присутствием случайных гранулем в белой пульпе.
На Фиг.15 показана селезенка мыши, вакцинированной Map74F. Белая и красная пульпы свободны от гранулем. Гематоксилиновое и эозиновое окрашивание. Толщина 100 нм. Вставка: Большее увеличение гранулемы, демонстрирующее отсутствие кислотоустойчивых бацилл. Окрашивание по Циль-Нильсену.
На Фиг.16-18 приведены данные, показывающие лимфопролиферативный отклик одноядерных периферических кровяных клеток (далее МКПК) у иммунизированных (группа I и II) и контрольных (группа III) групп животных на рекомбинантные антигены (85A, 85B, Map74F и СОД), КонА и туберкулин. Результаты выражены в виде индекса стимуляции (SI), и планки погрешностей показывают стандартное отклонение от среднего.
Фиг.19-21 отображают данные, показывающие антиген-специфичный ИФН-котклик МКПКу иммунизированных (группа I и II) и контрольных (группа III) групп животных. Результаты показаны в виде значений оптической плотности, и планки погрешностей показывают стандартное отклонение от среднего.
Фиг.22-27 отображают данные, показывающие экспрессию субпопуляции лимфоцитов в МКПК, взятых у иммунизированных (группа I и II) и контрольных (группа III) групп животных в заданное время после стимуляции рекомбинантными и контрольными антигенами и анализированные с помощью проточной цитофлюометрии. Результаты выражены, как процент клеток, дающих положительное окрашивание, относительно неиндуцированных образцов (обработанных средой). Планки погрешностей показывают стандартное отклонение от среднего значения.
Фиг.28 и 29 отображают данные, показывающие экспрессию мРНКгена цитокина в ответ на рекомбинантные антигены для иммунизированных групп (I и II) и контрольной группы (III). Результаты выражены как средняя кратность увеличения по сравнению с нестимулированным МКПК, который служит в качестве контроля. Планки погрешностей указывают на стандартное отклонение от среднего значения.
Фиг.30 отражает иммунный ответ на индивидуальные рекомбинантные антигены в вакцинированных группах животных I и II и контрольной группе животных III. Планки погрешностей указывают на стандартное отклонение от среднего значения.
Фиг.31 показывает сводку в виде таблицы результатов MAP культур (в колониеобразующих единицах, далее KOE), измеренных в различных тканях, собранных во время некропсии.
Осуществление изобретения
Следующие примеры описывают различные варианты осуществления изобретения. Эти примеры являются иллюстративными и не должны рассматриваться как ограничивающие.
Пример 1
Данный Пример предлагает описание клонирования, экспрессии и очистки Map74F.
Образование тандемсвязанной ОРС, кодирующей Map74F
Map74F был образован путем последовательного сшивания в тандем рамок ОРС C-концевого фрагмента MAP_3527 с массой 16,6 кДа с ОРС, кодирующей MAP_1519 белок, обладающий молекулярной массой 46,8 кДа, а затем на C-конце - N-концевого участка MAP_3527 с массой окло 14,6 кДа. Образование конструкции MAP_3527 с, лишенной стоп-кодона.
5' и 3' олигонуклеотиды к C-концевому MAP_3527 (MAP_3527 с) были сконструированы следующим образом: 5' (ТА CATATG CAT CAT CAT CAT CAT CAT CTC AAC CAG AGC GTC TCG GC 3'' (SEQ ID NO: 4)) и (5'' ТА GAATTC GGC CGG CGG CCC CTC CGC С 3' (SEQ ID NO: 5)). После 5' олигонуклеотида, содержащего Ndel сайт рестрикции, предшествующий ATG инициирующему кодону, следовали нуклеотидные последовательности, кодирующие шесть гистидиновых остатков (курсив). 3' Олигонуклеотид содержал EcoRI сайт рестрикции. Эти олигонуклеотиды применялись для амплифицирования MAP_3527 с, карбоксильного 540-нуклеотидного участка (14,6 кДа, 180 аминокислотных остатков) MAP_3527, и полученный ПЦР-амплифицированный продукт лигировали в ПЦР2.1 Торо вектор. Плазмидную ДНК с правильной вставкой обрабатывали Ndel и EcoRI, и лигировали в pET17b экспрессирующий вектор, расщепленный теми же ферментами. Продукты лигирования переносили в клетки Escherichia coli DH5ct и один трансформант с правильной вставкой (MAP_3527c) идентифицировали с помощью рестрикционного картирования и ДНК секвенирования.
ПЦР амплификация полноразмерных кодирующих последовательностей MAP_1519 и лигирование в MAP_3527 c-pET плазм иду.
5' и 3' олигонуклеотиды MAP_1519, содержали следующие последовательности: 5'(5'-CTA ATC GAATTC ATG TTC TAT GGG GCC TTT C-3' SEQ ID NO: 6)) и 3'(5'-TA ATC GATATC CAG GAC CTT GGA CTT GTC-3' SEQ ID NO: 7)). 5' Олигонуклеотид содержал EcoRI сайт рестрикции. 3' Оли гону клеотид содержал EcoRV сайт рестрикции, непосредственно за которым шли последовательности, включающие шесть C-концевых аминокислотных остатков, и не содержал стоп-кодона. Амплифицирование кодирующей последовательности MAP_1519 (1380 пар оснований; длиной 460-аминокислот с предсказанным размером около 46,8 кДа), и полученный ПЦР-амплифицированный продукт лигировали в ПЦР 2,1 Торо вектор, расщепленный теми же ферментами. Клон с правильной вставкой обрабатывали EcoRI и EcoRV и лигировали в предварительно обработанную ферментами EcoRI/EcoRV плазмиду MAP_3527 c-pET. Продукты лигирования затем переносили в клетки E.coli DH5α, и трансформанты с правильной вставкой (MAP_3527c-MAP_I 519) идентифицировали с помощью рестрикционного картирования и подтверждали ДНК секвенированием. Клонирование N-концевого фрагмента MAP_3527 в MAP_3527C-MAP_1519 конструкцию.
5' и 3' олигонуклеотиды N-концевого фрагмента MAP_3527 были сконструированы следующим образом: 5'(5'-AT GATATC GGG CTG GCG CCG GCG TCC-3' SEQ ID NO: 8)) и 3'(5'-AT CTCGAG TCA CGC GAC CTT GCC GGC-3' SEQ ID NO: 9)). 5' олигонуклеотид содержал EcoRV сайт рестрикции. 3' олигонуклеотид содержал Xhol сайт рестрикции. Они конструировались для того, чтобы амплифицировать N-концевой, содержащий 447-пар оснований (149-аминокислотных остатков) фрагмент MAP_3527. Полученный ПЦР-амплифицированный продукт был обработан EcoRV и Xhol, и лигирован в MAP_3527 с-MAP_1519 слитую pET плазмиду, обработанную EcoRV and Xhol. Лигирующая смесь использовалась для транформирования клеток E.coli DH5α и положительные клоны были идентифицированы рестрикционным картированием и подтверждены ДНКсеквенированием. Конечная конструкция кодирует полипептид с массой 75 кДа (Map74F), включающий единственную ОРС, организованную в линейном порядке MAP_3527C-MAP_1519-MAP_3527N. Экспрессия и очистка Map74F рекомбинантного полипептида
Конструкция плазмидной ДНК была трансформирована в клетки E.coli BL21 (DE3 pLysE). Трансформированные клетки E.coli были помещены на LB агар (среда Лурия-Бертани), дополненный ампициллином (100 мкг/мл). Каждая колония засевалась в 10 мл LB питательной среды, содержащей ампициллин (100 мкг/мл), и выращивалась при 37°C в течение ночи при встряхивании. Культура была разбавлена 1:100 LB питательной средой, содержащей ампициллин (100 мкг/мл) и хлоромицеитин (34 мкг/мл), и выращивалась при 37°C при встряхивании. Через 3 ч индукции с 1 мМ ИПТГ (Invitrogen Co, Carlsbad, CA), клетки отделяли центрифугированием (5000 g) и однократно промывали фосфатно-солевым буфером (ФСБ). Клетки суспендировали в буфере A (50 мМ ТрисHCl, 1 мМ ЭДТА, 50 мМ NaCl, pH 8,0) и лизировали в клеточном дезинтеграторе высокого давления или клеточном дезинтеграторе. После осаждения центрифугированием телец включения, осадки были трижды промыты промывочным буфером для телец включения (буфер А + 1% Triton Х-100) и дважды - буфером CHAPS (Sigma-Aldrich, St.Louis, МО) (1% CHAPS в 10 мМ ТрисHCl, pH 8,0) для удаления липополисахарида. Тельца включения растворяли в буфере В (100 мМ фосфата натрия, 10 мМ Трис-HCl, 8 М мочевины, 2 мМ PMSF (Sigma) и 20 мкг/мл леупептина (Sigma), pH 8,0) и очищали на Ni-NTA агарозной колонке (Invitrogen). Элюированные фракции исследовали с помощью SDS-PAGE электрофореза, и фракции, содержащие рекомбинантный полипептид, объединяли и диализировали против 10 мМ Трис-HCl (pH 7,8) в течение ночи при 40С° два раза. Полипептид пропускали через Detoxi-GelTM Endotoxin Removing Gel (Pierce, Rockford, IL) и очищенный полипептид исследовали на уровень эндотоксина с помощью ЛАЛ-теста (Limulus amoebocyte assay). Очищенный полипептид имел ничтожно малый уровень (10 пг/мл) эндотоксина.
На Фиг.1 дано схематическое изображение Map74F, показывающее структуру и сайты ферментативной рестрикции, используемые в конструкции полипептида. ОРС Map74F составляет 2397 нуклеотидов в длину, кодируя полипептид, состоящий из 799 аминокислот (Фиг.2), с предсказанной молекулярной массой около 79 кДа. Дизайн и конструкция ОРС вылились в введение двух шарнирных последовательностей (EcoRI и EcoKV) из шести нуклеотидов, которые кодируют две аминокислоты в каждом сайте соединения, соединяя три первоначальных ОРС. Кроме того, ОРС (Map74F) была сконструирована таким образом, что содержит шесть гистидиновых остатков на N-конце для очистки с использованием Ni-NTA матрицы. После экспрессии в E.coli, рекомбинантный полипептид был очищен от телец включения и проанализирован с помощью SDS-PAGE электрофореза (Фиг.2) с выходом в диапазоне около 1,5-2,0 мг очищенного полипептида на литр индуцированной культуры.
Пример 2
Данный пример демонстрирует применение Map74F для стимулирования иммунного ответа против MAP в модели на мышах. Было найдено, что мыши являются подходящей моделью для изучения MAP инфекции. Бактериальная нагрузка и патология специфических органов представляют хорошие показатели инфекционного статуса мышей после заражения MAP. У мышей печень, селезенка и мезентеричные лимфатические узлы являются лучшими органами для оценки бактериальной нагрузки после заражения MAP. В данном примере оценивалась нагрузка MAP на эти органы для определения эффективности защитных свойств Map74F после заражения. Из результатов, представленных ниже, очевидно, что Map74F иммунизированные животные были в состоянии либо ликвидировать, либо замедлить пролиферацию MAP в течение 16-недельного периода инфекции. В селезенке, печени и мезентеричных лимфатических узлах, число колониеобразующих единиц (KOE) уменьшалось через 8 недель после заражения, что предполагало уничтожение MAP. Кроме бактериальной нагрузки в печени и селезенке вакцинированных животных наблюдалось меньшее число гранулем и меньшее число кислотоустойчивых микроорганизмов, что указывало на защитное действие полипротеина. Значительно уменьшенная нагрузка MAP на органы и улучшение патологии печени и селезенки указывают, что иммунизация Map74F защищала мышей от инфекции MAP путем быстрого уменьшения или уничтожения нагрузки MAP. Map74F также вызывал установление высокого уровня γ-интерферона. Map74F вызывал хороший ответ T-хелперных клеток 1 типа (Th1 - ответ).
Материалы и методы Примера 2.
Животные
Эксперименты выполнялись с использованием самок мышей C57/BL6 (Harlan Sprague, Indianapolis, Indiana) в возрасте 6-8 недель. Животные содержались в лаборатории II уровня биологической безопасности и имели неограниченный доступ к пище и воде. Все экспериментальные работы проводились в соответствии с правилами, нормами и принципами законодательства об охране животных управления министерства здравоохранения по гуманному обращению и использованию лабораторных животных, применяемых для исследования, изучения и тренировки, Руководства Национальных Институтов Здоровья (NIH) по изучению и использованию лабораторных животных и Нью-Йоркского государственного управления здравоохранения.
Бактериальные штаммы
MAP выделенный из инфицированных коров, обозначенный как MAP 661 15-98, использовался для заражения мышей и для выделения геномной ДНК. MAP 661 15-98 культур провал и в среде 7Н9, с добавкой 10% олеиновая кислота - альбумин - декстроза - каталазы (Becton, Dickinson and Со, Sparks, MD) и микобактина J (Allied Monitor, Inc, Fayette, МО). После культурирования в течение 6-8 недель организмы собирали центрифугированием при 10 000 g и дважды промывали фосфатно-солевым буфером (ФСБ; pH 7,2). Микроорганизмы разбавляли ФСБ до требуемой концентрации и использовали для заражения мышей.
Иммунизация мышей
Мыши были поделены на две группы по 36 мышей в каждой группе. Животные группы I были иммунизированы дважды, с интервалом в три недели, 50 мкг/животное, рекомбинантным полипептидом вместе сэмульсией МФЛ + TDM (Ribi-адъювант, Corixa, Hamilton, МТ) в суммарном объеме 100 мкл на дозу путем подкожной инъекции в спину. Животные группы II были оставлены в качестве невакцинированного контроля, им вводили только эмульсию МФЛ + TDM. Через три недели после второй иммунизации 12 животных из каждой группы, предназначенных для определения иммуногенности, были забиты, и клетки селезенки были извлечены обычным способом. Клетки селезенки выращивались в среде RPMI 1640 (Gibco, Grand Island, NY), содержащей 10%FBS (Gibco) при 37°C и при 5% CO2. Эксперименты по иммунизации были повторены дважды с одинаковыми дозировками и в одинаковом режиме. Заражение мышей MAP
Через три недели после второй иммунизации 24 животных из групп I и II были заражены с помощью внутрибрюшинной инъекции 109 колониеобразующими единицами (KOE) Mycobacterium avium подвида paratuberculosis. По шесть животных в каждой группе были умерщвлены на 4, 8, 12 и 16 неделях после заражения, и селезенка, печень и брыжеечные лимфатические узлы были собраны и поделены на две части. Один набор тканей был гомогенизирован в ФСБ (100 мг/мл) и 100 мкл гомогенатов индивидуальных тканей были посеяны на яично-желточный скошенный агар (Herald's egg yolk (HEY), Becton, Dickinson and Co, Sparks, MD), содержащий микобактин J., для оценки бактериальной нагрузки. Культуры на скошенном агаре были изучены на рост бактерий путем подсчета колоний через 8-12 недель после высеивания. Другой набор тканей использовался для гистопатологического исследования.
Гистопатологическое исследование
Участки селезенки, печени и МЛУ фиксировали путем погружения в 10% нейтральный буферный формалин, заливали в парафин, делали срезы 4 мкм и окрашивали гематоксилином и эозином, окрашивали по Цилю-Нельсену с помощью обычных гистологических методов, а затем изучали с помощью оптической микроскопии.
Твердофазный иммуноферментный анализ гуморального иммунного ответа Антигенспецифичный lgG ответ измеряли с помощью обычного метода иммуноферментного анализа ИФА. На ИФА плашки (Nunc-immuno module, Nunc, Roskilde, Denmark) наносили 200 нг/лунку рекомбинантного полипептида и инкубировали при 4°C в течение ночи. После однократного промывания ФСБ-Т (0,05% Tween 20 в ФСБ), добавили 300 мкл блокирующего буфера (1% бычьего сывороточного альбумина (БСА) в ФСБ-Т) и инкубировали при 25°C в течение 1 часа. Плашки промыли три раза ФСБ-Т и добавили в каждую лунку 100 мкл разбавленных образцов сыворотки и инкубировали при 37°C в течение 1 часа. Для измерения общего иммуноглобулин-G (lgG) ответа, после промывания к каждой лунке добавили 50 нг конъюгированного с щелочной фосфатазой козлиного антимышиного lgG (KPL, Gaithersburg, MD) и инкубировали при 25°C в течение 30 минут. После промывания добавили 50 мкл субстрата BluePhos (KPL) и инкубировали 10 минут. После добавления 50 мкл стоп-раствора (KPL) плашки считывали на ELX 808 Ultra планшет-ридере (Bio-Tek Instruments, Inc. Winooski, VT) при 630 нм. Для измерения ответа по изотипам, после промывания к каждой лунке добавили 25 нг конъюгированного с биотином козлиного антимышиного lgG1 или lgG2a (Southern Biotech, Birmingham, AL) и инкубировали при 25°C в течение 30 минут. После промывания добавили 0,2 мкг/мл стрептавидина, меченного пероксидазой (KPL) и инкубировали при 25°C в течение 30 минут. После промывания к каждой лунке добавили 50 мкл 3,3',5,5'-тетраметилбензидина и инкубировали в течение 15 минут. Планшеты считывали на ELX 808 Ultra микропланшет-ридере (Bio-Tek Instruments) с помощью метода конечных точек при 450 нм после добавления 50 мкл 1N H2SO4 в качестве стоп-раствора.
Анализ интерферона-гамма
Клетки селезенки, полученные стандартными методами были засеяны в повторе с концентрацией 5×105 клеток/лунку и культивировались с и без рекомбинантного полипептида в качестве антигена в течение 48 ч. Супернатанты культур были собраны и проанализированы на γ-интерферон с использованием набора для твердофазного иммуноферментного сэндвич-метода (Biosource, Camarillo, CA) в соответствии с инструкцией производителя. Вкратце, 50 мкл супернатанта культуры добавляли в лунки с нанесенными моноклональными антителами, специфичными для мышиного γ-интерферона. Через 2 ч совместной инкубации при комнатной температуре с биотинилированными поликлональными антителами, лунки промывали и добавляли стрептавидин-пероксидазу. После 30 минутного инкубирования и промывания к лункам добавили раствор тетраметилбензидина и результаты считывали при 450 нм в ELx 808 Ultra микропланшет-ридере (Bio-Tek Instruments).
Иммуноферментный спот-анализ (ELIspot)
Набор для иммуноферментного спот-анализа (KPL) использовался для определения относительного числа клеток, экспрессирующих γ-интерферон, в суспензии единичных клеток селезенки в соответствии с инструкциями производителя. Вкратце, 10 мкг/мл антител, иммобилизованных интерфероном (BD Biosciences, San Jose, СА) были нанесены на Multiscreen 96-луночный фильтровальный планшет (Millipore, Bedford, MA) на ночь при 4°C. После однократного промывания промывочным раствором, плашки блокировали с помощью 1×БСА раствора в течение 1 часа при 25°C и снова промывали. Клетки селезенки помещали в повторе в концентрации 5×105 клеток/лунку и выращивали с и без антигена в течение 48 часов при 37°C. Плашки промывали однократно промывочным раствором и инкубировали 1 ч при 25°C с 5 мкг/мл вторичных крысиных антимышиных антител к γ-интерферону, конъюгированных с биотином (BD Biosciences). Плашки промывали и инкубировали 30 мин при 25°C с 0,2 мкг/мл HRP-стрептавидина. Фильтры проявляли TureBlue субстратом в течение 15 минут, высушивали в темноте и подсчитывали пятна.
Анализ возбужденной флюоресценции сортированных клеток (FACS анализ) на маркеры клеточной поверхности
Клетки селезенки наносили в повторе на 96-луночные культуральные микропланшеты в концентрации 1×106 клеток/лунку и культурировали 24 часа. Анализ возбужденной флюоресценции сортированных клеток проводили после стимулирования клеток селезенки полипептидом Map74F и конкавалином A с подходящими нестимулированными контрольными клетками. После трехкратного промывания FACS буфером (1% БСА и 0,05% азида натрия в ФСБ), клетки суспендировали в 50 мкл FACS буфера и смешивали с 0,5 мкг CD3, CD4 и CD8 антител, конъюгированных с ФИТЦ (флуоресцеин изотиацианат) или ФЭ (фикоэритрин, eBioscience, San Diego, СА), и инкубировали на льду 30 минут.Клетки дважды промывали FACS буфером и суспендировали в 100 мкл 3% формальдегида в ФСБ, а затем переносили в FACS пробирки, содержащие 500 мкл ФСБ. Данные получали для 10000 событий с использованием проточного цитомера FACS калибра (Becton-Dickinson, San Jose, СА) и обрабатывали с использованием программы Cellquest. Результаты выражали как увеличение среднего процента клеток с положительным окрашиванием по отношению к клеткам неиндуцированного образца, окрашенного тем же антителом. ПЦР в реальном времени для анализа экспрессии цитокиновой мРНК.
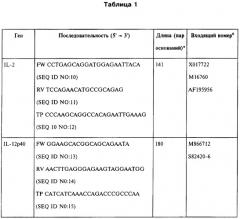
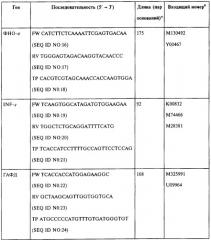
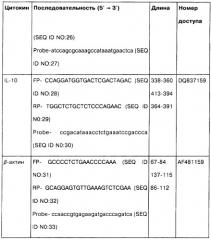
Тотальная РНК была выделена из тканей селезенки иммунизованных мышей с использованием мининабора RNeasy mini kit (Qiagen, Valencia, СА). Матричная РНК была обратно-транскрибирована с использованием Superscript™ II (Invitrogen) и использовалась в качестве матричной кДНК. Последовательности праймера и образцов представлены в Таблице 1. В Таблице 1 применялись следующие сокращения: FW, прямой праймер; RV, обратный праймер; TP, TaqMan проба, дважды меченная 5'FAM и 3TAMRA; а Длина ампликона в парах оснований. b Входящий номер кДНК и соответствующего гена в Genbank. c Антисмысловой образец.
Образцы были мечены флуоресцентным красителем, 6-карбоксифлуоресцеином на 5' конце и гасителем люминесценции, N', N\N',N',N'-6-карбокситетраметилродамином на 3' конце. Реакцию проводили в повторе в объеме 25 мкл, содержащем 2 мкл 10 пМ прямого и обратного праймеров, 2 мкл 2 пМ пробы, 12,5 мкл TaqMan ПЦР мастер-микса и 9,5 мкл разбавленной кДНК, используя следующие условия: 10 мин при 94°C с последующими 40 полными двухтемпературными циклами (15 секунд при 95°C и 1 мин при 60°C), в автоматическом флуориметре (7700 Sequence detector, Applied Biosystems, Foster city, СА). Количественная оценка проводилась с использованием сравнительного метода пороговых циклов и выражалась в виде относительной транскрипции или кратности n-раз по сравнению с калибровочной кДНК.
Статистический анализ
Данные были статистически обработаны с использованием программы Excel. Расхождение между группами и индивидуальными антигенами анализировали однофакторным дисперсионным анализом с последующим критерием множественных сравнений Тьюки-Крамера или критерием Стьюдента. Расхождения считались значимыми, когда были получены значения вероятности менее 0,05.
С помощью материалов и методов, изложенных в данном Примере, были получены следующие результаты.
Иммунный ответ у мышей, иммунизованных полипептидом Map74F
Через три недели после вторичной вакцинации четыре мыши из каждой группы были убиты, и была проведена оценка образования анти-Map74F антител и T-клеточной иммунной реакции. Мыши, иммунизированные Map74F, имели существенно (P<0,01) более сильный lgG1, но не lgG2a ответ против Map74F. Напротив, в контрольной группе не было обнаружено Map74F-специфичных антител.
ИФН-γ ответ оценив