Способ лечения онкологических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для комплексного лечения пациентов с онкологическими заболеваниями. Для этого в организм пациента вводят препарат цитостатической группы и препарат фрагментированной двуцепочечной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора в виде таблеток. Таблетку, содержащую 5 мг активного вещества, используют по схеме через 30 мин и на 2, 3 и 5 сутки после введения циклофосфана в количестве одна таблетка в первые 30 минут после введения циклофосфана, далее в указанные дни по одной таблетке каждые 2-3 часа в течение суток во время бодрствования, но не более 30 мг активного вещества в сутки. Использование данного способа позволяет достичь повышения количества зрелых дендритных клеток в организме, что позволяет достичь максимального проявления регрессирующего эффекта на опухоль. 1 з.п. ф-лы, 1 пр., 6 ил., 2 табл.
Реферат
Изобретение относится к медицине и может быть использовано при комплексном лечении пациентов препаратами цитостатической группы, в частности, для лечения пациентов с онкологическими заболеваниями сочетанием цитостатиков антрациклинового ряда доксорубицина и циклофосфана, которые разрушают раковые клетки, и препарата фрагментированной дцДНК человека, составляющей полный геном физиологически и генетически здорового донора, который используют в качестве субстрата для активации созревания, индукции антигенпрезентирующей и специфической аллостимуляторной активности в направлении Th1 пути антигенпрезентирующих дендритных клеток организма.
Известен способ лечения, основанный на использовании монопрепаратов цитостатической группы, например цисплатины для лечения больных с плоскоклеточным раком кожи туловища, путем использования цисплатины в дозе 100 мг/м2 (I день), внутривенно капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые 3-5 недель, или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 недели, или 50 мг/м2 в 1-й и 8-й дни каждые 4 недели, препарата митомицин С для лечения больных с раком желудка, кишечника, поджелудочной железы, мочевого пузыря, молочной железы, легкого, вульвы, предстательной железы (в составе лекарственных комбинаций), путем использования митомицина С внутривенно в дозе 10 мг/м2 1 раз в 3-4 недели (в составе лекарственных комбинаций) или также 2 мг/м2 с 1-го по 5-й и с 8-го по 12-й дни курса, суммарная доза 50 мг/м2, или препарата дактиномицина для лечения больных с хориокарциномой матки, саркомой мягких тканей, злокачественных опухолей яичка, меланомы, лимфосаркомы, нейробластом путем использования дактиномицина внутривенно 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 недель или 1-2 раза в неделю в течение 3-5 недель, суммарная доза 3000 мкг [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу не все типы неопластической ткани в одинаковой степени чувствительны к действию цитостатика в виде монопрепарата.
Известны также способы лечения, основанные на действии комбинации цитостатических препаратов.
Так, например, к наиболее эффективным препаратам для лечения рака молочной железы относятся комбинация доксорубицина с циклофосфаном с общей эффективностью (полная + частичная регрессия опухоли) около 80%.
Один из наиболее эффективных режимов высокодозовой химиотерапии включает постоянную инфузию 5-фторурацила 200 мг/м2 в день ежедневно длительно, эпирубицин 50 мг/м2 и цисплатин 60 мг/м2 каждые 3 недели в течение 6 месяцев.
Лечение получили 50 больных с опухолью 3-12 см (в среднем 6 см). Полная ремиссия была достигнута у 66% больных, частичная ремиссия - у 32%. Общая частота эффекта составила 94%. Всем больным были выполнены сохранные операции [2, 3].
Известен также способ лечения, хорошие результаты в соответствии с которым получены при лечении 30 больных с местно-распространенным раком молочной железы. Для лечения использовался эпирубицин 100 мг/м2 и циклофосфан 400 мг/м2 с поддержкой Г-КСФ с 14-дневным интервалом. Объективный ответ получен в 96,5% случаев (4 полных и 25 частичных ремиссий).
Интенсивный режим получили также 36 больных (Т2>3,5 см, T3No) с использованием эпирубицина 65 мг/м2, циклофосфана 600 мг/м2 и 5-фторурацила 600 мг/м2 в день 1, при поддержке Г-КСФ 5 мкг/кг, дни с 7 по 12. Интервалы между курсами составляли 14 дней. После трех курсов клинический эффект получен в 100% случаев; 80,5% больным выполнена сохранная операция [4, 5].
Известно также, что 42 больным раком молочной железы IIIA и IIIB стадии проводили лечение доксорубицином 90 мг/м2 и циклофосфаном 1000 мг/м2 при поддержке Г-КСФ с 3-недельным интервалом. Общий клинический эффект составил 98%, полная клиническая регрессия - 50%, полная гистологическая регрессия - 14%. У 40 пациентов, получавших 5-фторурацил 750 мг/м2 (дни 1-4), эпирубицин 35 мг/м2 (дни 2-4), циклофосфан 400 мг/м2 (дни 2-4) с интервалом 3 недели, с поддержкой Г-КСФ, клиническая полная регрессия составила 37,5%, частичная - 45%, полная гистологическая ремиссия отмечена у 15% больных [6].
Однако эти способы также имеют ограниченную применимость, поскольку ни один из способов действия комбинации цитостатиков не активирует противораковый иммунитет организма и лишь незначительно увеличивает безрецидивный интервал у больных раком молочной железы. У больных с местно-распространенным заболеванием 5-летняя безрецидивная выживаемость составляет от 13% до 45%, а 10-летняя - от 10% до 30%. Метастатический рак молочной железы остается неизлечимым заболеванием. В течение 2 и 5 лет от момента диагностики живут в среднем 30% и 5% пациентов, соответственно [7, 8].
Известны также способы лечения, основанные на действии комбинации цитостатических препаратов и последующей иммунотерапии. Сочетание химиотерапии с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект противоопухолевых препаратов.
Так, известен препарат Ингарон, представляющий собой интерферон-гамма. По своим свойствам он является уникальным природным цитокином, обеспечивающим формирование и стимуляцию клеточного иммунитета, что показывает целесообразность использования гамма-интерферона в сочетании с химиотерапией при ряде злокачественных опухолей [9].
Кроме того, известен способ, основанный на использовании цитостатических препаратов с последующей иммунотерапией специфическим олигонуклеотидами с фосфоротиоатным остовом и специфическим набором нуклеотидов (CpG) [10].
Этот препарат был разработан для лечения рака специфических антител и индуцирует секрецию интерферона-α, интерлейкина-10, а также стимулирует активность натуральных киллеров.
Однако этот способ обладает относительно низкой эффективностью лечения, обусловленной тем, что иммуномодулирующие CpG нуклеотиды воздействуют в основном на антигенпрезентирующие клетки, в том числе ДК напрямую, активируя их созревание и специфические активности. Основным рецептором активации ДК является.
Наиболее близким по своей сущности к предложенному является способ, основанный на введении в организм пациента препарата цитостатической группы, механизм действия которого основан на формировании межцепочечных сшивок в молекуле ДНК раковых клеток организма, причем дополнительно вводят препарат фрагментированной аллогенной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, за один час и через час после введения цитостатика и далее каждые два часа до завершения полного репаративного цикла, составляющего 12 ч [RU 2345792 C2, C12P 21/00, 10.02.2009].
Кроме того, по этому способу препарат фрагментированной аллогенной ДНК используют в качестве субстрата для гомологической рекомбинации с однонитчатыми участками ДНК и областями двуцепочечных разрывов молекулы ДНК, возникающими при репарации межцепочечных сшивок.
При этом препарат фрагментированной аллогенной ДНК вводят в количестве, равном или превышающем количество собственно ДНК плазмы крови, но не более максимально допустимого количества, равного 30 мкг/мл крови.
Способ, наиболее близкий по своей сущности к предложенному, обладает относительно низкой эффективностью лечения.
Требуемый результат заключается в повышении эффективности лечения.
Требуемый результат достигается тем, что в способе, основанном на введении в организм пациента препарата цитостатической группы и препарата фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, в качестве препарата фрагментированной ДНК используют двухцепочечную ДНК в виде таблеток, содержащих 5 мг активного вещества по схеме через 30 мин и на 2, 3 и 5 сутки после введения циклофосфана в количестве одна таблетка в первые 30 минут после введения циклофосфана и далее в указанные дни по одной таблетке каждые 2-3 часа в течение суток во время бодрствования, но не более 30 мг активного вещества в сутки.
Кроме того, требуемый технический результат достигается тем, что в качестве препарата цитостатической группы используют циклофосфан.
В более широком плане задачей настоящего изобретения является разработка обоснованного и экспериментально подтвержденного способа (стратегии) совместного воздействия на раковые клетки и опухоль в целом цитостатических препаратов доксорубицина и/или циклофосфана и препарата фрагментированной дцДНК человека, составляющей полный геном физиологически и генетически здорового донора, таким образом, что после деструктивного воздействия на опухоль цитостатиков и образования иммуногенного дебриса погибших раковых клеток происходит активация ДК доставленными в организм фрагментами дцДНК человека, в результате чего развивается противораковый адаптивный иммунитет, приводящий к полной элиминации онкогенного начала из организма пациента.
В современной литературе отсутствуют указания на предлагаемый способ лечения онкологических пациентов с использованием одновременного воздействия цитостатиков доксорубицин и циклофосфан и препарата фрагментированной дцДНК человека.
В настоящее время наиболее эффективное противораковое действие достигается химиотерапией, которая основана на деструктивном воздействии на клетки опухоли химических препаратов [21, 22].
Несмотря на то что химиотерапия улучшает качество жизни больных злокачественными раками, считается, что такая терапия при некоторых онкологических нозологиях практически не влияет на продолжительность жизни пациентов. В этой связи в экспериментальных исследованиях и клинической практике используются стратегии лечения злокачественных новообразований, в которых помимо деструктивного действия на опухолевые клетки цитостатиков применяются подходы, активирующие адаптивный противораковый иммунитет организма [23, 24]. В качестве индукторов развития адаптивного иммунитета применяются традиционные вакцины, а также вакцины на основе патоген-ассоциированных молекулярных паттернов бактерий (PAMPs), включающих эндо/экзотоксины бактериального происхождения, и препараты CpG ДНК [22, 25-33].
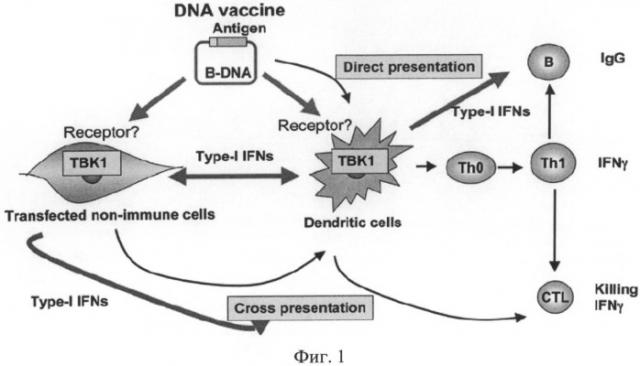
В последнее время немало исследований посвящено поиску новых индукторов противораковой активности иммунной системы. Установлено, что дцДНК млекопитающих, интродуцированная извне или присутствующая в организме в результате гибели клеток, приводит к созреванию антигенпрезентирующих клеток, в том числе ДК организма, и индуцирует гуморальный и клеточный иммунитет [34, 35]. Этот процесс происходит по TLR-независимому пути. Основное действие дцДНК связано с активацией ТВК1 киназы и сверхэкспрессией интерферонов I типа (ИФН-β) и индукцией созревания ДК [13-16, 35, 36].
Одним из широко используемых в клинической практике химиопрепаратов при лечении онкозаболеваний является цитостатик циклофосфан. Его противоопухолевое действие основано в первую очередь на прямом цитотоксическом действии на раковую клетку, приводящем к ее лизису [27]. Также установлено, что обработка циклофосфаном приводит к иммуносупрессии определенных клеток организма, в первую очередь регуляторных CD4+ CD25 FOX3 Т-клеток. Т-регуляторные клетки преимущественно аккумулируются у человека в микроокружении опухоли и лимфоидных органах [37] и подавляют активацию и пролиферацию других иммунных клеток организма [38-41]. В умеренных дозах циклофосфан не только уменьшает количество преимущественно Т-регуляторных лимфоцитов [42-44], но и приводит к снижению их функциональной активности, стимулируя апоптоз и подавление пролиферации этих клеток [41, 43]. Такое изменение в микроокружении опухоли позволяет активировать систему адаптивного противоракового иммунного ответа [40, 41, 44]. Помимо прямого действия циклофосфана на раковые клетки и его действия на Т-регуляторные лимфоциты описан также эффект его действия на ДК. Показано, что циклофосфан влияет на различные субпопуляции ДК таким образом, что обеспечивает формирование противоракового иммунитета [45-47].
Во многих работах описано совместное действие циклофосфана и иммуномодулирующих препаратов ДНК, например CpG ДНК [27], в результате которого стимулируется иммунная система и подавляется рост экспериментальных опухолей. Это объясняется тем, что цитостатик избирательно снижает количество Т-регуляторных лимфоцитов в микроокружении опухоли или напрямую убивает клетки опухоли, а препараты ДНК стимулируют созревание и активность клеток адаптивного звена иммунной системы [27, 30, 48].
Считается, что основными клетками, отвечающими за развитие адаптивного иммунитета, являются ДК. ДК проявляют по отношению к Т-цитотоксическим лимфоцитам аллостимуляторную активность [27, 30], т.е. инициируют их киллерную активность против клеток организма, несущих несвойственные клетке антигены, в том числе раковые. Для проявления ДК такой активности необходима эффективная индукция их созревания, сопровождающаяся экспрессией молекул МНС I и II класса и разнообразных костимуляторных молекул - CD40, CD54, CD80, CD86, и представление ими на своей поверхности чужеродных антигенов в составе МНС комплекса. Показано, что присутствие опухолевых антигенов в форме комплексов с МНС белками значительно повышает уровень аллостимуляторной активности ДК и индуцирует антиген-специфичный Т-цитотоксический ответ [34, 49-54].
Существуют препараты, которые способны повышать иммуногенность опухолевых клеток непосредственно в организме. К ним относятся цитостатики антрациклинового ряда - доксорубицин, идарубицин, митоксантрон [40, 55]. Было показано, что для активации противораковой активности иммунной системы необходима индукция экспозиции белка калретикулина на поверхности клеточной мембраны погибающей клетки [40, 55]. Калретикулин является кальций-связывающим лектиновым шапероном и представлен, главным образом, на эндоплазматической люмине. Его экспозиция на поверхности умирающих клеток служит сигналом «eat-me» для близлежащих фагоцитирующих клеток [56, 57] и способствует почти мгновенному захвату этих клеток [55]. Сочетание доксорубицина с цитостатическими препаратами циклофосфаном и паклитакселем и цельноклеточными вакцинами показало высокую иммунную эффективность на трансгенных мышах [58].
Как было отмечено выше, результаты многочисленных экспериментальных и обобщающих работ за последнее время свидетельствуют о том, что геномная дцДНК индуцирует гуморальный и адаптивный иммунитет организма [15]. Такая индукция обеспечивается воздействием препаратов дцДНК как на профессиональные антигенпрезентирующие клетки, так и на другие типы клеток организма, включая мышечные клетки. В обоих случаях наиболее значимым эффекторным проявлением является сверхэкспрессия и секреция интерферона I типа (ИФН-β) клетками, в которых произошла интернализация экзогенной ДНК [14, 15]. Кроме этого дцДНК индуцирует созревание антигенпрезентирующих клеток, в частности ДК, стимулируя выход на цитоплазматическую мембрану кофакторных молекул, обеспечивающих развитие адаптивного иммунитета [34].
В настоящей работе показано, что препарат экзогенной ДНК человека индуцирует созревание ДК селезенки и костного мозга мыши in vivo. Для оценки эффективности вакцинации препаратом дцДНК человека была выбрана стратегия, при которой проводилась обработка экспериментальных животных препаратом фрагментированной ДНК на фоне предобработки доксорубицином и циклофосфаном. Такой подход обеспечивает присутствие опухолевого антигена за счет деструкции опухоли конкретного организма in vivo путем совместного воздействия цитостатиков. Следующие за этим инъекции препарата дцДНК индуцируют эффективное созревание ДК. Использование такой стратегии лечения экспериментальных опухолей мыши приводит к значительной задержке роста опухоли-графта. Цитотоксический тест свидетельствует о появлении во фракции мононуклеаров крови высоко активной против клеток перевитой опухоли популяции клеток с индексом цитотоксичности 82%.
Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертежах представлены:
на фиг.1 - предположительная схема перекрестной ДНК-опосредованной активации адаптивного иммунитета, опосредованная ТВК1 киназой;
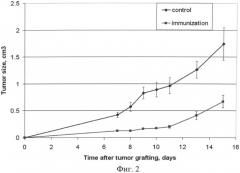
на фиг.2 - динамика роста опухоли Эрлиха в контроле и после введения мышам циклофосфана в дозе 200 мг/кг, препарата ДНК и иммунизации лизатом опухоли;
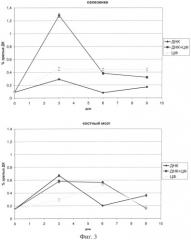
на фиг.3 - динамика созревания ДК селезенки (А) и костного мозга (В) мыши после обработки циклофосфаном и препаратом ДНК. Нулевая точка -количество зрелых ДК у интактных мышей;
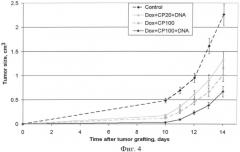
на фиг.4 - динамика роста опухоли RLS после введения мышам доксорубицина, циклофосфана и препарата ДНК;
на фиг.5 - динамика роста опухоли Кребс-2 после введения мышам доксорубицина, доксорубицина и препарата ДНК;
на фиг.6 - процентное содержание CD8+Pr+ Т-клеток в интактных мононуклеарных клетках (МНК) и после инкубации с ДК, созревшими в присутствии ЛПС, ДНК или в отсутствии дозревающего стимула (0).
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Способ лечения онкологических заболеваний основан на введении в организм пациента препаратов цитостатической группы и препарата фрагментированной дцДНК человека.
Пример реализации способа
Вместе с вводимым цитостатическими препаратами антрациклинового ряда и циклофосфана для лечения больных с раком молочной железы, путем использования препаратов в дозе: эпирубицин 100 мг/м2 и циклофосфан 400 мг/м2 или препаратами анрациклинового ряда, циклофофана и фторурацила для лечения больных с раком молочной железы, путем использования препаратов в дозе: эпирубицина 65 мг/м2, циклофосфана 600 мг/м2 и 5-фторурацила 600 мг/м2 в день 1, или препаратами доксорубицин и циклофофан для лечения больных с раком молочной железы, путем использования препаратов в дозе: доксорубицин 90 мг/м2 и циклофосфан 1000 мг/м2 вместе с вводимым цитостатическими препаратами в организм пациента вводится препарат дцДНК человека с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, в виде таблеток, содержащих 5 мг активного вещества, по схеме через 30 мин и на 2, 3 и 5 сутки после введения циклофосфана в количестве одна таблетка в первые 30 минут после введения циклофосфана и далее в указанные дни по одной таблетке каждые 2-3 часа в течение суток (время бодрствования), но не более максимально допустимого количества, равного 30 мг активного вещества в сутки.
Для подтверждения того, что предложенный способ позволяет достигнуть требуемого результата, приведем его теоретическое и экспериментальное обоснование.
Рассмотрим теоретическую основу используемого способа.
Опухоль обладает следующими свойствами, позволяющими ей ускользать и противодействовать обнаружению и подавлению защитными системами организма. Это, во-первых, генетическая пластичность, связанная с постоянно активированной репарационно-рекомбинационной системой клетки и возможностью в кратчайший срок перестроить генетическую моду клетки в соответствии с дискриминирующим давлением извне [59]. Во-вторых, опухолевая ткань использует ингибирующие иммунную систему свойства Т-регуляторных лимфоцитов. Цитокиновый инструмент Т-регуляторных лимфоцитов создает специфическое микроокружение опухоли, делая ее толерантной к надзирающему действию иммунной системы. Основное воздействие цитокиновый барьер, сформированный Т-регуляторными лимфоцитами, оказывает на антигенпрезентирующие клетки, которые в условиях такого давления теряют свои способности представлять антиген и индуцировать Th1 цитотоксический ответ. В-третьих, опухоль, как правило, слабоиммуногенна, что еще в большей степени затрудняет обнаружение переродившейся ткани иммунной системой организма и уничтожение неотрансформированных клеток. И, таким образом, если исключить или изменить эти три свойства опухолевой ткани, то создаются предпосылки для обнаружения опухоли иммунной системой и элиминации неотрансформированной ткани по любому из известных механизмов действия иммунной системы [59-62].
В настоящее время большое внимание уделяется стратегии воздействия на опухолевую ткань, включающей действие цитостатического препарата (наиболее используемый препарат циклофосфан) и следующую за ним иммунотерапию [22, 54, 63, 64]. Такая стратегия в полной мере соответствует изложенной выше концепции воздействия на опухолевую ткань. Как показали исследования последних лет, циклофосфан угнетает развитие и разрушает функции Т-регуляторных лимфоцитов, связанные с секрецией цитокинов, ингибирующих активность иммунной системы организма [41, 43, 44, 54, 64, 65]. Элиминация функции Т-регуляторных лимфоцитов как системы опухолевой ткани, ингибирующей активность иммунной системы, позволяет использовать иммунотерапевтические подходы для индукции агрессии иммунитета против неотрансформированной ткани. Следующая за действием цитостатика циклофосфана иммунотерапия имеет несколько вариантов. В некоторых случаях в качестве индуктора противоракового иммунитета используют традиционные пептидные вакцины. В последнее время огромное внимание уделяется ДНК-активаторам иммунной системы - CpG олигонуклеотидам, которые через TLR9 активируют антигенпрезентирующие клетки. Вследствие такой активации индуцируется развитие адаптивного звена иммунитета [30].
В последних работах, характеризующих действие цитостатиков антрациклинового ряда (например, доксорубицин), установлено, что проведенная обработка препаратом индуцирует выход на внешнюю часть цитоплазматической мембраны белка калретикулина. Этот белок является сигналом "eat me" для антигенпрезентирующих клеток. Такое свойство доксорубицина существенно повышает иммуногенность опухоли [55, 66]. И, таким образом, в настоящее время существуют все элементы стратегии воздействия на неотрансформированную ткань, позволяющей использовать в полной мере все эффекторные механизмы применяемых препаратов. Циклофосфан деструктирует опухолевые клетки и одновременно угнетает развитее Т-регуляторных лимфоцитов и элиминирует их функции; доксорубицин деструктирует опухоль и одновременно делает опухолевый дебрис иммуногенным; активированная иммунная система в промежуток времени, когда неактивны Т-регуляторные лимфоциты и опухоль лишена защиты, разрушает остатки опухоли и убивает остаточные неотрансформированные клетки.
В проведенных экспериментах мы основывались на описанном ранее свойстве дцДНК индуцировать аллостимуляторную активность ДК и активировать процесс их созревания [15, 67, 68]. Аналогичные свойства описаны для CpG олигонуклеотидов, однако трансдуцирующие пути активации принципиально отличаются. Для CpG ДНК это путь, опосредованный TLR9, и охарактеризованная для этого пути активации трансдукция сигнала [12, 16, 23, 30]. Для дцДНК о пути трансдукции активирующего сигнала известно немного. Неоспоримым является факт участия в такой активации TBK1 киназы [36]. И, таким образом, было предположено, что поскольку дцДНК индуцирует созревание ДК in vitro, то аналогичное свойство будет проявляться и при непосредственной инъекции ДНК в организм.
Также было предположено, что противораковая активность препарата дцДНК, обнаруженная и описанная в работах [69, 70], связана именно с активацией ДК и развитием адаптивного противоракового иммунного ответа. На то, что в противораковой активности инъекций препарата ДНК участвуют именно антигенпрезентирующие клетки, а не натуральные киллеры, свидетельствовали следующие эксперименты. Было показано, что дополнительная иммунизация экспериментальных мышей после инъекций циклофосфана и препарата ДНК приводит существенному усилению эффекта задержки прогрессии опухоли ([48] и фиг.2). Натуральные киллеры осуществляют надзор и противораковую активность по отношению к клеткам, содержащим пониженное количество белков класса MHCI или экспрессии на поверхности трансформированных клеток так называемых стресс-индуцированных молекул MICA и MICB, относящихся к семейству неканонических молекул гистосовместимости Ic класса, что характерно для опухолевых клеток [71, 72]. До настоящего времени не показано, чтобы эти клетки проявляли специфическую антиген-зависимую цитотоксичность, связанную с пульсацией гомогенатом опухоли.
В проведенных экспериментах была оценена зрелость ДК, выделенных из селезенки и костного мозга, и определено время максимального количества зрелых ДК. Учитывая полученные результаты, была разработана схема совместного применения доксорубицина и циклофосфана, формирующих иммуногенный апоптозный клеточный дебрис, и препарата ДНК. При применении такой схемы наблюдается максимальная степень торможения роста опухоли. При этом проведенный цитотоксический тест свидетельствует о том, что эффект торможения роста опухоли связан как с непосредственной цитотоксичностью цитостатиков, так и с формированием пула цитотоксических клеток. При таком двойном действии развитие опухоли практически прекращается.
В работе были использованы высокие дозы циклофосфана. В проведенных экспериментах, исследуя синергичное противораковое действие цитостатика и дцДНК, не было обнаружено усиления терапевтического эффекта, связанного с применением низких доз циклофосфана. Обнаруженный эффект, возможно, связан с дифференцированным воздействием циклофосфана на популяции ДК, отвечающих за эффективную презентацию антигена. Известно несколько популяций ДК. Резидентные ДК обнаруживаются в лимфатических узлах и селезенке, миграторные ДК обнаружены только в лимфатических узлах. Резидентные клетки существуют как CD8-, CD4+ и CD4- CD8- ДК. Основной эффект циклофосфана оказывает на CD8+ резидентные клетки лимфатических узлов. При этом сохранившаяся популяция ДК становится более иммунокомпетентной и может снижать супрессивную функцию Т-регуляторных лимфоцитов [46]. Кроме этого показано, что циклофосфан как монопрепарат индуцирует увеличение количества незрелых ДК в крови и одновременно усиливает антигенспецифический ответ CD8+ Т-лимфоцитов. Основной источник увеличения количества ДК - это активация предшественников этого ряда лимфоцитов в костном мозге [47]. Циклофосфан по-разному влияет на подавление их роста. Эти факты означают, что на фоне подавления популяции Т-регуляторных лимфоцитов и других типов лимфоцитов, циклофосфан оказывает противоположное действие на популяции ДК, способных эффективно представлять антиген. При действии циклофосфана происходит увеличение их количества и усиление эффективности презентировать антиген. Можно полагать, что такое воздействие на ДК цитостатиком создает условия для быстрого развития цитотоксического ответа против раковых клеток, обусловленного формированием цитотоксических клеток, как показано в цитотоксическом тесте.
Таким образом, в серии выполненных нами экспериментов показано, что введение экзогенной ДНК на фоне предобработки доксорубицином и циклофосфаном обеспечивает противораковый эффект, который, по-видимому, обусловлен активацией определенного звена иммунной системы - ДК. Этот эффект, вероятно, объясняется подавлением активности Т-регуляторных лимфоцитов, характерных для микроокружения опухоли [41, 43, 44, 54, 64, 65], и активацией ДК Т-цитотоксических лимфоцитов [46, 47]. При этом наиболее важными факторами являются зрелость ДК, то есть их компетентность поглощать, процессировать и представлять антиген, а также присутствие опухолевого(ых) антигена, которое достигается обработкой доксорубицином и циклофосфаном.
Полученные результаты по противораковой активности препарата дцДНК человека, которая связана с появлением в мононукларной фракции костного мозга высокоцитотоксичных клеток против опухоли-графта, находятся в соответствии с нашими результатами, полученными в системе in vitro на популяции сгенерированных по интерфероновому протоколу ДК человека. В проведенных экспериментах была показана способность ИФН-индуцированных ДК к генерации цитотоксических Т-лимфоцитов в смешанной культуре лимфоцитов.
Мы полагаем, что использование описанного подхода перспективно и позволяет использовать инъекции препарата ДНК в сочетании с классическими схемами программной химиотерапии при терапии злокачественных новообразований.
Ниже приводится экспериментальное доказательство участия экзогенных фрагментов дцДНК в активации противоракового иммунного ответа.
Используемые методики
В работе использовали 10-14-недельных мышей линии CBA/Lac (в тексте CBA), самцы или самки, развода вивария ИЦиГ СО РАН. Животных содержали по 7-10 особей в клетке в хорошо освещенном помещении. Мыши имели свободный доступ к еде и воде.
Общие характеристики модельных опухолей мыши, используемых в экспериментах и имеющихся в коллекции Института цитологии и генетики
Асцитная карцинома Кребс-2 - линейнонеспецифическая опухоль, полученая из эпителиальных клеток, трансплантируется на все инбредные линии мышей. При подкожной и внутримышечной прививке растет в виде солидных узлов. Слабо иммуногенна для мышей всех линий. Метастазов не образует.
Асцитная карцинома Эрлиха - линейнонеспецифическая опухоль, трансплантируется на все инбредные линии мышей. При подкожной и внутримышечной прививке растет в виде солидных узлов. По последним данным метастазирует в региональные лимфоузлы. При внутрибрюшинной прививке клеток этих опухолей в брюшной полости образуется асцитическая жидкость со взвесью опухолевых клеток.
Лимфосаркома LS - линейноспецифическая для мышей линии CBA, первично индуцирована у мыши этой линии нитрозометилмочевиной и пассируется в асцитной форме. При внутримышечной трансплантации образует солидные узлы. Развивается у 100% привитых животных, спонтанной регрессии не наблюдается. Подвергается тотальному апоптозу под влиянием алкилирующих противоопухолевых агентов. Метастазирует в печень, почки, легкие.
Лимфосаркома RLS-40 - вариант опухоли LS, резистентный к алкилирующим соединениям.
Опухоли прививались внутримышечно в правую заднюю лапу в количестве 1-3×105 клеток на мышь для формирования солидных опухолей. В ходе экспериментов, как только опухоли начинали пальпироваться (примерно через 7 дней после прививки), каждые 1-2 дня проводили измерение их объема с помощью штангенциркуля. Размеры опухоли подсчитывали, используя формулу длина × высота × ширина.
При иммунизации экспериментальных животных мышам-самкам СВА (n=11) внутрибрюшинно вводили циклофосфан (ЦФ) 200 мг/кг веса. 200 мкг ДНК человека вводили через 30 мин и следующие 2 суток после ЦФ. Через 10 дней мышей иммунизировали путем подкожного введения лизата клеток опухоли Эрлиха (12 млн инактивированных клеток). Через 10 дней этим мышам и мышам контрольной группы (n=11), получавшим инъекции равного объема физ. раствора, привито внутримышечно по 105 клеток опухоли Эрлиха.
Для оценки зрелости ДК in vivo мышам вводили ЦФ в дозе 200 мг/кг и 200 мкг препарата ДНК человека на 1 (в тот же день), 3, 4 и 5 сутки после ЦФ. На 3, 6 и 9 сутки после введения ЦФ выделяли мононуклеарную фракцию селезенки и клеток костного мозга.
Мышей забивали методом дислокации шейных позвонков, извлекали бедренные и большие берцовые кости. Эпифизы костей удаляли, диафизы дважды промывали 2 мл среды RPMI-1640 (Медиген). Вымытые клетки костного мозга мыши (костно-мозговые предшественники ДК) суспендировали в среде RPMI-1640. Содержимое селезенки вылущивали в пластиковых чашках Петри пинцетом и ресуспендировали в физ. растворе. Полученные взвеси наносили на 3 мл градиента фиколл 400 (Farmaceg) -урографин (Schering), центрифугировали (5810R, Eppendorf, США) при 1500 об/мин в течение 30 мин. Мононуклеарную фракцию собирали, переносили в чистый флакон, добавляли 2 мл среды RPMI-1640. Центрифугировали при 1200 об/мин в течение 5 мин (5810R, Eppendorf, США). Супернатант удаляли, клеточный осадок суспендировали в среде RPMI-1640, количество клеток считали на камере Горяева и разводили до 2×105 в 200 мкл среды.
Процент зрелых ДК селезенки и костного мозга оценивали по окрашиванию моноклональными антителами CD34-PE (sc-18917, Santa Cruz) и CD80-FITC (553768, BD Biosciences). Анализ проводили с помощью проточной цитофлуорометрии на приборе BD FACSAria (BD Biosciences, США) в центре коллективного пользования ИЦиГ СО РАН, результаты обрабатывали с помощью программы FACS Diva.
В работе были использованы следующие схемы введения препарата экзогенной ДНК после цитостатиков доксорубицина и ЦФ. Мышам СВА внутримышечно прививали по 105 клеток опухоли RLS-40. На 4 сутки после этого мышам вводили внутривенно по 6,7 мг/кг доксорубицина и внутрибрюшинно по 20 или 100 мг/кг ЦФ. 200 мкг ДНК человека вводили внутрибрюшинно через 30 мин и на 2 и 3 сутки после ЦФ. Было выделено 4 группы мышей (каждая n=10): 1) контроль (привитая опухоль и инъекции физ. раствора); 2) Доксорубицин + ЦФ 100 мг/кг; 3) Доксорубицин + ЦФ 20 мг/кг + ДНК; 4) Доксорубицин + ЦФ 100 мг/кг + ДНК.
Мышам СВА внутримышечно прививали по 3×105 клеток опухоли Кребс-2. На 4 сутки после этого мышам вводили внутривенно по 6 мг/кг доксорубицина и внутрибрюшинно по 200 мг/кг ЦФ. 200 мкг ДНК человека вводили внутрибрюшинно через 30 мин и на 2, 3 и 5 сутки после ЦФ. Было выделено 4 группы мышей (каждая n=10): 1) контроль (привитая опухоль и инъекции физ. раствора); 2) Доксорубицин + ЦФ; 3) ДНК; 4) Доксорубицин + ЦФ + ДНК.
МТТ-тест мононукларной фракции крови мыши был выполнен следующим образом. Мышей забивали методом декапитации, отбирали 200-500 мкл крови в пробирки, содержащие 800 мкл физ. раствора с 50 мМ ЭДТА. Клетки крови осаждали центрифугированием (5810R, Eppendorf, США) при комнатной температуре, 1100-1500 об/мин в течение 5 мин, супернатант отбирали, к осадку добавляли буфер для лизиса эритроцитов (0,15 М хлорид аммония (Реахим, осч), Tris-HCl pH 7,5 до 10 мМ, до 0,5 мМ ЭДТА), из расчета 3×108 клеток на 1 мл буфера. Суспензию оставляли при комнатной температуре на 7-10 мин до появления характерного цвета гемолиза - «лакированной крови». Разбавляли суспензию десятикратным объемом физ. раствора, центрифугировали 1500 об/мин 5 мин. Осадок ресуспендировали в 400-1000 мкл среды RPMI-1640, в зависимости от количества клеток.
Цитотоксичность фракции крови мыши без эритроцитов определяли на клетках опухоли Кребс-2. Клетки Кребс-2 помещали в 96-луночный планшет (3×104 клеток/лунку) и добавляли выделенные кровяные клетки мыши в соотношении к клеткам опухоли 1:1. Далее клетки инкубировали в среде RPMI-1640 с добавлением гентамицина сульфата (100 мкг/мл) в атмосфере 5%-ного CO2 при 37°C в течение 18 ч. После инкубации в лунки добавляли желтый раствор бромида 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ, Sigma) до конечной концентрации 0,5 мг/мл и культивировали в течение 3 ч. Клетки центрифугировали при 4000 об/мин в течение 10 мин (5810R, Eppendorf, США). Среду отбирали, выпавшие синие кристаллы формазана растворяли в 100 мкл диметилсульфоксида (ДМСО), определяли оптическую плотность на приборе «Multiskan RC» на длине волны 570 нм, вычитая фон при 620 нм. Результаты МТТ-теста обрабатывали с помощью программы «Microsoft Excel 2002».
Расчет процента погибших клеток проводился по стандартной формуле:
(%)=[1-(ОПэ+м-ОПэ)/ОПм]×100, где:
ОПэ+м - значение оптической плотности в опытных сериях;
ОПэ - значение оптической плотности в лунках с эффекторами;
ОПм - значение оптической плотности в лунках с мишенями.
Цитотоксический индекс (ЦИ) рассчитывался как разница процента погибших клеток в опытной группе и интактной мыши.
Остановимся на подборе на феномене дополнительной иммунизации, при которой усиливается эффект торможения роста экспериментальных опухолей мыши, индуцированного инъекциями ЦФ и препарата ДНК
В работе [68] было показано, что препарат фрагментированной дцДНК человека стимулирует созревание ДК мыши в культуре. Эффективность индукции созревания ДК препаратом ДНК оказалась сопоставима со стандартным индуктором созревания ФНОα. Полученные зрелые ДК, нагруженные антигеном в процессе созревания, были использованы