Ингибиторы для передачи сигнала брассиностероидов
Иллюстрации
Показать всеНастоящее изобретение описывает применение соединения, имеющего формулу (I)
, где Х представляет собой F, Cl, Br или I; R1 представляет собой СН3, С2Н5, C2H4R3, C2H3R3R4, С3Н7, С3Н6R3 или C3H5R3R4; R2 представляет собой Н, СН3, С2Н5, C2H4R3 или С2Н3R3R4; и R3 и R4 независимо представляют собой X, ОН или NH2, для обработки растений, в частности, для увеличения роста растений, повышения урожайности и/или обеспечения устойчивости к стрессу, кроме того, изобретение описывает метиловый эфир 4-[(5-йодпирид-2-ил)амино]-4-оксобутановой кислоты, а также способ получения данного соединения. Технический результат: получено и описано новое соединение, которое может быть полезно для обработки растений с целью увеличения роста растений. 7 н. и 1 з.п. ф-лы, 1 прим., 1 табл., 6 ил.
Реферат
Изобретение относится к ингибиторам передачи сигнала брассиностероидов.
Брассиностероиды представляют собой растительные стероидные гормоны, вовлеченные во многие процессы, включая рост и деление клеток, рост пыльцевой трубки, развитие сосудистой ткани, старение и модуляцию реакций на стресс. Брассиностероиды образуются из предшественников - стеролов. Многие ферменты, участвующие в биосинтезе брассиностероидов, были идентифицированы путем анализа мутантов Arabidopsis thaliana, таких как dwfl, cbbl, dwf4, cpd, det2 и stel/dwf7. В последнее время анализ мутации dx томата позволил идентифицировать фермент, участвующий в последней стадии биосинтеза брассиностероидов, а именно, в превращении кастастерона в брассинолид, самый активный брассиностероид. Два гомолога Arabidopsis thaliana смогли идентифицировать с помощью подхода "ген-кандидат". Данные ферменты, как и DWF4 и CPD, относятся к семейству монооксигеназ цитохрома Р450.
Брассинолид различают посредством рецепторной киназы BRI1 и ее корецептора BAKI, которые в отличие от стероидных рецепторов животных локализуются в клеточной мембране. Сигнал передается в ядро посредством невыясненных до сих пор механизмов и регулирует GSK-3/Shaggy-подобные киназы, включенные в передачу сигнала брассиностероидов: BIN2/UCU1, ASKL, ASKζ и ASKΘ (Vert and Chory, 2006). Данные киназы фосфорилируют транскрипционные факторы, относящиеся к семейству BES1/BZR1, в консервативном мотиве, состоящем из восьми смежных повторов последовательности SXXXS. Таким образом, активность данных транскрипционных факторов блокируется, так как только их нефосфорилированные варианты могут связываться с ДНК и регулировать экспрессию генов. Дефосфорилированию способствует ядерная протеинфосфатаза BSU1 и ее гомологи BSL 1-3. Более того, белки 14-3-3 могут связывать фосфорилированные BZR1 и BES1, которые могут способствовать их релокализации в цитоплазму.
Несмотря на то, что известен ряд ферментов, участвующих в синтезе и передаче сигнала брассиностероидов, доступно очень малое число ингибиторов. Первый известный селективный ингибитор синтеза брассиностероидов представлял собой КМ-01 (Kim et al., 1998). Применение данного ингибитора было очень ограничено из-за его низкой активности. Исследования, показавшие что ингибитор биосинтеза гиббереллиновой кислоты, униконазол (uniconazol), обладает слабым ингибирующим действием на биосинтез брассиностероидов, привели к разработке брассиназола (brassinazole) (Min et al., 1999) и Brz2001 (Sekimata et al., 2001). Аналогичным образом другой ингибитор брассиностероидов идентифицировали путем модификации пропиконазола (propiconazole) (Sekimata et al., 2002). «Мишень» действия брассиназола представляет собой гемовое железо монооксигеназы DWF4 цитохрома Р450. Брассиназол широко применяют для исследования синтеза и действия брассиностероидов. Кроме того, брассиназол применяли для генетических скринингов (селекции) с выделением мутантов, не реагирующих на данное соединение. Это позволило идентифицировать транскрипционный фактор BZRl.
4-[(5-бром-2-пиридинил)амино]-4-оксобутановая кислота представляет собой моноамид янтарной кислоты с 2-амино-5-бромпиридином. Было обнаружено, что бром в положении 5 пиридинового кольца и группа карбоновой кислоты являются признаками, имеющими важное значение для ее активности. В последнее время 4-[(5-бром-2-пиридинил)амино]-4-оксобутановая кислота была идентифицирована в качестве ингибитора передачи сигнала брассиностероидов с помощью методов химической генетики. 4-[(5-бром-2-пиридинил)амино]-4-оксобутановая кислота представляет собой нестероидное соединение, индуцирующее конститутивные реакции брассиностероидов в растениях путем ингибирования большинства GSK-3/Shaggy-подобных киназ. A. thaliana содержит 10 ASK (GSK-3/Shaggy-подобные киназы A. thaliana), которые могут быть подразделены на 4 группы. Киназы группы I (ASKα, ASKγ и ASKε) и киназы группы II (BIN2, ASKζ и ASKL) наиболее чувствительны к 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоте. Киназа ASKΘ группы III умеренно ингибируется, в то время как вторая киназа группы III, ASKβ, не ингибируется. ASKδ, киназа группы IV, также чувствительна к 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоте. Причина данной специфичности неизвестна.
4-[(5-бром-2-пиридинил)амино]-4-оксометиловый эфир бутановой кислоты имеет регистрационный номер CAS 697231-46-2. Burdulene et al. (Pharm. Chem. J., 30 (1996): 680-682) в частности описывают реакцию 2-амино-5-бромпиридина с янтарным ангидридом с получением бикинина (bikinin). В GB 1 162 727 А описаны N-замещенные аминовые кислоты, способствующие росту растений.
Asami et al. (Глава 19 в "Pesticide Chemistry", (2007), WILEY-VCH) сообщают общие сведения о небольших молекулах в науке о пестицидах. Ostaszewski et al. (J. Molec. Struct., 474(1999): 197-206) описывают исследования конформации молекул амидоэфиров пиридина, содержащих один и два заместителя. Roma et al. (Bioo. Med. Chem., 8 (2000): 751-768) сообщают о содержащих заместители пиримидин-4-онах. В WO 2008/049729 Al описаны нестероидные миметики брассиностероидов.
Задача настоящего изобретения заключается в получении дополнительных ингибиторов передачи сигнала брассиностероидов, подобных 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоте. Предпочтительно, ингибирующая активность новых катализаторов in vivo должна быть выше ингибирующей активности 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоты.
Соответственно, согласно настоящему изобретению предложено применение соединения формулы (I)
где Х представляет собой F, Cl, Br или I;
R1 представляет собой СН3, С2Н5, C2H4R3, C2H3R3R4, С3Н7, C3H6R3 или C3H5R3R4;
R2 представляет собой Н, СН3, С2Н5, C2H4R3 или C2H3R3R4; и
R3 и R4 независимо представляют собой X, ОН или NH2,
для обработки растений, в частности для увеличения роста растений, повышения урожайности и/или обеспечения устойчивости к стрессу.
В соединениях, где R1 представляет собой пропильный остаток (т.е. соединение представляет собой пропиловый эфир), С3Н7, C3H6R3 или C3H5R3R4 могут быть присоединены через атом О к карбонилу посредством крайних атомов С (н-пропил) или посредством центрального атома С (изопропил).
Согласно настоящему изобретению предложены варианты эфиров 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоты, образованные небольшими алифатическими спиртами, возможно содержащими в качестве заместителей галоген, ОН или NH2. Представители данных вариантов эфиров 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоты (R1=H) согласно настоящему изобретению обладают улучшенными физико-химическими свойствами для введения растениям (обработка и поглощение in vivo растениями или клетками растений). С помощью настоящего изобретения может быть показано, что по меньшей мере некоторые члены данной группы неожиданно продемонстрировали проявление улучшенной ингибирующей активности in vivo (т.е. во время введения растениям или клеткам растений) в отношении киназ, включенных в передачу сигнала брассиностероидов, по сравнению с 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислотой.
В частности, соединение, имеющее формулу (II)
,
а именно, метиловый эфир 4-[(5-йодпирид-2-ил)амино]-4-оксобутановой кислоты, продемонстрировало значительно улучшенное действие in vivo по сравнению с 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислотой. Cl- и Br-варианты формулы (II) также являются в частности предпочтительными. Другое предпочтительное соединение представляет собой этилатную форму формулы (I), то есть соединение, где R1 представляет собой C2H5 и R2 представляет собой Н. В данной этилатной форме I-, Br- и Cl-соединение является предпочтительным.
Соединения согласно настоящему изобретению представляют собой миметики брассиностероидов, которые могут быть использованы в технологии выращивания растений, например, для увеличения роста растений, устойчивости к биотическому и/или абиотическому стрессу или урожайности. С помощью настоящего изобретения можно повышать урожаи биомассы.
Другой аспект настоящего изобретения относится к композиции для увеличения роста растений и/или урожайности, содержащей эффективное количество соединения согласно формуле (I) или (II). Указанное «эффективное количество» может быть легко установлено специалистом в данной области техники путем применения лабораторной модели к внелабораторной обработке. Соединение согласно настоящему изобретению может быть использовано в эффективной концентрации в зависимости от условий в соответствующей области. Подходящие концентрации могут находиться в диапазоне (мкмоль/л) от низкой до средней, например, от 1 до 500 мкмоль/л, предпочтительно от 5 до 100 мкмоль/л. Соединения согласно настоящему изобретению могут быть растворены в органических растворителях, подходящих и разрешенных в технологии выращивания растений и сельском хозяйстве, предпочтительно в ДМСО или этаноле, и разбавлены до необходимой концентрации водой или водными растворами буферов и/или способствующих росту растений соединений, и/или средств защиты растений.
В соответствии с настоящим изобретением композицию согласно настоящему изобретению применяют для обработки растений. Согласно наиболее предпочтительному варианту реализации, соединения формулы (I) или (II) применяют в качестве гербицидов. В связи с тем, что применение для стимуляции роста растений, как правило, осуществляют в диапазоне концентраций 1-10 мкМ или даже ниже, применение в качестве гербицида предпочтительно осуществляют в концентрациях, равных 50 мкМ или больше, например, 50-500 мкМ.
Настоящее изобретение также относится к способу получения соединения согласно формуле (II), в котором 2-амино-5-йодпиридин подвергают реакции с метилсукцинилгалогенидом, предпочтительно метилсукцинилхлоридом. 2-амино-5-йодпиридин растворяют в подходящем растворителе, предпочтительно тетрагидрофуране, также содержащем четвертичный амин, предпочтительно триэтиламин (предпочтительно в молярном избытке (в частности 10-40%) по сравнению с 2-амино-5-йодпиридином). Затем метилсукцинилгалогенид (предпочтительно в том же растворителе, что и 2-амино-5-йодпиридин) добавляют (предпочтительно в небольшом молярном избытке (в частности 2-10%)) таким образом, чтобы температура не поднималась выше 50°С, предпочтительно не выше 45°С, в частности не выше 40°С. Затем реакционную смесь можно дополнительно перемешивать в течение 5-60 минут при температуре 20-40°С, в частности при комнатной температуре (25°С). Затем добавляют воду и снижают рН (предпочтительно путем добавления соляной кислоты) до рН ниже 6,5, в частности до примерно 6. Затем продукт может быть экстрагирован подходящим растворителем для экстракции, например, диэтиловым эфиром, и промыт (например, разбавленной слабой кислотой, такой как 1% уксусная кислота). Перед выпариванием эфира при пониженном давлении остаточная вода может быть удалена гигроскопическими веществами, такими как безводный сульфат натрия. Перекристаллизация может быть выполнена, например из 95% этанола или толуола с получением почти белого продукта.
Настоящее изобретение также относится к способу получения соединения согласно формуле (III)
и его последующей этерификации или алкилированию с получением соединения согласно формуле (II) (X представляет собой I и R2 представляет собой Н). Данный способ согласно настоящему изобретению отличается тем, что 2-амино-5-йодпиридин подвергают реакции с янтарным ангидридом с получением соединения, имеющего формулу (III). Карбоксильная группа данного соединения может быть затем этерифицирована или алкилирована с получением соединения, имеющего формулу (II).
Более подробно, для получения соединения согласно формуле (III) 2-амино-5-йодриридин растворяют в подходящем растворителе, предпочтительно тетрагидрофуране. Затем янтарный ангидрид (предпочтительно в том же растворителе, что и 2-амино-5-йодпиридин) добавляют (предпочтительно в молярном избытке (в частности 10-40% избытке) по сравнению с 2-амино-5-йодпиридином) и смесь нагревают в колбе с обратным холодильником в течение подходящего количества времени, чтобы реакция прошла в необходимой степени, предпочтительно в течение 30 минут - 5 часов, более предпочтительно в течение 1-4 часов, в частности 2 часов. Неочищенный продукт может быть получен путем охлаждения реакционной смеси, например, до 4°С в течение нескольких часов (например, 1-10 часов). Неочищенный продукт может быть перекристаллизован, например, из 95% этанола.
Затем свободная кислота согласно формуле (III) может быть алкилирована с использованием метилгалогенида, диметилсульфата или диазометана или этерифицирована СН3-ОН с получением вещества согласно формуле (II).
В предпочтительном варианте реализации настоящего изобретения 2-амино-5-йодпиридин подвергают взаимодействию с метилсукцинилхлоридом.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами и фигурами.
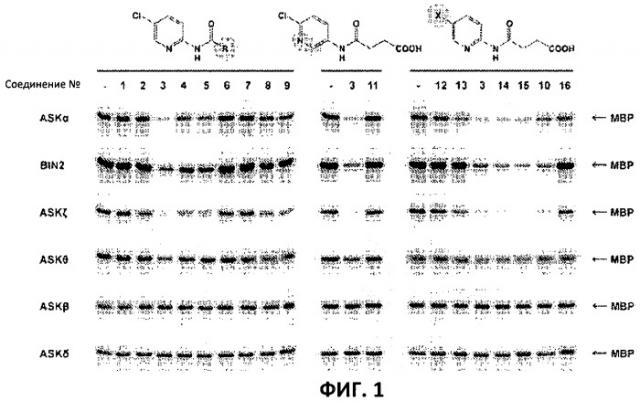
Фиг.1: Некоторые пиридиламинопроизводные ингибируют киназы ASK., in vitro. Гибридные белки GST-ASK инкубировали с МБР (основной белок миелина) в качестве субстрата и γ~[32Р]-АТФ в качестве косубстрата в отсутствии (-) или присутствии различных производных (цифры соответствуют Таблице 1). Соединения 1-9 (левый блок) отличаются алифатической боковой цепью. Влияние положения гетероциклического азота тестировали с помощью соединений 3 и 11 (средний блок; показанная молекулярная структура представляет собой соединение 11). Правый блок показывает влияние водородного заместителя пиридинового кольца. Указанные соединения использовали в концентрации, равной 10 мкМ. Белки разделяли путем SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия) и введенный радиоактивный фосфат детектировали с использованием фосфорного экрана с длительным послесвечением (storage phosphor imager screen).
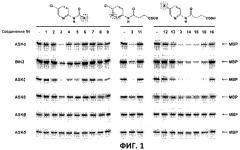
Фиг.2: Соединение 15 демонстрирует самую высокую активность. GST-BIN2 инкубировали с МБР и γ~[32Р]-АТФ в отсутствии или присутствии соединений 3, 14 и 15 в концентрации, равной 10 мкМ. Белки разделяли путем SDS-PAGE и фосфорилирование МВР количественно определяли с использованием фосфорного экрана с длительным послесвечением. Остаточную активность выражают в % от контроля. Средние значения и стандартные отклонения рассчитывали по данным четырех независимых анализов.
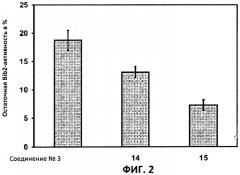
Фиг.3: Действия на фенотип мутантов брассиностероидов. 7-дневные всходы мутанта cpd синтеза брассиностероидов и мутанта bril-1 передачи сигнала переносили в среду 1/2 MS, содержащую 1 мкм эпи-брассинолид (Epi-BL) или соединения 10 и 15 в концентрации, равной 30 мкМ., и инкубировали в течение 7 дней в условиях длинного дня. Все изображения получали с одинаковым увеличением. Полоса представляет собой 1 мм.
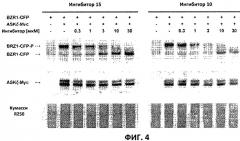
Фиг.4: Соединения 10 и 15 представляют собой сильные ингибиторы in vivo. Протопласты A. thaliana котрансформировали с помощью экспрессионных конструкций BZR1-CFP и Мус-меченых ASKζ и подвергали воздействию увеличивающихся концентраций соединений 10 и 15. BESl-CFP и ASKζ-Myc детектировали путем вестерн-блоттинга (western blot analysis) с использованием поликлональных антител анти-GFP и моноклональных антител анти-Мус соответственно. Окрашивание Кумасси R250 представлено в качестве контроля нагрузки. В зависимости от активности киназы ASKζ BZRl-CFP можно наблюдать в фосфорилированной или нефосфорилированной форме (показано стрелками). Применение ингибитора не влияло на соотношение двух полос ASKζ-Myc, обозначающих посттрансляционную модификацию данного белка.
Фиг.5: Этерифицированные соединения быстро гидролизуются в растениях. Всходы А. thaliana пропитывали средой 1/2 MS, содержащей 50 мкМ соединения 10. Контрольные образцы отбирали перед пропитыванием (А) и анализировали путем ВЭЖХ. Продукт биотрансформации (обозначенный Р) соединения 10 можно обнаружить по истечении 15 минут (В). Хроматограмма смеси соединений 10, 15 и 17 (меченых С10, С 15 и С17 соответственно) представлена для сравнения (С). Небольшие графики, помещенные на хроматограммы, демонстрируют УФ-спектры пиков в диапазоне 220-360 нм. mAu, милли-единицы поглощения, зафиксированные при 250 нм.
Фиг.6: Метилирование увеличивает тканевую проницаемость. Всходы A. thaliana инкубировали в 50 мкМ растворах соединений 10 и 15 в среде 1/2MS. Образцы отбирали после указанного времени и уровни in situ соединения 15 анализировали путем ВЭЖХ. Сплошная линия отображает результаты для растений, инкубированных с соединением 10, а пунктирная линия - результаты для соединения 15. Средние и стандартные отклонения рассчитывали по данным трех независимых анализов.
ПРИМЕРЫ
Важное значение длины и пространственной конфигурации алифатической боковой цепи, а также положения гетероциклического азота выявляли путем синтеза ряда производных, обладающих структурой, схожей с 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислотой, и варьирования длины алифатической боковой цепи от двух до шести атомов углерода. Более того, пространственную структуру модифицировали путем введения двойной связи. Для получения более активного ингибитора получали производные, содержащие фтор-, хлор-, бром- и йод-заместители в положении 5 пиридинового кольца. Синтезированные соединения тестировали in vitro и in vivo. Кроме того, определяли клеточную проницаемость выбранных соединений.
Материалы и способы
Химические вещества
Химические вещества, используемые для синтеза соединений, приобретали в компании "Fluka" (Букс, Швейцария) или "Aldrich" (Штайнхайм, Германия). Использовали растворители для ВЭЖХ и ТСХ фирмы "Roth" (Карлсруэ, Германия).
Синтез
Соединения для реакции и выходы продуктов приведены в Таблице 1.
| Таблица 1 | ||||||||
| Соединения, синтезированные и проанализированные на предмет биологической активности | ||||||||
| № | Соединения для реакции | Способ | Х | R | Выход | tR a | λ1; λ2 b | pKac |
| 1 | 2-Амино-5-хлорпиридин, Метилоксалилхлорид | D | Cl | 39% | 5,6 | 254; 291 | ||
| 2 | 2-Амино-5-хлорпиридин, Метилмалонилхлорид | D | Cl | 30% | 5,9 | 245; 287 | ||
| 3 | 2-Амино-5-хлорпиридин Янтарный ангидрид | А | Cl | 54% | 8,6 | 245; 287 | 5,4 | |
| 4 | 2-Амино-5-хлорпиридин, Глутаровый ангидрид | A | Cl | 71% | 9,9 | 245; 288 | ||
| 5 | 2-Амино-5-хлорпиридин, Метиладипоилхлорид | D | Cl | 20% | 11,5 | 245; 288 | ||
| 6 | 2-Амино-5-хлорпиридин, Малеиновый ангидрид | А | Cl | 22% | 7,5 | 222; 298 | ||
| 7 | 2-Амино-5-хлорпиридин, Фталевый ангидрид | А | Cl | 63% | 9,1 | 249; 289 | ||
| 8 | 2-Амино-5-хлорпиридин, Метилмалонилхлорид | C | Cl | 41% | 14,6 | |||
| 9 | 2-Амино-5-хлорпиридин, Метилсукци нилхлорид | C | Cl | 33% | 15,7 | 245; 288 | ||
| 10d | 2-Амино-5-йодпиридин, Метилсукци нилхлорид | C | I | 30% | 17,8 | 252; 293 | ||
| 11 | 5-Амино-2-хлорпиридин, Янтарный ангидрид | A | Cl | 69% | 6,7 | 248; 284 | ||
| 12 | 2-Аминопиридин, Янтарный ангидрид | A | H | 74% | 4,2 | 235; 276 | 4,9 | |
| 13 | 2-Амино-5-фторпиридин, Янтарный ангидрид | A | F | 68% | 5,7 | 235; 283 | ||
| 14d | 2-Амино-5-бромпиридин, Янтарный ангидрид | A | Br | 65% | 9,6 | 247; 289 | 5,6 | |
| 15d | 2-Амино-5-йодпиридин, Янтарный ангидрид | А | I | 35% | 10,7 | 252; 292 | 5,8 | |
| 16 | 2-Амино-5-нитропиридин, Янтарный ангидрид | В | NO2 | 29% | 9,1 | 221; 350 | ||
| 17 | 2-Амино-5-йодпиридин, Янтарный ангидрид | D | I | 28% | 17,9 | 253; 291 |
| a Время удерживания в минутах. | |
| b Максимумы поглощения в нм (при рН 4,8) | |
| c рКа (отрицательны и десятичный логарифм константы диссоциации) карбоновой кислоты определяли в 50% (в объемном отношении) метаноле. | |
| d Соединения 10, 14 и 15 также называются метиловым эфиром 4-[(5-йодпирид-2-ил)амино]-4-оксобутановой кислоты, 4-[(5-бромпирид-2-ил)амино]-4-оксобутановой кислотой и 4-[(5-йодпирид-2-ил)амино]-4-оксобутановой кислотой, соответственно. |
Способ А: Раствор 25 мМ ангидрида дикарбоновой кислоты, растворенного в 15 мл тетрагидрофурана (10 мл для фталевого ангидрида), помещали в круглодонную колбу, оснащенную обратным холодильником, и добавляли 20 мМ амина, растворенного в 10 мл тетрагидрофурана. Смесь нагревали в колбе с обратным холодильником в течение двух часов. Продукт начинал кристаллизоваться в конце реакции. Кристаллизацию завершали путем охлаждения до 4°С в течение нескольких часов. Неочищенный продукт фильтровали с отсасыванием и перекристаллизовывали из 95% этанола, за исключением производного фталиевой кислоты, которое перекристаллизовывали из 80% ацетонитрила.
Способ В: Раствор 20 мМ 2-амино-5-нитропиридина, растворенного в 30 мл тетрагидрофурана, помещали в круглодонную колбу и добавляли 25 мМ твердого янтарного ангидрида. К колбе присоединяли обратный холодильник и нагревали смесь в мягких условиях кипения в течение двух часов. Затем реакционную смесь охлаждали до -20°С в течение нескольких дней. Неочищенный продукт фильтровали с отсасыванием и перекристаллизовывали из горячей воды.
Способ С: 20 мМ амина растворяли в смеси 40 мл тетрагидрофурана и 3,5 мл (25 мМ) триэтиламина и помещали в трехгорлую круглодонную колбу, оснащенную обратным холодильником, капельной воронкой и термометром. Реакционную смесь смешивали путем магнитного перемешивания. Через капельную воронку медленно добавляли раствор 21 мМ хлорангидрида, растворенного в 10 мл тетрагидрофурана, с такой скоростью, чтобы температура не была выше 40°С. После добавления всего хлорида реакционную смесь перемешивали в течение еще 15 минут при комнатной температуре. Затем указанную смесь добавляли к 200 мл холодной воды и рН доводили до 6 разбавленной соляной кислотой. Продукт три раза экстрагировали 50 мл диэтилэфира (каждый раз) и смешанные эфирные экстракты промывали 50 мл 1% уксусной кислоты. Перед выпариванием эфира при пониженном давлении остаточную воду удаляли безводным сульфатом натрия. Желтоватый остаток перекристаллизовывали из 95% этанола (хлорпроизводные) или толуола (йодпроизводное) с получением почти белого продукта.
Способ D: 21 мМ хлорангидрида растворяли в 10 мл тетрагидрофурана и добавляли к смеси 20 мМ 2-амино-5-хлорпиридина, 3.5 мл (25 мМ) триэтиламина и 40 мл тетрагидрофурана, как описано в способе С.Смесь перемешивали в течение 15 минут перед фильтрацией с удалением гидрохлорида триэтиламина. Твердое вещество промывали 10 мл тетрагидрофурана и смешанные фильтраты выпаривали при пониженном давлении. В случае оксалилпроизводного остаток растворяли в 90 мл горячего 95% этанола и горячий раствор фильтровали. Смесь перемешивали и добавляли 40 мМ КОН, растворенного в 10 мл воды, с такой скоростью, чтобы температура не была выше 40 С.Реакцию завершали путем перемешивания в течение еще 10 минут.Продукт отделялся в виде белой соли калия, которую собирали путем отсасывания. Остаток растворяли в 100 мл (йодпроизводное: 250 мл) горячей воды и фильтровали. К горячему фильтрату добавляли соляную кислоту до рН, равного 2. Продукт отделялся в виде свободной кислоты во время инкубации при 4°С в течение ночи. Затем продукт очищали путем перекристаллизации из 95% этанола.
В случае малонил- и адипоилпроизводных остаток растворяли в 200 мл МеОН и фильтровали. Раствор помещали в трехгорлую круглодонную колбу, оснащенную обратным холодильником, капельной воронкой и термометром, и нагревали до 50°С. При перемешивании смеси через капельную воронку быстро добавляли 40 мМ КОН, растворенного в 40 мл воды, и температуру поддерживали при 50°С. Реакцию завершали путем перемешивания в течение еще 10 минут при той же температуре. Избыток КОН нейтрализовали путем добавления 40 мМ NH4Cl, растворенного в 10 мл воды. Большую часть растворителя удаляли при пониженном давлении, а остаток растворяли в воде (примерно 200 мл) и фильтровали. К прозрачному фильтрату добавляли муравьиную кислоту до рН, равного 3. Продукт отделялся в виде белых кристаллов во время инкубации при 4°С в течение ночи. Малонил- и адипоилпроизводные очищали путем перекристаллизации из 95% или 50% этанола соответственно.
Анализ чистоты синтезированных соединений
Тонкослойная хроматография (ТСХ): указанные соединения растворяли в этаноле и наносили в виде пятен на пластины с предварительно нанесенным силикагелем 60 F254 (Merck, Дармштадт, Германия). Пластины оставляли в смеси этилацетат/петролейный эфир/уксусная кислота/вода = 100/60/1/1, чтобы растворитель поднялся. Гашение флюоресценции наблюдали при облучении пластины коротковолновым УФ (254 им). Некоторые соединения демонстрировали автофлуоресценцию, которую наблюдали при средневолновом УФ-облучении (302 нм).
Высокоэффективная жидкостная хроматография (ВЭЖХ): Система ВЭЖХ включала насос Dionex Р680, автодозатор ASI-100 и фотодиодный матричный детектор PDA-100. Систему оснащали колонкой Macherey-Nagel 250 мм × 4 мм Nucleosil 100-5 С 18, которую предварял 2 мкм встроенный фильтр Valco. Постоянную скорость потока, равную 1 мл/мин, поддерживали градиентом растворителя А (20 мМ уксусная кислота, доведенная до рН, равного 4.8, с помощью NaOH в 15% ацетонитриле) и растворителя В (20 мМ уксусная кислота, доведенная до рН, равного 4.8, с помощью NaOH в 60% ацетонитриле). Элюирование начинали изократическим потоком растворителя А в течение 1 минуты. Затем концентрацию растворителя В линейно повышали до 100% в течение 19 минут и поддерживали изократической в течение еще 2 минут перед ее уменьшением до 0% в течение одной минуты. Колонку уравновешивали растворителем А в течение 5 минут перед введением следующего образца. УФ-спектры регистрировали от 220 до 400 нм с интервалами 1 нм. Для количественного определения использовали поглощение при 250 нм с шириной полосы 10 нм.
Определение значений рКа
Взвешивали 50-100 мг соединения и растворяли в 50 мл 50% (в объемном отношении) метанола. Кривую титрования с использованием 50 мМ NaOH в качестве стандартного раствора снимали с помощью рН-метра Greisinger electonics GPHR 1400A. Точку эквивалентности определяли методом отношения разностей (ΔрН/ΔVNa0H) и рКа, полученной из кривой титрования при 50% нейтрализации.
Анализы киназной активности in vitro и in vivo ASK экспрессировали в виде GST-гибридных белков в BL21 E.coli. Анализы киназной активности in vitro осуществляли путем инкубации 50 нг GST-гибридного белка, 10 мкг основного миелинового белка (МВР; Sigma, St Louis, МО) в качестве субстрата и 0,15 МБк γ-[32Р]-АТФ в качестве косубстрата при 25°С в течение 30 минут. Реакционный буфер содержал: 20 мМ HEPES рН 7,4, 15 мМ MgCl2, 5 мМ EGTA и 1 мМ DTT. Для первоначальных экспериментов включали охлажденный АТФ в концентрациях до 3 мкМ. Продукты реакции разделяли путем SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия) и количество радиоактивности, введенное в МВР, количественно определяли с использованием фосфорного экрана storage phosphor imager screen Amersham и Molecular Imager FX Biorad. Киназную активность in vivo детектировали путем анализов фософорилирования на замедление подвижности в геле с использованием BZR1-CFP в качестве субстрата.
Физиологические тесты
Всходы CoIO или bril-1 Arabidopsis thaliana выращивали in vitro в планшетах 1/2 MS, содержащих 1% сахарозу в ростовой камере в условиях длинного дня (16 часов свет с 50 мкЕ·м-2·с-1, 8 часов темнота) в течение 7 дней. Затем их переносили в планшеты с добавлением ингибиторов в разных концентрациях и спустя 7 дней наблюдали действия на фенотип.
Анализ растительных экстрактов методом ВЭЖХ
Двухнедельные всходы CoIO A. thaliana пропитывали в вакууме 1/2 MS или 1/2 MS, содержащей 100 мкМ соединения 10, как описано ранее (Rozhon et al., 2005). Образцы отбирали через 15 минут и через 48 часов, промывали водой и растирали в жидком азоте в мелкодисперсный порошок. Взвешивали 100 мг порошка в реакционную пробирку и добавляли 1 мл буфера для экстракции (20 мМ TRIS/HCl рН 6,8, растворенный в 20% ацетонитриле). После инкубации в течение 30 минут в шейкере, настроенном на 800 об/мин, смесь центрифугировали и надосадочную жидкость фильтровали через 0.2 мкм фильтр. Экстракты анализировали путем ВЭЖХ с теми же параметрами, что указаны выше.
Анализ клеточной проницаемости
Двухнедельные всходы CoIO A. thaliana переносили в среду 1/2 MS, содержащую 50 мкМ ингибитора. После указанных моментов времени образцы удаляли, промывали водой, сушили фильтровальной бумагой и замораживали в жидком азоте. Для анализа растительный материал растирали в мелкодисперсный порошок в ступке, предварительно охлажденной жидким азотом. Приблизительно 100 мг порошка взвешивали в 1,5 мл реакционные пробирки и добавляли 1 мл 20 мМ TRIS/HCl рН 9,0. В качестве внутреннего стандарта добавляли 50 мкл 200 мкМ реакционной массы соединения 4. Экстракцию осуществляли при 80°С в течение 30 минут в термомиксере Eppendorf, настроенном на 800 об/мин. Экстракт центрифугировали в течение 5 минут при 15000 g и собирали прозрачную надосадочную жидкость. Прозрачный раствор подкисляли путем добавления 25 мкл 4М фосфорной кислоты и центрифугировали в течение двух минут при 15000 g. Надосадочную жидкость сразу же загружали в 100 мг РН картридж для твердофазной экстракции (Varian, Lake Forest, CA), кондиционированный 1 мл ацетонитрила и два раза 1 мл 100 мМ фосфорной кислоты. Колонки промывали 1 мл 100 мМ фосфорной кислоты и сушили путем использования вакуума в течение 1 минуты. Затем проводили элюирование 1 мл 100 мМ TRIS/HCl рН 9,0, содержащего 5% ацетонитрил. Элюат подкисляли путем добавления 15 мкл 4М фосфорной кислоты и использовали для ВЭЖХ, как описано выше.
Результаты
Синтез
4-[(5-бром-2-пиридинил)амино]-4-оксобутановую кислоту и другие производные получали путем образования амидов из замещенных аминопиридинов и ангидридов циклических карбоновых кислот или хлоридов монометиловых эфиров дикарбоновых кислот (Таблица 1). В последнем случае метальную группу впоследствии удаляли путем щелочного гидролиза, если необходимо. Чистоту подтверждали методами ТСХ и ВЭЖХ. На пластинах ТСХ с поднявшимся растворителем можно было наблюдать только одно пятно и пик необходимого соединения представлял собой по меньшей мере 95% от общей площади всех пиков на хроматограмме ВЭЖХ.
Ингибирование ASK in vitro
4-[(5-бром-2-пиридинил)амино]-4-оксобутановая кислота представляет собой сильный ингибитор ASK группы I и группы II. ASKΘ, ASK группы III, умеренно ингибируется. Вторая киназа данного класса, ASKβ, и киназа группы IV ASKδ не ингибируются. Представителей всех групп экспрессировали в качестве рекомбинантных гибридных белков GST в Е.coli. Активность синтезированных соединений в отношении выбранных ASK анализировали путем анализов киназной активности in vitro с использованием МВР (основного миелинового белка) в качестве субстрата и γ-[32Р]-АТФ в качестве косубстрата (Фиг.1).
Соединения 1-5 синтезировали для исследования эффекта от изменения длины алифатической боковой цепи. Самое активное соединение, №3, содержало цепь, состоящую из 4 атомов углерода (Фиг.1). Глутарильные (№4, 5 атомов углерода) и адипоильные (№5, 4 атома углерода) производные обладали значительно более низкой активностью, в то время как более короткие производные (№1 и 2, 2 или 3 атома углерода соответственно) почти не оказывали действия. В результате введения двойной связи в боковую цепь оптимальной длины активность полностью исчезала (Фиг.1, соединение 6). Это означает, что пространственная конфигурация имеет крайне важное значение. Для исследования того, имеет ли карбоксильная группа алифатической цепи ключевое значение для активности или достаточно оксогруппы, включали соединения 9 и 10, представляющие собой метилированные варианты соединений 3 и 15 соответственно. Кроме того, тестировали соединение 8, которое представляет собой структурный изомер соединения 3. Как показано на Фиг.1, метилированные варианты демонстрировали существенно сниженные ингибирующие эффекты, тем самым подтверждая важное. значение терминальной карбоксильной группы.
После идентификации оптимальной боковой цепи более подробно исследовали гетероциклическое кольцо. Оба соединения 3 и 11 содержат амидосукцинильную боковую цепь, но отличаются положением гетероциклического азота. Исследования киназной активности показали, что соединение 3 является более активным (Фиг.1), демонстрируя, что гетероциклический азот должен находиться рядом с положением, несущим заместитель амидоянтарной кислоты. Предшествующие данные указывали на то, что заместитель бром в положении 5 пиридинового кольца имеет ключевое значение для биологической активности 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоты. Для тестирования влияния других заместителей синтезировали соединения. 12-16. Как показано на Фиг.1, хлор-, бром- и особенно йодпроизводные проявили высокую активность. Данная степень активности может быть подтверждена путем количественного определения остаточной киназной активности BIN2 (Фиг.2). В отличие от этого, фторсоединение проявляло очень низкую активность, а незамещенные производные и нитропроизводные были неактивными.
Все исследуемые соединения обладали схожей специфичностью к ASK. Активные производные сильно ингибировали ASKα, BIN2 и ASKζ, в то время как ASKΘ была лишь умеренно ингибирована. Действие тестируемых соединений на ASKβ и ASKδ было незначительным.
Ингибирование ASK in vivo
Отрицательная регуляция активности ASK имеет ключевое значение для передачи сигнала брассиностероидов. ASK конститутивно активны в мутантах cpd и bril-1, являющихся «дефектными» в биосинтезе или передачи сигнала брассиностероидов соответственно. Это приводит к тому, что растения значительно отстают в росте и имеют темно-зеленые закрученные вниз листья и укороченные гипокотили. Применение эпибрассинолида, синтетического брассиностероида, «спасает» cpd, но не bril-1, в то время как 4-[(5-бром-2-пиридинил)амино]-4-оксобутановая кислота «спасает» обоих мутантов. Для скрининга активности in vivo мутанты cpd и bril-1 переносили в среды, содержащие производные 4-[(5-бром-2-пиридинил)амино]-4-оксобутановой кислоты в концентрации 30 мкМ. Всходы, обработанные активными соединениями, демонстрировали широкие листья, увеличенные длины гипокотилей и имели светло-зеленый цвет. Активность в отношении «спасения» фенотипа коррелировала с результатами анализа in vitro. Однако интерес представляет тот факт, что соединение 10 было высокоактивным in vivo, но демонстрировало небольшую активность in vitro (Фиг.3).
По причине данного неожиданного результата влияние ингибирования на активнорть ASK in vivo анализировали прямым способом. Было показано, что некоторые ASK фосфорилируют факторы транскрипции BZR1, BES1 и ВЕН2 in vivo. Это приводит к сдвигу электрофоретической подвижности данных факторов транскрипции, что позволяет детектировать киназную активность in vivo. Протопласты A.thaliana котрансформировали с конструкциями CFP-меченого BZR1 и Мус-меченой ASKζ. Указанные два белка были выбраны, поскольку они хорошо экспрессированны в си