Адипонектин для лечения заболеваний легких
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложены средство для ингибирования увеличения воздушного пространства альвеол и средство для ингибирования деструкции стенок альвеол, включающие адипонектин. Предложенная группа изобретений обеспечивает новое терапевтическое средство для лечения заболеваний легких, сопровождаемых необратимым ухудшением функции легких. 2 н. и 2 з.п. ф-лы, 2 ил., 2 табл., 1 пр.
Реферат
Область техники
Настоящее изобретение относится к средству для лечения заболеваний легких, которое ингибирует патологическое увеличение воздушного пространства альвеол, ассоциированное с деструктивными изменениями стенок альвеол, вызванными их хроническим повреждением, и/или которое ингибирует деструктивные изменения стенок альвеол.
Предшествующий уровень техники изобретения
Различные известные болезни легких (БЛ (PD)) включают острый бронхит из-за острого воспаления, вызванного вирусами или бактериями; бронхиальную астму, преимущественно вызванную воспалительным ответом дыхательных путей из-за эозинофилов; интерстициальную пневмонию, вызванную воспалением эпителия альвеол; рак легких, вызванный раковым клетками; и хронические обструктивные болезни легких (ХОБЛ (COPD)), которые известны как заболевания, характеризуемые хроническим воспалением легких, вызванным различными факторами, особенно курением, приводящими к деструкции стенок альвеол и гипертрофии слизистых желез бронхов, приводящих к одышке, увеличению кашля и мокроты и др. В частности, заболевание, ранее называемое эмфиземой, часто осложняет заболевание, ранее называемое хроническим бронхитом, в различной степени. В настоящее время обструктивные болезни легких, в отношении таких двух заболеваний, называют ХОБЛ.
Известно, что ХОБЛ характеризуются прогрессирующим развитием ограничения воздушного потока (обструкции воздушного потока) (Непатентный документ 1).
В отличие от хронического бронхита, при котором гиперсекреция и инфекция дыхательных путей не включают ограничение воздушного потока, необратимое ограничение воздушного потока расценивают как результат патологических изменений периферических дыхательных путей. Такие заболевания легких включают, в добавление к вышеупомянутым обструктивным болезням легких, включающим эмфизему и хронический бронхит, муковисцидоз, бронхоэктаз, туберкулез, пневмокониоз и подобные.
К настоящему времени в отношении лекарственной терапии заболеваний легких, включая ХОБЛ, сопровождаемых необратимым ограничением воздушного потока, лекарственные препараты, такие как стимуляторы β2, антихолинергические средства и подобные, обладающие бронхорасширяющей активностью, используют для временного предупреждения или подавления симптомов. Однако, такие лекарственные средства, обладающие бронхорасширяющей активностью, не могут уменьшать в течение длительного периода времени ухудшение функции легких, что является наиболее важным клиническим показателем.
Во множестве крупных клинических исследований изучали эффекты терапии с использованием в качестве ингаляторов стероидов, обладающих сильным ингибирующим эффектом на продукцию цитокинов; однако, в некоторых документах сообщают, что стероиды могут не снижать ухудшение функции легких в течение длительного периода времени (см. Непатентные документы 2-4).
Относительно эффектов терапии БЛ с использованием лекарственных средств, обладающих ингибирующими эффектами на продукцию активного кислорода, не было проведено надежных клинических исследований.
В соответствии с клиническим исследованием, N-ацетилцистеин, антиоксидант, который расценивается как имеющий механизм действия, сходный с таковым средств для ингибирования продукции активного кислорода, может снижать частоту обострений ХОБЛ (Непатентный документ 5). Однако, ни в одном документе не сообщают о том, что N-ацетилцистеин проявляет эффект уменьшения ухудшения функции легких в течение длительного периода времени.
Кроме того, для лечения БЛ обсуждалось применение лекарственных средств, ингибирующих активность фосфодиэстеразы IV. Однако, сообщают, что такие лекарственные средства обладают нежелательными побочными эффектами, такими как тошнота, рвота и секреция желудочной кислоты (Непатентный документ 6).
Как описано выше, не было разработано лекарственных средств, которые обладают удовлетворительным эффектом в качестве лекарственного средства для лечения хронических болезней легких и которые уменьшают необратимое ухудшение функции легких, т.е. которые ингибируют патологическое увеличение воздушного пространства альвеол, ассоциированное с деструктивными изменениями стенок альвеол из-за их хронического повреждения и/или которые ингибируют деструктивные изменения стенок альвеол.
Список ссылок
Патентная литература
PTL 1: WO1996/39429
PTL 2: WO1999/21577
PTL 3: Японский патент № 3018186
PTL 4: Японский патент № 4147220
PTL 5: Японский нерассмотренный патент № 2004-16074
Непатентная литература
NPL 1: Pauwell, R.A. et.al., Am. J. Respir. Crit. Care Med., 2001(163), 1256-1276
NPL 2: Pauwels R.A., Lodahl C.G., Laitinen L.A., Schouten J.P., Postma D.S., Pride N.B., et al. N. Engl. J. Med., l999(340), 1948-1953
NPL 3: Vestbo J., Sorensen T., Lange P., Brix A., Torre P., Viskum K., Lancet, 1999(353)1819-1823
NPL 4: Burge PS, Calverley PM, Jones PW, Spencer S, Anderson JA, Maslen TK, BMJ, 2000(320), 1297-1303
NPL 5: C. Stey, J. Steurer, S. Bachmann, T.C. Medici, M.R. Tramer, Eur. Respir. J., 2000(16), 253-262
NPL 6: Peter J. Barnes, N. Engl. J. Med., 2000(343) No. 4, 269-280
NPL 7: Maeda, K. et al., Biocjem. Biophys. Res. Commun., 1996(221), 286-289
Сущность изобретения
Техническая проблема
Задачей настоящего изобретения является обеспечение высокобезопасного лекарственного средства, которое является применимым для лечения пациента с заболеванием легких, чья функция легких необратимо нарушена.
Решение проблемы
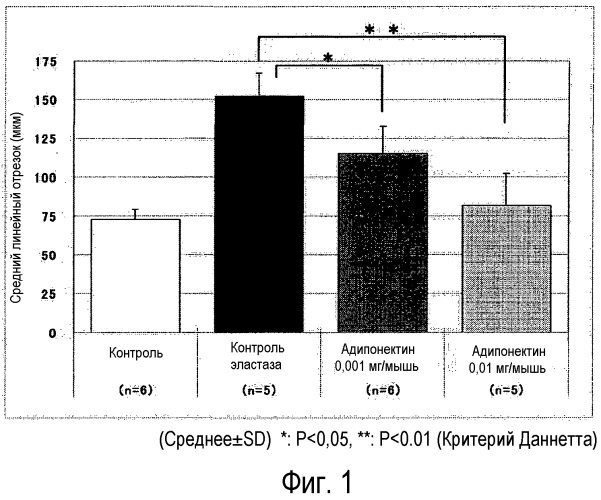
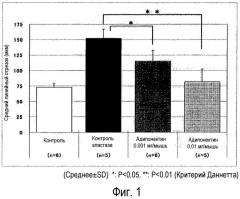
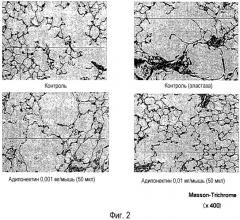
Авторы настоящего изобретения получили животную модель, которая отражает патогенетические характеристики, клинически очень сходные с ХОБЛ, сопровождаемые необратимым ухудшением функции легких, и провели обширные исследования с использованием такой модели на животных. В результате авторы обнаружили, что адипонектин, который известен как коллагеноподобный секреторный белок, специфически секретируемый жировыми клетками, ингибирует эмфизему легких и расстройства функции легких, вызванные обработкой эластазой, и обнаружили высокобезопасное новое терапевтическое средство, которое проявляет очень выраженный эффект лечения заболеваний легких, сопровождаемых необратимым ухудшением функции легких, с небольшим количеством нежелательных побочных эффектов, таких как тошнота, рвота и секреция желудочной кислоты. Настоящее изобретение было осуществлено на основании таких открытий.
Настоящее изобретение обеспечивает адипонектинсодержащее средство для ингибирования увеличения воздушного пространства альвеол и адипонектинсодержащее средство для ингибирования деструкции стенок альвеол.
Пункт 1. Средство для ингибирования увеличения воздушного пространства альвеол, включающее адипонектин.
Пункт 2. Средство по п.1, где адипонектин содержится в количестве, эффективном для ингибирования увеличения воздушного пространства альвеол, ассоциированного с деструктивными изменениями стенок альвеол.
Пункт 3. Средство по п.1 или 2, где адипонектин содержится в количестве от 0,01 до 70% масс.
Пункт 4. Средство по любому из пп.1-3, для применения в лечении эмфиземы, хронического бронхита, муковисцидоза, бронхоэктаза, туберкулеза, пневмокониоза или хронических обструктивных болезней легких.
Пункт 5. Средство для ингибирования деструкции стенок альвеол, включающее адипонектин.
Пункт 6. Средство по п.5, где адипонектин содержится в количестве, эффективном для ингибирования деструктивных изменений стенок альвеол.
Пункт 7. Средство по любому из пп.5 или 6, где адипонектин содержится в количестве от 0,01 до 70% масс.
Пункт 8. Средство по любому из пп.5-7, для применения для лечения эмфиземы, хронического бронхита, муковисцидоза, бронхоэктаза, туберкулеза, пневмокониоза или хронических обструктивных болезней легких.
Средство для ингибирования увеличения воздушного пространства альвеол по настоящему изобретению, содержащее адипонектин в количестве, эффективном для ингибирования увеличения воздушного пространства альвеол, ассоциированного с деструктивными изменениями стенок альвеол, и средство для ингибирования деструкции стенок альвеол по настоящему изобретению содержит адипонектин в количестве, эффективном для ингибирования деструкции стенок альвеол.
Адипонектин, который является активным ингредиентом средства для ингибирования увеличения воздушного пространства альвеол или средства для ингибирования деструкции стенок альвеол по настоящему изобретению, представляет собой коллагеноподобный белок, секретируемый жировыми клетками.
Адипонектин, который является активным ингредиентом средства для ингибирования увеличения воздушного пространства альвеол или средства для ингибирования деструкции стенок альвеол (далее в настоящем описании сокращаемого как "средства для лечения болезней легких") по настоящему изобретению, является легко доступным и хорошо известным веществом. Коммерчески доступный адипонектин или адипонектин, полученный известным способом, показанным в справочном примере, описанном позже, может быть обычно использован в изобретении.
Гены адипонектина человека и мыши описаны в Патентном документе 1, как человеческий Acrp30 и мышиный Acrp30, и человеческий адипонектин описан как apM1 в Непатентном документе 7 и Патентном документе 2. Предполагаемая последовательность аминокислот полипептида адипонектина, используемого в средствах для лечения болезней легких по настоящему изобретению в качестве активного ингредиента, описана в Патентном документе 2; однако, Патентный документ 2 относится единственно к ингибирующему эффекту полипептида на рост гладкомышечных клеток и его доступности в качестве средства для предотвращения или улучшения атеросклероза, средства для предотвращения или лечения рестеноза после ангиопластики и противовоспалительного средства.
Кроме того, Патентный документ 3 показывает применимость адипонектина, который подавляет, без макрофагов или лимфоцитов, клональный рост относительно зрелых моноцитарных клеток-предшественников в стадии дифференцировки, в качестве противовоспалительного средства и супрессора воспроизводства моноцитарных клеток. Более того, Патентный документ 4 указывает, что С-концевой боковой сферический домен адипонектина (соответствующий последовательности аминокислот SEQ ID NO: 114-239 человеческого адипонектина, и последовательностям аминокислот SEQ ID NO: 111-242 мышиного адипонектина) обладает эффектом снижения экспрессии фагоцитарного рецептора A и может быть использован в качестве профилактического и терапевтического средства при атеросклерозе. Сходным образом Патентный документ 5 относится к доступности С-концевого бокового сферического домена адипонектина в качестве активатора АМФ-активируемой протеинкиназы.
Следующий адипонектин является коммерчески доступным от Bio Vendor (Czechoslovakia; http://www.biovendor.com/products/proteins): глобулярный рекомбинантный адипонектин (Adiponectine Globular Human (E. coli)), рекомбинантный адипонектин, продуцируемый E. coli (Adiponectine Human E. coli His), рекомбинантный адипонектин, продуцируемый человеческими эмбриональными клетками почек (Adiponectine Human HEK293 Flag), тримерный рекомбинантный адипонектин, продуцируемый человеческими эмбриональными клетками почек (Adiponectine Human Trimeric form (HEK)), низко- и высокомолекулярный адипонектин, продуцируемый человеческими эмбриональными клетками почек (Adiponectine LMW и MMW oligomer-rich Human (HEK)), средне- и высокомолекулярный адипонектин, продуцируемый человеческими эмбриональными клетками почек (Adiponectine MMW и HMW oligomer-rich Human (HEK)), и др.
Специфическим примером полипептида, используемого в средствах для лечения болезней легких по настоящему изобретению в качестве активного ингредиента, является полипептид, известный как "адипонектин", кодируемый продуктом ПЦР и показанный в примерах, описанных позднее. Полноразмерная последовательность ДНК человеческого адипонектина имеет 4517 п.н. в длину, и последовательность ДНК, кодирующая открытую рамку считывания (ORF), имеет 732 п.н. в длину, как показано в SEQ ID NO: 2. Последовательность аминокислот, кодирующая ORF, состоит из последовательности 244 аминокислот, как показано в SEQ ID NO: 1, и последовательность гена зарегистрирована как GenBank номер по каталогу NM_004797. Кроме того, полноразмерная последовательность ДНК мышиного адипонектина имеет 1276 п.н. в длину, как показано в SEQ ID NO: 5, и последовательность ДНК, кодирующая ORF, имеет 741 п.н. в длину, как показано в SEQ ID NO: 4. Последовательность аминокислот, кодирующая ORF, состоит из последовательности 247 аминокислот, как показано в SEQ ID NO: 3, и последовательность гена зарегистрирована как GenBank номер по каталогу AF304466. Более того, была установлена экспрессия гена человеческого и мышиного адипонектина, специфическая для жировой ткани.
Гомология последовательности аминокислот между человеческим адипонектином и мышиным адипонектином составляет 83,61%, и гомология последовательности ДНК ORF составляет 79,78%. Такой заметно высокий уровень гомологии указывает, что оба имеют одинаковую активность.
Авторы настоящего изобретения обнаружили, что адипонектин ингибирует патологическое увеличение воздушного пространства альвеол, ассоциированное с деструктивными изменениями стенок альвеол из-за хронического повреждения или проявляет улучшение функции легких, достигаемое путем ингибирования деструктивных изменений стенок альвеол, и авторы заключили, что адипонектин может предпочтительно использоваться в качестве лекарственного средства.
Как описано выше, так как адипонектин может ингибировать патологическое увеличение воздушного пространства альвеол, ассоциированное с деструктивными изменения стенок альвеол из-за хронического повреждения, он может быть использован для лечения болезней легких, таких как эмфизема, хронический бронхит, муковисцидоз, бронхоэктазы, туберкулез, пневмокониоз и ХОБЛ.
Патентный документ 1: WO1996/39429
Патентный документ 2: WO1999/21577
Непатентный документ 7: Maeda, K. et al., B.B.R.C., (1996) Vol. 221 No.2, pp286-289
Далее описано получение адипонектина для использования в качестве активного ингредиента средств для лечения болезней легких по изобретению, получение средств для лечения болезней легких с использованием адипонектина в качестве активного ингредиента, и др.
Обозначения аминокислот, пептидов, последовательностей нуклеотидов, нуклеиновых кислот и др. посредством сокращений в настоящей спецификации соответствуют правилам номенклатуры, рекомендованной IUPAC-IUB (IUPAC-IUB Communication on Biological Nomenclature, Eur. J. Biochem., 138, 9(1984)), "The Guidelines for Drafting of Specifications Etc. Containing Nucleotide Sequence or Amino Acid Sequence Information" (Edited by the Japanese Patent Office, (July, 1998) и конвенциям в соответствующей области техники.
Адипонектин может быть представлен в форме рекомбинантного белка, полученного путем установленных генно-инженерных методик [например, Science, 224, 1431(1984): Biochem. Biophys. Res. Comm., 130, 692(1985); Proc. Natl. Acad. Sci., USA., 80, 5990 (1983)]. В таком случае в качестве гена адипонектина (apM1) может быть использован ген, который был ранее установлен авторами настоящего изобретения [Biochem. Biophys. Res. Commun., 221, 286-289 (1996)].
В качестве альтернативы, адипонектин может быть получен обычным способом химического синтеза в соответствии с информацией о последовательности аминокислот, кодируемой указанным геном.
Получение адипонектина посредством генно-инженерных методик может быть проведено в соответствии со способом, описанным в ссылочном примере 1 ниже. В частности, получение включает создание рекомбинантной ДНК, с которой ген, кодирующий белок по изобретению, может быть экспрессирован в клетке-хозяине, введение ДНК в клетку-хозяин для получения трансформанта и культивирование трансформанта.
В описании полинуклеотид (молекула ДНК) охватывает не только двухцепочечную ДНК, но также одноцепочечную ДНК, включая смысловые последовательности или антисмысловые последовательности, которые их составляют, и не ограничивается их длиной. Следовательно, полинуклеотид, кодирующий адипонектин, включает двухцепочечную ДНК и одноцепочечную ДНК (смысловая цепь), включая кДНК, и одноцепочечную ДНК (антисмысловая цепь), имеющую последовательность, комплементарную смысловой цепи, и синтетические фрагменты ДНК, если не упомянуто иначе.
Полинуклеотид (молекула ДНК) в настоящем описании не определяется функциональным участком и может включать, по меньшей мере, один участок подавления экспрессии, кодирующий участок, лидер-последовательность, экзон и интрон.
Полинуклеотид также включает РНК и ДНК. Полинуклеотид, включающий определенную последовательность аминокислот, и полинуклеотид, включающий определенную последовательность ДНК, включает ее фрагменты, гомологи, производные и мутации.
Мутанты полинуклеотида (мутантные ДНК) включают естественные аллельные мутанты, неестественные мутанты и мутанты, имеющие делеции, замены, добавления и вставки. Но такие мутанты кодируют полипептид, имеющий по существу ту же функцию, как функция полипептида, кодируемого полинуклеотидом до мутации.
Мутация полипептида (модификация последовательности аминокислот) необязательно возникает естественно, например, мутация или посттрансляционная модификация, и могут быть таковыми, искусственно произведенными путем использования натурального белка (например, человеческого адипонектина). Вышеуказанные мутанты полипептида включают аллельные варианты, гомологи и натуральные мутанты, имеющие по меньшей мере 80%, предпочтительно 95% и более предпочтительно 99% гомологию с полипептидом до мутации.
Гомология полипептида или полинуклеотида может быть проанализирована путем оценки с использованием программы FASTA (Clustal, V., Methods MoI. Biol., 25, 307-318(1994)). Как наиболее предпочтительный и простой метод для анализа гомологии возможно проиллюстрировать метод, в котором последовательность хранится на носителе (например, гибком диске, CD-ROM, жестком диске, внешнем диске, DVD, и др.), способном к считыванию компьютером, и затем ее ищут в известной базе данных последовательностей в соответствии с хорошо известной методикой поиска с использованием хранящейся последовательности. Специфические примеры известных баз данных последовательностей включают следующие:
- база данных ДНК Японии (DDBJ) (http://www.ddbj.nig.ac.jp/); - Genebank (http://www.ncbi.nlm.nih.gov/web/Genebank/Index.htlm); и
- База данных последовательностей нуклеиновых кислот Европейской лаборатории молекулярной биологии (EMBL) (http://www.ebi.ac.uk/ebi docs/embl db.html).
Множество алгоритмов поиска для анализа гомологии доступны специалисту в области техники. Один пример включает программу, называемую программой BLAST. Существует 5 методик BLAST в этой программе. Среди них три (BLASTN, BLASTX и TBLASTX) были созданы для проверки последовательности нуклеотидов. Оставшиеся две были созданы для проверки последовательности белка (Coulson, Trends in Biotechnology, 12:76-80(1994); Birren, et al., Genome Analysis, 1:543-559(1997)).
Кроме того, дополнительные программы, например программа выравнивания последовательности и программа для идентификации последовательностей, более дистанционно разделенных, доступны в области техники для анализа идентифицированной последовательности.
Мутантная ДНК является молчащей (отсутствие изменений остатков аминокислот, кодируемых мутантной последовательностью аминокислот) или консервативной для аминокислот, кодируемых ею. Примеры консервативных замен аминокислот показаны ниже.
| Исходный остаток аминокислоты | Консервативно замещенный остаток аминокислоты |
| Ala | Ser |
| Arg | Lys |
| Asn | Gln или His |
| Asp | Glu |
| Cys | Ser |
| Gln | Asn |
| Glu | Asp |
| Gly | Pro |
| His | Asn или Gln |
| Ile | Leu или Val |
| Leu | Ile или Val |
| Lys | Arg, Asn или Glu |
| Met | Leu или Ile |
| Phe | Met, Leu или Tyr |
| Ser | Thr |
| Thr | Ser |
| Trp | Tyr |
| Tyr | Trp или Phe |
| Val | Ile или Leu |
Обычно один или более кодонов, кодирующих остаток Cys, влияет на дисульфидную связь определенного полипептида.
Обычно считают, что замена остатка аминокислоты, влияющая на характеристики белка, включает следующие:
a) замена гидрофобного остатка гидрофильным остатком, например, замена Leu, Ile, Phe, Val или Ala с помощью Ser или Thr;
b) замена остатка аминокислоты, иных чем Cys и Pro, с помощью Cys или Pro;
c) замена остатка, имеющего электрически положительную боковую цепь, например, Lys, Arg или His, с помощью электрически отрицательного остатка, например, Glu или Asp; и
d) замена остатка аминокислот, имеющего крайне крупную боковую цепь, например, Phe, с помощью остатка аминокислоты, не имеющего боковой цепи, например, Gly.
Адипонектин включает последовательность аминокислот SEQ ID NO:1 или 3 или последовательность аминокислот, имеющую одну или более делеций, вставок, замен или добавлений аминокислот в последовательности аминокислот SEQ ID NO:1 или 3, и обладает активностью ингибирования увеличения воздушного пространства альвеол и/или эффектом улучшения функции легких.
Адипонектин может быть полипептидом, экспрессируемым в системе экспрессии белка с использованием Escherichia coli или системе экспрессии белка с использованием бакуловируса (AcNPV), показанных в примерах, описанных позже посредством генно-рекомбинантной методики, или полипептидом, полученным химическим синтезом.
В качестве одного специфического примера последовательности аминокислот адипонектина возможно проиллюстрировать одну из SEQ ID NO:1 или 3. Последовательность аминокислот адипонектина не ограничена одной из SEQ ID NO:1 или 3 и может быть таковой (гомологичной), имеющей определенную гомологию с ней. Гомологичные последовательности могут включать полипептиды, включающие последовательность аминокислот, имеющие одну или более делеций, вставок, замен или добавлений аминокислот в последовательности аминокислот SEQ ID NO:1 или 3 и обладающие активностью ингибирования увеличения воздушного пространства альвеол и/или активностью ингибирования деструкции стенок альвеол и эффектом улучшения функции легких (активность ингибирования патологического увеличения воздушного пространства альвеол, ассоциированного с деструктивными изменениями стенок альвеол из-за хронического повреждения, и/или активность ингибирования деструктивных изменений стенок альвеол).
Специфически, эффекты улучшения функции легких адипонектина включают эффект улучшения или уменьшения снижения дыхательной способности легких, или увеличения сопротивления дыханию в дыхательном тракте (особенно бронхоальвеолярном тракте) млекопитающих, таких как человек.
В качестве клетки-хозяина могут быть использованы клетки, полученные от эукариот и прокариот. Эукариотные клетки включают клетки позвоночных и клетки эукариотных микроорганизмов. В качестве клеток позвоночных часто используют клеточную линию обезьян COS (Cell, 23, 175 (1981)), клеточную линию клеток яичника китайского хомячка и соответствующую клеточную линию, дефицитную по дигидрофолатредуктазе (Proc. Natl. Acad. Sci., USA., 77, 4216 (1980)) и подобные, но они не являются единственным выбором.
В качестве вектора экспрессии позвоночного происхождения обычно может использоваться вектор, имеющий последовательность промотора, расположенную ниже в экспрессируемом гене, участок сплайсинга РНК (предшественник), участок полиаденилирования и последовательность терминирования транскрипции. Если необходимо, вектор может дополнительно иметь репликационное происхождение. В качестве примера такого вектора экспрессии может быть упомянут pSV2dhfr, содержащий ранний промотор SV40 (Mol. Cell. Biol., 1, 854 (1981)).
В качестве эукариотных микроорганизмов обычно используют дрожжи. Из них с преимуществом могут быть использованы дрожжи рода Saccharomyces. В качестве вектора экспрессии, полученного от эукариотных микроорганизмов, таких как дрожжи, может быть использован pAM82, имеющий промотор для гена кислой фосфатазы (Proc. Natl. Acad. Sci., USA., 80, 1 (1983)).
В качестве прокариотного организма-хозяина обычно используют Escherichia coli и Bacillus subtilis. Когда их используют в качестве организмов-хозяев с использованием плазмидного вектора, способного реплицироваться в микроорганизме-хозяине, возможно подходящим образом использовать плазмиду экспрессии, полученную путем включения последовательности промотора и SD (Shain и Dalgarano) и кодона инициации (например, ATG), требуемого для инициации синтеза белка выше гена, так что ген может экспрессироваться в таком векторе. Как указано, Escherichia coli в качестве организма-хозяина обычно используют E. coli K12, и в качестве вектора обычно используют pBR322 или его модифицированный продукт. Однако они не являются единственным выбором, а также могут использоваться различные известные бактериальные штаммы и векторы. Примерами промотора, которые могут быть использованы, являются триптофановый промотор (trp), lpp промотор, lac промотор и PL/PR промотор.
В качестве вектора для клеток насекомых возможно проиллюстрировать бакуловирусный вектор (Takara), в который включена кДНК адипонектина. В частности, продукт экспрессии по настоящему изобретению может быть получен путем введения бакуловирусного вектора экспрессии, в который включена кДНК адипонектина, в культивируемые клетки BmN4 или гусеницы шелкопряда (Bombyx mori) с использованием ядерного вируса полигедроза (BmNPV) шелкопряда для экспрессии и выделения из культуральной среды или жидкости тела шелкопряда путем хроматографии.
Экспрессируемый продукт по настоящему изобретению также может быть получен путем включения кДНК адипонектина в ядерный вирус полигедроза (AcNPV) Autographa californica, экспрессируемый в клетках Sf9 Spodoptera frugiperda или клетках Tn5 Trichoplusia ni, и иным образом очистки из надосадочной культуральной жидкости путем хроматографии.
Введение полученной рекомбинантной ДНК в клетку-хозяин для трансформации может проводиться в соответствии с известным способом.
Полученный трансформант может культивироваться в соответствии со стандартными методами, посредством чего рекомбинантный белок по изобретению экспрессируется и продуцируется (накапливается и секретируется) внутриклеточно, внеклеточно или на мембране клеток. В качестве среды, используемой для культивирования, различные обычно используемые среды могут быть соответствующим образом выбраны и использованы в соответствии с используемой клеткой-хозяином. Культивирование также может проводиться в других условиях, подходящих для роста клеток-хозяев.
Если необходимо, адипонектин, полученный вышеуказанным способом, может быть выделен и очищен различными процедурами разделения с использованием его физических, химических и других характеристик (Biochemical Data Book II, 1175-1259, First Edition, 1st impression, Jun. 23, 1980, published by Tokyo Kagaku Dojin, K.K.; Biochemistry, 25 (25), 8274 (1986); Eur. J. Biochem., 163, 313 (1987), etc.). В частности, указанное выделение и очистка могут быть достигнуты путем обычного восстановления, обработки с помощью средства, осаждающего белок (высаливание), центрифугирования, метода шока осмотического давления, обработки ультразвуком, ультрафильтрации, различными типами жидкостной хроматографии, такими как хроматография с молекулярным ситом (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография, аффинная хроматография, высокоэффективная жидкостная хроматография (ВЭЖХ), и др., и диализом, при использовании отдельно или в комбинации.
Альтернативно адипонектин, упомянутый выше, также может быть получен обычным методом химического синтеза, основанным на информации о последовательности аминокислот. Способ включает обычные жидкофазные и твердофазные методы пептидного синтеза. Более подробно, каждый из таких способов включает так называемую методику пошаговой элонгации, которая включает конденсацию компонентов аминокислот одна после другой для удлинения цепи в соответствии с информацией о последовательности аминокислот, и методику конденсации фрагмента, которая включает предварительный синтез фрагментов пептидов, каждый состоящий из нескольких остатков аминокислот и связывание их вместе друг за другом в соответствии с указанной информацией.
Метод конденсации, используемый для пептидного синтеза, также может проводиться в соответствии со стандартными методами. Примеры стандартных методов включают азидный метод, метод смешанного кислого ангидрида, метод DCC, метод активного эфира, метод окисления и восстановления, метод DPPA (дифенилфосфорилазида), метод DDC + добавки (1-гидроксибензотриазол, N-гидроксисукцинамид, N-гидрокси-5-норборнен-2,3-дикарбоксиимид) и метод Вудворта.
Растворитель, который может быть использован в таких методах, может быть соответственно выбран из растворителей, которые хорошо известны как используемые в реакциях конденсации с образованием пептидов. Их примеры включают N,N-диметилформамид (DMF), диметилсульфоксид (DMSO), гексафосфорамид, диоксан, тетрагидрофуран (THF), этилацетат, и др., и их смеси.
Во время вышеуказанной реакции пептидного синтеза аминокислота не включается в реакцию или карбоксильная группа в пептиде может быть защищена как сложный эфир низшего алкила, такой как метиловый эфир, этиловый эфир и трет-бутиловый эфир, и сложный аралкиловый эфир, такой как бензиловый эфир, п-метоксибензиловый эфир и п-нитробензиловый эфир, обычно путем этерификации.
Гидроксильная группа в аминокислоте, такой как остаток тирозина, имеющий функциональную группу в боковой цепи, может быть защищена ацетилом, бензилом, бензилоксикарбонилом, трет-бутилом или подобным, хотя такая защита не является обязательно необходимой.
Более того, гуанидиновая группа аргининового остатка может быть защищена соответствующей группой, такой как нитро, тозил, п-метоксибензолсульфонил, метилен-2-сульфонил, бензилоксикарбонил, изоборнилоксикарбонил или адамантилоксикарбонил.
Реакции для удаления таких защитных групп из защищенных аминокислот или пептидов или из конечного белка могут проводиться в соответствии с обычно используемыми способами, такими как метод катализируемой реакции или метод с использованием жидкого аммония/металла натрия, фторводорода, бромводорода, соляной кислоты, трифторуксусной кислоты, уксусной кислоты, муравьиной кислоты или метансульфоновой кислоты и подобного.
Полученный таким образом адипонектин может быть очищен различными методами, такими как методы с использованием ионообменной смолы, распределительная хроматография и гель-хроматография, и метод противоточного распределения, обычно используемый в области пептидной химии.
Средства для лечения болезней легких по настоящему изобретению включают адипонектин или его фармацевтически приемлемую соль в качестве активного ингредиента. Соли включают таковые с щелочными металлами, щелочноземельными металлами и аммонием, такие как соли натрия, калия, лития, кальция, магния, бария и аммония. Такие соли могут быть получены способами, хорошо известными в области техники. Вышеупомянутые соли включают аддитивные соли кислот, которые могут быть получены путем реакции адипонектина с подходящей органической или неорганической кислотой обычным известным методом. Примерами аддитивных солей кислот являются гидрохлорид, гидробромид, сульфат, бисульфат, ацетат, оксалат, валерат, олеат, лаурат, борат, бензоат, лактат, фосфат, п-толуолсульфонат (тозилат), цитрат, малеат, фумарат, сукцинат, тартрат, сульфонат, гликолат, аскорбат, бензолсульфонат, напсилат и подобные соли.
Средства для лечения болезней легких по изобретению обычно обеспечивают и применяют в форме фармацевтического препарата, содержащего фармакологически эффективное количество активного ингредиента вместе с соответствующим фармацевтическим носителем.
Носитель, который может быть использован в таких фармацевтических препаратах, включает различные разбавители и/или вспомогательные вещества, такие как наполнители, разбавители, вяжущие средства, увлажнители, дезинтегрирующие средства, поверхностно-активные вещества, смазывающие средства и подобные. Такие носители необязательно используют в соответствии со стандартной лекарственной формой конечной композиции.
Стандартные лекарственные формы фармацевтических препаратов могут быть выбраны из различных форм в соответствии с целью терапии. Типичные примеры включают твердые формы, такие как таблетки, пилюли, порошки, тонкоизмельченные порошки, гранулы и капсулы, и жидкие формы, такие как растворы, суспензии, эмульсии, сиропы и эликсиры. Такие препараты классифицируют по пути введения на пероральные препараты, парентеральные препараты, трансназальные препараты, вагинальные препараты, ректальные препараты, сублингвальные таблетки, мази и подобные, и каждая может быть рецептирована и прессована или иным образом обработана с помощью установленных фармацевтических методик. Более того, такие фармацевтические препараты могут содержать различные добавки, которые могут быть рецептированы в обычных фармацевтических препаратах, такие как стабилизаторы, антибактериальные средства, буферные вещества, изотонические средства, комплексообразующие средства, средства, регулирующие рН, и поверхностно-активные вещества.
Стабилизатор включает человеческий альбумин сыворотки и L-аминокислоты, сахариды и производные целлюлозы. Они могут быть использованы каждый отдельно или в комбинации с поверхностно-активным веществом или подобными. В частности, такая комбинация может участвовать в усилении стабильности активного ингредиента.
L-аминокислоты особо не ограничены и включают глицин, цистеин, глютаминовую кислоту и др.
Сахариды особо не ограничены, но включают моносахариды, такие как глюкоза, манноза, галактоза и фруктоза; сахарные спирты, такие как маннит, инозит и ксилит; дисахариды, такие как сахароза, мальтоза и лактоза; и полисахариды, такие как декстран, гидроксипропилкрахмал, хондроитинсульфат и гиалуроновая кислота и их производные.
Поверхностно-активные вещества особо не ограничены и могут быть использованы и ионные и неионные поверхностно-активные вещества. Примерами поверхностно-активных веществ являются алкильные эфиры полиоксиэтиленгликольсорбитана, алкильные эфиры полиоксиэтилена, моноациловые эфиры сорбитана и глицериды жирных кислот.
Производные целлюлозы особо не ограничиваются, но включают метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу натрия и др.
Сахариды могут быть использованы в количестве, по меньшей мере, около 0,0001 мг, и предпочтительно в диапазоне от около 0,01 до около 10 мг на 1 мкг активного ингредиента. Поверхностно-активные вещества могут быть использованы в количестве, по меньшей мере, около 0,00001 мг, и предпочтительно в диапазоне от около 0,0001 до около 0,01 мг на 1 мкг активного ингредиента. Человеческий альбумин сыворотки может быть использован в количестве, по меньшей мере, около 0,0001 мг, и предпочтительно в диапазоне от около 0,001 до около 0,1 мг на 1 мкг активного ингредиента. Аминокислоты могут быть использованы в количестве в диапазоне от около 0,001 до около 10 мг на 1 мкг активного ингредиента. Производные целлюлозы могут быть использованы в количестве, по меньшей мере, около 0,00001 мг, и предпочтительно в диапазоне от около 0,001 до около 0,1 мг на 1 мкг активного ингредиента.
Количество активного ингредиента, содержащееся в фармацевтических препаратах по настоящему изобретению, может быть соответствующим образом выбрано из широкого диапазона. Приемлемо, когда количество активного ингредиента составляет обычно от около 0,00001 до около 70% масс, и предпочтительно от около 0,0001 до около 5% масс.
Буферное вещество, которое может быть необязательно включено в фармацевтические препараты, включает борную кислоту, фосфорную кислоту, уксусную кислоту, лимонную кислоту, ε-аминокапроновую кислоту, глутаминовую кислоту и соответствующие соли (например, соли с щелочными металлами или щелочноземельными металлами, такие как соли натрия, калия, кальция и магния). Изотонические средства включают хлорид натрия, хлорид калия, сахара и глицерин. Комплексообразующие средства включают эдетат натрия и лимонную кислоту.
Фармацевтические препараты по изобретению могут быть получены как жидкие препараты и дополнительно могут быть преобразованы в лиофилизированные лекарственные формы, полученные лиофилизацией фармацевтической композиции, которую получают в соответствующей концентрации для использования путем растворения в солевом растворе, содержащем буферное вещество.
При прессовании фармацевтической композиции по изобретению в форму таблетки могут быть использованы в качестве