Способ лечения онкологических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано при комплексном лечении пациентов больных раком молочной железы II-IV. Для этого после однократного в рамках одного цикла химиотерапии пациенту вводят цитостатики: циклофосфан (500 мг/м2) и доксорубицин (50 мг/м2) (схема AC) или циклофосфан (500 мг/м2), доксорубицин (50 мг/м) и фторурацил (500 мг/м2) (схема PAC) внутривенно. А также препарат Панаген в форме таблеток, покрытых гастроэнтерическим покрытием в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день через каждые два часа с началом приема с третьего дня после проведенной химиотерапии. Продолжительность приема препарата Панаген в течение 17 дней, с продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии. Способ позволяет повысить эффективность лечения рака молочной железы с сохранением и стимуляцией гранулацитарно-макрофагального и лимфоцитарного ростков кроветворения, что компенсирует негативное лейкоредуцирующее действие цитостатиков. 40 ил., 38 табл.
Реферат
Изобретение относится к медицине и может быть использовано при комплексном лечении пациентов больных раком молочной железы II-IV стадии препаратами цитостатической группы, в частности, сочетанием цитостатика антрациклинового ряда доксорубицина и циклофосфана (схема AC), а также с с добавлением в схему третьего цитостатика фторурацила (схема FAC).
Известен способ лечения, основанный на использовании монопрепаратов цитостатической группы, например, цисплатины для лечения больных с плоскоклеточным раком кожи туловища, путем использования цисплатины в дозе 100 мг/м2 (I день), внутривенно капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые 3-5 недель, или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 недели, или 50 мг/м в 1-й и 8-й дни каждые 4 недели, препарата митомицин C для лечения больных с раком желудка, кишечника, поджелудочной железы, мочевого пузыря, молочной железы, легкого, вульвы, предстательной железы (в составе лекарственных комбинаций), путем использования митомицина C внутривенно в дозе 10 мг/м2 1 раз в 3-4 недели (в составе лекарственных комбинаций) или также 2 мг/м2 с 1-го по 5-й и с 8-го по 12-й дни курса, суммарная доза 50 мг/м2, или препарата дактиномицина для лечения больных с хориокарциномой матки, саркомой мягких тканей, злокачественных опухолей яичка, меланомы, лимфосаркомы, нейробластом путем использования дактиномицина внутривенно 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 недель или 1-2 раза в неделю в течение 3-5 недель, суммарная доза 3000 мкг [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу не все типы неопластической ткани в одинаковой степени чувствительны к действию цитостатика в виде монопрепарата.
Известен также способ, основанный на применении высоко дозовой химиотерапии (XT), включающий постоянную инфузию 5-фторурацила 200 мг/м2 в день ежедневно длительно, эпирубицин 50 мг/м2 и цисплатин 60 мг/м2 каждые 3 недели в течение 6 месяцев [2, 3].
Недостатком способа также является относительно низкая эффективность лечения.
Кроме указанных выше известен способ лечения эпирубицином 100 мг/м2 и циклофосфаном 400 мг/м2 с поддержкой Г-КСФ с 14-дневным интервалом. Объективный ответ получен в 96,5% случаев (4 полных и 25 частичных ремиссий). Интенсивный режим получили 36 больных (Т2>3,5 см, T3No) с использованием эпирубицина 65 мг/м, циклофосфана 600 мг/м и 5-фторурацила 600 мг/м2 в день 1, при поддержке Г-КСФ 5 мкг/кг, дни с 7 по 12. Интервалы между курсами составляли 14 дней. После трех курсов клинический эффект получен в 100% случаев; 80,5% больным выполнена сохранная операция [4, 5].
Этот способ имеет ограниченную применимость и относительно низкую эффективность.
К известным относится способ лечения рака молочной железы IIIA и IIIB стадии доксорубицином 90 мг/м2 и циклофосфаном 1000 мг/м2 при поддержке Г-КСФ с 3-недельным интервалом. Общий клинический эффект составил 98%, полная клиническая регрессия - 50%, полная гистологическая регрессия - 14%. У 40 пациентов, получавших 5-фторурацил 750 мг/м2 (дни 1-4), эпирубицин 35 мг/м2 (дни 2-4), циклофосфан 400 мг/м2 (дни 2-4) с интервалом 3 недели, с поддержкой Г-КСФ, клиническая полная регрессия составила 37,5%, частичная - 45%, полная гистологическая ремиссия отмечена у 15% больных [6].
Этот способ также имеет ограниченную применимость и относительно низкую эффективность, поскольку он не активирует противораковый иммунитет организма и лишь незначительно увеличивает безрецидивный интервал у больных раком молочной железы. У больных с местно-распространенным заболеванием 5-летняя безрецидивная выживаемость составляет от 13% до 45%, а 10-летняя - от 10% до 30%. Метастатический рак молочной железы остается неизлечимым заболеванием. В течение 2 и 5 лет от момента диагностики живут в среднем 30% и 5% соответственно [7, 8].
Кроме того известно, что все способы с использованием цитостатиков обладают крайне негативным действием на гемопоэз.
Известны также способы лечения, основанные на действии комбинации цитостатических препаратов и последующей иммунотерапии. Так известен препарат Ингарон, представляющий собой интерферон-гамма. По своим свойствам он является уникальным природным цитокином, обеспечивающим формирование и стимуляцию клеточного иммунитета, что показывает целесообразность использования гамма-интерферона в сочетании с XT при ряде злокачественных опухолей. Сочетание XT с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект противоопухолевых препаратов. [9].
Известен способ лечения, основанный на использовании цитостатических препаратов с последующей иммунотерапией специфическими олигонуклеотидами с фосфоротиоатным остовом и специфическим набором нуклеотидов (CpG) [10].
Однако этот способ также имеет низкую эффективность лечения, обусловленную тем, что, иммуномодулирующие CpG нуклеотиды воздействуют в основном на антигенпрезентирующие дендритные клетки (ДК), активируя их созревание и специфические активности через систему TLR рецепторов, и не в состоянии активировать ДК через другие молекулярные пути активации Так в последнее время большое внимание уделяется изучению сенсорных путей, задействованных при активации ДК препаратами линейной двуцепочечной ДНК, которые не связаны с функционированием TLR рецепторов. Описаны основные метаболические пути, осуществляющие обнаружение и трансдукцию сигнала, определяемого взаимодействием ДК и молекул экзогенной ДНК. К ним относятся NRL, STING зависимый пути, а также сигнальный путь, опосредованный активностью РНК полимеразы III [11-13] Завершением процесса передачи сигнала любым из указанных путей является активация транскрипционных факторов nfκb, API, группы белков IRF, которые интернализуются в ядро и связывают и активируют ИФН-(3 промотор. ИФН-β секретируется, связывается с рецептором (IFNAR) и активирует по аутокринному или паракринному механизму Jak/STAT метаболический путь инициации продукции большого числа интерферон-индуцибельных генов [14, 15]. В результате указанных процессов у ДК повышается экспрессия поверхностных молекул MHCI, МНСП, костимулирующих молекул (CD40, CD80, CD86), рецепторов хемокинов. ДК начинают секретировать хемокины и цитокины для привлечения эффекторных клеток и их дифференцировки [16].
Основным недостатком указанных способов лечения онкологических заболеваний является их ограниченное действие на системы организма, индуцирующие противораковый адаптивный иммунитет в случае использования цитостатиков в качестве монопрепарата, и высокая токсичность и угнетающее влияние на лейкопоэз при способах лечения с использованием цитостатиков в сочетании с иммунотерапевтическими препаратами.
Для частичного устранения указанных недостатков в настоящее время разработаны и используются достаточно обширный арсенал лекарственных препаратов, используемых для корректирующей гемопоэз терапии после проведения циторедуцирующей терапии цитостатиками. Используются два принципиальных типа препаратов, одни из которых индуцируют мобилизацию стволовых клеток крови (СКК) и пролиферацию поздних предшественников нейтрофильного ростка кроветворения, и препараты, индуцирующие пролиферацию предшественников всех ростков кроветворения разной степени коммитирования. К первой группе относятся препараты на основе колониестимулирующих факторов (Г-КСФ и ГМ-КСФ), ко второй группе - препараты на основе экзогенной ДНК.
Препараты на основе фрагментированной экзогенной ДНК оказывают активирующее пролиферацию действие на все типы гемопоэтических предшественников в разной степени их зрелости. Такое действие позволяет одномоментно запустить деление СКК, увеличив процент делящихся клеток в несколько раз. Такое действие, как и мобилизация ККМ под действием колоний - стимулирующих факторов, приводит к появлению в периферической крови всей гаммы форменных элементов лейкоцитарного и лимфоцитарного рядов. Однако выход в кровоток зрелых клеток в результате такого воздействия в отличие от мобилизации, которая представляет собой насильственный выход СКК и их коммитированных потомков из стромальных ниш, является физиологичным и поэтому на 1-3 суток оттянут во времени. Использование препаратов на основе фрагментированной ДНК для профилактики миелосупрессий и стимуляции гемо- и лейкопоэза у онкологических больных является общепринятым подходом, который имеет свои положительные стороны, поскольку при его применении не нарушается функционирование основных клеточных систем организма.
В связи с этим можно указать на известность способа лечения с применением препарата «Дезоксинат», представляющего собой натриевую соль двухспиральной дезоксирибонуклеиновой кислоты, получаемую из молок осетровых рыб и частично деполимеризованную с помощью ультразвука до молекулярной массы 2,7-4,0×105 Да. Содержание ДНК в препарате более 90%, в качестве примесей в препарате присутствуют РНК (от 3 до 5%) и белки негистонового типа, связанные с ДНК. Препарат обладает антитоксическим и радиопротекторным действием и используется в качестве стимулятора лейкопоэза при химиолучевой терапии, проводимой у онкологических больных [17].
Однако «Дезоксинат» не обладает собственной противоопухолевой активностью и поэтому применяется лишь в качестве вспомогательного лейкостимулирующего препарата для профилактики миелодепрессий при химиолучевой терапии онкологических больных, при этом лейкостимулирующий эффект развивается медленно и стойкие изменения наблюдаются через 4-10 дней. Радиопротекторный эффект «Дезоксината» носит непрямой характер и направлен на коррекцию лейкопении и стимуляцию иммунитета, развивающиеся при острой лучевой болезни II-III степени тяжести [18].
Известен способ стимуляции лейкопоэза у больных с запущенными формами опухолей органов брюшной полости путем однократного подкожного введения экзогенной ДНК, полученной из молок осетровых рыб. ДНК представлена в виде порошка низкополимерной, содержащей не менее 80% нативной натриевой соли ДНК с молекулярной массой 270-500×103 Да при весовых соотношениях нуклеотидов, в масс.%: аденин - 29, тимин - 27, гуанин - 22, цитозин - 20. Способ не вызывает осложнений и одновременно стимулирует костномозговое кроветворение [19].
Этот способ также обладает относительно низкой эффективностью лечения.
Известен также способ лейкостимуляции при лечении генерализованных опухолей путем внутримышечного или подкожного введения предварительно приготовленной смеси цитостатика и лейкостимулятора, причем в качестве цитостатика используют 5-фторурацил, а в качестве лейкостимулятора - натриевую соль ДНК. В качестве натриевой соли ДНК можно использовать «Деринат». Способ позволяет повысить эффективность лечения за счет изменения транспортирования 5-фторурацила, сохранения концентрации цитостатика в опухолевой ткани [20].
Этот способ также обладает относительно низкой эффективностью лечения.
Предложен также способ использовать трехкомпонентный конъюгат, состоящий из лейкостимулятора «Деринат», антибиотика и белков крови, что позволяет депонировать антрациклиновые антибиотики внутримышечно или подкожно в неактивной форме. Отсутствие кардиотоксичности и гематотоксичности позволяет применять данный способ на этапе генерализации, в условиях стойкой лейкопении или тяжелом общем состоянии больных [21].
Этот способ обладает относительно низкой эффективностью лечения. Описан способ использования препарата экзогенной ДНК для лечения больных с запущенными формами опухолей органов брюшной полости путем внутримышечного введения смеси нативной ДНК и антрациклинового антибиотика, содержащей 5 мг антрациклинового антибиотика, растворенного в 4 мл растворителя, 75 мг ДНК и 2 мл 0,5% раствора новокаина (всего на курс 50 мг антрациклинового антибиотика) и активации противоопухолевых клеток организма хозяина (CD 16 натуральных киллерных клеток) путем экстракорпорального подключения донорской свиной селезенки. Способ позволяет усилить эффект лечения больных с запущенными формами опухолей органов брюшной полости [22].
Этот способ обладает относительно низкой эффективностью лечения.
Также описан способ применения препарата экзогенной ДНК при лечении злокачественных новообразований, заключающийся во введении ДНК внутримышечно, от 1 до 3 раз в день, суммарным количеством 0,1-0,5 г, и в приеме противоопухолевых фитопрепаратов. Дополнительно вводят антитоксические, и/или антианемические, и/или тонизирующие, и/или антигистаминные, и/или иммуномодулирующие и/или мочегонные лекарственные фитопрепараты. Лечение данным способом оказывает дифференцированное воздействие на нормальные и патологически измененные клетки, вследствие чего происходит стимуляции пролиферации и дифференцировки нормальных клеток наряду с индукцией механизмов апоптоза в трансформированных клетках [23].
Этот способ обладает относительно низкой эффективностью лечения.
Известен и другой способ применения препарата экзогенной ДНК при лечении злокачественных новообразований, заключающийся в том, что в зависимости от характера и тяжести заболевания больному вводят парентерально натриевую соль ДНК, в разовой дозе 0,5-4,0 мг/кг 1 раз в четыре дня, в сочетании с введением человеческого альфа-фетопротеина, в разовой дозе 500-5000 МЕ/кг 1-2 раза в сутки ежедневно, курсом 14-30 дней. Альфа-фетопротеин вводят подкожно, внутримышечно или внутривенно, а ДНК вводят внутримышечно [24].
Этот способ обладает относительно низкой эффективностью лечения, указанные запатентованные способы имеют также ограниченную применимость, поскольку ориентируются либо только на лейкостимуляцию с использованием инъекционных форм препаратов чужеродного происхождения, в которых молекула ДНК гидролизована до низкомолекулярных фракций и в некоторых случаях денатурирована с последующей неконтролируемой реассоциацией, что нарушает нативную структуру активного начала препарата, либо применяются в сочетании с другими противораковыми препаратами без какого-либо логического объяснения механизма воздействия.
Помимо этого ни один из приведенных способов применения препаратов ДНК не активирует противораковый иммунитет организма.
В настоящее время продолжается активный поиск новых препаратов, стимулирующих лейкопоэз, и препаратов, индуцирующих противораковый адаптивный иммунитет.
Известны способы применения препарата экзогенной ДНК человека «Панаген», обладающего одновременно противоопухолевым, антитоксическим и радиопротекторным действием. Препарат «Панаген» содержит нативный, видоспецифичный фрагментированный нуклеопротеидный комплекс, состоящий из двуцепочечной ДНК и связанных с ней белков ядерного матрикса, что позволяет расширить спектр терапевтической активности препарата [25].
Этот способ с использованием фрагментированной ДНК человека Панаген имеет ограниченную применимость.
Описан способ применения препарата ДНК человека Панаген при лечении онкологических заболеваний путем использования гомологичной ДНК, имеющей биологически активный размер, составляющий полный геном физиологически и генетически здорового донора. ДНК пациенту вводят в дозе, создающей такую концентрацию ДНК в плазме крови, которая равна или превышает концентрацию собственно ДНК плазмы крови, но не превышает максимально допустимую концентрацию, равную 30 мкг/мл. Изобретение обеспечивает естественную гомологичную репарацию ДНК с заменой участков хромосом, несущих мутации, приведшие к ораковеванию клеток, без нежелательных эффектов при использовании ДНК в указанной дозе [26].
Этот способ с использованием фрагментированной ДНК человека Панаген также имеет ограниченную применимость.
Известен способ применения препарата ДНК человека при лечении нарушений гемопоэза, связанных с дефектами хромосом и последующей гибелью СКК при терапии цитостатиками или высокими дозами радиации, лечения заболеваний, связанных с нарушением механизмов дифференцировки СКК. Способ основан на введении в организм пациента фрагментированной ДНК, которая является аллогенной, получена от генетически и физиологически здоровых доноров и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента, в ассоциации с белками ядерного матрикса. Вводят такое количество фрагментированной ДНК, чтобы достичь концентрации фрагментированной ДНК в плазме крови пациента, равной или превышающей концентрацию собственной ДНК плазмы крови, но не более 1500 нг/мл. Способ позволяет восстанавливать нарушения ДНК СКК пациента путем замещения поврежденных участков хромосом гомологической рекомбинацией и обеспечивает расширение области применения препарата фрагментированной ДНК [27].
Способ также имеет ограниченную применимость.
В ряде публикаций описан возможный механизм лейкостимулирующего действии препарата Панаген. Например, в источнике [28] раскрыто, что фрагменты ДНК, доставленные во внутриядерное пространство CD34+ СКК, своими двуцепочечными концами активируют пул иерархических киназ, при этом в СКК, покоящихся до этого времени, запускается молекулярная машина ареста клеточного цикла. Через некоторое время система репарации удаляет эти фрагменты из ядерного пространства, но клетка при этом уже вошла в активированное состояние и обязана продвинуться по клеточному циклу с последующим его завершением. При постоянной доставке фрагментов ДНК в ядерное пространство этого типа клеток будет происходить постоянная активация деления этих клеток, что и определяет лейкостимулирующий эффект действия экзогенной ДНК.
Выявлены публикации, свидетельствующие о том, что инъекции экзогенной фрагментированной геномной ДНК связаны с эффектами, при которых затрагивается функциональная целостность СКК. Так, в экспериментах, выполненных в работе [29], отмечалось появление селезеночных колоний у смертельно облученных мышей после своевременных инъекций экзогенной ДНК. Это наблюдение косвенно свидетельствовало о том, что экзогенная ДНК при внутрибрюшинном введении достигает клеток костного мозга и воздействует на CD34+ СКК, сохраняя их жизнеспособность. Потомки выживших стволовых клеток крови формируют колонии в селезенке, которые возрождают иммунную систему экспериментального животного.
Все указанные способы применения препарата фрагментированной ДНК человека Панаген имеют ограниченную применимость, поскольку не учитывают в одной стратегии всю совокупность обнаруженных терапевтических свойств препарата.
Наиболее близким по своей сущности к предложенному является способ лечения онкологических заболеваний, основанный на введении в организм пациента препарата цитостатической группы циклофосфана, который вводят в дозах от 20 до 100 мг/кг веса пациента, и препарата фрагментированной аллогенной двуцепочечной геномной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора (экзогенная ДНК), при этом, препарат экзогенной ДНК вводят через 48 часов после каждого введения препарата цитостатической группы и на протяжении последующих 30 суток для схемы, когда пациент получил полную курсовую дозу 6-14 г, либо на протяжении следующих 3-5 суток после однократной инъекции и за день до следующей по счету инъекции, продолжая такую прерывистую схему до полного набора терапевтической или поддерживающей дозы цитостатика [30].
Для реализации известного способа может быть применен препарат Панаген (ЛСР №004429/08 от 09.06.2008), который используют в качестве субстрата для активации созревания, индукции антигенпрезентирующей и специфической аллостимуляторной активности в направлении Th1 пути антигенпрезентирующих ДК организма. При этом может быть использована лекарственная форма препарата в виде таблеток, содержащих 5 мг активного вещества, например, по схеме через 30 мин и на 2, 3 и 5 сутки после введения циклофосфана в количестве одна таблетка в первые 30 минут после введения циклофосфана и далее в указанные дни по одной таблетке каждые 2-3 часа в течение суток (время бодрствования), но не более максимально допустимого количества, равного 30 мг активного вещества в сутки.
Однако и наиболее близкий способ обладает относительно низкой эффективностью лечения, обусловленной тем, что, используется только одно направление воздействия экзогенная ДНК на организм пациента и не обеспечивается влияние других эффективных терапевтических его свойств, проявляющихся в сочетании с действием цитостатиков циклофосфана и доксорубицина.
Требуемый результат заключается в повышении эффективности лечения.
Требуемый результат достигается тем, что в способе, основанном на применении в схемах лечения рака молочной железы II-IV стадии препаратов цитостатической группы, дополнительно после однократного в рамках одного цикла химиотерапии внутривенного введения цитостатиков циклофосфан (500 мг/м2) и доксорубицин (50 мг/м2) (схема АС) или циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м ) (схема FAC) пациенту назначают препарат на основе экзогенной ДНК человека Панаген (ЛСР №004429/08 от 09.06.2008) в форме таблеток, покрытых гастроэнтерическим покрытием, в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной химиотерапии в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его приема через 42 часа, то есть через 48 часов после проведенной химиотерапии (день 3), продолжением приема препарата в течение 17 дней до 20 дня после химиотерапии (включительно), и продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии.
Кроме того, требуемый результат достигается тем, что, применение препаратов цитостатической группы при их синергичном сочетании с препаратом Панаген по указанной схеме представляет собой новую стратегию лечения рака молочной железы, применение которой приводит к одновременному в рамках одного курса химиотерапии проявлению трех типов терапевтического воздействия: к сохранению и стимуляции гранулоцитарно-макрофагального и лимфоцитарного ростков кроветворения, что компенсирует негативное лейкоредуцирующее действие цитостатиков, к сохранению врожденного противоракового иммунитета на уровне до терапии цитостатиками и индукции противоракового адаптивного иммунитета характеризующегося повышением в периферической крови пациентов цитотоксических CD8+ лимфоцитов с высоким содержанием перфоринов.
В более широком плане задачей настоящего изобретения является разработка обоснованного и экспериментально подтвержденного способа (стратегии) одновременного воздействия в рамках процедуры лечения рака молочной железы с применением многократных курсов программной полихимиотерапии и на опухолевую ткань, редуцируя ее развитие за счет активации ДК и индукции развития адаптивного иммунитета, и на организм пациента, помогая ему пережить негативные последствия действия мощных цитостатиков, которыми являются циклофосфан и доксорубицин за счет протекции и стимуляции пролиферации гемопоэтических предшественником костного мозга различной степени зрелости.
Ниже приводятся теоретические и экспериментальные данные подтверждающие, что изобретение отвечает критериям новизны, изобретательского уровня и практической (промышленной) применяемости.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Способ лечения онкологических заболеваний основан на применении препарата экзогенной ДНК Панаген в форме таблеток, покрытых гастроэнтерическим покрытием, в схемах лечения рака молочной железы II-IV стадии с использованием однократного в рамках одного цикла химиотерапии внутривенного введения цитостатиков циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2). Препарат Панаген применяется в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной химиотерапии в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его через 42 часа, то есть через 48 часов после проведенной химиотерапии (день 3) и продолжением в течение 17 дней до 20 дня после химиотерапии (включительно). При таком воздействии в организме пациента происходит одновременно лейкостимуляция и активация адаптивного иммунитета.
Для подтверждения того, что предложенный способ позволяет достигнуть требуемого результата, приведем его теоретическое и экспериментальное обоснование. Предложенный способ (стратегия) лечения рака молочной железы основывается да двух эффектах связанных с одновременным воздействием фрагментированной экзогенной ДНК (активное начало препарата Панаген) на СКК и иммунокомпетентные ДК, приводящим одновременно к индукции пролиферации первых и активации профессиональных свойств вторых. Рассмотрим теоретическое и экспериментальное доказательства обоих свойств препарата «Панаген».
На чертеже представлены:
на фиг.1 - Постэмбриональный гемопоэз (схема по НА. Юриной). Стадии дифференцировки крови: I-IV - морфологически неидентифицируемые клетки; V, VI - морфологически идентифицируемые клетки; Б - базофил; БОЕ - бурстобразующая единица; Г - гранулоциты; Гн - гранулоцит нейтрофильный; КОЕ - колониеобразующие единицы; КОЕ-С - селезеночная колониеобразующая единица; Л - лимфоцит; Лск - лимфоидная стволовая клетка; М - моноцит; Мег - мегакариоцит; Эо - эозинофил; Э - эритроцит [31].
на фиг.2 - Доставка экзогенной ДНК в ККМ in vivo. A - Электрофореграмма (слева) и рентгенограмма (справа) геномной ДНК ККМ мышей после в/б введения меченого Alu повтора человека на фоне инъекции циклофосфана (ЦФ) (1) и в виде монопрепарата (2), меченого HpaI повтора лосося на фоне инъекции ЦФ (3) и в виде монопрепарата (4), меченой плазмиды pEGFP-N1 на фоне инъекции ЦФ (5) и в виде монопрепарата (6), а также после в/б введения меченого dATP фоне инъекции ЦФ (7) и в виде монопрепарата (8). М - маркер молекулярного веса λHindIII. Б - ПЦР на предметном стекле с биотин-мечеными нуклеотидами и с использованием ДНК человека, фрагментированной до размеров 20-500 п.н., в качестве праймера. Ядра ККМ интактных мышей и после 12-кратного (через 18 часов после введения ЦФ) ежечасного в/б введения 0,5 мг ДНК человека. В - Электрофореграмма (слева) и рентгенограмма (справа) продуктов ПЦР с праймерами на уникальный ген каспазы 3 человека с использованием в качестве матрицы ДНК человека (1), ДНК клеток костного мозга мышей СВА (2) и ДНК ядерной фракции клеток костного мозга мышей, выделенных через 8 часов после введения ДНК человека по описанной выше схеме (3). В качестве зонда для гибридизации использовали фрагмент ~260 п.н., меченый в ПЦР с праймерами на ген каспазы 3 человека и матрицей ДНК человека. 2% агарозный гель. М - маркер молекулярного веса (100 п.н.). Стрелка обозначает гибридизующийся фрагмент, соответствующий продукту ПЦР с праймерами на ген каспазы 3 человека. Г - FISH с меченым биотином Alu повтором человека препаратов ККМ мыши, приготовленных через 38 часов после инъекции ЦФ (200 мг/кг), на фоне введения ДНК человека по указанной ранее схеме и без него, а также фибробластов человека. Стрелками указаны зоны гибридизации.
на фиг.3 - Доставка экзогенной ДНК в ККМ in vitro. A - Результаты инкубации ККМ с фрагментом ДНК Alu повтором 300 п.н., синтезированным и меченым в ПЦР, в количестве от 0,5 до 32,5 мкг. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ, и интактной мыши. М - маркер молекулярного веса λHindIII. Справа приведена количественная оценка меченого материала, содержащегося в ядрах ККМ. Оценка проведена с использованием фосфоимеджера Molecular Imager FX Pro+ и программы Quantity One. Б - Результаты инкубации ККМ с плазмидой pEGFP-N1, гидролизованной рестриктазой HindIII и меченой по липкому концу, в течение различного времени - 1, 2, 4 и 7 часов. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ, и интактной мыши. М - маркеры молекулярного веса. Справа приведена количественная оценка меченого материала, содержащегося в ядрах ККМ. Оценка проведена с использованием фосфоимеджера Molecular Imager FX Pro+ и программы Quantity One. В - Результаты инкубации ККМ с ДНК плазмиды pEGFP-N1, гидролизованной рестриктазой Smal (1), рестриктазой HindIII (2), суперскрученной формой плазмиды pEGFP-N1 (3) и в отсутствие экзогенной ДНК (4) в течение 7 часов. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ и интактной мыши СВА. Р1 и Р2 - ДНК плазмиды pEGFP-N1 суперскрученной и линейной формы, М - маркер молекулярного веса.
на фиг.4 - Интернализация экзогенной ДНК в CD34+ СКК. Препарат ККМ, выделенных через 18 ч после инъекции мышам ЦФ (200 мг/кг) и культивированных ex vivo с ДНК Alu повтора человека, меченного флуорохромом TAMRA. Дополнительно клетки окрашивали специфическими FITC мечеными антителами к поверхностному маркеру CD34. DAPI - окраска хроматина ядер, FITC - окраска специфическими антителами к поверхностному маркеру CD34+ плюрипотентных клеток, TAMRA - детекция в ядрах клеток ПЦР меченой флуорохромом TAMRA экзогенной ДНК.
на фиг.5 - Стимуляция лейко- и эритропоэза. А - Мышам-самцам линии СВА в течение 6 дней ежедневно внутрибрюшинно вводили по 50 мкг ДНК различного происхождения, выделенной из молок лосося, плаценты человека и органов мышей линии СВА, в 0,2 мл физ. раствора. ЦФ в дозе 200 мг/кг веса вводили однократно в брюшную полость на второй день после первой инъекции ДНК. Количество лейкоцитов в крови индивидуально подсчитывали у каждой мыши на 3, 5 и 7 день после введения ДНК. Кровь брали из кончика хвоста. Видно, что на 3 день после инъекции ЦФ количество лейкоцитов в крови составляло 5-6% от исходного. На 5 день в группе мышей, получавших один ЦФ, количество лейкоцитов еще не достигало исходного уровня, тогда как у мышей, получавших ДНК, наблюдалось их восстановление до нормы. На 7 день, когда в группах мышей, получавших ДНК человека и мыши, уровень лейкоцитов превышал исходный более, чем в 1,5-2 раза, в группе, получавшей ДНК лосося, их уровень не изменился по сравнению с предыдущим измерением. Таким образом, экзогенная гомологичная ДНК стимулирует восстановление количества лейкоцитов в крови мышей СВА после однократного введения ЦФ, угнетающего кроветворение. Б - Мононуклеарные клетки (МНК) костного мозга человека в течение 1 часа инкубировали при 37°С с экзогенной ДНК человека в концентрации 100 мкг/мг. В контроле вместо ДНК в соответствующем количестве добавляли среду для культивирования клеток. На 8 и 14 сутки после инкубации проводили оценку числа эритроидных колоний, образовавшихся в культуре клеток. После преинкубации МНК с экзогенной ДНК регистрируется значительное, статистически достоверное увеличение числа генерируемых эритроидных колоний (p<0,001). Наиболее демонстративное повышение числа эритроидных колоний после обработки экзогенной ДНК человека наблюдается на ранних сроках - на 8 сутки культивирования, когда число формирующихся эритроидных колоний в опыте превышает количество таковых в контроле в 3-4 и более раз. При использовании модели эритроидного колониеобразования действие препарата экзогенной ДНК человека на поврежденные гемопоэтические предшественники в 40% случаев носит не количественный, а качественный характер. При этом экзогенная ДНК явилась тем активным началом, которое позволило предшественникам сохранить (восстановить) жизнеспособность. Механизм, объясняющий спасение предшественников в результате воздействия фрагментов экзогенной ДНК не известен.
на фиг.6 - Динамика роста опухоли Кребс-2 у мышей после проведенной XT.
на фиг.7 - Процентное содержание CD8+ перфорин+ Т-клеток в интактных МНК и после инкубации с ДК, созревшими в присутствии ЛПС, ДНК или в отсутствии дозревающего стимула (0).
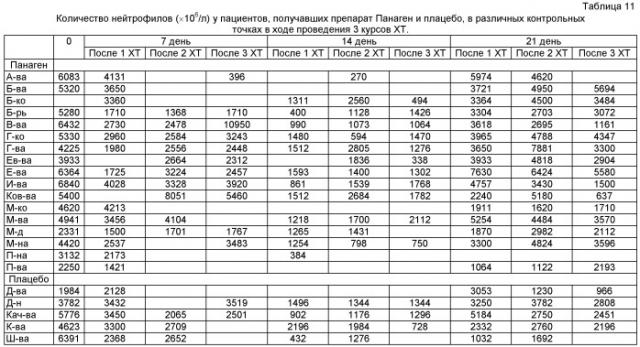
на фиг.8 - Контрольные точки исследования. * - Анализ крови на абсолютное количество лейкоцитов и нейтрофилов, общий анализ крови. # - Подсчет количества CD34+ клеток.
на фиг.9 - Абсолютное число лейкоцитов в исходной точке 0 и определенное в контрольных точках 7, 14 и 21 день после проведения XT. Отмечается достоверное снижение количества клеток в периферической крови пациентов, участвующих в испытаниях, в контрольной точке 14 суток относительно исходного уровня. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
на фиг.10 - Условное содержание лейкоцитов относительно соответствующей контрольной точки после 1 XT в группах «Плацебо», «Панаген-отвечающие» и «Панаген-не отвечающие» на 21 день после проведения XT. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
на фиг.11 - Сравнение условных значений содержания лейкоцитов в каждой группе на втором курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки.
на фиг.12 - Сравнение условных значений содержания лейкоцитов в каждой группе на третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
на фиг.13 - Сравнение условных значений содержания нейтрофилов на 14 день после введения цитостатиков (контрольная точка) после 2 и 3 XT относительно значения параметра после 1 XT.
на фиг.14 - Сравнение условных значений содержания нейтрофилов на 21 день после введения цитостатиков (контрольная точка) после 2 и 3 XT относительно значения параметра после 1 XT.
на фиг.15 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольной точке 14 сутки после введения цитостатика по отношению к показателю 1 XT.
на фиг.16 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольной точке 21 сутки после введения цитостатика по отношению к показателю 1 XT.
на фиг.17 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольных точках 14 и 21 сутки после введения цитостатика по отношению к исходному значению.
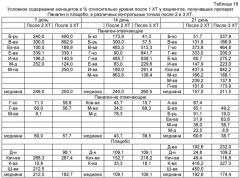
на фиг.18 - Сравнение условных значений содержания нейтрофилов в каждой группе на втором курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки.
на фиг.19 - Сравнение условных значений содержания нейтрофилов в каждой группе на третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
на фиг.20 - Частота проявления нейтропений всех степеней у пациентов в различных контрольных точках в ходе проведения 3 курсов XT.
на фиг.21 - Частота проявления нейтропений II степени у пациентов в различных контрольных точках в ходе проведения 3 курсов XT.
на фиг.22 - Динамика восстановления нейтрофилов после наибольшего падения их числа в периферической крови до значений, индуцирующих фебрилярную нейтропению, в группах «Плацебо» и «Панаген» без дополнительной лейкостимуляции.
на фиг.23 - Абсолютное число моноцитов в исходной точке 0 и определенное в контрольных точках 7, 14 и 20 день после проведения XT. Отмечается достоверное снижен