Тетрагидрофенантридиноны и тетрагидроциклопентахинолиноны в качестве ингибиторов parp и ингибиторов полимеризации тубулина
Иллюстрации
Показать всеНастоящее изобретение относится к соединениям формулы (I), их применению в качестве ингибиторов полимеризации тубулина и в качестве ингибиторов PARP, а также в составе фармацевтических композиций, содержащих указанные соединения формулы (I), где R1, R2, R3, R4, R5, R6, R7 и Y имеют значения, приведенные в формуле изобретения. Изобретение также относится к промежуточным соединениям для получения соединений формулы (I) и к способу получения промежуточных соединений. 9 н. и 7 з.п. ф-лы, 3 табл., 16 пр. получения промежуточных соединений, 17 пр. получения целевых соединений, 6 фармакологических пр., 1 пр. композиции.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к ингибиторам PARP и ингибиторам полимеризации тубулина, и в настоящем изобретении предлагаются соединения и композиции, содержащие раскрываемые соединения. Кроме того, в настоящем изобретении предлагаются способы применения раскрываемых ингибиторов PARP и ингибиторов полимеризации тубулина, например, в качестве лекарственного средства.
Предпосылки к созданию изобретения
Нуклеарный фермент поли(АДФ-рибозо)полимераза-1 (PARP-1) является членом семейства ферментов PARP. Указанное растущее семейство состоит из ферментов PARP, таких как, например: PARP-1, PARP-2, PARP-3 и Vault-PARP; и ферментов танкираз (TANK), таких как, например: TANK-1 и TANK-2. PARP называют также поли(аденозин-5'-дифосфорибозо)полимеразой или PARS (поли(АДФ-рибозо)синтетаза).
Танкиразы (TANK) были идентифицированы в качестве компонентов теломерного комплекса человека. Было также высказано предположение, что они играют определенные роли в контролировании митотического веретена и регулировании направления миграции везикул, а также могут служить в качестве каркасов для белков, которые принимают участие в различных других клеточных процессах. Теломеры, которые играют существенную роль в обеспечении жизнедеятельности и устойчивости хромосом, поддерживаются теломеразой, специализированной обратной транскриптазой. TANK представляют собой (АДФ-рибозо)трансферазы, которые обладают некоторыми свойствами как сигнальных, так и цитоскелетных белков. Они содержат домен PARP, который катализирует поли-АДФ-рибозилирование субстратных белков, домена SAM (sterile alpha motif), который является общим для некоторых сигнальных молекул, и домена ANK, включающего от 16 до 24 анкириновых повтора, которые присутствуют также в цитоскелетном белке анкирине. Домен ANK взаимодействует со многими другим белками, включая теломерный белок фактор-1 связывания теломерного повтора (TRF-1). Поэтому указанные белки называют TRF1-взаимодействующими анкирин-связанными АДФ-рибозополимеразами (TANK).
Одной из функций TANK является АДФ-рибозилирование TRF-1. Функционирование теломеров человека контролируется комплексом связанных с теломерами белков, который включает два теломер-специфичных ДНК-связывающих белка, TRF-1 и TRF-2. TRF-2 защищает концы хромосом, а TRF-1 регулирует длину теломера. АДФ-рибозилирование подавляет способность TRF-1 связываться с теломерной ДНК. Указанное поли-АДФ-рибозилирование TRF-1 высвобождает TRF-1 из теломеров, тем самым раскрывая теломерный комплекс, и открывает доступ к теломеразе. Таким образом, TANK функционируют в качестве позитивного регулятора длины теломеров, позволяя осуществлять удлинение теломеров под действием теломеразы.
На некоторые из ролей TANK указывает идентичность белков, с которыми они взаимодействуют - чувствительная к инсулину аминопептидаза, белки Mc11 (которые являются членами семейства Bc1-2), ядерный антиген-1 Эпштейна-Барра, ядерный белок и белок митотического аппарата, а также цитоплазменный и гетерохроматиновый фактор TAB182 - и их разнообразные внутриклеточные локализации (ядерные поры, аппарат Гольджи и митотические центросомы).
Танкираза-2 (TANK-2) отличается от танкиразы-1 (TANK-1) тем, что у нее отсутствует N-концевой домен HPS (составлен гомополимерными повторами остатков His, Pro и Ser), который обнаруживается в TANK-1. Тем не менее, она, вероятно, обладает некоторыми перекрывающимися функциями с танкиразой-1, при условии, что оба белка имеют сходные субклеточные локализации, связаны друг с другом и связывают многие из одинаковых белков.
PARP-1 является основным нуклеарным белком, имеющим размер 116 кДа, который включает три домена: N-концевой ДНК-связывающий домен, который содержит две цинкосодержащие пальцеообразные области, домен аутомодифицирования и С-концевой каталитический домен. Указанный фермент синтезирует поли(АДФ-рибозу) - разветвленный полимер, который содержит более 200 единиц АДФ-рибозы. Белки-акцепторы поли(АДФ-рибозы) прямо или опосредованно участвуют в поддержании целостности ДНК. Они включают гистоны, белки HMG, топоизомеразы, ДНК- и РНК-полимеразы, ДНК-лигазы и Ca2+- и Mg2+-зависимые эндонуклеазы, факторы репарации одноцепочечных разрывов и факторы восстановления путем удаления поврежденного участка. Белок PARP экспрессируется с высоким уровнем во многих тканях и в основном в иммунной системе, сердце, мозге и клетках зародышевой линии. В обычных физиологических условиях PARP проявляет минимальную активность. Тем не менее, повреждение ДНК вызывает немедленное вплоть до 500-кратное увеличение активности PARP. В результате продукция поли(АФД-рибозы) имеет три последствия: во-первых, вызываемое повреждением ДНК поли-АФД-рибозилирование N- или C-концевых хвостов гистона H1 и H2B или селективное взаимодействие указанных белков со свободной или связанной с PARP-1 поли(АФД-рибозой) приводит к смягчению 30-нм хроматиновых волокон и увеличивает доступ к разрывам; во-вторых, она сигнализирует о возникновении и степени повреждения ДНК, так что клетка может установить адаптивный ответ в соответствии с тяжестью повреждения (репарация ДНК или самоубийство клеток); в-третьих, она опосредует быстрый рекрутмент факторов репарации одноцепочечного разрыва и факторов восстановления путем удаления поврежденного участка.
Одноцепочечные разрывы (SSB) спонтанно возникают во всех клетках. В отсутствие активности PARP-1 указанные SSB могут при репликации превратиться в двухцепочечные разрывы (DSB), которые могут привести к разрушению репликационных вилок. DSB идентифицируют по их эпигенетической отметке, фосфорилированию варианта корового гистона H2AX (γH2AX). Очень быструю локальную деконденсацию хроматина, который независимо от γH2AX возникает в DSB, можно отнести на счет продукции поли(АФД-рибозы), которую локально опосредует PARP-1.
Кроме того, эволюционные или внешние стимулы, такие как стероиды или тепловой шок, индуцируют активацию PARP-1 и зависимое от поли(АФД-рибозы) отделение гистонов от хроматина, и тем самым благоприятствуют раскрытию структуры хроматина, что в отсутствие разрывов ДНК может позволить активацию транскрипции.
Интенсивная активация PARP в клетках, страдающих от массового повреждения ДНК, приводит к значительной элиминации NAD+. Короткий полупериод существования поли(АДФ-рибозы) приводит к быстротечности функционального цикла. Как только поли(АДФ-рибоза) образовалась, она быстро разлагается под действием конститутивно активной поли(ADP-рибозо)гликогидролазы (PARG), а также фосфодиэстеразы и (АДФ-рибозо)протеинлиазы. PARP и PARG составляют цикл, в котором большое количество NAD+ превращается в АДФ-рибозу. Менее чем за час избыточное стимулирование PARP может вызвать падение уровня NAD+ и АТФ до уровня, составляющего меньше, чем 20% от нормального. Подобный сценарий особенно пагубен при ишемии, когда кислородная недостаточность уже подвергла значительному риску выработку энергии клетками. Полагают, что последующее образование свободных радикалов при реперфузии является основной причиной повреждения тканей. Часть падения концентрации АТФ, что типично для многих органов при ишемии и реперфузии, можно связать с элиминацией NAD+, вызванной функциональным циклом поли(АДФ-рибозы). Таким образом, ожидают, что ингибирование PARP или PARG сохраняет уровень клеточной энергии и тем самым обеспечивает возможность ишемизированным тканям выжить после инсульта.
Как указано выше, внутриклеточная локализация нескольких PARP указывает на физиологическую роль поли-АФД-рибозилирования при регулировании клеточного деления.
Вероятно, TANK-1 требуется для полимеризации поли(АФД-рибозы), связанной с митотическим веретеном. Активность TANK-1 по отношению к поли-АФД-рибозилированию может иметь большое значение для точного образования и поддержания биполярности веретена. Кроме того, было показано, что PARP-активность TANK-1 необходима для нормального отделения теломеров перед анафазой. Препятствия для проявления PARP-активности танкиразы приводят к аберрантному митозу, который вызывает блокировку цикла транзиторных клеток, вероятно, вследствие активации контрольной точки веретена, за которой следует смерть клетки. Поэтому ожидают, что ингибирование транкираз вызывает цитотоксическое действие на разрастающиеся опухолевые клетки.
PARP-1 и PARP-2 локализуются в центросомах, где они взаимодействуют с кинетохорными белками. Удаление гена Parp-2 у мышей приводит к значительному вызванному повреждением ДНК неправильному разделению хромосом, связанному с кинетохорными дефектами, которое указывает на то, что PARP-2 обладает важной охранной функцией для целостности перицентрического гетерохроматина. Кроме того, PARP-1 ассоциируется с центросомами, связывающими цепь контролирования повреждений ДНК с митотической контрольной точки.
Надежно установлена кардинальная роль PARP при репарации разрывов цепи ДНК, особенно в тех случаях, когда они вызваны непосредственно ионизирующим излучением или проявляются опосредованно после ферментативной репарации повреждений ДНК, вызываемых метилирующими агентами, ингибиторами топоизомеразы I типа и другими химиотерапевтическими средствами, такими как цисплатин и блеомицин. Различные исследования с использованием мышей-“нокаутов”, моделей транс-доминантного ингибирования (сверхэкспрессия ДНК-связывающего домена), антисмысловых ингибиторов и ингибиторов с небольшой молекулярной массой демонстрируют роль PARP при репарации и выживании клеток после индуцирования повреждения ДНК. Ингибирование ферментативной активности PARP должно приводить к повышенной чувствительности опухолевых клеток к обработкам, вызывающим повреждение ДНК.
Сообщалось, что ингибиторы PARP эффективны при радиосенсибилизации (гипоксической) опухолевых клеток и эффективно препятствуют восстановлению опухолевых клеток при потенциально летальном и сублетальном повреждении ДНК после радиационной терапии, в первую очередь за счет способности ингибиторов препятствовать воссоединению разрывов нити ДНК и за счет воздействия на несколько путей передачи сигнала о повреждении ДНК.
В патенте США № 5177075 рассмотрено несколько изохинолинов, которые применяли для усиления летального действия на опухолевые клетки ионизирующего излучения или химиотерапевтических средств. Weltin et al., “Effect of 6(5-Phenanthridinone), an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells”, Oncol. Res., 6: 9, 399-403 (1994) обсуждают ингибирование активности PARP, уменьшение пролиферации опухолевых клеток и выраженный синергический эффект в том случае, когда опухолевые клетки подвергают совместной обработке с алкилирующим средством.
Обзоры, касающиеся современного уровня техники, опубликованы в Li and Zhang, IDrugs 2001, 4(7): 804-812, Ame et al., Bioassays 2004, 26: 882-883 и Nguewa et al., Progress in Biophysics & Molecular Biology 2005, 88: 143-172.
Утрата PARP-1 усиливает образование разрывов ДНК, которые залечиваются путем гомологической рекомбинации без непосредственного регулирования самого процесса гомологической рекомбинации. Наследственный рак груди обычно связан с наследуемыми дефектами в одном из аллелей BRAC1 или BRAC2. BRAC1 и BRAC2 важны для гомологической рекомбинации. Оставшийся функциональный аллель BRCA1 или BRCA2 может быть потерян в некоторых клетках, тем самым способствуя онкогенезу. Таким образом, возникающие опухоли дефицитны по BRCAl или BRCA2 (например, BRCA2 -/-), в то время как соматические клетки сохраняют функциональные белки BRCA (BRCA2 +/-). Подавление активности PARP в BRCA1- или BRCA2-дефектном окружении может привести к возникновению повреждений ДНК, которые обычно залечиваются путем родственного хроматидного обмена, что приводит к хроматидным отклонениям от нормы и утрате жизнеспособности. При условии повышенной чувствительности BRCA-дефективных клеток для достижения терапевтического эффекта могут потребоваться лишь относительно небольшие уровни ингибиторов PARP-1. Это еще один пример того, как ингибиторы несущественного белка репарации ДНК могут использоваться в качестве единственного средства для лечения опухолей.
Согласно обзору Horvath и Szabo (Drug News Perspect 20(3), April 2007, 171-181), самые последние исследования показывают, что ингибиторы PARP повышают смертность раковых клеток в основном вследствие того, что ингибиторы препятствуют репарации ДНК на различных уровнях. Недавние исследования также показывают, что ингибиторы PARP подавляют развитие кровеносных сосудов либо за счет ингибирования экспрессии фактора роста, либо за счет подавления индуцированных фактором роста пролиферативных клеточных ответов. Указанные наблюдения также могут быть причастны к способам противоракового воздействия, которое ингибиторы PARP оказывают в условиях in vivo.
Кроме того, исследование, проведенное Tentori et al. (Eur. J. Cancer, 2007, 43 (14) 2124-2133), показывает, что ингибиторы PARP аннулируют миграцию, вызванную действием VEGF или плацентарного фактора роста, и препятствуют образованию трубочкоподобных сетей в клеточных системах, а также уменьшают развитие кровеносных сосудов в условиях in vivo. Указанное исследование также показывает, что индуцированное фактором роста развитие кровеносных сосудов отсутствует у лишенных PARP-1 мышах-нокаутах. Результаты данного исследования подтверждают необходимость нацеливаться на PARP для оказания действия, направленного против развития кровеносных сосудов, и придают новый терапевтический смысл использованию ингибиторов PARP при лечении рака.
Ингибиторы PARP по настоящему изобретению проявляют также противораковую активность, связанную с прерыванием полимеризации тубулина.
Тубулин представляет собой гетеродимер двух родственных белков, обозначаемых как α- и β-тубулин. Тубулин полимеризуется с образованием структур, которые называют микротрубочки. Микротрубочки представляют собой высоко активные цитоскелетные элементы и играют критическую роль во многих процессах клеток эукариотов, включая митоз, подвижность клеток, форму клеток, транспорт внутриклеточных органелл и межклеточные взаимодействия.
Для протекания правильного процесса деления клеток важно, чтобы микротрубочки были способны полимеризоваться и деполимеризоваться. Микротрубочки в митотическом веретене более активны, чем микротрубочки в неделящихся клетках, и таким образом, на них могут быть нацелены агенты, которые влияют на активность микротрубочек. Изменяя полимеризацию/деполимеризацию микротрубочек, указанные агенты влияют на образование митотического веретена, останавливают делящиеся клетки в фазе G2/M клеточного цикла и, в конце концов, приводят к смерти клеток в результате апоптоза. Поскольку опухолевые клетки обладают высокими скоростями пролиферации, то на них могут быть нацелены указанные антимитотические агенты.
Были идентифицированы три основных класса тубулин-связывающих лекарств, а именно: аналоги колхицина, алкалоиды винка и таксаны, каждый из которых имеет специфический участок для связывания в молекулах β-тубулина. Паклитаксел и родственные таксаны представляют собой класс лекарств, которые стабилизируют микротрубочки, т.е. контролируют процесс, который, в конце концов, приводит к замораживанию структур микротрубочек, так что они не могут реструктурироваться. Последующая остановка митоза индуцирует механизм апоптоза, который приводит к смерти клеток. Второй класс указанных соединений, аналоги колхицина, а также несколько других соединений, связываются с одним и тем же участком в β-тубулине, что и колхицин, и нарушают процесс полимеризации и образования микротрубочек. Третий класс соединений, винбластины и другие родственные лекарства на основе винка, связываются с участком Vinca и препятствуют образованию микротрубочек, а также дестабилизируют микротрубочки.
Тубулин является также мишенью при лечении болезненных состояний, которые зависят от или являются результатом аномального образования кровеносных сосудов (неоваскуляризация), таких как злокачественные опухоли. В таких случаях цитоскелет эндотелиальных клеток сосудов разрушается за счет деполимеризации микротрубочек, что является следствием ингибирования полимеризации тубулина, приводящей к образованию микротрубочек. Длина микротрубочек зависит от скорости деполимеризации по сравнению со скоростью полимеризации. Деполимеризация микротрубочек путем ингибирования полимеризации приводит к изменению морфологии клеток эндотелия, что может вызвать блокирование или остановку кровотока. В случае раковых опухолей поток крови к болезненным тканям прекращается, тем самым опухоль лишаются кислорода и питательных веществ, что приводит к смерти клеток вследствие некроза. Неоваскулярные системы более чувствительны к действию указанных агентов, поскольку они более зависимы от цитоскелета микротрубочек, чем нормальные, здоровые эндотелиальные клетки сосудов, которые также поддерживаются цитоскелетными структурами на основе актина. Для ряда ингибиторов полимеризации тубулина, которые нацеливаются на участок связывания колхицина в тубулине, воздействия на сосуды можно добиться при более низкой концентрации in vivo, по сравнению с антипролиферативным способом воздействия. Таким образом, агенты, которые нацеливаются на участок связывания колхицина в тубулине потенциально могут обладать двойным действием, т.е. оказывать антимитотическое и антиваскулярное воздействие.
Сохраняется потребность в эффективной и действенной противораковой терапии, которая эффективна против опухолей, в настоящее время неизлечимых или трудно поддающихся лечению, которая эффективна против опухолей, обладающих множественной лекарственной устойчивостью, и которая вызывает минимальные побочные эффекты. В настоящем изобретении предлагаются соединения, композиции для ингибирования и способы ингибирования активности PARP и ингибирования связывания тубулина, с целью лечения рака. Соединения и композиции по настоящему изобретению отличаются от известных из области техники тем, что они способны оказывать двойное действие (ингибирование PARP и ингибирование связывания тубулина). Кроме того, они обладают высокой ингибиторной активностью по отношению к TANK, приводящей к усиленному противораковому действию, что делает их наиболее пригодными для терапии с использованием одного агента. Они также пригодны для повышения эффективности химиотерапии и радиационной терапии, при этом основной эффект от их воздействия заключается в запускании механизма отмирания клеток в условиях повреждения ДНК.
Уровень техники
В WO 03/101985, опубликованной 11 декабря 2003, раскрываются производные 2-оксо-1,3,4-тригидрохиназолинила для лечения расстройств, связанных с пролиферацией клеток.
В EP 1487800, опубликованном 2 октября 2005, раскрывается фенантридиноны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В EP 1687277, опубликованном 16 июня 2005, раскрываются 6-алкенил- и 6-фенилалкилзамещенные 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В EP 1709011, опубликованном 16 июня 2005, раскрываются 6-фенилалкилзамещенные 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В EP 1709012, опубликованном 16 июня 2005, раскрываются 6-замещенные 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В EP 1694653, опубликованном 30 июня 2005, раскрываются 6-циклогексилалкилзамещенные 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2005/097750, опубликованной 2 октября 2005, раскрываются замещенные пиридоны в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2005/117876, опубликованной 15 декабря 2005, раскрываются низкомолекулярные ингибиторы, обладающие двойным ингибиторным действием на рак и развитие кровеносных сосудов.
В WO 2006/003146, опубликованной 12 января 2006, раскрываются производные хиназолинона в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2006/003147, опубликованной 12 января 2006, раскрываются производные фталазина в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2006/003148, опубликованной 12 января 2006, раскрываются производные хиназолиндиона в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2006/003150, опубликованной 12 января 2006, раскрываются замещенные производные 2-алкилхиназолинона в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2007/025009, опубликованной 1 марта 2007, раскрываются аналоги инденоизохинолинона в качестве ингибиторов поли(АДФ-рибозо)полимеразы.
В WO 2007/095628, опубликованной 23 августа 2007, раскрываются пиразолохинолиноны в качестве действенных ингибиторов PARP.
В WO 2008/107478, опубликованной 12 сентября 2008, раскрываются производные хинолинона в качестве ингибиторов PARP и TANK.
Публикация Tentori et al, European Journal of Cancer, vol. 43, no. 14, 2007 касается ингибирования поли(АДФ-рибозо)полимеразы (PARP) или делеции гена PARP-1, которая сдерживает развития кровеносных сосудов.
Описание изобретения
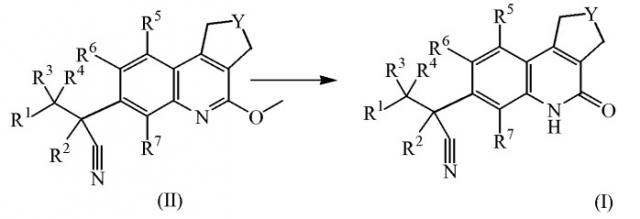
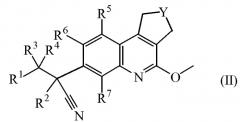
Настоящее изобретение касается соединений формулы (I)
включая их стереохимически изомерные формы;
где
Y обозначает CH2 или CH2-CH2;
R1 обозначает арил или Het;
где арил обозначает фенил или нафталинил;
где Het обозначает тиенил, пирролил, пирролинил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, фуранил, пиперидинил, пиридинил, пиридазинил, пиримидинил, пиперазинил, пиразинил, триазинил, индолизинил, азаиндолизинил, индолил, индолинил, бензотиенил, индазолил, бензоксазолил, бензимидазолил, бензофуранил, бензотиазолил, бензотриазолил, хроманил, пуринил, хинолинил, циннолинил, фталазинил, хиназолинил, хиноксазолинил, нафтиридинил или птеридинил;
два атома углерода в ариле или Het могут быть соединены мостиковой связью (т.е. образуют би- или трициклический фрагмент), при этом двухвалентный радикал выбран из
| -O-CH2-CH2-O- | (a-1), |
| -CH2-O-CH2-O- | (a-2), |
| -O-CH2-CH2-CH2- | (a-3), |
| -O-CH2-CH2-NR8- | (a-4), |
| -O-CR8 2-O- | (a-5), |
| -O-CH2-CH2- | (a-6), |
| -CH2-N-CH2-CH2- | (a-7), |
| -(CH2)3- | (a-8) или |
| -(CH2)4- | (a-9); |
каждый арил, Het, имеющий мостиковую связь арил или имеющий мостиковую связь Het может быть замещен одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из атома галогена, циано, нитро, гидроксикарбонила, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-6циклоалкила, C3-6цикло-алкиламино, метилэтиламино, аминоC3-6циклоалкила, галогеноC1-6алкила, тригалогеноC1-6алкила, C1-6алкилкарбонила, C1-6алкилоксикарбонила, C2-6алкенилкарбонила, оксима, C1-6алкилоксима, амидоксима, -C≡C-CH2O-CH3, -C≡C-CH2N(CH3)2, -C≡C-Si(CH3)3, гидроксиC1-6алкила, гидроксиC2-6алкенила, гидроксиC2-6алкинила, цианоC1-6алкила, цианоC2-6алкенила, аминокарбонилC1-6алкила, C1-6алкилсульфонилC1-6алкила, C1-6алкилсульфонилC2-6алкенила, C1-6алкилсульфонилC2-6алкинила, -PO(OC1-6алкил)2, -B(OH)2, -S-CH3, SF5, C1-6алкилсульфонила, -NR8R9, C1-6алкилNR8R9, -OR8, -C1-6алкилOR8, -CONR8R9, пиперидинилC1-6алкила, пиперазинилC1-6алкила, C1-6алкилпиперазинилC1-6алкила, морфолинилC1-6алкила, пиперидинила, пиперазинила, C1-6алкилпиперазинила, морфолинила, фенила, тиенила, пиразолила, пирролила, пирролидинила, пиридинила, пиримидинила, оксадиазолила, имидазолила, имидазолилC2-6алкинила, C1-6алкилимидазолилC2-6алкинила, цианопиридинила, фенилC1-6алкила, фенилC2-6алкенила, морфолинилC1-6алкила, C1-6алкилоксифенила, тригалогеноC1-6алкилфенила, метилпиразолила, галогенопиримидинила или диметиламинопирролидинила; или
R1 обозначает радикал формулы
где X1 обозначает CH2, NH или N-CH3;
где X2 обозначает CH2, C=O, O, NH или N-CH3;
где R10 обозначает фенил, пиридинил, пиридазинил или пиримидинил, где каждый фенил, пиридинил, пиридазинил или пиримидинил может быть замещен одним или двумя заместителями, каждый из которых независимо выбран из атома галогена, гидрокси, циано, C1-6алкила, амино, полигалгеноC1-6алкила или C1-6алкилокси; или
R1 обозначает радикал формулы
где X3 обозначает CH или N;
R2 обозначает метил, этил, пропил или C3-6циклоалкил;
каждый R3 и R4 независимо выбран из атома водорода, метила, этила, пропила, гидрокси, трифторметила, метилокси; или же R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют циклопропильный цикл или радикал формулы С(=О);
каждый R5 и R6 независимо выбран из атома водорода, атома галогена, C1-6алкилокси, циано, C1-6алкила, -OCH2CH2NR8R9, -CH2OCH2CH2NR8R9, -OCH2CH2CH2NR8R9;
R7 обозначает атом водорода, метил или атом фтора;
каждый R8 и R9 независимо выбран из атома водорода, атома галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, карбонила, C1-6алкилсульфонилC1-6алкила, C1-6алкилоксиC1-6алкила, гидроксиC1-6алкила, дигидроксиC1-6алкила, цианоC1-6алкила, тригалогеноC1-6алкила, фенилC1-6алкила, (диC1-6алкил)аминоC1-6алкила, C1-6алкилсульфонила, морфолинилC1-6алкила, морфолинилкарбонила, пиперазинилC1-6алкила, C1-6алкил-пиперазинилC1-6алкила, пиперидинилC1-6алкила, тиоморфолинилC1-6алкила, C3-6циклоалкилметила, пиридинила, пиримидинила, фенила, галогенофенила, оксанилC1-6алкила, C1-6алкилсульфонилC1-6алкила или C1-6алкилкарбониламиноC1-6алкила;
их N-оксидных форм, их фармацевтически приемлемых аддитивных солей и их сольватов.
Соединения формулы (I) и промежуточные соединения по настоящему изобретению могут также существовать в их таутомерных формах. Предполагается, что подобные формы, хотя они не указаны подробно в вышеприведенной формуле, должны быть включены в объем настоящего изобретения. Следует понимать, что таутомерные формы соединений формулы (I) включают такие соединения формулы (I), в которых, например, енольная группа превращается в кето-группу (кето-енольная таутомерия).
Всякий раз, когда гетероциклические системы в R1 содержат фрагмент -CH2-, -CH= или -NH-, заместители или остаток молекулы могут быть присоединены к каждому атому углерода или атому азота, при этом предполагается, что один или оба атома водорода у одного и того же атома углерода могут быть замещены.
Ниже разъясняется ряд терминов, которые использованы в предыдущих и последующих определениях. Указанные термины используются как самостоятельно, так и в составных терминах.
В приведенных выше и далее по тексту определениях термин атом галогена является общим термином для атомов фтора, хлора, брома и иода; C1-6алкил обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, бутил, пентил, гексил, 1-метилэтил, 2-метилпропил, 2-метилбутил, 2-метилпенил и т.п.; галогеноС1-6алкил означает C1-6алкил, содержащий один галогеновый заместитель, например, фторметил; тригалогеноС1-6алкил означает C1-6алкил, содержащий три идентичных или различных галогеновых заместителя, например, трифторметил; полигалогеноС1-6алкил в качестве группы или части группы обозначает C1-6алкил, замещенный одним или несколькими, например, 2, 3, 4 или 5 атомами галогена, в частности, обозначает метил, замещенный одним или несколькими атомами фтора, например, дифторметил или трифторметил, 1,1-дифторэтил, 1,1-дифтор-2,2,2-трифторэтил и т.п. В том случае, когда в рамках определения полигалогеноС1-6алкила к C1-6алкильной группе присоединено более одного атома галогена, они могут быть одними и теми же или разными; C2-6-алкенил обозначает углеводородные радикалы с прямой или разветвленной цепью, содержащие двойную связь, в частности, одну двойную связь, и имеющие от 2 до 6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил и т.п.; C2-6-алкинил обозначает углеводородные радикалы с прямой или разветвленной цепью, содержащие тройную связь, в частности, одну тройную связь, и имеющие от 2 до 6 атомов углерода, такие как, например, этинил, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-гексинил и т.п.; C3-6-циклоалкил включает циклические углеводородные группы, содержащие от 3 до 6 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Термин “фармацевтически приемлемые аддитивные соли” означает фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли. Следует понимать, что указанные выше или ниже фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли включают терапевтически активные нетоксичные кислотно-аддитивные и нетоксичные основно-аддитивные солевые формы, которые способны образовывать соединения формулы (I). Соединения формулы (I), обладающие свойствами основания, могут быть превращены в их фармацевтически приемлемые кислотно-аддитивные соли обработкой указанной основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, в частности, хлористоводородная или бромистоводородная кислота; серная; азотная; фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты.
Соединения формулы (I), обладающие кислотными свойствами, могут быть превращены в их фармацевтически приемлемые основно-аддитивные соли обработкой указанной кислотной формы соответствующим органическим или неорганическим основанием. Подходящие солевые формы включают, например, аммониевые соли, соли щелочных и щелочноземельных металлов, в частности, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, в частности, соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п.
Пригодными для терапевтического применения солями соединений формулы (I) являются такие соли, в которых противоион является фармацевтически приемлемым. Тем не менее, соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также использоваться, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения.
Четвертичная аммониевая соль соединения формулы (I) обозначает указанное соединение, которое способно образоваться по реакции между основным атомом азота соединения формулы (I) и подходящим кватернизующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, в частности метилиодид или бензилиодид. Могут также применяться другие реагенты с легко уходящей группой, такие как, например, алкил трифторметансульфонаты, алкил метансульфонаты и алкил п-толуолсульфонаты. Четвертичная аммониевая соль имеет, по меньшей мере, один положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают ионы хлора, брома, иода, трифторацетата и ацетата. Четвертичные аммониевые соли соединений формулы (I) входят в объем настоящего изобретения.
Термин сольваты включает гидраты и формы присоединения растворителя, которые способны образовать соединения формулы (I), и их фармацевтически приемлемые аддитивные соли. Примерами подобных форм являются, в частности, гидраты, алкоголяты и т.п.
Приведенный выше и далее по тексту настоящего описания термин стереохимически изомерные формы соединений формулы (I) обозначает все возможные соединения, составленные из одних и тех же атомов, которые соединены друг с другом той же самой последовательностью связей, но имеющие различные трехмерные структуры и не являющиеся взаимосовмещаемыми, которые могут иметь соединения формулы (I). Если не отмечено или не указано иное, то химическое обозначение соединений охватывает смесь всех возможных стереохимически изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Следует понимать, что в объем настоящего изобретения входят все стереохимически изомерные формы соединений формулы (I), как в чистой форме, так и в смеси друг с другом.
Особый интерес представляют такие соединения формулы (I), которые являются стереохимически чистыми.
Чистые стереоизомерные формы соединений и промежуточных соединений в контексте настоящего описания определяются как изомеры, практически не содержащие другие энантиомерные или диастереомерные формы той же самой основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" касается соединений или промежуточных соединений, имеющих стереоизомерный избыток, который составляет, по крайней мере, 80% (т.е. минимум 80% одного изомера и максимум 20% других возможных изомеров) вплоть до стереоизомерного избытка 100 % (т.е. 100% одного изомера и никаких других), более предпочтительно, соединения и промежуточные соединения имеют стереоизомерный избыток от 90% до 100%, еще более предпочтительно, имеют стереоизомерный избыток от 94% до 100% и, наиболее предпочтительно, имеют стереоизомерный избыток от 97% до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать по аналогии, однако в этом случае термины имеют отношение, соответственно, к энантиомерному избытку и диастереомерному избытку в рассматриваемой смеси.
Если соединение имеет один хиральный центр, и два энантиомера указанного соединения были разделены, то звездочка "*" на чертеже указывает, что абсолютная стереохимическая конфигурация энантиомера не была определена.
Следует понимать, что N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько третичных атомов азота окислены в так называемые N-оксиды, в частности, включают такие N-оксиды, где N-окислению подвергнуты один или несколько атомов азота пиперидина или пиперазина.
Соединения формулы (I) могут быть превращены в соответствующие N-оксидные формы по известным из области техники способам преобразования трехвалентного атома азот в его N-оксидную форму. Указанную реакцию N-окисления можно в общем случае осуществить по реакции исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочного металла или щелочноземельного металла, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, надбензойная кислота, или галогензамещенная надбензойная кислота, например 3-хлорнадбензойная кислота, пероксоалкановые кислоты, например, надуксусную кислоту, алкилгидропероксиды, например, гидропероксид трет-бутила. Подходящими растворителями являются, например, вода, низшие спирты, в частности, этанол и т.п., углеводороды, в частности, толуол, кетоны, в частности, 2-бутанон, галоидированные углеводороды, в частности, дихлорметан, и смеси подобных растворителей.
Предполагается, что настоящее изобретение включает также любые изотопы атомов, присутствующих в соединениях по настоящему изобретению. Например, изотопы водорода включают трит