Способ обнаружения и подсчета жизнеспособных микроорганизмов вида legionella pneumophila
Иллюстрации
Показать всеНастоящее изобретение относится к области микробиологии и касается способа обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце. Описанный способ предусматривает: (1) контактирование указанных микроорганизмов указанного образца по меньшей мере с одним восстанавливающим соединением, содержащим глутамат и пируват, и питательной средой, которая представляет собой забуференную угольно-дрожжевую (BCYE) или GVPC агаровую питательную среду, (2) инкубацию продукта этапа (1) и (3) обнаружение и определение количества жизнеспособных микроорганизмов. Используемое восстанавливающее соединение прямо или косвенно оказывает влияние на метаболизм, снижая окислительный стресс микроорганизма посредством уменьшения образования и/или разрушения реактивных форм кислорода. Представленный способ позволяет провести точный подсчет микроорганизмов вида Legionella pneumophila, находящихся в стрессовом состоянии. 6 з.п. ф-лы, 5 ил., 5 пр.
Реферат
Настоящее изобретение относится к способу обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце. Изобретение также включает набор, подходящий для применения в данном способе. Этот способ и набор дают возможность более быстро определить количество жизнеспособных микроорганизмов
Бактерии Legionella повсеместно распространены во влажных или сырых средах, таких как почва и неморская водная среда обитания. Также их можно найти в устройствах для теплой и холодной воды, стояках охлаждения в системах кондиционирования воздуха и увлажнителях воздуха.
Legionella, особенно Legionella pneumophila, являются патогенами, которые могут вызывать острую бактериальную пневмонию, известную обычно под названием "болезнь легионеров", которая часто имеет летальный исход для инфицированных индивидуумов.
Традиционно, обнаружение и подсчет Legionella pneumophila осуществляется посредством культивирования клеток. Этот способ может осуществляться путем определения количества культивируемых бактерий посевом на чашках Петри или подсчетом микроколоний, используя метод мембранного фильтрования. Этими способами оцениваются жизнеспособные бактерии по их способности образовывать колонию или микроколонию. К сожалению, такие способы обычно требуют от 3 до 10 дней для того, чтобы образовались колонии или микроколонии. Там, где водяные установки при этом находятся в работе, существует недопустимый риск инфицирования человека в течение этого периода времени.
Другие способы определения микроорганизмов Legionella в целом включают метод ПЦР (полимеразную цепную реакцию). В методе ПЦР используется ДНК-полимераза для амплификации участков ДНК путем ферментативной репликации in vitro. В ходе метода генерированная ДНК используется как матрица для репликации, которая приводит к цепной реакции, в которой матрица ДНК амплифицируется в геометрической прогрессии. ПЦР дает возможность одну или несколько копий участка ДНК увеличить до миллиона или более копий данного участка ДНК. В основном такой метод описан Diederen et al., J Med Microbiol. 2007 Jan; 56 (Pt 1):94-101.
Однако недостатком ПЦР является то, что образцы могут содержать ингибиторы реакции полимеризации и поэтому не всегда обеспечивают количественные результаты. Кроме того, в методе используется этап предварительной очистки ДНК, которая может приводить к потере ДНК с последующей недооценкой присутствия Legionella. В некоторой степени эти недостатки преодолеваются с помощью ПНР в режиме реального времени, которая обеспечивает количественную оценку. Однако этот метод не позволяет отличить жизнеспособные клетки от нежизнеспособных клеток.
Другой способ представляет собой флуоресцентную гибридизацию in situ (FISH), в которой олигонуклеотидный зонд, меченный флуоресцентным веществом, проникает в клетки бактерий. В случае если рибосомные нуклеиновые кислоты (рРНК) имеют подходящую последовательность по отношению к зонду, узнаваемую как мишень, то этот зонд будет присоединяться к своей мишени, и не будет удаляться на последующем этапе промывания. Бактерии, в которых зафиксировался зонд, затем будут излучать флуоресцентный сигнал. Этот флуоресцентный сигнал затем можно оценить количественно посредством способов, таких как проточная цитометрия, твердофазная цитометрия, эпифлуоресцентная микроскопия. Типичный FISH способ описывается Dutil S et al J Appl Microbiol. 2006 May; 100(5):955-63. Однако, применяя только FISH способ, можно было бы определить общее число жизнеспособных Legionella pneumophila, но, к сожалению, этим способом нельзя непосредственно определить только те бактерии Legionella pneumophila, которые способны делиться и создавать впоследствии колонию.
Другой способ численного определения жизнеспособных Legionella pneumophila включает ChemChrome V6 и описан Delgado-Viscogliosi et al Appl Environ Microbiol. 2005 Jul; 71 (7):4086-96. Этот способ позволяет осуществлять количественное определение Legionella pneumophila, а также устанавливать различие между жизнеспособными и нежизнеспособными бактериями. Он объединяет специфическое детектирование клеток Legionella, посредством использования антител и маркера бактериальной жизнеспособности (ChemChrome V6), и применение эпифлуоресцентной микроскопии для подсчета. Однако, хотя этот способ устанавливает различия между жизнеспособными и нежизнеспособными клетками, он не способен отдельно идентифицировать те бактерии, которые образуют колонии.
В US 20070218522 описаны способы и композиции для обнаружения и количественного определения жизнеспособных Legionella и других гетеротрофных аэробных бактерий, и способ для быстрого обнаружения и подсчета микро-колоний Legionella включает применение дипслайдов, которые включают абсорбирующую среду, вещества, стимулирующие рост, и вещества для селективного роста. При этом способе не регистрируются поврежденные бактерии.
Европейский патент ЕР 1329515 относится к способу тестирования на присутствие микроорганизмов в газообразной среде, содержащей перекись водорода, путем контактирования газообразной среды с агаровой питательной средой, содержащей соль пировиноградной кислоты, и позволяющей развиваться колониям микроорганизмов.
Способы, которые включают выращивание колоний на питательной среде, такой как чашка с питательным агаром, обычно считаются более точными. Поэтому чашечный способ подсчета остается предпочтительным выбором способа для получения общего числа жизнеспособных микроорганизмов. Он обычно означает помещение образца, который, предположительно, содержит микроорганизмы, на чашку, содержащую твердое питательное средство или питательную среду. На такой способ обычно ссылаются как на посев на чашках Петри. Под общим количеством жизнеспособных микроорганизмов мы имеем в виду общее число бактерий, способных образовывать популяцию, видимую наблюдателем. Обычно это означает видимую колонию на поверхности питательной среды, такой как питательная агаровая чашка Петри.
Однако микроорганизмы, такие как Legionella pneumophila, в окружающей среде могут подвергаться одному или более стрессовым воздействиям, которые препятствуют росту микроорганизма и размножению в окружающей обстановке. Такие находящиеся в стрессовом состоянии микроорганизмы не будут делиться вообще или образовать видимую колонию при обычных условиях культивирования. В окружающей среде часть клеток микроорганизмов обычно испытывает стресс из-за окружающих условий, таких как голодание, присутствие биоцида, тепловой шок и обезвоживание. Кроме того, эти клетки могут находиться в уязвимом физиологическом состоянии, при котором метод посева микроорганизмов на чашки может усилить стрессовое состояние этих, уже находящихся в стрессовом состоянии клеток микроорганизмов, вследствие присутствия атмосферного кислорода. Кроме того, это может привести к артефактной гибели бактерий, находящихся в стрессовом состоянии, и привести к недооценке общего числа жизнеспособных микроорганизмов.
В дополнение, недооценка числа жизнеспособных Legionella pneumophila при чашечном методе может стать опасной в связи с их патогенностью.
Начиная с 1970-х годов, сообщалось, что желательно использовать поглотитель, реактивных форм кислорода (РФК), чтобы ограничить влияние окислительного стресса во время процедуры посева на чашки. Это было опубликовано Speck et al., repair and enumeration of injured colifonns by a plating procedure, Appl Microbiol 29, 549-50 (1975); Martin et al., Catalase: its effect on microbial enumeration. Appl Environ Microbiol 32, 731-4 (1976); Brewer et al. Beneficial effects of catalase or pyruvate in a most-probable-number technique for the detection of Staphylococcus aureus. Appl Environ Microbiol 34, 797-800 (1977); McDonald et al. Enhanced recovery of injured Escherichia coli by compounds that degrade hydrogen peroxide or block its formation. Appl Environ Microbiol 45, 360-5 (1983); Marthi et al., Resuscitation effects of catalase on airborne bacteria. Appl Environ Microbiol 57, 2775-6 (1991); Busch and Donnelly, Development of a repair-enrichment broth for resuscitation of heat-injured Listeria monocytogenes and Listeria innocua. Appl Environ Microbiol 58, 14-20 (1992); и Dukan et al., Oxidative stress defense and deterioration of growth-arrested Escherichia coli cells. J Biol Chem 274, 26027-32 (1999).
Однако изобретатели настоящего изобретения полагают, что во всех вышеупомянутых случаях РФК были бы понижены прямым способом, при котором соединение химически реагирует с РФК.
Berube et al., "Rapid detection and identification of Legionella pneumophila by membrane immunoassay", Applied and Environmental Microbiology, 1989, 55, 1640-1641 описывают обнаружение и идентификацию Legionella pneumophila посредством иммуноблот-анализа, используя моноклональное антитело. Не предусматривается никаких средств для решения проблемы поврежденных бактерий.
В статье Pine et al. (Role of keto acids and reduced-oxygen-scavenging enzymes in the growth of Legionella species. J Clin Microbiol 23, 33-42 (1986)) показывается необходимость добавления кетокислот и поглощающего восстановленный кислород фермента, для того, чтобы оптимизировать культивирование Legionella pneumophila, и предлагается применять эти материалы в среде, используемой для стандартного подсчета этого микроорганизма.
Однако применение только кетокислот и поглощающего восстановленный кислород фермента является недостаточным, для восстановления находящихся в стрессовом состоянии клеток Legionella pneumophila, так, чтобы клетки были восстановлены и позволили проводить точный подсчет. Это особенно справедливо в случае применения специфической питательной среды для Legionella pneumophila, такой как забуференный угольно-дрожжевой агар (BCYE). В действительности нет никаких данных, касающихся оптимизации стандартной среды, пригодной для точного подсчета Legionella pneumophila.
Таким образом, задачей настоящего изобретения является нахождение способа точного подсчета Legionella pneumophila. Это особенно необходимо в отношении стандартного способа, в котором используется метод посева на чашки.
Таким образом, по настоящему изобретению мы обеспечиваем способ обнаружения и подсчета жизнеспособных микроорганизмов в образце, который, как предполагается, содержит указанные микроорганизмы, и предусматривает:
(1) контактирование указанных микроорганизмов указанного образца по меньшей мере с одним восстанавливающим соединением и питательной средой и
(2) инкубацию продукта этапа (1) и
(3) обнаружение и определение количества указанных жизнеспособных микроорганизмов, при этом микроорганизмы представляют собой вид Legionella pneumophila, и восстанавливающее соединение прямо или косвенно оказывает влияние на метаболизм, снижая окислительный стресс микроорганизма.
Под окислительным стрессом мы подразумеваем дисбаланс между концентрацией РФК (эндогенное образование или эгзогенное приведение) и способностью микроорганизмов легко обезвреживать реактивные промежуточные продукты или эффективно восстанавливать полученные повреждения. Такое нарушение нормальных метаболических процессов микроорганизма может вызвать токсические эффекты в результате образования свободных радикалов и окислительных веществ, таких как пероксиды, которые могут привести к повреждению компонентов клеток микроорганизмов, например, ДНК, белков или липидов.
Воздействие на метаболизм микроорганизма приводит к изменению естественных внутренних химических процессов в клетке микроорганизма.
Ссылка на эндогенность означает, что изменения происходят внутри клетки микроорганизма и приводят к снижению окислительного стресса. Это могло бы быть, например, изменение метаболических процессов в микроорганизме. Это также может включать удаление РФК из клетки микроорганизма.
Желательно, чтобы восстанавливающее соединение могло представлять собой или включать по меньшей мере одно соединение, которое ингибирует образование и/или разрушает РФК. Вообще это могло бы быть достигнуто посредством изменения метаболизма.
При этом восстанавливающее соединение может представлять собой или включать, по меньшей мере, одно соединение, которое косвенно ингибирует образование и/или разрушает РФК. Такое соединение, которое оказывает косвенное влияние на РФК, может осуществлять это, вмешиваясь в метаболизм микроорганизма. Такое соединение может рассматриваться как косвенно снижающее РФК эндогенно, например, во время аэробного дыхания.
Мы обнаружили, что настоящий способ вызывает восстановление находящихся в стрессовом состоянии клеток Legionella pneumophila и таким образом дает более точное общее число жизнеспособных микроорганизмов. Неожиданно мы обнаружили также, что этот способ снижает количество требуемого на инкубацию времени. В общем, мы обнаружили, что способ может снизить время инкубации на несколько часов, а в некоторых случаях, по меньшей мере, на одни сутки. В некоторых случаях способ по настоящему изобретению позволяет снизить время инкубации на несколько суток, например, на пять суток, по сравнению с обычным способом.
Неожиданно мы также обнаружили, что способ по изобретению может приводить к уменьшению мешающих микроорганизмов, то есть микроорганизмов, отличных от Legionella pneumophila.
Способ по настоящему изобретению желательно включает контактирование клеток микроорганизма Legionella pneumophila, находящегося в стрессовом состоянии, по меньшей мере, с одним соединением, которое ингибирует образование, и/или снижает, и/или удаляет РФК, и это действует таким образом, что приводит к восстановлению клеток, подвергнутых стрессу.
Микроорганизм Legionella pneumophila может быть приведен в непосредственный контакт с восстанавливающим соединением при отборе образца. Так, контейнер, в который отбирается образец воды, предположительно содержащей микроорганизм, уже может содержать восстанавливающее соединение. В альтернативном варианте, после того как был отобран образец воды, содержащей Legionella pneumophila, для целей анализа, он может быть разбавлен водой, содержащей восстанавливающее соединение. В другом альтернативном варианте, образец, не обязательно разбавленный, может быть приведен в контакт с питательной средой, содержащей восстанавливающее соединение, или восстанавливающее соединение может быть применено после контактирования микроорганизма с питательной средой.
Один вариант этого изобретения, желательно, включает контактирование указанного образца с восстанавливающей средой, предпочтительно, неселективной восстанавливающей средой, содержащей указанное восстанавливающее соединение, и последующее приведение этого в контакт с питательной средой, предпочтительно, селективной питательной средой. Предпочтительно, восстанавливающая среда представляет собой жидкость, более предпочтительно, бульон. Когда восстанавливающая среда представляет собой жидкость, это соответственно принято называть как жидкостной способ восстановления. Как правило, при жидкостном способе восстановления образец сначала вводится в жидкую среду, содержащую восстанавливающее соединение. Теоретически, жидкостной способ восстановления позволяет восстанавливать находящиеся в стрессовом состоянии бактерии в неселективной жидкой среде. Предпочтительно, при жидкостном способе восстановления в качестве жидкой среды применяется бульон. Обычно жидкая среда, содержащая микроорганизмы, затем переносится на питательную среду. Микроорганизмы, находящиеся в стрессовом состоянии, либо восстановились перед переносом на питательную среду, либо восстанавливаются при контакте с питательной средой. Более предпочтительно, питательная среда представляет собой селективную питательную среду. Обычно жидкая среда, содержащая микроорганизмы, наносится на чашку с селективной питательной средой, такую как чашка с селективной агаровой питательной средой.
В альтернативном предпочтительном варианте этап (1) содержит контактирование указанного образца с питательной средой, предпочтительно, неселективной питательной средой, содержащей указанное восстанавливающее соединение, и последующее приведение его в контакт с восстанавливающей средой, также содержащей названное восстанавливающее соединение. Предпочтительно, восстанавливающая среда представляет собой неселективную восстанавливающую среду, более предпочтительно, твердую среду, и особенно предпочтительно, селективную агаровую питательную среду. Если восстанавливающая среда является твердой, этот случай следует называть метод восстановления на твердой среде. Обычно способ восстановления на твердой среде может включать контактирование образца с неселективной питательной средой, содержащей восстанавливающее соединение. Затем это может быть приведено в контакт с селективной питательной средой, содержащей восстанавливающее соединение. В этом варианте селективные ингредиенты и соединение или соединения, которые предупреждают образование, снижают или удаляют РФК, будут диффундировать в неселективную среду. Желательно, чтобы неселективная питательная среда могла быть неселективной агаровой питательной средой. Соответственно, в этом варианте образец может высеваться на чашки на любой неселективный агар, и затем селективная агаровая питательная среда, содержащая соединение или соединения, которые предупреждают образование, снижают или удаляют РФК, накладывается на неселективную агаровую питательную среду.
В другом альтернативном варианте образец может наноситься на селективную питательную среду, которая уже содержит восстанавливающее соединение. Такая селективная питательная среда может представлять собой селективную агаровую питательную среду. Посев образца на чашку может выполняться так, как описано ранее.
В другом альтернативном варианте образец может отбираться из воды в форме аэрозоля. Обычно аэрозоль может быть локализован в охлаждающей стояке или воздушном кондиционере. Желательно, чтобы воду конденсировали из аэрозоля перед испытанием согласно способу по настоящему изобретению. В альтернативном предпочтительном варианте этап (1) содержит контактирование указанного образца из аэрозоля с разбавляющей водой, содержащей восстанавливающую среду, предпочтительно, неселективную восстанавливающую среду, содержащую названное восстанавливающее соединение, и последующее приведение его в контакт с питательной средой, также содержащей названное восстанавливающее соединение.
Во всех упомянутых выше вариантах изобретения питательная среда должна быть подходящей для культивирования Legionella pneumophila. Подходящие типы питательных сред описаны в литературе и хорошо известны специалистам в данной области. Обычно питательная среда должна содержать активированный уголь и цистеин.
Предпочтительно, чтобы селективная питательная среда представляла собой селективную агаровую питательную среду и, более предпочтительно, представляла собой забуференный угольно-дрожжевой агар (BCYE). BCYE питательная среда становится селективной при добавлении антибиотика. Чрезвычайно желательная BCYE питательная среда с антибиотиком известна как GVPC (глицин, ванкомицин, полимиксин В, циклогексимид.
Способ посева на чашки описан в литературе и хорошо известен специалистам в данной области. Обычно способ включает нанесение некоторого количества образцов воды на агаровый гель, который помещен в чашку Петри. Это может быть названо как метод чашек Петри или способ посева на чашки с агаром. Целью посева на чашки с агаром является нанесение аликвоты, обычно 100 мкл воды, предположительно содержащей микроорганизм, называемой бактериальной суспензией, на твердую среду в чашке Петри. Могут использоваться стеклянные шарики или клеточный скребок, чтобы распределить бактериальную суспензию на агаре в чашке. После распределения большая часть жидкости поглощается агаром, и тонкий слой с бактериями остается на поверхности агара. При инкубации на поверхности агара происходил рост бактерий в виде колоний. Инкубация обычно происходит при температуре, наилучшим образом подходящей для микроорганизма, что хорошо отражено в литературе и известно специалистам. Обычно температура находится в пределах между 30°С и 50°С, например, около 37°С.
Восстанавливающее соединение должно быть добавлено в количестве, эффективном для снижения окислительного стресса микроорганизма. Предпочтительно, это составляет количество, эффективное для того, чтобы снизить или существенно удалить РФК из клетки микроорганизма.
В одном предпочтительном варианте изобретения восстанавливающее соединение включает, по меньшей мере, тиогликолевую кислоту или ее соли. Желательно, тиогликолевая кислота находится в форме тиогликолдта и обычно в форме натриевой соли. Тиогликолевая кислота или ее соли эгзогенно поглощают РФК. Предпочтительно, концентрация, присутствующих в среде тиогликолевой кислоты или ее солей, находится в пределах между 0,01 и 1% по массе (рассчитано как тиогликолят).
В другом предпочтительном варианте изобретения восстанавливающее соединение включает по меньшей мере одно соединение из группы, состоящей из каталазы, аскорбиновой кислоты (или ее соли), пиросернистой кислоты (или ее соли), диметил-сульфоксида (DMSO), 3,3'-тиодипропионовой кислоты (TDPA) (или ее соли) и пировиноградной кислоты (или ее соли). Как было найдено, все эти соединения снижают или удаляют РФК. Когда применяются аскорбиновая кислота и пировиноградная кислота, они, предпочтительно, присутствуют в среде в концентрации от 0.01 до 1% по массе, из расчета на натриевую соль. DMSO, предпочтительно, применяют в концентрации между 0.01 и 0.1% по массе, и каталаза, желательно, присутствует в концентрации в пределах от 0.001 до 0.1% по массе. Пировиноградная кислота, особенно ее натриевая соль, является особенно предпочтительной.
В более предпочтительном варианте выполнения изобретения восстанавливающая среда или питательная среда может содержать как тиогликолевую кислоту (или соль), так и по меньшей мере одно соединение, выбранное из группы, состоящей из каталазы, аскорбиновой кислоты (или ее соли), пиросернистой кислоты (или ее соли), диметилсульфоксида (DMSO), 3,3'-тиодипропионовой кислоты (TDPA) (или ее соли) и пировиноградной кислоты (или ее соли). Комбинация тиогликолята и пирувата натрия является особенно предпочтительной.
В случае если восстанавливающее соединение может представлять собой или включать, по меньшей мере, одно соединение, которое косвенным образом препятствует образованию и/или разрушает РФК, то названное соединение может вызывать снижение уровней РФК тем, что вмешивается в процесс метаболизма микроорганизма. Обычно такое соединение включает аминокислоты или их соли. Особенно предпочтительным соединением является глутаминовая кислота или глутамат.
Еще в одном предпочтительном варианте изобретения восстанавливающее соединение может включать глутаминовую кислоту или глутамат, особенно натриевую соль. В общем, количество глутаминовой кислоты или глутамата находится в пределах между 0.01 и 5% по массе в расчете на натриевую соль.
Особенно предпочтительно, чтобы восстанавливающее соединение включало пировиноградную кислоту или ее соль (особенно натриевую соль) вместе с глутаминовой кислотой или ее солью (особенно натриевой солью). Эта комбинация пировиноградной кислоты или пирувата с глутаминовой кислотой или глутаматом по-видимому имеет синергетический эффект, который обеспечивает более высокую оценку (и поэтому более точную оценку) культивируемой Legionella, чем соответственно любое из этих соединений, применяемое в отдельности. Кроме того, мы обнаружили, что эта комбинация дополнительно снижает латентную фазу во время развития Legionella pneumophila, в частности, в жидкой среде. Такое снижение латентной фазы в жидкой среде приводит к уменьшению времени, которое требуется для получения видимой колонии на агаровой чашке.
Желательно, чтобы количество пирувата и глутамата составляло, как указано ранее. Особенно предпочтительно, чтобы отношение глутамата к пирувату находилось в пределах между 1:1 и 50:1, особенно между 5:1 и 20:1 и, более предпочтительно, между 7:1 и 15:1.
Неизвестно, является ли глутамат антиоксидантом. Однако представляется, что глутамат может косвенно снижать эндогенное образование РФК, сформированных естественным путем во время культивирования, или их последующее влияние на макромолекулы (окисление).
Не будучи ограниченными теорией, считают, что глутаминовая кислота изменяет метаболизм Legionella, увеличивая эффект пирувата, и это вмешательство в метаболизм Legionella косвенным образом ингибирует образование и/или разрушает внутриклеточные РФК.
Также может быть желательным включение кетокислоты и/или фермента, поглощающего восстановленный кислород, с восстанавливающей средой и/или питательной средой. Кетокислота и/или фермент, поглощающий восстановленный кислород, не рассматриваются как восстанавливающие соединения согласно настоящему изобретению. Тем не менее, может быть полезным включение одного или обоих этих соединений с любыми из упомянутых выше восстанавливающих соединений или их комбинациями.
Обнаружение и подсчет жизнеспособных микроорганизмов может выполняться любым известным способом, представленным в литературе. Обычно это означает подсчет видимых колоний на поверхности питательной среды, такой как чашка с питательным агаром.
Способ по настоящему изобретению облегчает точное количественное определение наличия Legionella pneumophila. Кроме того, может быть в значительной мере снижено время инкубации. Способ подходит для определения Legionella pneumophila в образцах, отобранных из любой группы, выбранной из промышленных охлаждающих вод, питьевых вод и природных вод.
Настоящее изобретение включает также набор для более точного определения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце, который предположительно содержит названные микроорганизмы, содержащий:
(1) по меньшей мере одно восстанавливающее соединение,
(2) питательную среду,
(3) устройство для инкубации,
(4) устройство для обнаружения и подсчета микроорганизмов, в котором восстанавливающее соединение прямо или косвенно оказывает влияние на метаболизм, снижая окислительный стресс микроорганизма,
в котором микроорганизмы представляют собой вид Legionella pneumophila, и в котором восстанавливающее соединение прямо или косвенно оказывает влияние на метаболизм, снижая окислительный стресс микроорганизма.
Набор может содержать также любой из вариантов выполнения, описанных относительно первого аспекта изобретения
Набор подходит для применения в способе настоящего изобретения и дает возможность более точного подсчета Legionella pneumophila.
Изобретение иллюстрируется следующими примерами.
Пример 1.
В 5 колб, содержащих по 50 мл стерильного фосфатного буфера (PBS), добавляли суспензию Legionella pneumophila до конечной концентрации 108 бактерий/мл. Добавляли биоцидный раствор до получения конечных концентраций в пределах от 10 до 30 мг/л. Одна колба подготавливалась параллельно и служила контролем без биоцида. Используемый биоцид представлял собой THPS (тетракис(гидроксиметил)фосфоний сульфат).
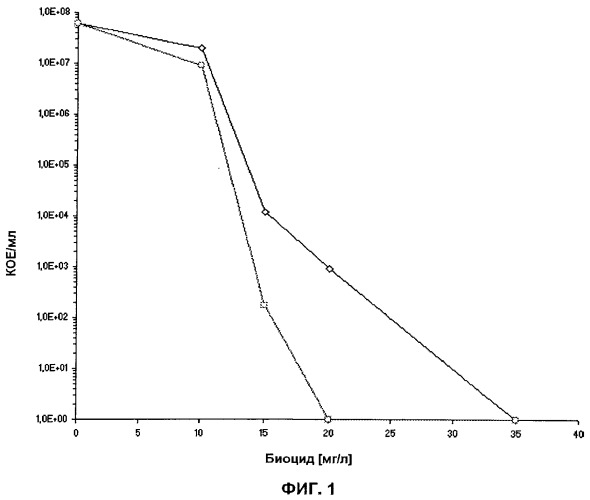
После гомогенизации, все суспензии инкубировали при температуре 37±1°С, в темноте и при перемешивании в течение 60 мин. Биоцид удаляли путем 2-кратного промывания в PBS (5000 × g, 10 мин) перед подсчетом бактерий. Осуществляли последовательное разведение, и 2 аликвоты по 100 мкл из одного и того же разведения высевали на BCYE агаровую чашку и BCYE с добавлением 0.1% пирувата.
Результаты показаны на Фиг.1. На Фиг.1 показан подсчет культивируемых Legionella Pneumophila после обработки биоцидом на BCYE среде (квадраты) и BCYE среде плюс 0.1% пирувата (кружки). Присутствие биоцида должно привести микроорганизмы к стрессу. Результаты показывают, что в случае, когда микроорганизмы находятся в стрессовом состоянии, в присутствии пирувата насчитывается значительно большее число микроорганизмов. В отсутствии биоцида микроорганизмы не подвергаются стрессу. В этом случае можно видеть, что присутствие и отсутствие пирувата дает один и тот же результат. Это показывает, что в присутствии пирувата находящиеся в стрессовом состоянии микроорганизмы Legionella pneumophila восстанавливаются, и таким образом обеспечиваются более точные показания.
Пример 2.
В колбу 1, содержащую 50 мл стерильного фосфатного буфера (PBS), добавляли суспензию Legionella pneumophila до конечной концентрации 108 бактерий/мл. Добавляли биоцидный раствор, чтобы получить конечную концентрацию 15 мг/л. Используемый биоцид представлял собой THPS (тетракис(гидроксиметил)фосфоний сульфат).
После гомогенизации суспензию инкубировали при температуре 37±1°С, в темноте и при перемешивании в течение 60 мин. Биоцид удаляли путем 2-кратного промывания в PBS (5000 × g, 10 мин) перед подсчетом бактерий. Осуществляли последовательное разведение, и 2 аликвоты по 100 мкл из одного и того же разведения высевали на BCYE агаровую чашку, BCYE с добавлением 0.1% пирувата, BCYE с добавлением 0.1% пирувата и 1% глутаминовой кислоты и BCYE с добавлением 1% глутаминовой кислоты. Результаты показаны на Фиг.2. На Фиг.2 показано отношение между числом культивируемой Legionella, полученных на стандартной среде (BCYE) и числом культивируемой Legionella, полученных на среде с добавлением 2 соединений, описанных в данном патенте (пируват и глутаминовая кислота).
Добавление пирувата к стандартной среде (BCYE) ведет к увеличению культивируемой Legionella, обнаруженной после обработки биоцидом (число культивируемой Legionella на "BCYE + Пируват" в 45 раз выше, чем число культивируемой Legionella на стандартной среде). Добавление одной глутаминовой кислоты к стандартной среде (BCYE) ведет к уменьшению культивируемой Legionella, обнаруженной после биоцидной обработки (×0.2). Удивительно, что добавление пирувата и глутаминовой кислоты приводит к большему увеличению культивируемой Legionella, по сравнению с тем, что наблюдается с соединениями по отдельности. Это показывает, что в присутствии пирувата находящиеся в стрессовом состоянии микроорганизмы Legionella pneumophila восстанавливаются в большей степени при добавлении глутаминовой кислоты, и таким образом обеспечиваются более точные показания.
Пример 3.
В 1 колбу, содержащую 1 л стерильного фосфатного буфера (PBS), добавляли суспензию Legionella pneumophila до конечной концентрации 3×102 бактерий /л. После концентрирования путем фильтрования 2 аликвоты по 100 л из одной и той же суспензии высевали на GVPC агаровую чашку (GVPC), GVPC с добавлением 0.1% пирувата и 1% глутаминовой кислоты (GVPC+X). Число колоний подсчитывали на 0, 3, 5 и 10 сутки после инкубации при 37°С. Эти результаты показаны на Фиг.3. На 3 сутки инкубации на среде GVPC никаких видимых колоний не было обнаружено, в то время как на среде GVPC с добавками можно было насчитать уже 300 колоний. На 5 и 10 сутки инкубации на среде GVPC можно было насчитать 100 колоний, в то время как на среде GVPC с добавками можно было насчитать 300 колоний. В случае использования среды с добавками, колонии можно было обнаружить, по меньшей мере, на 2 суток раньше, чем колонии, подсчитанные на стандартной среде GVPC.
Пример 4.
Образец из окружающей среды, содержащий культивируемую Legionella, концентрировали посредством фильтрования. Из концентрата 2 аликвоты по 100 мкл из одной и той же суспензии культивировали на GVPC агаровой чашке (GVPC), GVPC с добавлением 0.1% пирувата и 1% глутаминовой кислоты (GVPC+X). Число колоний подсчитывали спустя 5 суток после инкубации при 37°С. В этом случае никаких колоний Legionella на стандартной среде GVPC подсчитать не смогли, в то же время смогли насчитать 17 колоний, которые не являлись Legionella. В противоположность этому, по меньшей мере, 10 колоний Legionella можно было подсчитать на среде с добавками (GVPC+X), и только 2 колонии, которые не являлись Legionella. Это показано на Фиг.4.
Пример 5.
В 1 колбу, содержащую 50 мл стерильного фосфатного буфера (PBS), добавляли суспензию Legionella pneumophila до конечной концентрации 108 бактерий/мл. Добавляли биоцидный раствор, чтобы получить конечную концентрацию 15 мг/л. Используемый биоцид представлял собой THPS (тетракис(гидроксиметил)фосфоний сульфат).
После гомогенизации суспензию инкубировали при температуре 37±1°С, в темноте и при перемешивании в течение 60 мин. Биоцид удаляли путем 2-кратного промывания в PBS (5000 × g, 10 мин) перед подсчетом бактерий. Осуществляли последовательное разведение, либо в PBS, либо в PBS с добавлением 0.5% пирувата. Из каждого буфера разведения (с добавкой пирувата или без нее) 2 аликвоты по 100 мкл из одного и того же разведения высевали на BCYE агаровую чашку, BCYE с добавкой 0.1% пирувата. Результаты показаны на Фиг.5. На Фиг.5 показано число культивируемой Legionella pneumophila, полученной на стандартной среде, и число культивируемой Legionella pneumophila, полученной на стандартной среде с добавлением пирувата после разведения в PBS (заштрихованный столбик) или PBS + Пируват (темный столбик).
Как уже наблюдалось, добавление пирувата в стандартную среду (BCYE) приводит к увеличению культивируемой Legionella pneumophila, обнаруженной после обработки биоцидом, когда для разведения раствора используется только PBS. К удивлению, добавление пирувата в буфер разведения приводит к увеличению культивируемой Legionella pneumophila, обнаруженной на стандартной среде (BCYE), но также на стандартной среде с добавлением пирувата. Это показывает, что присутствие пирувата в буфере разведения позволяет в большей степени восстановить находящиеся в стрессовом состоянии Legionella pneumophila.
1. Способ обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце, предположительно содержащем указанные микроорганизмы, предусматривающий(1) контактирование указанных микроорганизмов указанного образца по меньшей мере с одним- восстанавливающим соединением, содержащим глутамат и пируват, и- питательной средой, которая представляет собой забуференную угольно-дрожжевую (BCYE) или GVPC агаровую питательную среду, и(2) инкубацию продукта этапа (1) и(3) обнаружение и определение количества указанных жизнеспособных микроорганизмов,в котором микроорганизмы представляют собой вид Legionella pneumophila и в котором восстанавливающее соединение прямо или косвенно оказывает влияние на метаболизм, снижая окислительный стресс микроорганизма.
2. Способ по п.1, в котором восстанавливающее соединение представляет собой соединение, которое ингибирует образование и/или разрушает РФК.
3. Способ по п.1, в котором этап (1) содержит контактирование указанного образца с указанным восстанавливающим соединением, содержащимся в восстанавливающей среде, предпочтительно в неселективной восстанавливающей среде, и затем приведение его в контакт с питательной средой, предпочтительно селективной питательной средой.
4. Способ по п.3, в котором восстанавливающая среда представляет собой жидкую среду, предпочтительно бульон.
5. Способ по п.1, в котором этап (1) содержит контактирование указанного образца с питательной средой, предпочтительно неселективной питательной средой, и затем приведение его в контакт с указанным восстанавливающим соединением, содержащимся в восстанавливающей среде.
6. Способ по п.3, в котором восстанавливающая среда представляет собой селективную восстанавливающую среду, предпочтительно твердую среду и более предпочтительно селективную агаровую питательную среду.
7. Способ по п.1, в котором этап (1) содержит контактирование указанного образца с питательной средой, содержащей указанное восстанавливающее соединение.