Способ моделирования дисфункции эндотелия in vitro
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной медицине и лабораторной диагностике, и касается моделирования дисфункции эндотелия in vitro. Для этого осуществляют инкубацию культуры эндотелиальных клеток, выделенных из пупочной вены человека, с фактором некроза опухоли альфа TNF-α в концентрации 10 нг/мл одновременно с воздействием гипоксии: 5% CO2, 95% N2, 1-2% О2 в течение 24 часов. Такое выполнение способа обеспечивает развитие эндотелиальной дисфункции, характеризующейся содержанием не менее 19% апоптотических эндотелиоцитов, 41×104/мкл и более единиц эндотелиальных микрочастиц, концентрацией сосудисто-эндотелиального фактора роста 190,864 и более пг/мл в питательной среде, которую собирают после модуляции дисфункции эндотелия. Изобретение может быть использовано для разработки методов коррекции эндотелиальной дисфункции и оценки действия лекарственных препаратов на функцию эндотелия. 4 табл., 4 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной и молекулярной медицине, лабораторной диагностике и клинической патофизиологии, и может быть использовано для изучения эндотелиальной дисфункции, оценки внутриклеточных изменений, а также действия лекарственных веществ на культуре клеток HUVEC in vitro.
Известно несколько способов моделирования дисфункции эндотелия, в частности способ, предложенный С. Wilasrusmee et al. и заключающийся в воздействии на линию трансформированных мышиных эндотелиоцитов (SVEC) циклоспорином А в концентрации 10-20 мг/мл. Было обнаружено, что при этой дозировке циклоспорина нарушается образование «капиллярных трубочек» in vitro [A new in vitro model to study endothelial injury. / C. Wilasrusmee [et al.] // J. of Surgical Research. - 2002. - N.104. - P.131-136]. Основным недостатком предложенного способа является моделирование на линии эндотелиоцитов мыши и отсутствие сопоставления с клинической картиной человека.
Другой известный способ моделирования дисфункции эндотелия in vitro предложен A. Barilli et al. и связан с воздействием на культуру умбиликальных эндотелиальных клеток человека (HUVEC) химическим соединением рапамицином, являющимся продуктом жизнедеятельности бактерий Chronic exposure to rapamycin induces endothelial dysfunction in vitro. / A.Barilli [et al.] // FASEB J. - 2007. - N.21. - P.707-708]. Авторами были исчерпывающе представлены доказательства развития дисфункции эндотелия под воздействием рапамицина, что нашло отражение в апоптозе клеток, снижении синтеза эндотелиальной NO синтетазы, увеличении экспрессии Е-селектина. Недостатком способа является то, что рапамицин воздействует на mTOR киназу, отвечающую за процессы метаболизма клеток и их отклика на внешние воздействия. Другими словами, рапамицин сам является лекарственным препаратом и не может быть применен для моделирования дисфункции эндотелия близкой к физиологическим условиям человека, а так же изучения влияния сердечно-сосудистых препаратов на клетки эндотелия.
Широко используется моделирование дисфункции эндотелия in vitro с применением физической гипоксии (5% CO2, 95% N2, О2 1-2%). Доказано, что такой подход приводит к индуцированию процесса свободнорадикального окисления, повышению синтеза факторов роста эндотелиоцитов, индукции апоптотического ответа, снижению выработки оксида азота эндотелиальными клетками [RGS5, a hypoxia-inducible apoptotic stimulator in endothelial cells. / Y.Jin [et al.] // J. of Biological Chemistry. - 2009. - V.284, N.35. - Р.23436-23443.; Повреждение и активация эндотелиальных клеток при гипоксии in vitro. / О.А. Антонова [и др.] // Бюллетень экспериментальной биологии и медицины. - 2007. - №10. - С.384-386]. Основным недостатком способа является одностороннее моделирование дисфункции эндотелия, приближенной к физиологическим условиям. Известно, что эндотелиальные клетки в организме человека в условиях, приводящих к дисфункции эндотелия, испытывают кислородное голодание, а так же подвержены усилению свободнорадикального окисления и апоптозу. Вместе с тем, одним из первых этапов вступления в дисфункцию эндотелиальных клеток является их активация и увеличение синтеза хемоаттрактанов для иммунных клеток, что приводит к взаимодействию эндотелиоцитов с цитокинами, которые ведут к запуску внутрисигнальных клеточных путей.
Способ изолированной симуляции функции эндотелия с использованием интерлейкинов (Патент JP 2002355075 (A), C12N 15/09, G01N 33/68, 10.12.2002) или фактора некроза опухоли альфа [Chong A.-Y., Blann A.D., Lip G.Y.H. Assessment of endothelial damage and dysfunction: observations in relation to heart failure. // Q. J.Med. - 2003. - N.96. P.253-267; Bratt J., Palmblad J. Cytokine-induced neutrophil-mediated injury of human endothelial cells. // J. of Immunology. - 1997. - N.159. - P.912-918] так же не может считаться моделью адекватной физиологическим условиям развития дисфункции эндотелия в организме человека в физиологических условиях.
Наиболее близкий к предлагаемому является способ оценки дисфункции эндотелия, предложенный М. Otto et al., заключающийся в воздействии на культуру клеток HUVEC (human umbilical vein endothelial cells) и НРМЕС (human pulmonary micro vascular endothelial cells) сначала гипоксией (10% О2), а затем стимуляцией эндотелиоцитов фактором некроза опухоли альфа 300 ЕД/мл в течение 4 и 12 часов. Затем клетки были ко-инкубированы с полиморфноядерными лейкоцитами. Дисфункция эндотелия оценивалась по степени адгезии полиморфноядерных лейкоцитов к эндотелиоцитам [Otto М., Bittinger F., Kriegsmann J., Kirkpatrick C.J. Differential adhesion of polymorphous neutrophilic granulocytes to macro- and microvascular endothelial cells under flow conditions. // Pathobiology. - 2001. - N.69. - P.159-171]. Основным недостатком способа является то, что гипоксия не является достаточно глубокой, нет анализа экстраполяции экспериментальных данных в клинику, а так же воздействие полиморфноядерными лейкоцитами снижает диагностическую ценность предложенного способа.
Задачей заявляемого способа является разработка модели дисфункции эндотелия для решения задач трансляционной медицины, в частности разработки мишеней лекарственной терапии эндотелиальной дисфункции.
Поставленную задачу осуществляют за счет того, что одновременно инкубируют культуру эндотелиальных клеток, выделенных из пупочной вены человека, с фактором некроза опухоли альфа TNF-α в концентрации 10 нг/мл, с воздействием гипоксии: 5% CO2, 95% N2, 1-2% О2 в течение 24 часов; развитию эндотелиальной дисфункции соответствует содержание не менее 19% апоптотических эндотелиоцитов, 41×10 /мкл и более единиц эндотелиальных микрочастиц, концентрация сосудисто-эндотелиального фактора роста 190,864 и более пг/мл в питательной среде, которую собирают после модуляции дисфункции эндотелия.
Способ осуществляют следующим образом:
1) культуру эндотелиальных клеток, выделенных из пупочной вены человека, (далее клетки HUVEC) помещают в культуральный флакон × 25 мл с питательной средой ЕВМ (endothelial cell basal medium) с добавлением hEGF (human epidermal growth factor; 0,5 мл), гидрокортизона (hydrocortisone; 0,5 мл), GA-1000 (antibiotics; 0,5 мл), ВВЕ (bovine brain extract; 2,0 мл), FBS (fetal bovine serum, 2% - 10,0 мл). Условия культивирования: 21% Oz; 37°С. Культивирование осуществляют до покрытия ростовой поверхности флакона эндотелиальными клетками, что соответствует 1 миллиону клеток в 1 культуральном флаконе. Смену питательной среды производят каждые 2 дня до покрытия клетками ростовой поверхности;
2) при достижении покрытия культуральной поверхности флакона эндотелиальными клетками, удаляют питательную среду и вносят свежую питательную среду ЕВМ того же состава, в том числе с 2% FBS, в объеме 5 мл / флакон;
3) в питательную среду культурального флакона с клетками HUVEC вносят 10 нг/мл TNF (Sigma Aldrich, USA) и помещают в стерильный инкубатор при 37°C в условия гипоксии (5% CO2, 95% N2, 1-2% O2) в течение 24 часов;
4) после инкубации питательную среду собирают из флакона, центрифугируют 350 g, 10 минут и подвергают исследованию на маркеры эндотелиальной дисфункции;
5) в зависимости от задач культивирования лекарственные препараты могут быть добавлены непосредственно вместе с TNF и помещением в условия гипоксии;
6) или лекарственные препараты могут быть добавлены после моделирования дисфункции эндотелия и с помещением культурального флакона вновь в условия гипоксии или нормоксии.
Контроль развития дисфункции эндотелия аналогичной пациентам с гипертонической болезнью осуществляют за счет анализа апоптотических эндотелиоцитов, содержание должно быть не менее 19%, эндотелиальных микрочастиц - количество не менее 41×104/мкл и сосудисто-эндотелиального фактора роста - концентрация не менее 190,864 пг/мл в питательной среде, которую собирают после модуляции дисфункции эндотелия:
1) осадок после центрифугирования питательной среды при 350g, 10 минут обрабатывают аннексином V из набора Annexin detection kit (Clonthech Laboratories, USA) согласно протоколу фирмы-производителя; затем с помощью флуоресцентной микроскопии осуществляют подсчет аннексии положительных эндотелиоцитов (увеличение × 450) не менее чем в 10 полях зрения;
2) 2 миллилитра питательной среды, полученной после центрифугирования при 350 g, 10 минут, вновь центрифугируют при 13000 g, 45 минут, 4°C, супернатант удаляют, а к осадку добавляют 100 мкл PBS, затем осуществляют подсчет количества микрочастиц в камере Буркера в 4 больших квадратах;
3) 1 миллилитр питательной среды, полученный после центрифугирования при 350g, 10 минут, подвергают иммуноферментному анализу на содержание сосудисто-эндотелиального фактора роста с помощью VEGF detection kit (Invitrogen, USA) согласно протоколу фирмы-производителя.
Нами проведена серия экспериментов по моделированию дисфункции эндотелия in vitro аналогичной пациентам с гипертонической болезнью. Все эксперименты in vitro повторены 5 раз. На схеме 1 предсталена модель экспериментов in vitro, описанных ниже. Сокращения: МР - микрочастицы, VEGF - сосудисто-эндотелиальный фактор роста; Са2+ - концентрация внутриклеточного кальция эндотелиоцитов; АФК - внутриклеточная концентрация активных форм кислорода.
В эксперименте 1 воздействие осуществляли на культуру HUVEC только гипоксией (5% CO2, 95% N2, 1-2% O2) в течение 24 часов. Были определены параметры, представленные в таблице 1.
| Таблица 1 | ||
| Характеристика параметров дисфункции HUVEC в эксперименте 1 in vitro | ||
| HUVEC+гипоксия (1-2% O2) | Контроль HUVEC в условиях нормоксии | |
| Апоптотические эндотелиоциты (%) | 40,8±6,2%*** | 2,5±0,5% |
| Мембранные микрочастицы (шт) | 216000±52600* | 100000±5682 |
| VEGF-A (пг/мл) | 629,742±139,3*** | 9,538±2,35 |
| Са2+ (в условных единиц, УЕ) | 2395000±63960*** | 1800000±2480 |
| Концентрация свободные радикалы (в условных единиц, УЕ) | 764600±23420*** | 282749±2333 |
| Тест раневого дефекта 3 часа | >100% | 30% |
При анализе табличных данных обращает на себя внимание резкое возрастание концентрации сосудисто-эндотелиального фактора роста - VEGF-A до 629,742 пг/мл по сравнению с контролем, что сопровождается ускоренной пролиферацией клеток и образованием апоптотических эндотелиоцитов до 40,8% по сравнению с контролем на фоне довольно слабого прироста содержания клеточных мембранных микрочастиц в питательной среде до 216000 штук по сравнению с нормальными условиями культивирования. При этом увеличение концентрации кальция в эндотелиоцитах под воздействием гипоксии возрастает до 2395000 УЕ, свободных радикалов до 764600 УЕ, что в 2,7 раза по сравнению с нормальными условиями культивирования.
В эксперименте 2 воздействие осуществляли на культуру HUVEC только 10 нг/мл фактора некроза опухоли альфа (TNF-α) в условиях нормоксии (20% O2) в течение 24 часов. Были определены параметры, представленные в таблице 2.
| Таблица 2 | ||
| Характеристика параметров дисфункции HUVEC в эксперименте 1 in vitro | ||
| HUVEC+TNF-α (20% O2) в условиях нормоксии | Контроль HUVEC в условиях нормоксии | |
| Апоптотические эндотелиоциты | 8,1±1,3%** | 2,5±0,5% |
| Мембранные микрочастицы (шт) | 370000±36000** | 100000±5682 |
| VEGF-A (пг/мл) | 90,648±9,05* | 9,538±2,35 |
| Са2+ (в условных единиц, УЕ) | 2964000±52770*** | 1800000±2480 |
| Концентрация свободные радикалы (в условных единиц, УЕ) | 417100±2057** | 282749±2333 |
| Тест раневого дефекта 3 часа | 40% | 30% |
Воздействие TNF в условиях нормоксии привело к умеренному возрастанию продукции сосудисто-эндотелиального фактора роста - VEGF-A до 90,648, незначимому приросту содержания апоптотических эндотелиоцитов до 8,1%, умеренному возрастанию содержания высвобожденных клеточных мембранных микрочастиц до 370000 штук, что сопровождалось слабым приростом покрытия ростовой поверхности в «тесте раневого дефекта» по сравнению с нормальными условиями культивирования. Концентрация внутриклеточного кальция составила 2964000 УЕ; свободных радикалов - 417100 УЕ, что 1,5 раза выше по сравнению с нормоксией.
В эксперименте 3 проводили одновременную инкубацию HUVEC с 10 нг/мл фактора некроза опухоли альфа (TNF-α) под воздействием гипоксии (5% CO2, 95% N2, 1-2% О2) в течение 24 часов. Были определены параметры, представленные в таблице 3.
| Таблица 3 | ||
| Характеристика параметров дисфункции HUVEC в эксперименте 3 in vitro | ||
| HUVEC + 10 нг/мл TNF + гипоксия (1-2% О2) | контроль HUVEC в условиях нормоксии | |
| Апоптотические эндотелиоциты | 19,3±2,7%** | 2,5±0,5% |
| Мембранные микрочастицы (шт) | 416000±52000** | 100000±5682 |
| VEGF-A (пг/мл) | 190,864±54,0*** | 9,538±2,35 |
| Са2+ (в условных единиц, УЕ) | 3800000±475540*** | 1800000±2480 |
| Концентрация свободные радикалы (в условных единиц, УЕ) | 764614±1350** | 282749±2333 |
| тест раневого дефекта 3 часа | 80% | 30% |
Как видно из табличных данных, на фоне увеличения количества апоптотических эндотелиоцитов до 19,3%; возрастает высвобождение эндотелиальных мембранных микрочастиц до 416000 штук, увеличивается концентрация внутриклеточного кальция до 3800000 УЕ и свободных радикалов до 764614 УЕ, а так же возрастает концентрация сосудисто-эндотелиального фактора роста VEGF-A до 190,864 пг/мл, что сопровождается значимым приростом пролиферирующих эндотелиоцитов, однако, не чрезмерным, как в изолированном воздействии гипоксии, которое приводит к появлению апоптотических эндотелиоцитов за счет «клеточного суицида».
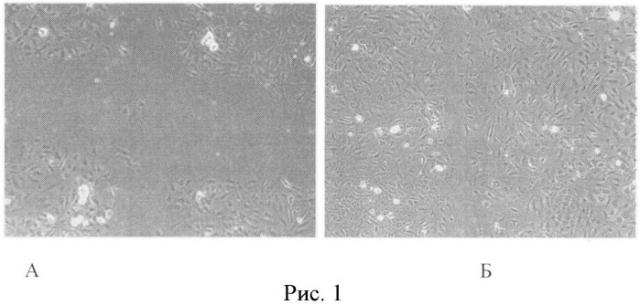
Тест раневого дефекта отображает скорость покрытия свободного пространства пролиферирующими эндотелиальными клетками, что сопряжено с повышенной концентрацией факторов роста, которые компенсаторно продуцируются в ответ на дисфункцию эндотелиальными клетками. На рисунке 1 показано в сравнении степень покрытия пролиферирующими клетками пустого пространства - «раневого дефекта» (А)-клетки HUVEC при инкубации в условиях нормоксии и (Б) клетки HUVEC при инкубации с TNF-α в условиях гипоксии. Увеличение × 900.
Эксперимент 4. Изучение эндотелиальной дисфункции у пациентов с гипертонической болезнью было проведено с использованием: гуморальных, клеточных и инструментальных подходов к диагностике дисфункции эндотелия. Обследовали 90 пациентов с гипертонической болезнью II стадии, риск 3 обоего пола в возрасте от 30-60 лет, находящиеся на лечении в учреждениях здравоохранения г.Красноярска. Диагноз был подтвержден суточным мониторированием артериального давления и проведением стандартных лабораторно-клинических анализов. Все пациенты на момент включения не получали регулярной медикаментозной терапии в течение 1 года. В качестве контрольной группы были обследованы здоровые волонтеры соответствующего возрастно-полового состава. Определены следующие параметры, представленные в таблице 4 (представлены средние значения).
| Таблица 4 | ||||||
| Характеристика параметров функциональной активности эндотелия у пациентов с артериальной гипертензией и в контрольной группе | ||||||
| Исследование | Гипертоническая болезнь (90 человек) | Контрольная группа (30 человек) | ||||
| Апоптотические эндотелиоциты (N×10000/мл) | 2,5±0,2* | 0,75±0,5 | ||||
| Микрочастицы CD62E+(N×10000/ul) | 671,8±7,2** | 100,6±1,9 | ||||
| sPECAM-1 (нг/мл) | 6,6±1,9* | 0,23±0,03 | ||||
| VEGF-A (пг/мл) | 29,94±7,032*** | 2,309±2,066 | ||||
| Са2+ (в условных единицах,УЕ) | 352346±44639*** | 223828±4222 | ||||
| Свободные радикалы (в условных единицах, УЕ) | 8578384±1026199*** | 2886650±83665 | ||||
| «Манжеточная проба» | D | % РГ | % НГ | D | % РГ | % НГ |
| 3,72±0,6* | 6,0±2,1*** | 9,4±6,7*** | 4,9±0,4 | 15,8±1,7 | 20,3±1,12 | |
| Здесь: D - диаметр плечевой артерии; % РГ - процент вазодилатации на реактивную гиперемию; % НГ - процент вазодилатации на нитроглицерин сублингвально (0,5 мг). |
Как видно из табличных данных, инструментальное исследование подтверждает наличие дисфункции эндотелия у пациентов с гипертонической болезнью. Концентрация кальция у пациентов с гипертонической болезнью в эндотелиальных клетках достигает 352346 УЕ, что в 1,6 раз выше, чем у здоровых волонтеров. Концентрация свободных радикалов равна 8578384 УЕ, что больше в 2,97 раз, чем у здоровых волонтеров. Содержание апоптотических эндотелиоцитов равно 2,5*1000/мл; CD62E + эндотелиальных микрочастиц - 671,8*1000/ш; сосудисто-эндотелиального фактора роста VEGF-A составляет 29,94 пг/мл, что в 12,96 раз, чем у здоровых волонтеров. Достоверным гуморальным маркером наравне с инструментальными методами является концентрация sPECAM в сыворотке крови, которая у пациентов с гипертонической болезнью больше в 28,7 раза и составляет 6,6 нг/мл.
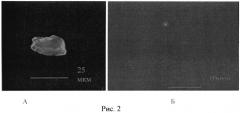
На рисунке 2 представлены фотография аннексин + эндотелиоцита (А) и CD62E + микрочастиц (Б) препарата крови пациентов с гипертонической болезнью. Увеличение ×900.
Учитывая изменения, происходящие на молекулярно-клеточном уровне, обращает внимание тот факт, что гипоксия без TNF приводит к резкому увеличению продукции сосудисто-эндотелиального фактора роста и чрезмерному повышению пролиферации клеток и одновременному апоптозу эндотелиоцитов на фоне незначительного увеличения продукции клеточных мембранных микрочастиц.
В то же время инкубация с TNF в условиях нормоксии сопровождается недостаточным для модели дисфункции эндотелия усилением пролиферации эндотелиоцитов, низким апоптозом эндотелиальных клеток и пониженной концентрацией свободных радикалов в эндотелиоцитах.
В модели эндотелиальной дисфункции, основанной на сочетании воздействия на эндотелиоциты гипоксии с инкубацией с TNF, достигается комплексная характеристика эндотелиальной дисфункции, присущая пациентам с гипертонической болезнью: умеренный прирост апоптотических циркулирующих эндотелиоцитов, средняя выраженность активации эндотелия, умеренное возрастание сосудисто-эндотелиального фактора роста, увеличение не менее чем в 1,5 раза концентрации внутриклеточного кальция и не менее чем в 2,5 раза концентрации свободных радикалов.
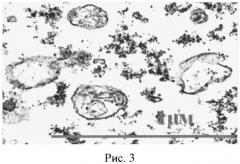
На рисунке 3 представлена электронная фотография микрочастиц в неочищенной питательной среде после инкубации HUVEC с TNF-α в условиях гипоксии.
Вместе с тем, необходимо учитывать, что характеристики эндотелиоцитов in vitro не могут полностью повторять состояние эндотелиоцитов и экспонировать в тех же абсолютных единицах маркеры дисфункции эндотелия, как в организме человека. Это связано, прежде всего, с тем, что в организме человека происходит нормальная элиминация биологически-активных веществ, клеточных микрочастиц и апоптотических клеток, а продукция сосудисто-эндотелиального фактора роста запускается преимущественно тканями, испытывающими гипоксию. Общее количество эндотелиоцитов в организме взрослого человека составляет 1-6×1012-1013 клеток, они находятся в сосудах различного калибра, постоянно подвергаются взаимодействию с клетками сосудистой стенки, крови и биологически-активными веществами.
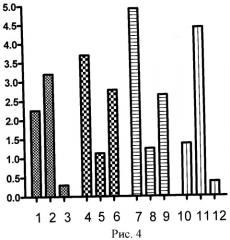
Для определения релевантности предложенного способа моделирования дисфункции эндотелия in vitro, приближенной к условиям эндотелиальной дисфункции у пациентов с гипертонической болезнью, нами был проведен анализ содержания сигнальных протеинкиназ МАРК (митоген-активированные протеинкиназы ERK, JNK, р38) в циркулирующих эндотелиоцитах крови пациентов с гипертонической болезнью, здоровых волонтеров контрольной группы, а так же в клетках HUVEC до воздействия гипоксией в сочетании с инкубацией с TNF-α и после моделирования дисфункции эндотелия. Данные представлены на рисунке 4, где отображено соотношение содержания фосфорилированной формы (ось ординат) к нефосфорилированной форме протеинкиназ (ось абсцисс), определенных методом вестерн блоттинга по коэффицинту флуоресценции: фосфо- JNK / JNK - 1, 4, 7, 10 столбцы графика; фосфо- ERK / ERK - 2, 5, 8, 11 столбцы графика; фосфо- р38 / р38 - 3, 6, 9, 12 столбцы графика.
Статистический анализ выполнен в программе GraphPad Prism 4 с помощью теста AN OVA (Ньюмана-Келли тест). На графике хорошо видно, что соотношение содержания изучаемых протеинкиназ в модели дисфункции эндотелия in vitro соответствует таковому в циркулирующих эндотелиоцитах от пациентов с гипертонической болезнью. Статистическое отличие соотношения содержания фосфорилированной (активной формы) к нефосфорилированной форме соответствующей протеинкиназы отличалось у пациентов с гипертонической болезнью (колонки графика 4, 5, 6) от такого же у здоровых пациентов (колонки графика 1, 2, 3) с коэффициентом достоверности p<0,001, а в культуре клеток HUVEC, подвергнутой инкубации с 10 нг/мл TNF-α в условиях гипоксии (7, 8, 9), отличие соотношения от HUVEC в состоянии нормоксии (10, 11, 12) было с коэффициентом достоверности p<0,001 для JNK и ERK; p<0,01 для р38.
Таким образом, предложенный способ наиболее приближенно моделирует дисфункцию эндотелия in vitro, что позволяет изучить непосредственно эндотелиальные клетки без влияния факторов микроокружения.
Использование заявляемого способа позволяет создать условия эндотелиальной дисфункции in vitro на культуре умбиликальных эндотелиальных клеток человека, обладающих характеристиками сходными с эндотелиальной дисфункцией в организме человека, что имеет значение в проведении экспериментов с культурой клеток для изучения механизмов развития и коррекции дисфункции эндотелия, а также может быть использовано для тестирования влияния лекарственных препаратов непосредственно на эндотелиальные клетки человека, находящиеся в условиях дисфункции.
Способ моделирования дисфункции эндотелия in vitro, включающий одновременную инкубацию культуры эндотелиальных клеток, выделенных из пупочной вены человека, с фактором некроза опухоли альфа TNF-α в концентрации 10 нг/мл, с воздействием гипоксии: 5% CO2, 95% N2, 1-2% О2 в течение 24 ч; развитию эндотелиальной дисфункции соответствует содержание не менее 19% апоптотических эндотелиоцитов, 41·104/мкл и более единиц эндотелиальных микрочастиц, концентрация сосудисто-эндотелиального фактора роста 190,864 и более пг/мл в питательной среде, которую собирают после модуляции дисфункции эндотелия.