Способ восстановления кровотока в регионе тромбированной вены в эксперименте
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине. Моделируют острый венозный тромбоз у лабораторного животного - крысы. Затем в просвет тромбированной вены вводят суспензию мезенхимальных стволовых клеток с концентрацией не менее 1×106 клеток/мл в количестве 30-50 мкл. При этом введение суспензии мезенхимальных стволовых клеток осуществляют ниже сформированного тромба на 0,5 см в направлении тромба. Последующую визуализацию восстановления кровотока в регионе тромбированной вены проводят известными методами. Способ обеспечивает существенное ускорение сроков реваскуляризации тромба и восстановления адекватного кровотока в тканях, в т.ч. за счет образования новых сосудов в регионе тромбированной вены. 2 з.п. ф-лы, 4 ил., 1 пр.
Реферат
Изобретение относится к экспериментальной медицине и может быть использовано для восстановления кровотока в тканях региона тромбированной вены.
Профилактика и лечение сосудистых тромбозов является одной из острейших и наиболее значимых проблем современной медицины во всем мире. При этом истинная частота тромбоза глубоких вен остается неизвестной, поскольку заболевание зачастую протекает бессимптомно. Около 30% пациентов, перенесших тромбоз, погибают в ближайший месяц, а еще у 20% в течение 3 месяцев развивается рецидив заболевания (Шевченко Ю.Л., Стойко Ю.М., Лыткина М.И. Основы клинической флебологии. М: ОАО «Изд-во «Медицина», 2005. 312 с.).
Реваскуляризация пораженных вследствие сосудистого тромбоза тканей проходит двумя основными путями: развитием коллатерального кровотока и реканализацией тромбированной вены. Оба этих процесса протекают в течение длительного времени, достаточного для некротизирования заинтересованных тканей и, даже, органов и конечностей. Поэтому актуальной задачей является разработка оптимальной технологии стимуляции ангиогенеза для восстановления кровотока в ишемизированной зоне.
Ангиогенез - процесс образования новых кровеносных сосудов за счет ветвления и разрастания предсуществующего кровеносного русла. В ходе образования новых кровеносных сосудов можно выделить несколько этапов: миграцию и пролиферацию эндотелиальных клеток и формирование ими новых капилляров; миграцию и пролиферацию субэндотелиальных клеток (перицитов) и их взаимодействие с эндотелиальными клетками. Взаимодействие перицитов с эндотелиальными клетками необходимо для формирования функционально зрелой и стабильной сосудистой сети, обеспечивающей нормальную трофику окружающих тканей. Все перечисленные этапы находятся под контролем целого ряда факторов, стимулирующих или подавляющих рост и/или стабилизацию сосудов. К таким факторам относятся факторы роста, цитокины, гормоны и их метаболиты, модуляторы апоптоза, а также трансмембранные белки, экспрессирующиеся на поверхности клеток (кадгерины, интегрины и эфрины).
Возможность регулирования процесса формирования новых кровеносных сосудов открывает большие перспективы при разработке методов лечения и профилактики целого ряда тяжелых патологических состояний человека, в частности ишемических заболеваний сердца и нижних конечностей, которые сегодня являются одной из наиболее распространенных причин потери трудоспособности и смертности населения в развитых странах. Несмотря на внедрение в практику здравоохранения эффективных хирургических и медикаментозных методов лечения такого рода заболеваний для значительной категории больных единственной альтернативой является терапия, направленная на стимуляцию роста новых сосудов в зоне ишемии.
Сравнительно недавно для стимуляции ангиогенеза стали использовать мезенхимальные стволовые клетки костного мозга (прогениторные клетки). С этой тактикой, получившей название терапевтического ангиогенеза, современная медицина связывает большие надежды, что определяет актуальность новых исследований и разработок в данной области.
Мезенхимальные стволовые клетки костного мозга (МСК) обладают способностью к дифференцировке в эндотелиоциты и перициты, что позволяет применять такие клетки для ускорения реваскуляризации тканей с нарушенной микроциркуляцией (Modarai B., Burnand K.G., Sawyer B. and Smith A. Endothelial progenitor cells are recruited into resolving venous thrombi. Circulation, 2005, vol. 111, №20, p.2645-2653). Реваскуляризация тромба, быстрая реканализация вены и восстановление кровообращения в ишемизированных в результате тромбоза тканях были достигнуты в экспериментальных моделях с проангиогенными агентами (Santo S.D., Tepper O.M., Ballmoos von M.W. et al. Cell-based therapy facilitates venous thrombus resolution. Thromb. Haemost, 2009, vol. 101, №3, p.460-464).
Наиболее ближайшим к заявляемому способу - прототипом, является способ улучшения кровотока после венозного тромбоза путем регуляции уровня цитокинов, связанных с организацией тромба и его реканализацией, заключающийся в следующем. Предварительно моделируют хронический тромбоз нижней полой вены. Затем в экспериментально индуцированный тромб нижней полой вены доступом через бедренную вену инъекционно вводят эндотелиальные прогениторные клетки, полученные из костного мозга молодых крыс, культивированные с человеческим фибронектином (Sigma) в питательной среде ЕВМ-2 с добавлением 5% эмбриональной телячьей сыворотки, рекомбинантным человеческим фактором роста васкулярного эндотелия (VEGF, 1000 нг/мл), рекомбинантным бычьим основным фактором роста фибробластов (bFGF, 1 нг/мл), человеческим эпидермальным фактором роста (EGF, 10 нг/ мл), гидрокортизоном (1 мг / мл) и антибиотиками (Li X.Q., Meng Q.Y. and Wu H.R. Effects of bone marrow-derived endothelial progenitor cell transplantation on vein microenvi-ronment in a rat model of chronic thrombosis. Chin. Med. J. (Engl), 2007, vol. 120, №24, p.2245-2249). Способ позволяет существенно повысить уровень фактора роста эндотелия сосудов, ангиопоэтина-1, моноцитарного хемотаксического белка-1, мРНК через 28 дней после трансплантации в тканях около тромба.
Недостатками известного способа являются недостаточная эффективность способа (повышение уровня роста цитокинов наблюдается только на 28 день), сложность моделирования хронического тромбоза (доступ к нижней полой вене через брюшную полость), использование только одного класса клеток (предшественников эндотелиоцитов), отсутствие появления новых сосудов в регионе тромбированной вены.
Технической задачей изобретения является сокращение сроков восстановления кровотока в регионе тромбированной вены.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Предварительно осуществляют моделирование острого венозного тромбоза стандартным способом. Для этого под общим ингаляционным эфирным наркозом у лабораторных животных по внутренней стороне бедра выполняют разрез кожи от точки, расположенной на 0,5 см выше паховой складки до нижней трети бедра. Затем тупым способом выделяют сосудистый пучок, на бедренную вену ниже на 0,5 см от места впадения ее в глубокую подвздошную вену накладывают лигатуру плетеной нерассасывающейся нитью 4/0. Далее бедренную вену пунктируют на уровне границы средней и нижней трети бедра и вводят 0,03-0,05 мл раствора тромбина (0,5 Ед/мл), а место инъекции придавливают в течение 3 мин. (до формирования тромба), для исключения ретроградного распространения введенного препарата. Затем кожный разрез ушивают непрерывным «П-образным» швом и обрабатывают спиртом.
Для восстановления кровотока в тромбированную вену вводят МСК следующим образом. Выполняют хирургический доступ к тромбированной вене, в тромбированную вену ниже сформированного тромба на 0,5 см вводят суспензию МСК с концентрацией не менее 1×106 клеток/мл в количестве 30-50 мкл. Введение МСК осуществляют в направлении тока крови, от периферии к центру. После процедуры кожу ушивают узловыми швами.
Выделение МСК осуществляют стандартным способом посредством вымывания костного мозга из эпифизов бедренных костей, взятых под эфирным наркозом у крыс. Клетки культивируют в стандартных условиях, оптимизированных для успешной экспансии мезенхимальных стволовых клеток (Human mesenchymal related products and protocols // StemCell Technologies - April 2002). В результате получают суспензию МСК в культуральной среде с концентрацией не менее 1×106 клеток/мл. Характеристику полученных клеток проводят по описанным для МСК морфологии, фенотипическим маркерам и функциональным свойствам (Jones E.A., Kinsey S.E., English A. et al. Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells. // Arthritis Rheum. - 2002. - Vol.46. - №12. - P.3349-3360).
Для отслеживания судьбы (перемещения) введенных клеток и для обеспечения точного контроля над их участием в процессах восстановления кровотока, их подвергают трансфекции геном GFP (green fluorescent protein - зеленый светящийся белок). Трансфекцию проводят согласно рекомендациям производителя, по протоколу для трансфекции суспезионных клеток (Fermentas Part of Thermo Fisher Scientific, www.thermoscientific.com/fermentas). Для введения используют, преимущественно, клетки третьего пассажа, содержащие до 1% предшественников эндотелиальных клеток.
МСК сразу после введения начинают создавать новые сосуды взамен тромбированных или облитерированных или встраиваются в сосуды, растущие из собственных клеток, что обеспечивает ускорение и улучшение реваскуляризация и восстановление адекватного кровотока в регионе тромбированной вены. Введение МСК в тромбированную вену стимулирует ангиогенез, экономит время на миграцию собственных МСК, обеспечивает более быстрый рост и функционирование сосудов. Со временем клетки и структуры, сформированные из введенных извне МСК, постепенно замещаются соответствующими клетками и структурами организма-реципиента.
Определяющими отличиями заявляемого способа от прототипа, являются:
1. Моделируют острый венозный тромбоз путем перевязки бедренной вены ниже на 0,5 см от места впадения ее в глубокую подвздошную вену, введения в вену на уровне границы средней и нижней трети бедра раствора тромбина с последующим придавливанием места инъекции в течение 3 минут, что позволяет быстро сформировать тромб и исключить элиминацию введенного препарата (в прототипе моделируют хронический венозный тромбоз нижней полой вены).
2. В просвет тромбированной вены, на 0,5 см ниже тромба, вводят суспензию МСК с концентрацией не менее 1×106 клеток/мл в количестве 30-50 мкл, при этом введение суспензии МСК осуществляют в направлении тока крови, от периферии к центру, что позволяет сократить срок восстановления кровотока в регионе тромбированной вены за счет образования новых сосудов из введенных МСК и реканализации при участии МСК тромбированных мелких вен, впадающих в бедренную вену.
4. Используют МСК, трансфицированные геном светящегося зеленого белка (GFP, green fluorescent protein), что позволяет сделать более наглядной доказательную базу участия введенных МСК в образовании новых сосудов и реканализации тромбированных вен, а также обеспечить точный контроль над их участием в процессах восстановления кровотока, (светящийся зеленый белок в препаратах тканей региона тромбированной вены доказывает непосредственное участие введенных клеток в образовании новых сосудов и реканализации тромбированных вен).
3. Преимущественно используют МСК третьего пассажа, 1% которых представлен предшественниками эндотелиальных клеток, что позволяет дополнительно стимулировать ангиогенез.
Изобретение иллюстрируется следующим примером конкретного выполнения способа.
Пример
Для моделирования острого венозного тромбоза в условиях чистой операционной, при соблюдении правил асептики и антисептики, под общим ингаляционным эфирным наркозом после тщательного состригания волос и обработки кожи спиртом, у лабораторных животных - крыс-самцов инбредной линии Wag, - по внутренней стороне бедра выполняли разрез кожи скальпелем от точки на 0,5 см выше паховой складки до нижней трети бедра. Затем тупым способом выделяли сосудистый пучок, на бедренную вену ниже на 0,5 см от места впадения ее в глубокую подвздошную вену накладывали лигатуру плетеной нерассасывающейся нитью 4/0. Далее вену на уровне границы средней и нижней трети бедра пунктировали и вводили 0,03-0,05 мл раствора тромбина (0,5 Ед/мл), а место инъекции придавливали в течение 3 мин. Затем кожный разрез ушивали непрерывным «П-образным» швом и обрабатывали спиртом.
Мезенхимальные стволовые клетки (МСК) выделяли, вымывая костный мозг из эпифизов бедренных костей, взятых под эфирным наркозом у самцов крыс инбредной линии Wag. Для получения культуры МСК, полученную суспензию клеток помещали в культуральные пластиковые флаконы («Nunk», Дания), через 48 часов после эксплантации костного мозга удаляли неприкрепившиеся клетки. Прикрепившиеся клетки культивировали в среде α-МЕМ с добавлением 10% эмбриональной телячьей сыворотки («Biolot», Россия) при 37°C в CO2-инкубаторе с 5% CO2 в условиях насыщенной влажности. Среду меняли каждые три дня. При субкультивировании монослойную культуру рассевали в плотности 2500 клеток/см2, используя стандартные растворы Версена и трипсина. Таким образом, клетки культивировали в условиях, оптимизированных для успешной экспансии мезенхимальных стволовых клеток.
Характеристику полученных клеток проводили по описанным для МСК морфологии, фенотипическим маркерам и функциональным свойствам (Jones E.A., Kinsey S.E., English A. et al. Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells. // Arthritis Rheum. - 2002. - Vol.46. - №12. - P.3349-3360).
Методами световой и флуоресцентной микроскопии и цитологическими методами окрашивания показали, что культивируемые клетки костного мозга крысы 3-го пассажа при культивировании in vitro прикреплялись к поверхности пластика культивирования, имели фибробластоподобную морфологию, которую сохраняли во время культивирования, поддерживались в культуре при субкультивировании, формировали колонии фибробластоподобных клеток при посеве в низкой плотности, имели фенотип CD90+, CD106+, CD45-, в присутствии линейно-специфичных факторов дифференцировались в клетки костной ткани, жировой и хрящевой ткани.
Для индукции остеогенной дифференцировки использовали дезоксиметазон, аскорбиновую кислоту и β-глицерофосфата («Sigma», США). Остеогенную дифференцировку определяли по 2 маркерам: по активности щелочной фосфатазы и минерализации межклеточного матрикса ионами кальция. Цитохимическое выявление щелочной фосфатазы проводили с использованием нитротетразолиевого синего в присутствии субстрата щелочной фосфатазы 5-бромо-4-хлоро-3-индолила («Sigma», США). Накопление кальция в межклеточном матриксе регистрировали по окрашиванию Ализарином красным («Sigma», США).
Для индукции хондрогенной дифференцировки использовали среду культивирования с высоким содержанием глюкозы дезоксиметазон, аскорбиновую кислоту, трансформирующий фактора роста 1 («Sigma», США). Хондрогенную дифференцировку определяли по 3 маркерам: накопление внеклеточных протеогликанов, сульфатированных глюкозоаминов и синтезу коллагена II типа («Sigma», США). Цитохимическое выявление внеклеточных протеогликанов, сульфатированных глюкозоаминов проводили с использованием Алцианового голубого и толуидинового синего («Sigma», США), соответственно. Для выявления коллагена 2 типа использовали специфичные коллагену 2 типа антитела (Abeam, USA).
Для индукции адипогенной дифференцировки использовали индометацин, изобутил-метилксантин, гидрокортизон («Sigma», США). Адипогенную дифференцировку определяли по накоплению липидных капель в клетках. Цитохимическое выявление липидных капель во внутриклеточных вакуолях проводили с использованием красителя нейтрального жира Oil Red («Sigma», США). (Pittenger. M.F. Mackay A.M., Beck S.C. 1999. Multi-lineage potential of adult human mesenchymal stem cells. Sciense. 284, 143-147).
Для исследования присутствия предшественников эндотелиальных клеток в культуре клеток третьего пассажа, клетки культивировали в присутствии DIL-AC-LDL (BTI, MA, USA), FITC-Lectin-ulex europaeus agglutinin (UEA)-1 (Sigma, USA). Часть культивируемых клеток (1%) расщепляла ацилированный липопротеин низкой плотности, меченный Dil (iCLDLDil), вызывающий внутриклеточное окрашивание, и клеточная поверхность, которых взаимодействовала с Лектином, приводящим к окрашиванию поверхности клетки. Двойное окрашивание клеток свидетельствовало о присутствии в культуре мезенхимальных стволовых клеток - предшественников эндотелиальных клеток (Chinese Medical Journal 2007; 120(24): 2245-2249).
Для обеспечения возможности точного контроля над участием МСК в процессах восстановления кровотока, последние были трансфицированы геном GFP (green fluorescent protein - зеленый светящийся белок). Трансфекцию проводили согласно рекомендациям производителя, по протоколу для трансфекции суспезионных клеток (Fermentas Part of Thermo Fisher Scientific, www.thermoscientific.com/fermentas). Клетки с геном GFP светятся зеленым цветом при облучении ультрафиолетовым светом. Ген GFP неизменным передается дочерним клеткам, и они также начинают светиться при соответствующих условиях.
Введение мезенхимальных стволовых клеток осуществляли следующим образом.
После состригания волосяного покрова и обработки кожи спиртом производили хирургический доступ к тромбированной вене, далее в тромбированную вену, на 0,5 см ниже сформированного тромба, вводили внутривенно суспензию МСК с концентрацией не менее 1×106 клеток/мл в количестве 30-50 мкл. Введение МСК осуществляли в направлении тока крови, от периферии к центру. После процедуры кожу ушивали узловыми швами с помощью нити викрил «3-0».
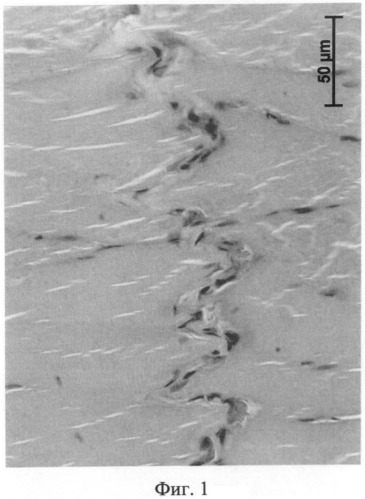
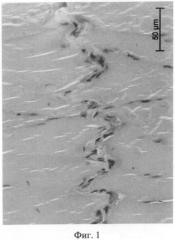
Через 1 неделю после внутривенного введения МСК в межфасцикулярных пространствах поперечно-полосатой мышечной ткани бедра, где проходят сосудисто-нервные пучки, обнаружено присутствие множества кровеносных сосудов с облитерированным просветом. О поражении мелких сосудов при тромбозе магистральной вены свидетельствует наличие в мышечной ткани варикозно измененных сосудов (фиг.1).
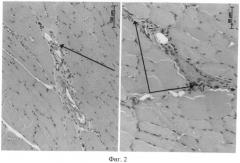
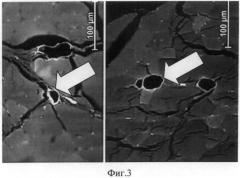
Через 2 недели после введения МСК в тромбированую вену между пучками поперечно-полосатой мышечной ткани бедра были найдены сосуды с широким просветом, в котором находились остатки тромба с макрофагами, также в таких сосудисто-нервных пучках присутствовали сосуды с полностью облитерированным просветом (остатки сосудов) (фиг.2). В массиве мышц бедра были найдены сосуды венозного типа с ярким свечением в стенке. Число таких сосудов со специфическим свечением значительно возросло, они встречались практически у каждого животного и неоднократно (фиг.3).
Учитывая появление значительного числа таких сосудов, можно заключить, что восстановление кровотока в регионе тромбированной вены, в мелких ее ветвях, также тромбированных, максимально происходит в течение 2 недель после введения МСК в просвет магистральной вены с тромбозом.
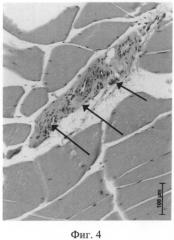
На 3 неделе в мышечной ткани по ходу сосудисто-нервных пучков были обнаружены значительные прослойки плотной волокнистой соединительной ткани с фрагментами облитерированных сосудов (фиг.4) - результат склеротической трансформации тромбированных мелких ветвей магистральной вены. На этот срок уже отсутствовали сосуды со специфическим свечением в стенке, расположенные в мышечном массиве бедра, но эти сосуды имели признаки варикозных изменений: очень широкий растянутый просвет и на гистологическом срезе представлены в виде цепочки (поперечный срез через извитой сосуд). Остаточных признаков тромбоза в сосудах уже найдено не было.
В более отдаленные сроки (4-5 недель) сосуды, проходящие в мышечной ткани, не имели значительных патологических изменений и в большинстве случаев не содержали в стенке светящихся объектов.
Таким образом, восстановление кровотока в регионе тромбированной вены, в мелких ее ветвях, также тромбированных, завершается через две недели после введения МСК в просвет такого сосуда.
Исчезновение свечения в стенке сосудов объясняется тем, что сначала сосуды образуются с участием введенных МСК, трансфицированных геном GFP, затем МСК (и клетки, в которые дифференцировались введенные МСК), постепенно замещаются собственными клетками, не несущими ген GFP.
Использование предлагаемого способа позволит существенно (в два раза) ускорить реваскуляризацию тромба и восстановить адекватный кровоток в тканях, находящихся в регионе тромбированной вены.
1. Способ восстановления кровотока в регионе тромбированной вены в эксперименте, включающий предварительное моделирование венозного тромбоза у лабораторного животного, введение в тромбированную вену суспензии прогениторных клеток и последующую визуализацию восстановления кровотока известными методами, отличающийся тем, что у крысы моделируют острый тромбоз бедренной вены, далее в просвет тромбированной вены вводят суспензию мезенхимальных стволовых клеток с концентрацией не менее 1·106 клеток/мл в количестве 30-50 мкл, при этом введение суспензии мезенхимальных стволовых клеток осуществляют ниже сформированного тромба на 0,5 см в направлении тромба.
2. Способ по п.1, отличающийся тем, что острый венозный тромбоз моделируют путем перевязки бедренной вены ниже на 0,5 см от места впадения ее в глубокую подвздошную вену, введения в вену на уровне границы средней и нижней трети бедра раствора тромбина с последующим придавливанием места инъекции в течение 3 мин.
3. Способ по п.1, отличающийся тем, что используют мезенхимальные стволовые клетки третьего пассажа.