Композиции стабильных солей элсамитруцина
Иллюстрации
Показать всеПредложена жидкая композиция элсамитруцина для лечения опухолевых заболеваний или состояний, включающая: a) по меньшей мере одну стабильную соль элсамитруцина, которая представляет собой продукт свободного основания элсамитруцина и органической кислоты и может существовать как стабильное твердое вещество и не включает псевдосоли или соли, полученные in situ, которые существуют только в растворе, и b) фармацевтически приемлемый носитель, причем указанная жидкая композиция не содержит антиоксидантов или метанола, этанола, хлороформа, н-бутанола или т-бутанола в качестве примесей, и указанная стабильная соль элсамитруцина сохраняет по меньшей мере 90% своей противоопухолевой активности в течение 18 месяцев в жидкой форме при подходящей температуре хранения. Показано, что композиции, а именно раскрытые в настоящем изобретении водные растворы истинных солей элсамитруцина, могут быть сохранены и введены без восстановления перед использованием. 15 з.п. ф-лы, 7 ил., 7 пр.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка притязает на приоритет по предварительной заявке на патент США № 61/015183, поданной 19 декабря 2007. Содержание этой заявки включено путем ссылки во всей ее полноте в настоящую заявку.
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям элсамитруцина, подходящим для парентерального введения для лечения опухолевых заболеваний и состояний.
Уровень техники
Элсамитруцин представляет собой гетероциклический противоопухолевый антибиотик, выделенный из штамма J907-21 грамположительной бактерии Actinomycete, как описано в патентах США №№ 4518589 и 4572895, которые включены в настоящую заявку путем ссылки во всем, что касается природы, химического состава, способов получения и биологической активности элсамитруцина. Элсамитруцин встраивается в ДНК в богатые гуанидином-цитозином (G-C) последовательности и ингибирует топоизомеразу I и II, приводя к однонитевым разрывам и ингибированию репликации ДНК. Элсамитруцин обладает значительной онколитической активностью по отношению к метастатическому раку груди, раку толстой кишки и раку прямой кишки, немелкоклеточному раку легкого и раку яичников, и у пациентов с рецидивировавшей или резистентной неходжкинской лимфомой.
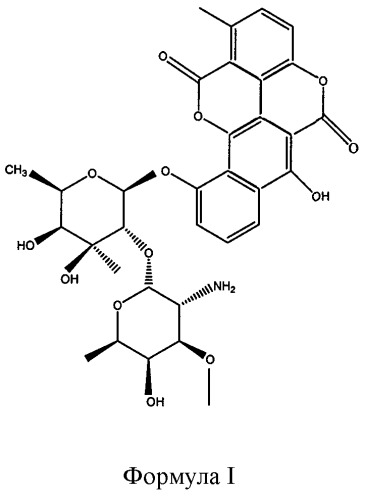
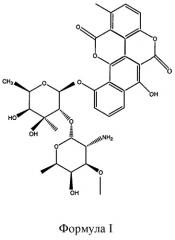
Элсамитруцин с химической точки зрения известен как 10-((2-O-(2-амино-2,6-дидезокси-3-O-метил-альфа-D-галактопиранозил)-6-дезокси-3-C-метил-бета-D-галактопиранозил)окси)-6-гидрокси-1-метил-бензо(h)(1)бензопирано(5,4,3-cde)(1)бензопиран-5,12-дион и имеет структуру, полностью представленную формулой I. Элсамитруцин также известен как 10-O-элсаминосилелсарозилчартарин, BBM 2478A, BMY-28090, SPI-28090, BRN 5214813, элсамицин A, элсамитруцина и элсамитруцин.
В известный из уровня техники порошок лиофилизированного элсамитруцина вводят янтарную кислоту с добавлением стерильной воды. Это приводит к образованию соли элсамитруцина in situ в результате растворения основания элсамитруцина в органическом растворителе и затем добавления достаточного количества водной янтарной кислоты с образованием раствора с отношением солюбилизированного свободного основания к кислоте 1:1. Затем pH полученного раствора элсамитруцина-янтарной кислоты доводят до значения в диапазоне от 3,5 до 4,5 и смешивают с наполнителем, таким как маннит, чтобы повысить стабильность перед лиофилизацией (смотри, например, патент США № 5508268). Стабильные соли элсамитруцина в порошкообразной форме (кристаллической или аморфной) в настоящее время не доступны, следовательно, все высокорастворимые фармацевтические композиции элсамитруцина должны быть получены in situ с использованием свободного основания. Элсамитруцин типично вводят парентерально (обычно внутривенно) животным, включая людей, и поставляют в виде лиофилизированного порошка, который разводят стерильной водой для инъекций непосредственно перед применением вследствие присущей образованным in situ солям известного уровня техники нестабильности.
Следовательно, существует необходимость в композициях, которые содержат стабильные соли элсамитруцина. Данные композиции должны содержать соли, которые могут быть получены без использования свободного основания и соответствующих органических растворителей, необходимых для того, чтобы солюбилизовать свободное основание in situ.
Сущность изобретения
Настоящее изобретение относится к композициям, содержащим водорастворимые, твердые соли элсамитруцина, которые подходят для парентерального введения для лечения опухолевых заболеваний и состояний.
В одном варианте осуществления настоящего изобретения композиция включает раствор по меньшей мере одной стабильной твердой соли элсамитруцина и фармацевтически приемлемый носитель.
В другом варианте осуществления настоящего изобретения композиция не требует буфера для поддержания pH раствора.
В другом варианте осуществления настоящего изобретения композиция не требует стабилизирующего антиоксиданта.
В другом варианте осуществления настоящего изобретения композиция дополнительно включает регулирующий осмотическое давление агент.
В другом варианте осуществления настоящего изобретения композиция дополнительно включает агент для установления pH в диапазоне от примерно 3,5 до примерно 4,5.
В другом варианте осуществления настоящего изобретения pH композиции составляет примерно 4,0.
В другом варианте осуществления настоящего изобретения твердая соль элсамитруцина композиции выбрана из группы, состоящей из лактата элсамитруцина, фумарата элсамитруцина, малеата элсамитруцина, сукцината элсамитруцина, тартрата элсамитруцина, тозилата элсамитруцина, метансульфоната элсамитруцина, бензоата элсамитруцина, салицилата элсамитруцина, гидрохлорида элсамитруцина, сульфата элсамитруцина и фосфата элсамитруцина.
В другом варианте осуществления настоящего изобретения твердая соль элсамитруцина композиции представляет собой тозилат элсамитруцина.
В другом варианте осуществления настоящего изобретения фармацевтически приемлемый носитель представляет собой воду или солевой раствор.
Данные и другие задачи, преимущества и признаки изобретения будут более подробно рассмотрены далее.
Краткое описание чертежей
На Фиг.1 изображены кристаллы тозилата элсамитруцина, перекристаллизованного из смеси ацетонитрил:вода 1:1, полученного согласно идеям настоящего изобретения.
Фиг.2A и 2B иллюстрируют активность лекарственной формы 2,5 мл элсамитруцина F2 RTU при 5°C в зависимости от времени.
Фиг.3A и 3B иллюстрируют активность лекарственной формы 2,5 мл элсамитруцина F2 RTU при 25°C в зависимости от времени.
Фиг.4A и 4B иллюстрируют активность лекарственной формы 2,5 мл элсамитруцина F2 RTU при 40°C в зависимости от времени.
Фиг.5A и 5B иллюстрируют активность лекарственной формы 2,5 мл элсамитруцина F2 RTU при 60°C в зависимости от времени.
На Фиг.6 показана диаграмма Аррениуса для лекарственной формы элсамитруцина F2 RTU в перевернутом положении.
На Фиг.7 показана диаграмма Аррениуса для лекарственной формы элсамитруцина F2 RTU в вертикальном положении.
Определение терминов
Перед изложением описания может быть полезно дать толкование определенным терминам, которые будут использованы ниже в настоящем описании.
Аналог(и): В том смысле как этот термин использован здесь, “аналог(и)” включают соединения, имеющие структурное сходство с другим соединением. Например, противовирусное соединение ацикловир является аналогом нуклеозидов и структурно схож с нуклеозидом гуанозином, который является производным основания гуанина. Таким образом, ацикловир имитирует гуанозин (биологически “аналогичен ему”) и препятствует синтезу ДНК, замещая остатки гуанозина (конкурируя с ними) в вирусной нуклеиновой кислоте, и предотвращает трансляцию/транскрипцию. Таким образом, соединения, имеющие структурное сходство с другим (исходным соединением), которое имитирует биологическую или химическую активность исходного соединения, являются аналогами. Не существует минимальных или максимальных чисел замещений элементных или функциональных групп, требуемых для квалификации в качестве аналога, в том смысле как этот термин использован здесь, если аналог способен имитировать некоторым релевантным образом, либо идентично, комплиментарно, либо конкурентно, с биологическими или химическими свойствами исходного соединения. Аналоги могут представлять собой, и часто представляют собой, производные исходного соединения (смотри ниже “производное”). Аналоги соединений, раскрытых здесь, могут иметь равную, меньшую или большую активность, чем их исходные соединения.
Производное: В том смысле как этот термин использован здесь, “производное” представляет собой соединение, полученное либо в природе, либо синтетически из (происходящее из) исходного соединения. Производное может являться аналогом (смотри выше “аналог”) и, таким образом, может обладать схожей химической или биологической активностью. Однако, в том смысле как этот термин использован здесь, производное не обязательно должно имитировать активность исходного соединения. Не существует минимальных или максимальных чисел замещений элементных или функциональных групп, требуемых для квалификации в качестве производного. Например, противовирусное соединение ганкловир является производным ацикловира. Ганкловир имеет другой спектр противовирусной активности в отличие от ацикловира, а также другие токсикологические свойства. Производные соединений, раскрытых здесь, могут иметь равную, меньшую, большую или несхожую активность, в сравнении с их исходными соединениями.
Элсамитруцин: В том смысле как он использован здесь, термин “элсамитруцин” относится к противоопухолевому соединению, имеющему молекулярную массу приблизительно 825,83 Да и химически известному как 10-((2-O-(2-амино-2,6-дидезокси-3-O-метил-альфа-D-галактопиранозил)-6-дезокси-3-C-метил-бета-D-галактопиранозил)окси)-6-гидрокси-1-метил-бензо(h)(1)бензопирано(5,4,3-cde)(1)бензопиран-5,12-дион и которое имеет общую структуру, представленную формулой I. Элсамитруцин также известен как 10-O-элсаминосилелсарозилчартарин, BBM 2478A, BMY-28090, SPI-28090, BRN 5214813, элсамицин A, элсамитруцина и элсамитруцин. Смотри патенты США №№ 4518589 и 4572895 касательно способов выделения элсамитруцина из природных источников и его характеризации. Смотри также Konishi M, Sugawara K, Kofu F, Nishiyama Y, Tomita K, Miyaki T, Kawaguchi H. 1986. Elsamicins, new antitumor antibiotics related to chartreusin I. Production, isolation, characterization and antitumor activity. J. Antibiot. (Tokyo) Jun; 39(6):784-91.
Композиция: В том смысле как он использован здесь, термин «композиция» относится к фармацевтически приемлемому препарату, включающему одну или более солей элсамитруцина настоящего изобретения и по меньшей мере один фармацевтически приемлемый носитель, такой как, но без ограничения ими: вода для инъекций или солевой раствор. Более того, композиции настоящего изобретения могут также включать стабилизаторы, консерванты или дополнительные терапевтические агенты. Фармацевтические композиции настоящего изобретения могут быть введены любым способом, известным специалистам в данной области, и идеально подходят для внутривенного введения или инъекции в кожу, мышцу или другие ткани тела. Фармацевтическая композиция может быть предназначена для перорального введения.
Соль: В том смысле как этот термин использован здесь, “соль” или “соли” включают любые соединения, которые получаются в результате замещения части или всего кислого водорода кислоты металлом или группой, действующей как металл: ионное кристаллическое соединение. В данном случае соль представляет собой продукт свободного основания и органической кислоты, который может существовать как стабильное твердое вещество и не включает псевдосоли или соли, полученные in situ, которые существуют только в растворе.
Подходящая(ие) солевая(ые) форма(ы): В том смысле как он использован здесь, термин “подходящая(ие) солевая(ые) форма(ы)” означает соль элсамитруцина, полученную в стабильном твердом состоянии либо в виде аморфной, либо в виде кристаллической формы.
Твердое вещество или твердая соль: В том смысле как он использован здесь, термин твердое вещество или твердая соль относится к соли элсамитруцина, существующей в твердом состоянии и содержащей менее 30% остаточной влаги, предпочтительно, менее 10% остаточной влаги и, более предпочтительно, менее 5% остаточной влаги. В том смысле как он использован здесь, термин “влага” относится к воде или органическому растворителю. Термин “твердое вещество” также использован здесь, чтобы отличить соли элсамитруцина настоящего изобретения от солей, образованных in situ и существующих главным образом в водной фазе. Более того, настоящие твердые соли не являются продуктом сушки в вакууме при замораживании или лиофилизации.
Стабильный: В том смысле как он использован здесь, термин “стабильный” относится к соли элсамитруцина или к парентеральной композиции, содержащей соль элсамитруцина (полученной способом, отличным от образования соли in situ), в которой соль элсамитруцина сохраняет показатели ЯМР, указывающие на практически идеальное солевое отношение 1:1 (таким образом, не показывая разложения в твердом состоянии) в ходе высушивания при повышенных температурах при 75°C в течение девяти часов или, более предпочтительно, при 98°C в течение ночи. Более того, в том смысле как он использован здесь, термин стабильный относится к соли элсамитруцина, содержащейся в парентеральной композиции, которая сохраняет по меньшей мере 90% своей противоопухолевой активности, как определено в in vitro испытании на торможение роста (смотри пример 4), в течение по меньшей мере 24 месяцев в твердой форме и в течение 18 месяцев в жидкой форме при подходящей температуре хранения.
Подробное описание изобретения
Элсамитруцин и структурно родственные ему антибиотики связываются с GC-богатыми участками ДНК, явно предпочитая В-ДНК по сравнению с Z-ДНК. Они ингибируют синтез РНК и вызывают однонитевой разрыв ДНК через образование свободных радикалов. Элсамитруцин можно также рассматривать как наиболее активный ингибитор топоизомеразы II из тех, о которых сообщалось до настоящего времени, и он может ингибировать образование некоторых комплексов ДНК-белок. Элсамитруцин связывается с P1 и P2 промотирующими участками онкогена c-myc, ингибирует связывание фактора транскрипции Sp1, ингибируя таким образом транскрипцию.
Элсамитруцин показал активность у пациентов с рецидивировавшей или резистентной неходжкинской лимфомой и in vivo активность в отношении широкого ряда мышиных новообразований, включая лейкоз P388, лейкоз L1210 и меланому B16 и M5076, а также в отношении ксенотрансплантатов MX1 и HCT116 (смотри, например, Raber MN, Newman RA, Newman BM, Gaver RC, Schacter LP. 1992 Phase I trial and clinical pharmacology of elsamitrucin. Cancer Res. Mar 15; 52(6):1406-10).
Кроме того, экспериментальная терапия резистентной/рецидивировавшей неходжкинской лимфомы продемонстрировала, что связанная с элсамитруцином токсичность относительно слаба и заключалась главным образом в астении, тошноте и рвоте, и не включала миелосупрессию. Активность элсамитруцина и отсутствие миелосупрессии предполагает, что он подходит для лечения данного заболевания особенно в сочетании с другими доказавшими свою эффективность агентами (смотри Allen SL, Schacter LP, Lichtman SM, Bukowski R, Fusco D, Hensley M, O'Dwyer P, Mittelman A, Rosenbloom B, Huybensz S. 1996. Phase II study of elsamitrucin (BMY-28090) for the treatment of patients with refractory/relapsed non-Hodgkin's lymphoma. Invest. New Drugs. 14(2):213-17).
In vivo активность элсамитруцина также была исследована в сравнении с активностью доксорубицина (DX) на двух чувствительных клеточных линиях рака груди: одной положительной по рецепторам эстрогенов линии (ER+, MCF7) и одной отрицательной по рецепторам эстрогенов линии (ER-, MDA-MB-231), и на DX-резистентной сублинии (MCF7DX). Активность двух лекарственных средств также исследовали на 19 клинических образцах рака груди, взятых у нелеченых пациентов. Лекарственные средства испытывали при фармакологически релевантных концентрациях, как рассчитано из площади под кривой для 3-часового воздействия до летальной дозы, дающей смертность 10% (LD10) у мышей, и при 10- и 100-кратных концентрациях. В случае DX-чувствительных линий ингибирование РНК и включения предшественников ДНК, а также клеточной пролиферации, вызывалось в большей степени элсамитруцином, чем DX. Более того, антипролиферативный эффект был в 10 раз выше в случае ER+ MCF7, чем в случае клеточной линии ER- MDA-MB-231 (IC50: 0,25 против 0,21 микрограмм/мл). В сублинии MCF7DX наблюдалась перекрестная резистентность элсамитруцина к DX. В клинических образцах воздействия на включение предшественников ДНК отмечались чаще для элсамитруцина, чем для DX при одинаковых концентрациях лекарственных средств. In vitro чувствительность к элсамитруцину была более выражена в случае опухолей ER+, чем в случае опухолей ER-: минимальные концентрации ингибирования лекарственного средства составляли 0,1 и 3,5 микрограмм/мл, соответственно, в двух группах. Данные in vitro результаты могут указывать на обещающую роль элсамитруцина в клинической терапии, главным образом пациентов с раком груди ER+ (смотри Silvestrini R, Sanfilippo O, Zaffaroni N, De Marco C, Catania S. 1992. Activity of a chartreusin analog, elsamitrucin, on breast cancer cells. Anticancer Drugs. Dec; 3(6):677-81).
Патент США №5508268, выданный 16 апреля 1996, авторы Nassar и др., патентообладатель Bristol-Myers Squibb (далее в настоящем описании патент '268), раскрывает парентеральные композиции, включающие основание элсамитруцина, органическую кислоту, стабилизатор и буфер. Композиции элсамитруцина, раскрытые в этом патенте, получали, используя различные органические кислоты, включая соляную, L(+)-молочную, L-винную, D-глюкуроновую, метансульфоновую, адипиновую и янтарную, причем янтарная кислота являлась предпочтительной. Композиции элсамитруцина получают согласно содержанию примера, приведенного в столбце 4, строки 5-30. В данном примере описана только сукцинатная соль. Конкретно, согласно приведенной в патенте '268 информации соль элсамитруцина образуется in situ при использовании органической кислоты в сочетании с по меньшей мере одним восстановителем (консервант) при pH, отрегулированном до приблизительно 4. Полученный раствор фильтровали и сохраняли в жидком состоянии для испытания на стабильность. В других вариантах осуществления, раскрытых в патенте '268, органическую кислоту, основание элсамитруцина, восстановитель и другие подходящие фармацевтические формообразующие, такие как сахара, но без ограничения ими, смешивают в растворе и полученную композицию лиофилизируют.
Однако патент '268 не раскрывает, не обсуждает и не дает сведений о стабильных твердых солях элсамитруцина. Полностью в отличие от идей патента '268 авторы настоящего изобретения обнаружили способы, которые дают стабильные твердые соли элсамитруцина, полученные с использованием основания элсамитруцина и выбранных органических кислот. Конечные композиции, полученные в соответствии с идеями настоящего изобретения, представляют собой твердые, сухие или частично высушенные порошки солей элсамитруцина в противоположность лиофилизатам, описанным в патенте '268. Таким образом, композиции солей элсамитруцина настоящего изобретения представляют собой истинные соли в твердом состоянии, а не in situ растворы, содержащие смесь солюбилизированного основания и органической кислоты.
Настоящее изобретение предлагает многочисленные преимущества по сравнению с in situ образованными смесями, описанными в патенте '268. Во-первых, соли элсамитруцина, полученные в соответствии с идеями настоящего изобретения, могут быть тщательно проанализированы на наличие примесей и очищены по необходимости, чтобы отвечать весьма высоким государственным предписаниям. Более того, истинные соли по настоящему изобретению могут быть с точностью взвешены и растворены в подходящих фармацевтических носителях, таких как вода для инъекций. Выбранные соли сами являются чрезвычайно стабильными при хранении в твердом состоянии и имеют длительные сроки хранения, как и соответствующие им солюбилизированные растворы. Таким образом, парентеральные растворы могут быть получены с использованием солей элсамитруцина настоящего изобретения и могут быть сохранены в течение длительных периодов времени.
В одном варианте осуществления настоящего изобретения композиция включает по меньшей мере одну стабильную твердую соль элсамитруцина и фармацевтически приемлемый носитель.
В другом варианте осуществления настоящего изобретения композиция не требует буфера для поддержания pH раствора.
В другом варианте осуществления настоящего изобретения композиция не требует стабилизирующего антиоксиданта.
В другом варианте осуществления настоящего изобретения композиция дополнительно включает регулирующий осмотическое давление агент.
В другом варианте осуществления настоящего изобретения композиция дополнительно включает агент для установления pH в диапазоне от примерно 3,5 до примерно 4,5.
В другом варианте осуществления настоящего изобретения pH композиции составляет примерно 4,0.
В другом варианте осуществления настоящего изобретения твердая соль элсамитруцина композиции выбрана из группы, состоящей из лактата элсамитруцина, фумарата элсамитруцина, малеата элсамитруцина, сукцината элсамитруцина, тартрата элсамитруцина, тозилата элсамитруцина, метансульфоната элсамитруцина, бензоата элсамитруцина, салицилата элсамитруцина, гидрохлорида элсамитруцина, сульфата элсамитруцина и фосфата элсамитруцина.
В другом варианте осуществления настоящего изобретения твердая соль элсамитруцина композиции представляет собой тозилат элсамитруцина.
В другом варианте осуществления настоящего изобретения фармацевтически приемлемый носитель представляет собой воду или солевой раствор.
Раскрытые в настоящем изобретении композиции могут не требовать буфера для поддержания pH. Буферные агенты обычно представляют собой либо слабую кислоту, либо слабое основание, которые составляют буферный раствор. Буферные агенты обычно добавляют в воду, чтобы создать буферные растворы. Они представляют собой вещества, которые ответственны за буферное поведение, наблюдаемое в данных растворах. Данные агенты добавляют к веществам, которые подлежат помещению в кислые или основные условия, для того, чтобы стабилизировать вещество. Например, забуференный аспирин содержит буферный агент, такой как MgO, который будет поддерживать pH аспирина, когда он проходит через желудок пациента. Другим применением буферного агента являются антацидные таблетки, основная цель которых заключается в том, чтобы понизить кислотность желудка. Примерами буферных агентов являются следующие, но без ограничения ими: дигидрофосфат калия, янтарная кислота, L(+)-молочная кислота и L-винная кислота.
При получении настоящих композиций можно просто использовать агент, чтобы установить желаемое pH, но его использование для поддержания pH не является необходимым. Кислоты и основания могут быть использованы с данной целью. Примером одного такого агента является сильное основание, такое как NaOH. Сильное основание представляет собой основное химическое соединение, которое способно депротонировать очень слабые кислоты в кислотно-основной реакции. Соединения с pKa более примерно 13 называются сильными основаниями. Обычными примерами сильных оснований являются гидроксиды щелочных металлов и щелочноземельных металлов, подобные NaOH и Ca(OH)2.
Специалист обычной квалификации в данной области может определить желаемое pH или диапазон(ы) pH для композиции элсамитруцина и установить данное pH или диапазон(ы) pH, используя pH-регулирующий агент, если необходимо. Для целей настоящего изобретения диапазоны pH могут представлять собой следующие, но без ограничения ими: от примерно 3,5 до примерно 4,5 и от примерно 2,0 до примерно 4,0. В другом варианте осуществления pH может составлять примерно 4.
Также, настоящая композиция не требует стабилизирующего антиоксиданта. Стабилизирующий антиоксидант представляет собой молекулу, способную замедлять или предотвращать окисление других молекул. Окисление представляет собой химическую реакцию, которая переносит электроны от вещества к окислителю. Реакции окисления могут порождать свободные радикалы, которые запускают цепные реакции, которые повреждают клетки. Антиоксиданты обрывают данные цепные реакции, удаляя свободнорадикальные интермедиаты, и ингибируют другие реакции окисления за счет того, что окисляются сами. Поэтому антиоксидантами часто являются восстановители, такие как тиолы или полифенолы. Дополнительные примеры антиоксидантов включают следующие, но без ограничения ими: антиоксиданты, содержащие серу и щелочной металл. Примеры антиоксидантов, содержащих серу и щелочной металл, включают следующие, но без ограничения ими: метабисульфит натрия, ацетон-бисульфит натрия и формальдегид-сульфоксилат натрия.
Один или более регулирующих осмотическое давление агентов могут быть включены в раскрытую в настоящем изобретении композицию. Регулирующие осмотическое давление агенты представляют собой химикаты, которые устанавливают осмотическое давление раствора. Осмотическое давление представляет собой гидростатическое давление, оказываемое раствором в пространстве, разделенном полупроницаемой мембраной вследствие разницы в концентрациях растворенного вещества. Включение регулирующих осмотическое давление агентов может быть необходимо для соответствия осмотическому давлению организма пациента. Примеры таких регулирующих осмотическое давление агентов включают следующие, но без ограничения ими: маннит и хлорид натрия.
Раскрытые в настоящем изобретении композиции могут быть получены в виде готовых к использованию растворов. Тогда как ранее описанные растворы элсамитруцина, такие как описано в патенте США № 5508628, лиофилизировали, чтобы получить твердую форму, которую восстанавливали фармацевтическим носителем, таким как вода, непосредственно перед введением, раскрытые в настоящем изобретении композиции стабильны в жидкой форме и имеют длительный срок хранения, как описано в примерах ниже. Следовательно, раскрытые в настоящем изобретении растворы, могут быть сохранены и введены без восстановления перед использованием. Пригодная для использования композиция патента США № 5508628 требует лиофилизации, поскольку in situ образованный раствор соли элсамитруцина содержал остаточные растворители, такие как метанол, этанол, хлороформ, н-бутанол и т-бутанол. Высушивание при замораживании (также известное как лиофилизация или криосушка) представляет собой способ обезвоживания, типично используемый для консервации портящегося материала или чтобы сделать материал более удобным для транспортировки. Высушивание при замораживании осуществляется замораживанием материала и затем снижением окружающего давления и подводом достаточного тепла, чтобы позволить замороженной воде в материале сублимироваться непосредственно из твердой фазы в газ.
Присутствие остаточных растворителей было бы неприемлемым в случае введения пациенту. Лиофилизация была необходима для удаления данных примесей в патенте США № 5508628. В одном варианте осуществления раскрытые в настоящем изобретении композиции не содержат таких примесей, которые представляют собой, например, метанол, этанол, хлороформ, н-бутанол и т-бутанол.
Следующие примеры приведены в качестве иллюстративных вариантов осуществления настоящего изобретения. Следует понимать, что стабильные высушенные или почти высушенные соли элсамитруцина настоящего изобретения не ограничены следующими примерами. Идеи примеров, которые описаны ниже, могут быть использованы химиком-фармацевтом обычной квалификации в качестве руководства для создания других вариантов, которые приводят к таким же композициям, которые раскрыты здесь.
ПРИМЕРЫ
Пример 1
Первоначальное получение стабильных солей элсамитруцина настоящего изобретения
Малые порции солей элсамитруцина получали перед оптимизацией и масштабированием. Выбирали восемь противоионов на основе органических кислот, причем они включали молочную кислоту, малеиновую кислоту, янтарную кислоту, L-винную кислоту, п-толуолсульфокислоту (также называемую здесь п-TSA или тозилат), бензойную кислоту, салициловую кислоту и серную кислоту. Три растворителя выбирали на основе способов предварительного скрининга, известных специалистам в области фармацевтической химии, причем выбранные растворители включали диоксан, диметилформамид (DMF) и уксусную кислоту (AcOH). Дополнительное сочетание п-TSA/MeOH включали для суммарного числа двадцати пяти реакций варьирования.
В каждый реакционный флакон помещали 3,0×10-5 моль основания элсамитруцина. Основание элсамитруцина растворяли в 0,25 мл DMF или AcOH при 55°C, 1,5 мл диоксана при 80°C или 12 мл MeOH при 70°C и перемешивали в течение пяти минут, чтобы обеспечить растворение. Затем в каждый флакон помещали 245-270 мкл 0,126 М раствора в диоксане одной из органических кислот, перечисленных выше (смотри Таблицу 1), что соответствовало 1,05 эквивалента каждой из восьми кислот (винную кислоту суспендировали в смеси метанол/вода 1:1 вследствие ее нерастворимости в диоксане).
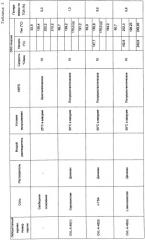
| Таблица 1 | |||||||||
| Кислота | A - Диоксан (1,5 мл) | B - DMF (0,25 мл) | C - AcOH (0,25 мл) | D - MeOH (12 мл) | |||||
| API (мг) | Раствор кислоты 0,126 М (мл) | API (мг) | Раствор кислоты 0,126 М (мл) | API (мг) | Раствор кислоты 0,126 М (мл) | API (мг) | Раствор кислоты 0,126 М (мл) | ||
| 1 | Молочная | 20,25 | 0,200 | 20,01 | 0,255 | 19,13 | 0,245 | - | - |
| 2 | Малеиновая | 19,96 | 0,255 | 21,22 | 0,270 | 20,23 | 0,260 | - | - |
| 3 | Янтарная | 20,42 | 0,260 | 19,18 | 0,245 | 19,12 | 0,245 | - | - |
| 4 | L-винная | 20,65 | 0,265 | 19,55 | 0,250 | 19,62 | 0,250 | - | - |
| 5 | п-TSA | 19,52 | 0,250 | 19,41 | 0,250 | 19,61 | 0,250 | 21,08 | 0,270 |
| 6 | Бензойная | 19,63 | 0,250 | 21,03 | 0,270 | 19,96 | 0,255 | - | - |
| 7 | Салициловая | 19,95 | 0,255 | 21,04 | 0,270 | 20,15 | 0,260 | - | - |
| 8 | Серная | 19,54 | 0,250 | 21,17 | 0,270 | 19,97 | 0,255 | - | - |
| API = основание элсамитруцина |
Начальную температуру поддерживали в течение десяти минут и затем снижали до комнатной температуры со скоростью 20°C/час для DMF и AcOH, 30°C/час для диоксана и 25°C/час для MeOH. Твердые вещества образовывались во флаконах с диоксаном/L-винной кислотой, диоксаном/п-TSA, диоксаном/серной кислотой и AcOH/серной кислотой. Твердые вещества отделяли фильтрованием и высушивали в вакууме при 50°C и 30 дюймах Hg. В случае флаконов, в которых твердые вещества не образовывались, проводили концентрирование досуха потоком азота и высушивали в вакууме при 50°C и 30 дюймах Hg. Метанол удаляли в вакууме, и полученный остаток высушивали в высоком вакууме при комнатной температуре. Все образцы анализировали рентгеновской дифракцией (XRPD), дифференциальной сканирующей калориметрией (DSC) и термогравиметрическим анализом (TGA) для определения кристалличности солей. Кристаллические твердые вещества были получены из диоксана/серной кислоты и из AcOH/серной кислоты; полукристаллические твердые вещества были получены из диоксана/L-винной кислоты, диоксана/п-TSA, DMF/молочной кислоты, DMF/малеиновой кислоты, DMF/L-винной кислоты, DMF/бензойной кислоты, DMF/серной кислоты, AcOH/молочной кислоты, AcOH/п-TSA и AcOH/бензойной кислоты. С помощью XRPD было найдено, что все остальные вещества являлись аморфными.
Пример 2
Оптимизация получения солей элсамитруцина
Следующие три соли элсамитруцина, полученные согласно идеям примера 1, были выбраны для разработки масштабированного способа получения. Выбранными солями являлись тартрат элсамитруцина, сульфат элсамитруцина и тозилат элсамитруцина. Они были выбраны поскольку каждая из них давала кристаллические или полукристаллические твердые вещества, которые осаждались в ходе охлаждения, что может улучшить выделение и очистку (если необходимо) соли и, таким образом, делает их более подходящими для более масштабных технологий производства. Однако то, что они выбраны для целей примера 2, не следует рассматривать как ограничение.
L-Винную кислоту, серную кислоту и п-TSA растворяли в диоксане. В каждую из подходящих реакционных емкостей загружали 1,7×10-4 моль основания элсамитруцина, которое растворяли в 7,5 мл диоксана при 80°C, и перемешивали в течение пяти минут, чтобы обеспечить растворение. Затем в каждый флакон помещали 350-380 мкл 0,5 М раствора органической кислоты в диоксане, что соответствовало приблизительно 1,05 эквивалента каждой из трех кислот (Таблица 2).
| Таблица 2 | |||||
| Эксперимент № | Элсамитруцин (мг) | Растворитель | Количество (мл) | Кислота (0,5 М) | Количество (мл) |
| 1 | 118 | Диоксан | 9,0 | Серная | 0,38 |
| 2 | 113 | Диоксан | 7,0 | п-TSA | 0,36 |
| 3 | 108 | Диоксан | 7,5 | L-винная | 0,35 |
Начальную температуру поддерживали в течение десяти минут и затем снижали до комнатной температуры со скоростью 30°C/час для диоксана. Твердые вещества образовывались при добавлении кислоты во флаконы в случае диоксана/L-винной кислоты и диоксана/серной кислоты, а для диоксана/п-TSA осаждение происходило в ходе охлаждения. После фильтрования твердые вещества высушивали в вакууме при 50°C и 30 дюймах Hg. Образцы анализировали с помощью XRPD, DSC и TGA для определения кристалличности (Таблица 3) и других физических свойств.
Как показано в Таблице 3, все твердые вещества в примере 2 являлись полукристаллическими, содержали вплоть до примерно 5% остаточного растворителя и были неизменно вязкими вследствие большого количества растворителя, который удерживался в твердых веществах из-за быстрого осаждения.
Соли элсамитруцина настоящего изобретения также получали, используя способ более медленного осаждения, чем описано выше. В реакционные емкости загружали 7,6×10-5 моль основания элсамитруцина и 5 мл диоксана при 80°C. После перемешивания смеси в течение пяти минут для обеспечения растворения основания, к растворенному основанию элсамитруцина прибавляли 400 мкл 0,2 М водного раствора винной кислоты, что соответствовало 1,05 эквивалентам. Температуру поддерживали при 80°C в течение десяти минут, и затем флаконы охлаждали до комнатной температуры со скоростью 30°C/час. В ходе охлаждения происходило осаждение фазы. Твердые вещества отделяли фильтрованием и высушивали в вакууме при 50°C и 30 дюймах Hg. Образцы анализировали с помощью XRPD, DSC и TGA для определения физических свойств [Таблица 3, OVL-A-55(1) и OVL-A-55(2)]. Первый образец [диоксан/серная кислота, OVL-A-55(1)] являлся кристаллическим согласно XRPD, но содержал 3,6% остаточно растворителя согласно TGA-анализу и имел три эндотермических пика на DSC-кривой. Второй образец [диоксан/L-винная кислота, OVL-A-55(2)] являлся полукристаллическим.
Затем, соли элсамитруцина получали в водной среде следующим образом. В реакционные флаконы загружали 100 мг основания элсамитруцина, 1,05 эквивалентов соответствующей кислоты (п-TSA, янтарную и L-винную кислоту добавляли в виде твердых веществ; серную кислоту растворяли в 0,5 мл воды) и воду (10 мл для п-TSA, янтарной и L-винной кислоты, 9,5 мл для серной кислоты). Суспензии нагревали до 80°C при перемешивании в течение десяти минут для образования прозрачного раствора и затем охлаждали до комнатной температуры со скоростью 30°C/час. После перемешивания в течение ночи при комнатной температуре осадки не образовывались ни в одном из экспериментов. Воду удаляли в слабом токе азота при 35°C. Осаждение наблюдалось в эксперименте с п-TSA после удаления одной трети воды, твердое вещество отфильтровывали и высушивали в вакууме при 50°C и 30 дюймах Hg. Фильтрат также анализировали. Другие три флакона упаривали досуха и высушивали в вакууме при 50°C и 30 дюймах Hg. Результаты показали, что полученные твердые вещества являлись полукристаллическими с высоким содержанием аморфного компонента [Таблица 3, OVL-A-47(1), OVL-A-47(2-1), OVL-A-47(3) и OVL-A-65].
Пример 3
Кристаллизация тозилатной соли элсамитруцина с использованием микроскопии
На предметное стекло микроскопа насыпали с использованием шпателя 1-2 мг аморфного тозилата элсамитруцина, и помещали покровное стекло. Капли растворителя помещали сбоку покровного стекла так, чтобы позволить растворителю проникнуть под покровное стекло и растворить лекарственное средство. Лекарственное средство выдерживали в контакте с растворителем при комнатной температуре и рассматривали в микроскоп при увеличении 100× или 400×. Использовали растворители: изопропиловый спирт, метанол, этанол, ацетонитрил, ацетон, пропиленгликоль, тетрагидрофуран, дихлорметан и смеси 1:1 изопропилового спирта, метанола, этанола, ацетонитрила, ацетона с водой. Игольчатые или палочковидные кристаллы наблюдали под микроскопом в растворителях: этанол, метанол, пропиленгликоль, изопропиловый спирт, ацетон и во всех смесях