Композиции и способы применения (r)-прамипексола
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтическим композициям однократной дозы (R)-прамипексола высокой хиральной чистоты и способам применения указанных композиций для лечения нейродегенеративных заболеваний или заболеваний, связанных с дисфункцией митохондрий или повышенным окислительным стрессом. Группа изобретений позволяет приостановить или замедлить развития патологии и/или симптоматики путем введения однократной дозы композиции (R)-прамипексола. 3 н. и 26 з.п. ф-лы, 5 ил., 18 табл., 17 пр.
Реферат
Перекрестная ссылка
Данная заявка испрашивает приоритет по временной заявке США № 60/870009, зарегистрированной 14 декабря 2006 г., временной заявке США № 60/894835, зарегистрированной 14 марта 2007 г., и временной заявке США № 60/894829, зарегистрированной 14 марта 2007 г., временной заявке США № 60/894799, зарегистрированной 14 марта 2007 г., заявке США № 11/733642, зарегистрированной 10 апреля 2007 г., и заявке США № 11/749497, зарегистрированной 16 мая 2007 г., и временной заявке США № 60/979049, зарегистрированной 10 октября 2007 г., каждая из которых полностью включена в настоящий документ в качестве ссылки.
Уровень техники
(R)-прамипексол представляет собой энантиомер активного фармацевтического ингредиента разрешенного лекарственного средства для лечения болезни Паркинсона (PD) и синдрома усталых ног (RLS) Mirapex (прамипексол; (S)-прамипексол). Mirapex® представляет собой высокоаффинный (низкая, нМ, IC50) агонист рекомбинантных дофаминовых рецепторов D2 и D3 человека и грызунов, свойство, которое является фармакологической основой его эффективности при указанных расстройствах. Как было показано в доклинических исследованиях, как (R)-, так и (S)-энантиомеры обладают нейропротективными свойствами, которые не зависят от аффинности в отношении дофаминовых рецепторов.
Нейропротективные свойства (S)-прамипексола признаны потенциально полезными для лечения нейродегенеративных расстройств, но клинический опыт применения лекарственного средства для лечения расстройств, связанных с дефицитом дофамина, таких как PD, показал, что введение лекарственного средства ограничивается как временным фактором, необходимостью длительного титрования дозы, так и абсолютно в том, что касается максимально переносимой дозы (MTD), из-за побочных эффектов, связанных с действием агониста дофаминовых рецепторов. Указанные ограничения дозирования являются типичными для агонистов дофаминовых рецепторов указанного класса.
Предельно допустимая однократная начальная доза Mirapex® составляет 0,125 мг, которую вводят три раза в день (t.i.d.); а предельно допустимая доза Mirapex составляет 1,5 мг t.i.d., что дает максимальную суточную дозу 4,5 мг Mirapex® после 7-8 недель титрования.
В то время как указанные уровни доз Mirapex® являются пригодными для лечения признаков и симптомов PD и RLS, в нейропротективных исследованиях эффективность (S)-прамипексола в качестве нейропротектора приблизительно в 1000 раз ниже его эффективности в качестве агониста дофаминовых рецепторов. Это наводит на мысль о том, что при использовании данного энантиомера невозможно достичь терапевтически пригодных нейропротективных доз.
(R)-прамипексол обладает сходной нейропротективной эффективностью, но более низкой аффинностью в отношении дофаминовых рецепторов. Соответственно, его продвигали как соединение, потенциально более пригодное для лечения нейродегенеративных расстройств. Однако разница в аффинности в отношении дофаминовых рецепторов между (R)-прамипексолом и (S)-прамипексолом, о которой сообщалось ранее, все же должна будет накладывать клинически важные ограничения на дозы и все же потребует титрования дозы и ограничений дозы, чтобы избежать побочных эффектов, связанных с дофамином. В предыдущих исследованиях, касающихся применения (R)-прамипексола для лечения бокового амиотрофического склероза (ALS), быстро прогрессирующего смертельного нейродегенеративного расстройства, было предложено ограничить введение (R)-прамипексола и потребовать достоверного титрования дозы в экспериментах на животных. Принятое требование титрования дозы, конкретно, требование начинать введение с очень низких доз и повышать дозу до конечного, терапевтически эффективного уровня дозы в течение 7-8 недель, строго ограничивает пригодность нейропротективного потенциала энантиомера (R)-прамипексола. Кроме того, принятая MTD будет строго ограничивать регулярное использование нейропротективного потенциала энантиомера (R)-прамипексола как при острых, так и при хронических нейродегенеративных расстройствах.
Сущность изобретения
Настоящее изобретение раскрывает терапевтический потенциал (R)-прамипексола путем получения клинически очищенного (R)-прамипексола и определения фактической in vitro и in vivo связывающей аффинности и переносимости пациентом очищенного (R)-прамипексола. В соответствии с вариантами осуществления настоящего изобретения более высокие дозы (R)-прамипексола можно вводить пациенту, который в этом нуждается.
Настоящее изобретение дополнительно относится к способу лечения нейродегенеративного заболевания у пациента, который в этом нуждается, включающему введение пациенту суточной дозы в количестве приблизительно от 25 мг до 5000 мг (R)-прамипексола, более предпочтительно, приблизительно от 500 мг до 2100 мг, наиболее предпочтительно, более 500 мг и менее 2100 мг (R)-прамипексола ежедневно.
В некоторых вариантах осуществления настоящего изобретения заболевание, подлежащее лечению, является острым, а в других вариантах - хроническим. В некоторых вариантах осуществления настоящего изобретения хроническое нейродегенеративное заболевание выбрано из первичного нейродегенеративного заболевания, хореи Гентингтона, метаболически индуцированного неврологического повреждения, сенильной деменции типа Альцгеймера, когнитивной дисфункции, связанной с возрастом, сосудистой деменции, мультиинфарктной деменции, деменции с тельцами Леви, нейродегенеративной деменции, нейродегенеративного двигательного расстройства, атаксии, атаксии Фридрейха, рассеянного склероза, спинальной мышечной атрофии, первичного бокового склероза, расстройств, сопровождаемых припадками, расстройства или заболевания двигательных нейронов, воспалительного демиелинизирующего расстройства, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, печеночной энцефалопатии и хронического энцефалита. В некоторых вариантах осуществления настоящего изобретения хроническое нейродегенеративное заболевание представляет собой боковой амиотрофический склероз. В некоторых вариантах осуществления настоящего изобретения пациент является пациентом, который ранее не подвергался лечению.
Краткое описание рисунков
Фиг.1 отражает средние концентрации (R)-прамипексола в плазме после перорального введения натощак однократных доз 50 мг, 150 мг и 300 мг здоровым добровольцам.
Фиг.2 отражает средние концентрации (R)-прамипексола в плазме после перорального введения однократных доз 150 мг здоровым добровольцам натощак и после приема пищи.
Фиг.3 отражает средние концентрации (R)-прамипексола в плазме в дни 1 и 7 во время перорального введения 50 мг и 100 мг доз в день 1, каждые 12 часов в дни с 3 до 6 и однократной дозы в день 7 здоровым добровольцам натощак.
Фиг.4 отражает воздействие (AUC) в зависимости от дозы (мг/м2) для самцов и самок крыс и людей (обоих полов).
Фиг.5 отражает среднее воздействие (AUC) в зависимости от дозы (мг/м2) для самцов и самок карликовых свиней и людей (обоих полов).
Подробное описание
Настоящее изобретение предоставляет данные о том, что аффинность (R)-прамипексола в отношении дофаминовых рецепторов фактически является намного ниже, чем было известно ранее, что значительно увеличивает клиническую пригодность композиции. В настоящем документе показано также, что разница в функциональной аффинности между энантиомерами (S)-прамипексолом и (R)-прамипексолом (например, в 10000-20000 раз) намного больше, чем сообщалось ранее. Указанные данные показывают, что (R)-прамипексол можно использовать в дозах, которые могут более полно и неожиданно раскрыть менее эффективный нейропротективный потенциал соединения без теоретического ограничения, которое накладывается допущениями в отношении разделения аффинности дофаминовых рецепторов между энантиомерами. Указанное введение можно осуществлять без необходимости титрования доз. Указанные данные также показывают, что загрязнение композиции чистого (R)-прамипексола малыми количествами (S)-прамипексола приводит к резким сдвигам в направленности композиции. Данная заявка представляет способы применения хирально более чистых композиций (R)-прамипексола для лечения острых и хронических нейродегенеративных расстройств, которые, как полагали ранее, являются недоступными для указанного лекарственного средства в том, что касается немедленного проявления полной эффективности, и/или без титрования дозы.
В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей (R)-прамипексол в дозах, достаточных для получения нейропротективных, антиоксидантных, антиапоптотических или других благоприятных клеточных эффектов, без одновременного возникновения значительных побочных эффектов. Способность доставлять клинически эффективные дозы без ограничивающих дозы побочных эффектов стала возможной благодаря двум основным открытиям: (i) синтезу (R)-прамипексола, который является чистым в пределах обнаружения, обсуждаемых в настоящем документе; и (ii) открытию того факта, что (R)-прамипексол обладает значительно меньшей аффинностью в отношении рецепторов дофамина, чем сообщалось ранее. Фармацевтическая композиция по настоящему изобретению может зависеть, в некоторых вариантах осуществления настоящего изобретения, от оптической чистоты (R)-прамипексола, используемого в композиции, или от ограниченной дофаминергической активности хирально чистого (R)-прамипексола, используемого в композиции, или от того и другого.
Прежде чем описывать настоящие композиции и способы, следует понять, что настоящее изобретение не ограничивается описанными конкретными способами, композициями или методиками, поскольку они могут меняться. Следует также понимать, что терминология, используемая в описании, предназначена только для описания конкретных версий или вариантов осуществления настоящего изобретения и не предназначена для ограничения объема настоящего изобретения, которое будет ограничиваться только прилагаемой формулой изобретения. Все публикации, упомянутые в настоящем документе, полностью включены в настоящий документ в качестве ссылки, до той степени, в которой они поддерживают настоящее изобретение.
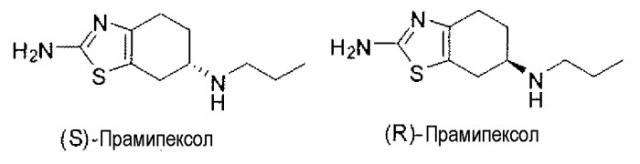
Соединение 2-амино-4,5,6,7-тетрагидро-6-(пропиламино)бензотиазол представляет собой синтетическое аминобензотиазольное производное, имеющее два энантиомера со структурами, показанными ниже. (S)-энантиомер представляет собой мощный агонист семейства дофаминовых рецепторов D2, с особой аффинностью в отношении подтипа рецепторов D3. В качестве агониста дофаминовых рецепторов (S)-прамипексол активирует дофаминовые рецепторы, имитируя, таким образом, эффекты нейротрансмиттера дофамина. Стереоизомер (S)-прамипексол представляет собой мощный агонист дофамина, лишь в очень малых необходимых суточных дозах и действительно переносимый пациентами. Оба энантиомера, как полагают, обладают нейропротективными свойствами за счет своей способности аккумулироваться в головном мозге, спинном мозге и митохондриях и, независимо от агонистической активности в отношении дофаминовых рецепторов, предположительно, посредством ингибирования перекисного окисления липидов, нормализации митохондриальной функции и/или детоксикации кислородных радикалов. Как таковые, указанные соединения могут быть пригодными в качестве ингибиторов каскадов клеточной гибели и утраты жизнеспособности, наблюдаемых при нейродегенеративных заболеваниях.
Степень, до которой введение молекулы имеет доказуемую фенотипическую активность, в основе которой лежит аффинность в отношении определенных рецепторов или других фармакологически эффективных белков, даже когда в основе активности лежат аффинности в отношении неизвестных мишеней, можно операционно определить с точки зрения того, вносит ли указанная активность положительный вклад (направленная активность) или отрицательный вклад (ненаправленная активность») в специфический и желательный терапевтический эффект. Для любой данной молекулы может быть теоретически идентифицирован ряд категорий ненаправленной активности, но направленная активность ограничена желательным терапевтическим эффектом. В той степени, которой указанные категории активности можно измерить и количественно охарактеризовать, или в которой можно осуществить сравнения с известными стандартами, можно вывести индекс активности для каждой из указанных категорий («эквивалент активности» или AE) и одно или более соотношений для сравнения направленной активности и ненаправленной активности, используемых для сравнения потенциальных соотношений риск-выгода у разных молекул.
В случае (R)-прамипексола две категории активности можно определить в данном контексте. Во-первых, активность, которая представляет собой агонистическую активность в отношении подгруппы человеческих дофаминовых рецепторов и результатом которой является поведенческий/токсикологический фенотип, представляет собой ненаправленную активность при большинстве нейродегенеративных расстройств. Указанная активность вызывает ограничивающие дозу побочные эффекты, возникающие в результате агонистической активности в отношении дофаминовых рецепторов, и для целей настоящего обсуждения может быть определена как эквивалент дофаминергической активности или DAE. В настоящей заявке термин «эквивалент дофаминергической активности» (DAE) будет относиться к средству измерения активности в отношении дофаминовых рецепторов, эквивалентной активности 1 мг (S)-прамипексола в отношении дофаминовых рецепторов. Например, доза (R)-прамипексола, имеющая DAE 0,01, будет обладать активностью в отношении дофаминовых рецепторов, которая эквивалентна активности 0,01 мг (S)-прамипексола. DAE также может относиться к ряду фармацевтических терминов, включая максимальную переносимую дозу (MTD), уровень, не вызывающий видимых неблагоприятных эффектов (NOAEL), и неэффективное дозовое количество, для ясности. Например, дозовое количество NOAEL для (S)-прамипексола, наиболее предпочтительно, составляет менее 0,05 мг. Это, в свою очередь, соответствует DAE менее 0,05. Дозовое количество (R)-прамипексола, имеющее DAE 0,01, будет, следовательно, менее DAE для наиболее предпочтительного дозового количества NOAEL (S)-прамипексола 0,05 мг. В некоторых вариантах осуществления настоящего изобретения DAE определяют измерением связывающей аффинности (IC50) или активности (EC50) для рецепторов D2 и/или D3 по отношению к тому же параметру для 1 мг (S)-прамипексола. В некоторых вариантах осуществления настоящего изобретения DAE определяют по связывающей аффинности или активности в отношении рецепторов D2. В некоторых вариантах осуществления настоящего изобретения DAE определяют по связывающей аффинности или активности в отношении рецепторов D3. В некоторых вариантах осуществления настоящего изобретения DAE определяют по связывающей аффинности в отношении рецепторов D2. В некоторых вариантах осуществления настоящего изобретения DAE определяют по связывающей аффинности в отношении рецепторов D3. В некоторых вариантах осуществления настоящего изобретения DAE определяют с использованием подходящего анализа in vitro, такого как анализ связывающей аффинности IC50 для рецепторов D2 или D3, как описано, например, в публикации Schneider, C.S.; Mierau, J., “Dopamine Autoreceptor Agonists: Resolution and Pharmacological Activity of 2,6-Diaminotetrahydrobenzothiazole and an Aminothiazole Analogue of Apomorphine”, (1987). J. Med. Chem. 30:494-498; или Wong, S.K.-F.; Shrikhande, A.V., S.K.-F. Wong, “Activation of Extracellular Signal-Regulated Kinase by Dopamine D2 and D3 Receptors”, (2003). Society for Neuroscience Abstracts. Указанная ненаправленная активность для (R)-прамипексола при нейродегенеративных расстройствах (не являющихся болезнью Паркинсона) будет направленной активностью для его энантиомера (S)-прамипексола, используемого для лечения PD и синдрома усталых ног.
Исследования авторов предполагают, что DAE для (R)-прамипексола гораздо ниже, чем могли оценить ранее. Например, исследования авторов показали, что связывающая аффинность для (R)-прамипексола в отношении дофаминовых рецепторов D2 и D3 приблизительно в 290 и в 649 раз ниже, чем для (S)-прамипексола, соответственно, при использовании (R)-прамипексола высокой хиральной чистоты. Для сравнения, в литературе сообщается о том, что связывающая аффинность для (R)-прамипексола в отношении дофаминовых рецепторов D2 приблизительно в 9-21 раз ниже, чем для (S)-прамипексола, в то время как связывающая аффинность для (R)-прамипексола в отношении дофаминовых рецепторов D3 приблизительно в 50 раз ниже, чем для (S)-прамипексола.
Еще более поразительно, исследования авторов на собаках породы бигль показали, что соотношение доз MTD (R)-прамипексола и (S)-прамипексола составляет 10000, в то время как соотношение доз NOAEL (R)-прамипексола и (S)-прамипексола составляет 20000. В качестве биологического анализа, MTD и NOAEL у собак выявляют переносимость in vivo, ранее полностью непредсказуемую. Ввиду ограничений стандартного и количественного анализа, in vivo MTD и NOAEL на собаках могут действительно предположить, что даже малейшая примесь в 0,005% может, фактически, быть ответственной за побочные эффекты, связанные с дофаминовой агонистической активностью. Указанные сравнительные исследования наводят на мысль о том, что DAE для (R)-прамипексола намного ниже, чем оценивалось ранее.
Другой активностью (R)-прамипексола и (S)-прамипексола является нейропротекция. Нейропротекция представляет собой явление, независящее от механизма, и, следовательно, квалифицируется как категория активности. Данная направленная активность (R)-прамипексола для лечения нейродегенеративных расстройств поддается измерению и является приблизительно эквивалентной у обоих энантиомеров, и она может быть определена в относительных значениях как эквивалент нейропротективной активности или NAE. Эквивалент нейропротективной активности (NAE) относится к нейропротективной активности, присущей 1 мг (S)-прамипексола. В отличие от DAE, величина NAE, как было показано, является равной у обоих энантиомеров прамипексола в ряде тестов in vitro. В данном примере DAE рассматривается как стандартная мера потенциальных неблагоприятных эффектов, в то время как NAE рассматривается как стандартная мера потенциальной терапевтической пользы. Для данного примера величины NAE как для (R)-прамипексола, так и для Mirapex®, можно определить по концентрациям, необходимым для получения нейропротекции в анализах in vitro.
В некоторых вариантах осуществления настоящего изобретения NAE можно определить измерением нейропротективной активности в стандартном нейропротективном анализе in vitro по отношению к активности 1 мг (S)-прамипексола. В некоторых вариантах осуществления настоящего изобретения нейропротективную активность определяют измерением клеточной гибели в присутствии МРР+ и/или ротенона на дофаминергических и/или недофаминергических клетках (в качестве неограничивающего примера см. анализ в M. Gu, Journal of Neurochemistry, 91:1075-1081 (2004)).
Предпочтительной целью настоящего изобретения является получение максимальных NAE, доставляемых пациенту, при минимизации количества эквивалентов активности, предполагающих неблагоприятные события, в данном случае, DAE.
(S)-прамипексол имеет высокое соотношение DAE/NAE благодаря высокой дофаминовой аффинности, в то время как соответствующее соотношение для (R)-прамипексола значительно ниже. С практической точки зрения варианты осуществления настоящего изобретения обеспечивают значительно более высокие уровни NAE и более высокие уровни NAE/DAE, чем полагали ранее, обеспечивая максимальную вероятность того, что терапевтически эффективное дозовое количество нейропротектора можно вводить нуждающемуся в этом пациенту. NAE и DAE могут быть полезными с точки зрения соотношения, особенно в качестве соотношения благоприятных и неблагоприятных эффектов, и пригодными для определения пределов, в которых можно вводить конкретную композицию.
Дозы (S)-прамипексола, однако, ограничены дофаминергической активностью (S)-энантиомера, которая может вызывать неблагоприятные побочные эффекты в дозах, превышающих «уровень, не вызывающий видимых неблагоприятных эффектов» (дозовое количество NOAEL). Доза NOAEL, используемая в настоящем документе, относится к количеству активного соединения или фармацевтического агента, которое не вызывает статистически или биологически значимых увеличений частоты или тяжести неблагоприятных эффектов при сравнении популяции, получающей лечение, и соответствующего контроля; некоторые эффекты могут возникать на данном уровне, но они не рассматриваются как неблагоприятные или как предшественники неблагоприятных эффектов. Популяцией, получающей лечение, может быть система, ткань, животное, индивидуум или человек, которым проводит лечение исследователь, ветеринар, врач или другой клиницист. Что касается (S)-прамипексола, примерами неблагоприятных событий являются головокружение, галлюцинации, тошнота, гипотензия, сонливость, запор, головная боль, тремор, боль в спине, постуральная гипотензия, гипертония, депрессия, боль в животе, тревожность, диспепсия, метеоризм, диарея, сыпь, атаксия, сухость во рту, экстрапирамидный синдром, судороги в ногах, подергивания мышц, фарингит, синусит, потливость, ринит, инфекция мочевыводящих путей, вазодилатация, гриппозный синдром, повышенное слюноотделение, заболевание зубов, одышка, кашель, нарушения походки, учащенное мочеиспускание, рвота, аллергическая реакция, гипертензия, зуд, гипокинезия, нервозность, нарушения сна, боль в груди, боль в шее, парестезия, тахикардия, вертиго, изменение голоса, конъюнктивит, паралич, шум в ушах, слезотечение, мидриаз и диплопия.
Например, доза 1,5 мг (S)-прамипексола, как было показано, вызывает сонливость у людей (публичное заявление по Mirapex®, внезапное засыпание, от европейского агентства по оценке медицинских продуктов; вкладыш для Mirapex®, продукта Boehringer Ingelheim, который указывает, что лекарственное средство вводят в виде трех доз в день). Кроме того, проведенные на собаках исследования, как представлено в настоящем документе (см. примеры и результаты, представленные в таблице 11), показывают, что доза NOAEL может составлять всего 0,00125 мг/кг, что эквивалентно дозе для человека 0,0007 мг/кг или 0,05 мг для индивидуума с массой тела 70 кг. Таким образом, что касается (S)-прамипексола, дозовое количество NOAEL может представлять собой количество менее 1,5 мг, менее 0,50 мг или, более предпочтительно, менее 0,05 мг. Что касается DAE, как определено в настоящем документе, доза NOAEL может иметь DAE менее 1,5, менее 0,5 или, более предпочтительно, менее 0,05.
Как правило, количество, превышающее неэффективное дозовое количество (S)-прамипексола, является необходимым для получения терапевтического эффекта при лечении заболеваний, облегчаемых дофаминовой агонистической активностью. Указанное количество, однако, может быть нежелательным, если добиваются нейропротективного эффекта, поскольку оно может вызывать описанные неблагоприятные побочные эффекты. Термин «неэффективное дозовое количество», используемый в настоящем документе, относится к количеству активного соединения или фармацевтического агента, которое вызывает биологический или лечебный ответ, сходный с биологическим или лечебным ответом на плацебо, наблюдаемый в ткани, системе, у животного, индивидуума или человека, которым проводит лечение исследователь, ветеринар, врач или другой клиницист. «Неэффективное дозовое количество» не может, таким образом, вызывать заметные отличия от плацебо по положительным эффектам, наблюдаемым в ткани, системе, у животного, индивидуума или человека, которым проводит лечение исследователь, ветеринар, врач или другой клиницист. Как таковое, «неэффективное дозовое количество» не предусмотрено для (1) профилактики заболевания; например, профилактики заболевания, состояния или расстройства у индивидуума, который может быть предрасположен к заболеванию, состоянию или расстройству, но до сих пор не ощущал и не демонстрировал патологии или симптоматики заболевания; (2) ингибирования заболевания; например, ингибирования заболевания, состояния или расстройства у индивидуума, который ощущает или демонстрирует патологию или симптоматику заболевания, состояния или расстройства (т.е. приостановки или замедления дальнейшего развития патологии и/или симптоматики) или (3) облегчения заболевания; например, облегчения заболевания, состояния или расстройства у индивидуума, который ощущает или демонстрирует патологию или симптоматику заболевания, состояния или расстройства (т.е. обратного развития или уменьшения патологии и/или симптоматики).
В качестве примера, у обезьян, которых лечили с использованием MPTP (1-метил-4-фенил-1,2,3,6-тетрагидропиридина), известного дофаминергического нейротоксина, (S)-прамипексол, как было показано, противостоит моторным дефицитам и паркинсоноподобным симптомам дозозависимым образом, при самой низкой эффективной пероральной дозе 0,053 мг/кг (см. научное обсуждение на http://www.emea.europa.eu/humandocs/PDFs/EPAR/Sifrol/059197EN6.pdf). Это должно быть эквивалентным дозе для человека 0,017 мг/кг, или 1,2 мг для индивидуума с массой тела 70 кг. В испытаниях на людях самая низкая эффективная пероральная доза (S)-прамипексола со значимым эффектом по сравнению с плацебо при лечении болезни Паркинсона составляла, как было показано, 1,1 мг/день. Отдельным пациентам могут потребоваться дозы, превышающие 1,1 мг/день, для получения эффектов, превышающих эффект плацебо (первоначальная научная дискуссия по разрешению использования Mirapex в европейском агентстве по оценке медицинских продуктов). В испытаниях на людях самая низкая эффективная пероральная доза со значимым эффектом по сравнению с плацебо при лечении синдрома усталых ног составляла, как было показано, 0,25 мг/день (вкладыш для Mirapex®, продукта Boehringer Ingelheim). Таким образом, по отношению к (S)-прамипексолу неэффективное дозовое количество может представлять собой количество менее 1,0 мг/день, менее 0,75 мг/день, менее 0,5 мг/день, менее 0,25 мг/день или, предпочтительно, менее 0,125 мг/день. Что касается DAE, неэффективное дозовое количество в день может иметь DAE в день менее 1,0, менее 0,75, менее 0,5, менее 0,25 или, предпочтительно, менее 0,125.
Другие ограничения для количества (S)-прамипексола, которое можно вводить пациенту, также включают максимальную рекомендованную терапевтическую дозу и максимальную переносимую дозу. «Максимальная рекомендованная терапевтическая доза» (MRTD) относится к дозам, приведенным центром FDA по оценке и исследованиям лекарственных средств, бюро фармацевтической науки, информатики и вычислительному анализу Staff безопасности максимальной рекомендованной терапевтической дозы, и описанным в Matthews, et al., “Assessment of the Health Effects of Chemicals in Humans: I. QSAR Estimation of the Maximum Recommended Therapeutic Dose (MRTD) and No Effect Level (NOEL) of Organic Chemicals Based on Clinical Trial Data”, Current Drug Discovery Technologies, 2004, 1:61-76). В базе данных FDA по MRTD приведены MRTD для (S)-прамипексола 0,1 мг/кг/день или 7,0 мг/день для индивидуума с массой тела 70 фунтов. Matthews, в свою очередь, доказывает, что NOEL (уровень отсутствия неблагоприятных эффектов) обычно составляет приблизительно одну десятую от MRTD, что соответствует 0,01 мг/кг или приблизительно 0,7 мг/день для индивидуума с массой тела 70 фунтов.
Ввиду своего неблагоприятного влияния на пациентов, не подвергавшихся ранее лечению, (S)-прамипексол следует титровать в течение нескольких недель, чтобы добиться указанных доз без ограничивающих дозу неблагоприятных эффектов (таких, которые описаны в документации во вкладыше для Mirapex®, продукта Boehringer Ingelheim). Например, при синдроме усталых ног рекомендованная начальная суточная доза Mirapex® составляет 0,125 мг один раз в день за 2-3 часа перед отходом ко сну. Для пациентов, требующих дополнительного облегчения симптомов, суточную дозу можно увеличить до 0,25 мг в течение периода 4-7 дней, а затем до 0,5 мг в течение еще одного периода в 4-7 дней. Для лечения болезни Паркинсона на вкладыше в упаковке рекомендована следующая схема титрования для Mirapex®:
| Неделя | Доза (мг) | Суммарная суточная доза (мг) |
| 1 | 0,125 tid | 0,375 |
| 2 | 0,25 tid | 0,75 |
| 3 | 0,5 tid | 1,5 |
| 4 | 0,75 tid | 2,25 |
| 5 | 1,0 tid | 3,0 |
| 6 | 1,25 tid | 3,75 |
| 7 | 1,5 tid | 4,5 |
Термин «максимальная переносимая доза» (MTD), используемый в настоящем документе, относится к количеству активного соединения или фармацевтического агента, которое вызывает значимую токсичность в ткани, системе, у животного, индивидуума или человека, которым проводит лечение исследователь, ветеринар, врач или другой клиницист. Токсичность однократной дозы (S)-прамипексола после перорального введения изучали на грызунах, собаках, обезьянах и людях. У грызунов смерть наступала при дозах 70-105 мг/кг и выше (первоначальная научная дискуссия по разрешению использования Mirapex в европейском агентстве по оценке медицинских продуктов). Это эквивалентно дозе для человека 7-12 мг/кг или приблизительно 500-850 мг для индивидуума с массой тела 70 кг. В случае испытаний на людях начальная суточная доза (S)-прамипексола, превышающая 0,20 мг, была непереносимой, когда ее вводили пациенту, ранее не подвергавшемуся лечению. У собак наблюдалась рвота при 0,0007 мг/кг и выше, в то время как у обезьян наблюдалось возбуждение при 3,5 мг/кг. Кроме того, вкладыш для продукта Mirapex® предписывает максимальную переносимую дозу для людей 4,5 мг/день, вводимую тремя однократными дозами по 1,5 мг. Однако дозу 4,5 мг/день не вводят пациенту, ранее не подвергавшемуся лечению, но, вместо этого, она достигается после схемы титрования (такой как описано в документации во вкладыше для продукта Mirapex®). В общем, начальная суточная доза для введения пациенту, ранее не подвергавшемуся лечению, составляет 0,125 мг, которую вводят три раза в день, и рекомендуется семинедельная схема титрования для достижения дозы 1,5 мг, которую вводят три раза ежедневно. У всех видов наблюдались признаки токсичности, связанные с повышенными фармакодинамическими ответами на (S)-прамипексол. Например, изменения поведения, включая гиперактивность, были широко распространены и приводили к ряду вторичных эффектов, таких как уменьшение массы тела и другие индуцированные стрессом симптомы. У минипигов и обезьян (S)-прамипексол умеренно влиял на сердечно-сосудистые параметры. У крыс мощный ингибирующий пролактин эффект прамипексола оказывал влияние на органы размножения (например, увеличенное corpora lutea, пиометра), и демонстрировал дозозивисимую дегенерацию сетчатки во время длительного воздействия (первоначальная научная дискуссия по разрешению использования Mirapex в европейском агентстве по оценке медицинских продуктов). Исследования на собаках показали, что количество MTD (S)-прамипексола может представлять собой количество менее 4,5 мг/день, предпочтительно менее 1,5 мг/день. Кроме того, количество MTD для человека может представлять собой количество менее 0,3 мг на дозу, на основании результатов исследований, описанных в настоящем документе, и, предпочтительно, менее 0,2 мг на дозу (см. таблицу 11). Что касается DAE, то количество MTD может иметь DAE ниже 1,5, ниже 0,3 или ниже 0,2.
При данных ограничениях количества (S)-прамипексола, которое можно вводить пациенту, применение вариантов осуществления настоящего изобретения представляет клинически важную альтернативу для разработки новых нейропротективных лекарственных средств. В литературе ранее сообщалось, что связывающая аффинность (R)-прамипексола в отношении рецепторов D2 приблизительно в 9-21 раз меньше таковой для (S)-прамипексола, в то время как связывающая аффинность (R)-прамипексола в отношении рецепторов D3 приблизительно в 50 раз меньше таковой для (S)-прамипексола (таблица 10). Указанные полученные из литературы сравнительные соотношения связывающей активности позволяют предположить, что (R)-прамипексол можно вводить только в несколько более высоких дозах по сравнению с (S)-прамипексолом. Указанное ограничение может иметь место в связи с тем, что сильная чувствительность тканей, систем, животных и человека к эффектам дофаминового агонизма будет препятствовать применению (R)-прамипексола в дозах, которые превышают переносимые дозы (S)-прамипексола на множитель, превышающий полученные из литературы сравнительные соотношения связывающей активности двух энантиомеров.
Кажущееся препятствие более высоких доз (R)-прамипексола можно продемонстрировать в отношении теоретической таблетки 50 мг. Предполагая 9-кратную разницу в величинах связывающей аффинности, таблетка 50 мг, которая является чистой на 99,95%, должна иметь DAE приблизительно 5,575 (5,55 DAE от (R)-прамипексола и 0,025 DAE от (S)-прамипексола). Аналогично, таблетка 25 мг, как ожидается, будет демонстрировать DAE 2,79 (2,78 от (R)-прамипексола и 0,0125 DAE от (S)-прамипексола). MTD (S)-прамипексола после семинедельной схемы титрования составляет 4,5 мг или 1,5 мг три раза в день, что эквивалентно 4,5 DAE в день или 1,5 DAE однократной дозой. Кроме того, дозовое количество NOAEL для (S)-прамипексола составляет менее 1,5 мг, предпочтительно, менее 0,50 мг или, более предпочтительно, менее 0,05 мг, которые эквивалентны 1,5 DAE, 0,5 DAE и 0,05 DAE, соответственно. Учитывая, что однократная доза MTD для (S)-прамипексола имеет 1,5 DAE, а NOAEL (S)-прамипексола имеет менее приблизительно 1,5 DAE, однократная доза 50 мг с DAE 5,55 и однократная доза 25 мг с DAE 2,79 должны быть устранены, если обращаться только к полученным из литературы сравнительным соотношениям связывающей аффинности. Кроме того, применение высокой хиральной чистоты 99,95%, которая используется в указанных теоретических дозах, должно приводить к неприемлемо высоким величинам DAE 5,55 и 2,79 свыше однократной дозы MTD DAE 1,5 мг, и намного выше предпочтительных величин NOAEL 0,5 DAE и 0,05 DAE.
Напротив, в некоторых вариантах осуществления, аспект настоящего изобретения включает неожиданно высокие величины хиральной чистоты, которые были получены. Указанные величины чистоты дают значения MTD или NOAEL для (R)-прамипексола, которые выше ранее оцененных величин, полученных на основании литературных сравнительных значений связывающей аффинности. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтическим композициям, начальным дозам, способу лечения и наборам, включающим (R)-прамипексол высокой хиральной чистоты. В соответствии с приведенным выше обсуждением можно прогнозировать, что доза 25 мг со сходной хиральной чистотой 99,95% будет значительно превышать MTD или NOAEL для (S)-прамипексола и, следовательно, вызывать видимые неблагоприятные побочные эффекты. Исследования на собаках, однако, позволяют предположить, что (R)-прамипексол высокой хиральной чистоты обеспечивает дозовые количества NOAEL, неожиданно отличающиеся от оцененных ранее (таблица 10). Невероятно, но доза 25 мг/кг (R)-прамипексола, не содержащего обнаруживаемого количества (S)-прамипексола (0,05% граница обнаружения), не вызывала видимых эффектов у собак, что является неожиданным, если принимать во внимание литературные данные по связывающей аффинности.
Кроме того, исследования на собаках показали высокую (приближающуюся к абсолютной) хиральную чистоту композиций прамипексола для (R)-энантиомера. (R)-прамипексол вводят в высоких дозах в исследованиях, описанных в настоящем документе (эквивалентных дозам для человека от 1000 мг до 3000 мг; см. примеры), так что даже наименьшее количество (S)-прамипексола должно вносить свой вклад в наблюдаемые NOAEL и MTD. Например, что касается эквивалентных доз для человека, то на основании данных, полученных на собаках, MTD для (R)-энантиомера, как было показано, эквивалентна приблизительно 3000 мг для человека с массой тела 70 кг, в то время как эквивалентная MTD для (S)-энантиомера будет эквивалентна лишь 0,30 мг для указанного субъекта (таблица 11). Это представляет собой разницу в 10000 раз. Доза NOAEL для (R)-энантиомера в 20000 раз выше, чем для (S)-энантиомера (таблица 11). Таким образом, композиции (R)-прамипексола, использованные в настоящем исследовании, должны быть по меньшей мере на 99,99% чистыми, если допускается, что наблюдавшиеся побочные эффекты являются результатом лишь загрязнения (S)-энантиомером. С другой стороны, приведенные данные демонстрируют высокие уровни доз (R)-энантиомера прамипексола, которые можно вводить безопасно. Приведенные данные подчерки