Sparc-связующие пептиды и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к генно-инженерным композициям для доставки терапевтического агента в область опухоли пациента, и может быть использовано в медицине. Композиция включает терапевтически эффективное количество фармацевтической композиции из функционального фрагмента Fc домена антитела, соединенного с одним или более SPARC-связывающим полипептидом (SBP), и фармацевтически приемлемого носителя. Композицию используют в способе доставки терапевтического агента, включающего функциональный фрагмент Fc домена антитела. Изобретение обеспечивает эффективную доставку терапевтического агента к области опухоли, экспрессирующей SPARC, у млекопитающего. 2 н. и 10 з.п. ф-лы, 16 ил., 4 пр.
Реферат
ПРИОРИТЕТНОЕ ТРЕБОВАНИЕ
Данная заявка испрашивает приоритет предварительной заявки США № 61/120228, поданной 5 декабря 2008 г., полное содержание которой включено в данное описание посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Секретируемый белок, кислый, обогащенный цистеинами (SPARC), также известный как остеонектин, представляет собой гликопротеин из 303 аминокислот, который экспрессируется в организме человека. Экспрессия SPARC регулируется онтогенетически с преимущественной экспрессией SPARC в тканях, подвергающихся ремоделированию в процессе нормального развития или в ответ на повреждение. Смотри, например, Lane et al., FASEB J., 8, 163-173 (1994). Например, высокие уровни белка SPARC экспрессируются в развивающихся костях и зубах, прежде всего в остеобластах, одонтобластах, околохрящевых фибробластах и дифференцирующихся хондроцитах мыши, крупного рогатого скота и эмбрионов человека. SPARC также играет важные роли в клетка-матриксных взаимодействиях в процессе ремоделирования ткани, заживления ран, морфогенеза, клеточной дифференцировки, клеточной миграции и ангиогенеза, включая те процессы, которые ассоциированы с болезненными состояниями. Например, SPARC экспрессируется в почечном интерстициальном фиброзе и играет роль в ответе хозяина на легочные инсульты, такие как индуцированный блеомицином легочный фиброз.
SPARC дифференциально экспрессируется в опухолях и окружающей их строме при различных злокачественных опухолях по сравнению с нормальной тканью с паттерном, зависящим от типа рака. Таким образом, отсутствует унифицированная модель, которая объясняет все аспекты его функции и содействие развитию и прогрессии рака. В одном примере было сообщено об увеличенной экспрессии SPARC в раке молочной железы (Bellahcene and Castronovo, 1995; Jones et al., 2004; Lien et al., 2007; Porter et al., 1995), меланоме (Ledda et al., 1997a) и глиобластомах (Rempel et al., 1998). Увеличенная экспрессия SPARC играет роль в опухолевой промоции или прогрессии этих злокачественных опухолей.
В связи с этим сверхэкспрессия SPARC в воспалении и в некоторых злокачественных опухолях делает SPARC потенциальной мишенью диагностики и терапии.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом («SBP») и фармацевтически приемлемым носителем («изобретательские композиции») включительно, где SBP включает один или несколько SEQ ID NOs:1-117.
Особенно предпочтительные варианты осуществления по изобретению включают, например, изобретательские композиции для доставки терапевтического агента в область заболевания млекопитающего, включающие один или несколько SBP, где терапевтический агент представляет собой антительный фрагмент, включающий функциональный антительный Fc домен включительно, например, где функциональный антительный Fc домен включает SEQ ID NO:118.
Дополнительные предпочтительные варианты осуществления по изобретению включают изобретательские композиции для доставки терапевтического или диагностического агента в область заболевания в композиции для млекопитающего, например, где SBP включает: по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117. Предпочтительно SBP может включать по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117. Другие варианты осуществления по изобретению включают композиции, например, где имеются два или несколько отдельных SBP, где каждый индивидуальный SBP включает по меньшей мере 10 последовательных аминокислот из любого одного SEQ ID NOs:1-112 и 117, предпочтительно любого одного или нескольких SEQ ID NOs:1-5. Варианты осуществления по изобретению включают композиции, например, где имеются два или несколько отдельных SBP, где индивидуальные SBP включают один или несколько SEQ ID NOs:1-117.
Изобретение также предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный с SBP, фармацевтически приемлемый носитель и фармацевтически приемлемый носитель, далее включающий альбумин-связывающий пептид («ABP»), где ABP включает SEQ ID NO:119 или SEQ ID NO:120 или оба SEQ ID NOs:119 и 120. Такие композиции включают [состав], где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах.
Изобретение далее предоставляет способы доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом и фармацевтически приемлемым носителем («изобретательские способы»), где SBP включает один или несколько SEQ ID NOs:1-117. Предпочтительные варианты осуществления по изобретению включают изобретательские способы, где композиции, например, где SBP, включает: по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117, более предпочтительно из любого одного или нескольких SEQ ID NOs:1-5 и 117.
Другие предпочтительные варианты осуществления по изобретению включают изобретательские способы, например, где имеются два или несколько отдельных SBP, где индивидуальные SBP включают один или несколько SEQ ID NOs:1-117. Изобретение также предоставляет изобретательские способы, где имеются два или несколько отдельных полипептидов, каждый включающий по меньшей мере один SBP, и где SBP включают по меньшей мере 10 последовательных аминокислот из любого одного SEQ ID NOs:1-112.
Особенно предпочтительные изобретательские способы включают композиции, например, в которых терапевтический агент представляет собой антительный фрагмент, включающий функциональный антительный Fc домен, такие, где антительный фрагмент включает SEQ ID NO:118. Такие способы в соответствии с изобретением включают, например, способы, в которых терапевтический агент представляет собой антительный фрагмент, который опосредует одну или несколько активаций комплемента, опосредованную клеткой цитотоксичность, индуцированный апоптоз, индуцированную клеточную гибель и опсонизацию.
Изобретательские способы, предоставляемые изобретением, также включают связывающие сывороточный альбумин пептиды («ABP»), включающие SEQ ID NOs:119 или 120 или оба SEQ ID NOs:119 и 120. Способы в соответствии с изобретением далее включают, например, способы, где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах. Однако SBP может также включать по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112.
Изобретательские композиции и предоставляемые изобретательские способы могут быть использованы там, где область заболевания представляет собой опухоль и где млекопитающим является человек-пациент.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ЧЕРТЕЖЕЙ
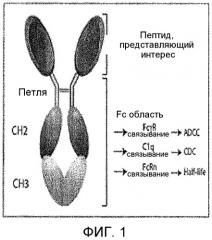
Фиг.1 показывает общий принцип слияния связывающего пептида с терапевтическим или диагностическим агентом. В примере, показанном в этом чертеже, терапевтический агент представляет собой антительный Fc домен.
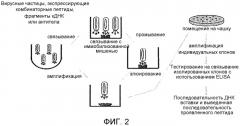
Фиг.2 показывает общую стратегию итеративного скрининга библиотеки фагового дисплея.
Фиг.3 показывает последовательности, идентифицированные после скрининга пептидной библиотеки фагового дисплея на связывание со SPARC определенное число раз, последовательность изолируется.
Фиг.4 показывает последовательности, идентифицированные после скрининга пептидной библиотеки фагового дисплея на связывание со SPARC посредством авидности связывания со SPARC (как указано посредством OD).
Фиг.5 показывает клонирование пептида пептидов PD15 или PD21 в вектор pFUSE-hIgG1-Fc с получением PD15 или PD21 Fc слитого белка.
Фиг.6 демонстрирует последовательность ДНК, полученную в результате клонирования последовательностей, кодирующих пептид 15 и пептид 21 в вектор pFUSE-hIgG1-Fc, кодирующий слитые белки пептид-Fc.
Фиг.7 показывает экспрессированные и очищенные слитые белки PD15-Fc и PD21-Fc при электрофорезе в полиакриламидном геле.
Фиг.8 показывает Проточип, используемый для определения отдаленных мишеней связывания PD15 и PD21.
Фиг.9 представляет собой график анализов связывания ELISA [фермент-связанный иммуносорбентный анализ], сравнивающий авидность связывания SPARC при посредстве PD15 и PD21 с авидностью связывания анти-SPARC антитела.
Фиг.10 представляет микрофотографии иммуногистологических исследований, выполненных на срезах опухоли человека, демонстрирующих опухолевую экспрессию SPARC с использованием анти-SPARC антитела (R&D Анти SPARC). Отрицательный контроль анти-Герцептиновое антитело (только Fc фрагмент) и слитый белок Стаблин-связывающий пептид-Fc (stab-Fc) не окрашивают опухоль.
Фиг.11 показывает гистологическое окрашивание экспрессирующей SPARC опухоли, демонстрируя связывание PD15 и PD21 с экспрессирующими SPARC клетками опухоли.
Фиг.12 показывает потенциальный сайт связывания SPARC на эластине.
Фиг.13 показывает противоопухолевую активность PD15 и PD21 в раковой опухоли предстательной железы человека/модельной системе голой мыши.
Фиг.14 показывает противоопухолевую активность PD15 и PD21 в раковой опухоли молочной железы человека/модельной системе голой мыши.
Фиг.15 показывает два полипептида svFc, ScFv 3-1 и ScFv 3-2 со SPARC-связывающей активностью.
Фиг.16 показывает два полипептида svFc, ScFv 2-1 и ScFv 2-2 со SPARC-связывающей активностью.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
SBP и ABP представляют собой «пептидные лигандные домены». Термин «пептидный лигандный домен» означает аминокислотную последовательность, которая может существовать сама по себе и/или в большей полипептидной последовательности и которая связывает другую биомолекулу со специфичностью. Например, основная транспортная система крови для жирных кислот, билирубина, триптофана, кальция, стероидных гормонов и других физиологически важных соединений вовлекает связывание этих биомолекул с сывороточным альбумином. Связывание этих биомолекул происходит в дискретных сайтах в аминокислотных последовательностях альбумина, т.е. в пептидных лигандных доменах в сывороточном альбумине.
Изобретение предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом («SBP») и фармацевтически приемлемым носителем («изобретательские композиции» и «изобретательские способы»). Настоящее изобретение включает композиции и способы, где SBP включает пептид с последовательностью любого одного или нескольких SEQ ID NOs:1-117, более желательно любого одного или нескольких SEQ ID NOs:1-5 или одного или нескольких гомологов любого одного из SEQ ID NOs:1-117.
Термин «гомолог» означает полипептид, имеющий существенно сходную аминокислотную последовательность с первоначальной последовательностью и проявляющий релевантные свойства, которые существенно сходны со свойствами, проявляемыми первоначальной последовательностью. Иллюстрацией одного из таких свойств является способность модулировать тканевое распределение активного агента, где гомолог SEQ ID NOs:1-117 был бы способен обеспечить существенно сходный уровень модуляции с уровнем, предоставляемым SEQ ID NOs:1-117. В этом контексте, например, и при желании гомолог SEQ ID NOs:1-117, проявляющий такую существенно сходную модуляцию, обеспечивал бы уровень в крови активного агента по меньшей мере примерно 80%, предпочтительно по меньшей мере примерно 85%, более предпочтительно по меньшей мере примерно 90% и наиболее предпочтительно по меньшей мере примерно 95% относительно уровня, предоставляемого SEQ ID NOs:1-117. Альтернативно, термин «гомолог» также относится к, например, пептидной последовательности из по меньшей мере 6 последовательных аминокислот, предпочтительно по меньшей мере 7 последовательных аминокислот, более предпочтительно по меньшей мере 8 последовательных аминокислот, даже более предпочтительно по меньшей мере 9 последовательных аминокислот, наиболее предпочтительно по меньшей мере 10 последовательных аминокислот любой одной из SEQ ID NOs:1-112 и наиболее желательно любой одной или нескольких SEQ ID NOs:1-5.
Композиции и способы, предоставляемые по изобретению, также включают ABP, включающие SEQ ID NOs:119 или 120, или оба SEQ ID NOs:119 и 120, и их гомологи. Способы в соответствии с изобретением далее включают, например, оба [белка], где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах.
В контексте изменений относительно первоначальной последовательности будет желательно, если гомолог первоначальной последовательности по меньшей мере примерно на 80% идентичен первоначальной последовательности, предпочтительно по меньшей мере примерно на 90% идентичен первоначальной последовательности, даже более предпочтительно по меньшей мере примерно на 95% идентичен первоначальной последовательности и наиболее предпочтительно по меньшей мере примерно на 99% идентичен первоначальной последовательности.
Как использовано в данном описании, «процент идентичности последовательностей» означает значение, определенное путем сравнения двух оптимально выровненных последовательностей в пределах окна сравнения. Дополнительно часть полипептидной последовательности в окне сравнения может включать добавления или делеции (т.е. бреши) по сравнению с эталонной последовательностью (которая не включает добавления или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определения числа положений, в которых идентичные аминокислотные остатки встречаются в обеих последовательностях, с получением определенного числа положений спаривания, деления числа положений спаривания на общее число положений в окне сравнения и умножения полученного результата на 100 с получением процента идентичности последовательностей. Предпочтительно оптимальное выравнивание проводится с использованием алгоритма гомологичного выравнивания Needleman и Wunsch (1970) J. Mol Biol. 48:443 453.
Также желательно, чтобы в случае, когда гомологи не содержат идентичных аминокислот, мутации приводят только к консервативным аминокислотным изменениям. В связи с этим положения остатков, которые не являются идентичными, отличаются, так что аминокислотные остатки замещаются на другие аминокислотные остатки со сходными химическими свойствами (например, заряд или гидрофобность) и поэтому не изменяют функциональные свойства молекулы. В случае если последовательности отличаются по консервативным заменам, процент идентичности последовательностей может быть отрегулирован в сторону увеличения коррекцией консервативной природы замены. Говорят, что последовательности, которые отличаются по таким консервативным заменам, проявляют «сходство последовательностей» или «сходство». Средства для проведения этой регулировки хорошо известны специалистам в данной области.
Затем далее приводится пример для понимания «консервативной» аминокислотной замены или изменения в контексте настоящего изобретения. Группы A-F перечислены ниже. Замещение одного члена следующих групп другим членом этой же группы считается «консервативной» заменой.
Группа A включает лейцин, изолейцин, валин, метионин, фенилаланин, серин, цистеин, треонин и модифицированные аминокислоты, имеющие следующие боковые цепи: этил, изобутил, -CH2CH2OH, -CH2CH2CH2OH, -CH2CHOHCH3 и CH2SCH3.
Группа B включает глицин, аланин, валин, серин, цистеин, треонин и модифицированную аминокислоту, имеющую этил боковой цепи.
Группа C включает фенилаланин, фенилглицин, тирозин, триптофан, циклогексилметил и модифицированные аминоостатки, имеющие замещенные бензил или фенил боковых цепей.
Группа D включает глутаминовую кислоту, аспарагиновую кислоту, замещенный или незамещенный алифатический, ароматический или бензиловый сложный эфир глутаминовой или аспарагиновой кислоты (например, метил, этил, н-пропил, изо-пропил, циклогексил, бензил или замещенный бензил), глутамин, аспарагин, CO-NH-алкилированный глутамин или аспарагин (например, метил, этил, н-пропил и изо-пропил), и модифицированные аминокислоты, имеющие боковую цепь -(CH2)3COOH, ее сложный эфир (замещенный или незамещенный алифатический, ароматический или бензиловый сложный эфир), ее амид и ее замещенный или незамещенный N-алкилированный амид.
Группа E включает гистидин, лизин, аргинин, N-нитроаргинин, п-циклоаргинин, г-гидроксиаргинин, N-амидиноцитрулин, 2-амино гуанидиномасляную кислоту, гомологи лизина, гомологи аргинина и орнитин.
Группа F включает серин, треонин, цистеин и модифицированные аминокислоты, имеющие C1-C5 прямые или разветвленные алкильные боковые цепи, замещенные с использованием -OH или -SH.
Изобретение далее предоставляет композиции, включающие конъюгированную молекулу; конъюгированная молекула включает пептидный лигандный домен, конъюгированный с активным агентом, где пептидный лигандный домен включает вплоть до дополнительно примерно 50 аминокислот, предпочтительно вплоть до дополнительно примерно 25 аминокислот, более предпочтительно вплоть до дополнительно примерно 15 аминокислот и наиболее предпочтительно вплоть до дополнительно примерно 10 аминокислот, добавленных к N- или C-концу или к обоим концам. Полученные в результате полипептиды, которые находятся в соответствии с изобретением, включают полипептиды, которые имеют менее чем 50, менее чем 40, менее чем 30, менее чем 25 или менее чем 20 аминокислот общей длины.
Изобретение далее предоставляет композиции, включающие конъюгированную молекулу; конъюгированная молекула включает SBP, конъюгированный с активным агентом, где имеются один или множество SBP, включающих любой один из SEQ ID NOs:1-137, 141-143 и наиболее желательно любой один или несколько из SEQ ID NOs:1-2 и 135-137, 141-143.
Изобретение далее предоставляет изолированные полинуклеотиды, которые кодируют полипептиды, имеющие аминокислотную последовательность пептидного лиганд-связывающего домена, включая полипептиды с указанной дополнительной аминокислотой, добавленной к N- или C-концу.
II. Способы получения пептидов в соответствии с изобретением
Содержащие пептидный лигандный домен полипептиды, предоставляемые настоящим изобретением, могут быть синтезированы, определены, количественно проанализированы и очищены с использованием известных методик. Например, клетки, экспрессирующие экзогенные, содержащие пептидный лигандный домен полипептиды, могут быть генерированы путем помещения кДНК под контроль сильного промотора/сайта инициации трансляции и вектора, трансфицирующего или трансформирующего приемлемые прокариотические или эукариотические клетки для запуска экспрессии содержащих пептидный лигандный домен полипептидов посредством методов, хорошо известных специалистам в данной области. Альтернативно, содержащие пептидный лигандный домен полипептиды могут быть получены химически посредством методов, хорошо известных специалистам в данной области.
Содержащие пептидный лигандный домен полипептиды могут быть получены путем стандартного твердофазного синтеза. Как общеизвестно, пептиды необходимой длины могут быть получены с использованием коммерчески приемлемого оборудования и реагентов, следуя инструкциям по получению для блокирования мешающих групп, защиты аминокислоты для вступления в реакцию, соединения, снятия защитных групп и кепирования непрореагировавших остатков. Приемлемое оборудование может быть получено, например, от Applied BioSystems, Фостер Сити, Калифорния или от BioSearch Corporation в Сан-Рафаэль, Калифорния.
Например, пептиды синтезируются с использованием протоколов стандартного автоматизированного твердофазного синтеза с применением т-бутоксикарбонил-альфа-аминокислот с соответствующей защитой боковой цепи. Полные пептиды удаляются с твердофазной подложки с одновременным снятием защиты боковой цепи с использованием стандартного метода на основе водород фторида. Неочищенные пептиды далее очищают посредством полупрепаративной обращенно-фазовой ВЭЖХ (Vydac C18) с использованием градиентов ацетонитрила в 0,1% трифторуксусной кислоте (TFA). Пептиды сушат в вакууме с удалением ацетонитрила и лиофилизируют из раствора 0,1% TFA в воде. Чистоту проверяют посредством аналитической обращенно-фазовой ВЭЖХ. Пептиды могут быть лиофилизированы и затем солюбилизированы в воде или в 0,01 М уксусной кислоте в концентрациях 1-2 мг/мл по массе.
Использование вышеупомянутых синтетических методов требуется, если в пептидах встречаются некодируемые аминокислоты или D-формы аминокислот. Однако пептиды, которые кодируются генами, могут быть также получены посредством рекомбинантных методик с использованием легкосинтезируемых последовательностей ДНК в коммерчески пригодных экспрессионных системах.
Изобретение в связи с этим предоставляет рекомбинантный вектор, включающий элементы, контролирующие экспрессию полинуклеотидной последовательности, кодирующей содержащий пептидный лигандный домен полипептид. Дополнительно изобретение предоставляет клетку, включающую нуклеиновую кислоту, кодирующую содержащий пептидный лигандный домен полипептид, где клетка представляет собой прокариотическую клетку или эукариотическую клетку. Методы микробного или тканевого культивирования хорошо известны специалистам в данной области (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 16.1-16.54). Изобретение, таким образом, предоставляет способ получения содержащих пептидный лигандный домен полипептидов, включающий: а) трансформацию клеток нуклеиновой кислотой, кодирующей полипептид по пункту 1; б) индукцию экспрессии полипептида трансформированной клеткой; и в) очистку полипептида.
Белковая экспрессия зависит от уровня транскрипции РНК, которая в свою очередь регулируется сигналами ДНК. Аналогично для трансляции мРНК требуется как минимум инициирующий кодон AUG, который обычно локализован в пределах 10-100 нуклеотидов 5'-конца матричной РНК. Было показано, что последовательности, фланкирующие инициирующий кодон AUG, влияют на его распознавание. Например, для распознавания эукариотическими рибосомами инициирующие кодоны AUG встроены в последовательности, соответствующие полной «консенсусной последовательности Козака», обеспечивающей оптимальную трансляцию (смотри Kozak, J. Molec. Biol. 196:947-950 (1987)). Также для успешной экспрессии экзогенной нуклеиновой кислоты в клетке может потребоваться посттрансляционная модификация полученного белка.
Молекулы нуклеиновой кислоты, описанные в данном описании, предпочтительно включают кодирующую область, функционально сцепленную с приемлемым промотором, например, промотором, функциональным в эукариотических клетках. Вирусные промоторы, такие как без ограничения промотор RSV [вирус саркомы Рауса] и главный поздний промотор аденовируса могут быть использованы в изобретении. Приемлемые невирусные промоторы включают, но не ограничиваясь ими, промотор [гена] фосфоглицеролкиназы (PGK) и промотор [гена] фактора элонгации 1α. Невирусные промоторы представляют собой желательно промоторы человека. Дополнительные приемлемые генетические элементы, многие из которых известны в данной области, также могут быть прикреплены или встроены в изобретательскую нуклеиновую кислоту и конструкции с обеспечением дополнительных функций, уровня экспрессии или паттерна экспрессии.
Дополнительно молекулы нуклеиновой кислоты, описанные в данном описании, могут быть функционально сцеплены с энхансерами для облегчения транскрипции. Энхансеры представляют собой цис-действующие элементы ДНК, которые стимулируют транскрипцию соседних генов. Примеры энхансеров, которые обеспечивают высокий уровень транскрипции на сцепленных генах в ряде различных клеточных типов многих видов, включают без ограничения энхансеры из SV40 [вирус обезьян 40] и LTR [длинный концевой повтор] RSV. Такие энхансеры могут быть скомбинированы с другими энхансерами, которые проявляют специфичные для клеточного типа эффекты, или любой энхансер может быть использован индивидуально.
Для оптимизации выработки белка в эукариотических клетках молекула изобретательской нуклеиновой кислоты может далее включать сайт полиаденилирования после кодирующей области молекулы нуклеиновой кислоты. Также предпочтительно, если все соответствующие транскрипционные сигналы (и трансляционные сигналы в необходимых случаях) будут точно согласованы, так что экзогенная нуклеиновая кислота будет правильно экспрессироваться в клетках, в которые она введена. При желании экзогенная нуклеиновая кислота также может вводиться в сайты сплайсинга (т.е. акцепторные и донорные сайты сплайсинга) для облегчения выработки мРНК-полноразмерного транскрипта помимо поддержания в рамке. Кроме того, молекулы изобретательской нуклеиновой кислоты могут далее включать соответствующие последовательности для процессинга, секреции, внутриклеточной локализации и подобное.
Молекулы нуклеиновой кислоты могут быть встроены в любой приемлемый вектор. Приемлемые векторы включают без ограничения вирусные векторы. Приемлемые вирусные векторы включают без ограничения ретровирусные векторы, альфавирусные, векторы [на основе] вируса осповакцины, аденовирусные, аденоассоциированные вирусные, герпесвирусные и векторы [на основе] вируса оспы птиц. Векторы предпочтительно обладают природной или созданной с помощью генетической инженерии способностью к трансформации эукариотических клеток, например, клеток CHO-K1. Дополнительно векторы, полезные в контексте изобретения, могут представлять собой «голые» [депротеинизированные] векторы на основе нуклеиновой кислоты (т.е. векторы, содержащие небольшое количество [белка] или не содержащие белки, сахара и/или липиды, инкапсулированные в них), такие как плазмиды или эписомы, или векторы могут быть связаны с другими молекулами. Другие молекулы, которые могут быть приемлемо скомбинированы с изобретательскими нуклеиновыми кислотами, включают без ограничения вирусные оболочки, катионные липиды, липосомы, полиамины, частицы золота и мишенные части, такие как лиганды, рецепторы или антитела, которые нацеливаются на клеточные молекулы.
Молекулы нуклеиновых кислот, описанные в данном описании, могут трансформировать любую приемлемую клетку, обычно эукариотическую клетку, такую как CHO, HEK293 или BHK, что желательно приводит к экспрессии содержащего пептидный лигандный домен полипептида, такого как, например, полипептид, включающий SEQ ID NOs:1-120 или его гомологи, как описано в данном описании. Клетка может быть культивирована с обеспечением экспрессии молекулы нуклеиновой кислоты и поэтому вырабатывает содержащий пептидный лигандный домен полипептид, такой как, например, полипептид, включающий аминокислотную последовательность SEQ ID NOs:1-120 или ее гомолог, как описано в данном описании.
Таким образом, изобретение предоставляет клетку, трансформированную или трансфицированную молекулой изобретательской нуклеиновой кислоты, описанной в данном описании. Средства трансформации или трансфекции клетки экзогенными молекулами ДНК хорошо известны в данной области. Например, без ограничения молекула ДНК вводится в клетку с использованием стандартных методик трансформации или трансфекции, хорошо известных в данной области, таких как опосредованная кальций-фосфатом или DEAE-декстраном трансфекция, слияние протопластов, электропорация, липосомы и прямая микроинъекция (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 1.1-1.162, 15.1-15.53, 16.1-16.54).
Другой пример метода трансформации представляет собой метод слияния протопластов; протопласты, полученные из бактерий, несущих большое число копий плазмиды, представляющей интерес, смешивают непосредственно с культивированными клетками млекопитающего. После слияния клеточных мембран (обычно с использованием полиэтиленгликоля) содержимое бактерий доставляется в цитоплазму клеток млекопитающего, и плазмидная ДНК переносится в ядро.
Электропорация, применение коротких электрических импульсов высокого напряжения, в различных клетках млекопитающих и растений ведет к образованию пор нанометрового размера в плазматической мембране. ДНК проникает непосредственно в клеточную цитоплазму через эти поры или в результате перераспределения мембранных компонентов, которые сопровождают закрытие пор. Электропорация может быть крайне эффективной и может быть использована для преходящей экспрессии клонов генов и для поддержания клеточных линий, которые несут интегрированные копии гена, представляющего интерес.
Такие методики могут быть использованы для стабильной и преходящей трансформации эукариотических клеток. Для изоляции стабильно трансформированных клеток требуется введение селектируемого маркера вместе с трансформацией гена, представляющего интерес. Такие селектируемые маркеры включают гены, которые обеспечивают резистентность к неомицину, а также ген HPRT в отрицательных по HPRT клетках. Для селекции может потребоваться длительное культивирование в селективной среде, по меньшей мере в течение примерно 2-7 дней, предпочтительно в течение по меньшей мере примерно 1-5 недель (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 16.1-16.54).
Содержащий пептидный лигандный домен полипептид может быть экспрессирован и очищен из рекомбинантной клетки-хозяина. Рекомбинантные клетки-хозяева могут быть прокариотическими или эукариотическими, включая, но не ограничиваясь ими, бактерии, такие как E. coli, грибные клетки, такие как дрожжи, клетки насекомых, включая, но не ограничиваясь ими, полученные из дрозофилы и тутового шелкопряда клеточные линии, и клетки и клеточные линии млекопитающих. При экспрессии содержащего пептидный лигандный домен полипептида в клетке, например, в клетке человека, или in vitro, или in vivo, кодоны, выбранные для такого полинуклеотида, кодирующего пептид, могут быть оптимизированы для данного типа клетки (т.е. видов). Много методов оптимизации кодонов известны в данной области (смотри, например, Jayaraj et al., Nucleic Acids Res. 33(9):3011-6 (2005); Fuglsang et al., Protein Expr. Purif. 31(2):247-9 (2003); Wu et al., «The Synthetic Gene Designer: a Flexible Web Platform to Explore Sequence Space of Synthetic Genes for Heterologous Expression» csbw, 2005 IEEE Computational Systems Bioinformatics Conference - Workshops (CSBW'05), pp. 258-259 (2005)).
Проблемы, которые должны быть рассмотрены для оптимальной полипептидной экспрессии в прокариотах, включают использование экспрессионных систем, селекцию штамма-хозяина, стабильность мРНК, смещение кодонов, образование телец включения и предотвращение [их образования], слитый белок и сайт-специфический протеолиз, компартмент-направленную секрецию (смотри Sorensen et al., Journal of Biotechnology 115 (2005) 113-128, которая включена в данное описание посредством ссылки).
Экспрессия обычно индуцируется плазмидой, содержащейся системой, совместимой с генетическим окружением. Генетические элементы экспрессионной плазмиды включают область инициации репликации (ori), маркер резистентности к антибиотику, транскрипционные промоторы, области инициации трансляции (TIR), а также транскрипционные и трансляционные терминаторы.
Может быть использована любая приемлемая экспрессионная система, например, Escherichia coli облегчает экспрессию белка посредством своей относительной простоты, высокой плотности культивирования, хорошо изученной генетикой и большим количеством совместимых средств, включая ряд пригодных плазмид, рекомбинантные слитые партнеры и мутантные штаммы, которые пригодны для полипептидной экспрессии. Штамм E. coli или генетическое окружение для рекомбинантной экспрессии являются в высшей степени важными. Экспрессионные штаммы должны быть дефектными по большинству вредных природных протеаз, поддерживать стабильность экспрессионной плазмиды и обеспечивать генетические элементы, релевантные к экспрессионной системе (например, DE3).
Число плазмидных копий контролируется областью инициации репликации, которая предпочтительно реплицируется в ослабленной форме (Baneyx, 1999). Репликон ColE1 присутствует в умеренных экспрессионных плазмидах, полученных из семейства плазмид pBR322 (число копий 15-20) или pUC (число копий 500-700), тогда как репликон p15A получен из pACYC184 (число копий 10-12). Большинство обычных маркеров лекарственной резистентности в рекомбинантных экспрессионных плазмидах обеспечивают резистентность к ампициллину, канамицину, хлорамфениколу или тетрациклину.
Экспрессионные системы [на основе] E. coli включают основанную на [фаге] T7 экспрессионную систему pET (запущенная в серийное производство Novagen), промотор лямбда PL/репрессор cI (например, Invitrogen pLEX), промотор Trc (например, Amersham Biosciences pTrc), промотор Tac (например, Amersham Biosciences pGEX) и гибрид lac/T5 (например, Qiagen pQE), промотор BAD (например, Invitrogen pBAD).
Для инициации трансляции с области инициации трансляции (TIR) транскрибированной матричной РНК требуется рибосомный сайт связывания (RBS), включающий последовательность Шайна-Дальгарно (SD) и кодон инициации трансляции. Последовательность Шайна-Дальгарно локализована в 7±2 нуклеотидах, вышележащих от инициирующего кодона, который представляет собой канонический AUG в эффективных рекомбинантных экспрессионных системах. Оптимальная инициация трансляции получается с мРНК с использованием SD-последовательности UAAGGAGG.
Использование кодонов в E. coli отражается уровнем сходных аминоацилированных тРНК, имеющихся в цитоплазме. Главные кодоны встречаются в высокой степени экспрессируемых генах, тогда как минорные или редкие кодоны проявляют тенденцию находиться в генах, экспрессируемых на низких уровнях. Кодоны, редкие в E. coli, часто имеются в избытке в гетерологичных генах из источников, таких как эукариоты, архебактерии и другие отдаленно родственные организмы с различной частотой предпочтения кодонов (Kane, 1995). Экспрессия генов, содержащих редкие кодоны, может привести к трансляционным ошибкам в результате рибосомной блокировки в положениях, требующих встраивания аминокислот, соединенных с минорным кодоном тРНК (McNulty et al., 2003). Проблемы смещения кодонов становятся крайне распространенными в рекомбинантных экспрессионных системах, когда транскрипты, содержащие редкие кодоны в кластерах, таких как дубликаты и триплеты, накапливаются в большом количестве.
Белковая активность требует сворачивания в точные трехмерные структуры. Стрессовые ситуации, такие как тепловой шок, нарушают сворачивание in vivo, и сворачивающиеся интермедиаты проявляют тенденцию к соединению в аморфные белковые гранулы, названные тельцами включения.
Тельца включения представляют собой набор структурно сложных агрегатов, часто воспринимаемых как стрессовый ответ, когда рекомбинантный белок экспрессируется с высокими скоростями. Макромолекулярное группирование белков в концентрациях 200-300 мг/мл в цитоплазме E. coli означает крайне неблагоприятные условия сворачивания белка, особенно в течение рекомбинантной экспрессии на высоком уровне (van den Berg et al., 1999). Неизвестно, формируются ли тельца включения посредством пассивного события, происходящего путем гидрофобного взаимодействия между экспозированными участками на несвернутых цепях, или путем специфических механизмов кластерирования (Villaverde and Carrio, 2003). Очищенные агрегаты могут быть солюбилизированы с использованием детергентов, подобных мочевине и гуанидия гидрохлорида. Природный белок может быть получен путем in vitro пересворачивания из солюбилизированных телец включения путем разведения, диализа или методами пересворачивания на колонке (Middelberg, 2002; Sorensen et al., 2003a).
Стратегии пересворачивания могут быть улучшены путем включения молекулярных шаперонов (Mogk et al., 2002). Оптимизация процедуры пересворачивания данного белка, однако, требует отнимающих много времени усилий и не всегда способствует высокому выходу продукта. Возможной стратегией пред