Комбинированный препарат для увеличения иммуногенности вакцины (варианты)
Иллюстрации
Показать всеИзобретение раскрывает комбинированный препарат для увеличения иммуногенности вакцин, содержащих антиген. Препарат содержит синтетический гликолипид PBS-57 и вакцину. Компоненты, входящие в комбинированный препарат, можно применять как совместно так и последовательно. Препарат по изобретению вводят внутривенно, внутрикожно, подкожно и другими известными способами. Препарат при введении стимулирует гуморальный иммунный ответ на антиген вакцины у субъекта, в частности способствует увеличению продукции IgG, IgA и/или IgM антител, активирует CD4+ Т-лимфоцитов и CD8+цитотоксических Т-лимфоцитов у субъекта. Гликолипид PBS-57 является адъювантом со сниженным числом побочных действий и в то же время способствующим выработке продолжительного защитного иммунитета. 4 н. и 6 з.п. ф-лы, 16 ил., 13 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области иммунологии и касается увеличения иммуногенности вакцин путем совместного введения синтетического гликолипида, обозначенного PBS-57, вместе с вакциной. PBS-57 обладает способностью стимулировать как опосредованный клетками, так и гуморальный иммунный ответ.
Уровень техники
Главным назначением вакцины является обеспечение длительного иммунитета против патологического состояния. В идеале, вакцины предоставляют функционально активные антитела, вырабатывают опосредованный клетками иммунитет и активируют Т- и В-лимфоциты с высокоспецифичной реактивностью, а также «память» для обеспечения защиты во время последующих столкновений с патогенном.
Адъюванты являются вспомогательными веществами вакцин, которые неспецифическим образом усиливают иммунный ответ. Механизмы, посредством которых адъюванты усиливают иммунную систему, варьируют в широких приделах. Адъюванты можно классифицировать как «иммуномодуляторные» агенты или «системы доставки ангигена». Иммуномодуляторные адъюванты запускают иммунную систему путем регуляции иммунных клеток посредством изменения продукции лимфокинов. Система доставки антигена, с другой стороны, функционирует для доставки антигена к соответствующей иммунной клетке. Дополнительно, адъюванты могут увеличивать скорость или продолжительность иммунного ответа, модулировать авидность антител, специфичность, распределение по изотипам или подклассам, стимулировать опосредованный клетками иммунитет, способствовать иммунитету слизистой оболочки или усиливать иммунные ответы у иммунологически незрелых или стареющих индивидуумов. Адъюванты могут воздействовать на гуморальный или опосредованный клетками иммунный ответ, или на их комбинацию.
Иммуномодуляция означает способность адъюванта изменять ответ лимфокинов путем активации характерных подмножеств иммунных клеток. Два основных подмножества CD4+ Т-лимфоцитов, Th1 и Th2, играют основную роль в определении иммунного ответа. Ответы ТЫ обычно индуцируют антитела, фиксирующие комплемент, и сильные реакции гиперчувствительности замедленного типа (DTH) и связаны с γ-IFN, IL-2 и IL-12, тогда как ответы Th2 приводят к высоким уровням циркулирующих и секреторных антител и связаны с цитокинами IL-4, IL-5, IL-6 и IL-10. Активация Th1 клеток регулирует также клеточный иммунный ответ путем активации пролиферации цитотоксических CD8+ Т-клеток и усиления цитолиза клеток-мишеней.
Исследованы адъювантные свойства разных видов липидов. В отличие от пептидных антигенов, липиды процессируются и представляются иммунной системе с помощью CD1 семейства связанных с β2 микроглобулинами молекул. Молекулы CD1 вовлечены в процесс захвата и переработки как чужеродных, так и собственных липидных антигенов для представления их конкретному подмножеству Т-клеток. Путь представления (презентации) с участием CD1 запускает как врожденный, так и приобретенный иммунные ответы путем активации двух комплементарных ограниченных CD1 подмножеств Т-клеток; Т-клеток природных убийц (NKT), которые осуществляют адъювантные действия, и не-NKT Т-клеток, способных к хелперной или цитолитической функции. NKT клетки экспрессируют как поверхностные маркеры природных убийц (NK), так и консервативные полу-инвариантные рецепторы Т-клеток (TCR), Vα24-Jα18/Vβ8 у мышей и Vα24-Jα18/Vβ11 у человека. Соответственно, NKT клетки играют важную роль в большом числе иммунных функций, включая противомикробные ответы, противоопухолевые ответы и регуляцию равновесия между толерантностью и аутоиммунитетом.
Большое число природных и синтетических липидных молекул обрабатывается антиген-представляющими клетками и представляется CD1 молекулами для NKT клеток. Соединениями-прототипами, применяемым для изучения активации NKT клеток in vitro и in vivo, являются KRN7000 и α-галактозилцерамид (αGalCer), полученные из морской губки Agelas mauritianus. Дополнительные соединения, идентифицированные недавно, включают изоглоботригексозилкерамид (iGB3), являющийся эндогенным гликолипидом, и PBS-57, модифицированный «амино 6» дезоксигалактозилцерамид, как описано в заявке PCT/US07/66250, раскрытие которой включено сюда посредством ссылки. Эти соединения активируют NKT клетки и регулируют на повышение ответы цитокинов in vitro. Однако, в контексте вакцинации in vivo немногое известно относительно эффективности адъювантного действия этих липидных соединений.
Немного адъювантов одобрено для применения в вакцинах для человека из-за их токсических побочных действий. Наиболее распространенные адъюванты представляют собой алюминий и масляные адъюванты, но известно, что они вызывают такие побочные действия, как лихорадка/жар, головная боль, мышечные боли и боли или сыпь. Другие недостатки включают сильную местную стимуляцию иммунной системы, приводящую к боли, покраснению, отеку или небольшому вздутию на месте инъекции. Адъюванты также предполагают сложные способы приготовления вакцин и могут не справляться с повышением иммуногенности в случае слабых антигенов. В настоящее время выбор адъювантов в вакцинах для человека отражает компромисс между необходимостью адъювантного действия и приемлемым уровнем побочных эффектов. Есть потребность в новых адъювантах с меньшим числом побочными действий и в то же время способствующими выработке продолжительного защитного иммунитета.
Раскрытие изобретения
Авторы изобретения открыли, что добавление синтетического гликолипида, называемого PBS-57, к препарату вакцины, вводимой субъекту, активирует как гуморальный, так и клеточный иммунный ответ при введении субъекту. Соответственно, изобретение касается продукта для увеличения иммуногенности вакцины, стимуляции гуморального иммунного ответа, стимуляции ответа CD4+ Т-клеток и стимуляции ответа CD8+ цитотоксических Т-клеток у субъекта при совместном введении субъекту PBS-57 и вакцины.
Краткое описание фигур
Фигура 1 представляет собой график, показывающий процент NKT клеток на 7-ой день в популяции CD3+ Т-клеток культивированных лимфоцитов периферической крови (PBL), обработанных разными количествами адъювантных гликолипидов αGalCer, PBS-20, PBS-25 и PBS-57.
Фигура 2 представляет собой график, показывающий процент NKT клеток на 7-ой день в популяции CD3+ Т-клеток культивированных PBL, обработанных разными количествами αGalCer, PBS-25, PBS-57 и PBS-83.
Фигура 3 представляет собой график, показывающий увеличение NKT клеток в культурах in vitro PBL, полученных от добровольцев и обработанных αGalCer, PBS-20, PBS-25, PBS-57 и PBS-83. Медианное значение приведено над графиком.
Фигура 4А представляет собой график, показывающий процент TCRαβ клеток в селезенке мышей через 24 часа после введения αGalCer, PBS-57 и PBS-83. Фигура 4В представляет собой график, показывающий процент NKT клеток в популяции TCRαβ клеток в селезенке мышей через 24 часа после введения адъювантных гликолипидов. Значения р на основе двустороннего теста рассчитаны для каждого адъюванта по сравнению с контролем.
Фигура 5А представляет собой график, показывающий процент CD40+ клеток в популяции CD11c+CD8α - клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов. Фигура 5В представляет собой график, показывающий процент CD40+ клеток в популяции CD11c+CD8α+клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов. Фигура 5С представляет собой график, показывающий процент CD80+ клеток в популяции CD11c+CD8α- клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов. Фигура 5D представляет собой график, показывающий процент CD80+ клеток в популяции CD11c+CD8α+ клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов. Фигура 5Е представляет собой график, показывающий процент CD86+ клеток в популяции CD11c+CD8α - клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов. Фигура 5F представляет собой график, показывающий процент CD86+ клеток в популяции CD11c+CD8α+клеток из селезенки мышей через 24 часа после внутривенного введения адъювантных гликолипидов.
Фигура 6 представляет собой график и гистограмму результатов проточной цитометрии с окрашиванием CFSE согласно анализу для определения специфического лизиса представляющих антиген клеток у мышей, иммунизированных овальбумином (Ova) самим по себе или Ova и αGalCer.
Фигура 7 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в селезенке мышей, иммунизированных адъювантом вместе с Ova или без него.
Фигура 8 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутривенно ("IV") ввели Ova в комбинации с различными концентрациями αGalCer.
Фигура 9 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутривенно ввели Ova в комбинации с различными концентрациями PBS-57.
Фигура 10 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутривенно ввели PBS-57 в комбинации с различными концентрациями Ova.
Фигура 11 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутримышечно (IM) ввели Ova в комбинации с различными концентрациями αGalCer.
Фигура 12 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутримышечно ввели Ova в комбинации с различными концентрациями PBS-57.
Фигура 13 представляет собой график, показывающий процент специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутривенно или внутримышечно ввели различные комбинации Ova и адъювантов.
Фигура 14 представляет собой график, показывающий усиленную продукцию антител у мышей, иммунизированных композицией вакцины с анатоксином столбняка (ТТ), содержащей PBS-57.
Фигура 15 представляет собой график, показывающий увеличенную реактивность CD8+ Т-клеток у мышей, иммунизированных внутримышечно овальбумином (Ova) в комбинации с PBS-57.
Фигура 16 представляет собой график, показывающий увеличенную реактивность CD8+ Т-клеток у мышей, иммунизированных подкожно Ova в комбинации с PBS-57.
Осуществление изобретения
Адъюванты усиливают иммуногенность антигенов в препаратах вакцин различными способами. В случае токсинов необходим хороший гуморальный иммунный ответ. В случае внутриклеточных бактерий важным является опосредованный клетками ответ, опосредованный в основном цитотоксическими Т-клетками и Th1 клетками. В случае вирусных инфекций как гуморальный, так и клеточный ответы важны для борьбы с инфекцией. Способность адъюванта усиливать не только гуморальный, но также опосредованный клетками иммунный ответ увеличивает вероятность развития продолжительного иммунитета. Эффективный адъювант был бы применим для комбинации с большим разнообразием антигенов. Авторы обнаружили, что гликосфинголипид, PBS-57, обладает способностью стимулировать как опосредованный клетками, так и гуморальный иммунный ответ in vivo. Дополнительно, PBS-57 способен стимулировать иммунный ответ на слабый незначительный антиген для продукции антител и одновременно обеспечивать опосредованный клетками лизис клеток, экспрессирующих специфические поверхностные антигены.
В одном осуществлении изобретение предоставляет способ усиления иммуногенности вакцины у субъекта путем совместного введения PBS-57 и вакцины. Как применяется здесь, «субъект» представляет собой млекопитающее, например, мышь, более предпочтительно, человека. «Усиление иммуногенности вакцины» означает способность PBS-57 усиливать гуморальный и/или опосредованный клетками иммунный ответ субъекта на вакцину относительно соответствующего контроля. С целью определения того, усилена ли иммуногенность относительно контроля, можно проводить количественное сравнение сигнала в образце, полученном от субъекта, вакцинированного антигеном и PBS-57, с сигналом в образце, полученном от субъекта, вакцинированного одним антигеном. Как применяется здесь, иммуногенность можно измерять с помощью любого подхода, применяемого специалистом в данной области техники для измерения гуморального или опосредованного клетками иммунного ответа. Например, иммуногенность можно измерять с помощью ELISA для различных уровней цитокинов, что является рутинным приемом для специалиста в данной области техники.
В конкретных осуществлениях иммунные ответы усилены по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 200%, по меньшей мере на 400% относительно соответствующего контроля. Соответствующим контролем может быть субъект, получивший композицию вакцины без PBS-57. Процент усиления можно рассчитывать с применением следующей формулы:
[(значение, представляющее иммунный ответ субъекта после введения композиции, содержащей PBS-57) - (значение, представляющее иммунный ответ в контроле)/(значение, представляющее иммунный ответ субъекта после введения композиции, содержащей PBS-57)]×100
Как применяется здесь, термин «совместное введение» означает введение по меньшей мере адъюванта и вакцины одновременно, т.е. в одно и то же время, или последовательно, например, введение адъюванта с последующим введением вакцины. При этом после введения адъюванта вакцину можно вводить практически сразу после адъюванта или вакцину можно вводить через эффективный период времени после адъюванта; эффективный период времени представляет собой время, необходимое для проявления максимального преимущества от введения адъюванта. Альтернативно, адъювант и вакцина могут входить в один и тот же состав.
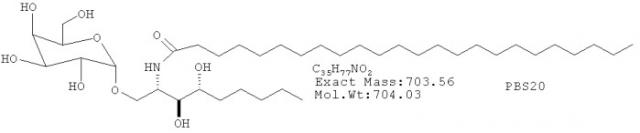
Композиции вакцин при необходимости составлены так, чтобы включать PBS-57. Термин «вакцина» относится к композиции, которая при введении субъекту индуцирует гуморальные иммунные ответы, как описано здесь. Композиции вакцин могут включать антиген или комбинацию антигенов; антиген может быть полипептидом или углеводородом или их сочетанием, например, гликопротеином. Антиген соответствующим образом получают из инфекционных агентов (например, патогенного микроорганизма), опухоли, эндогенной молекулы (например, «собственной» молекулы) или, с целью исследования, применяется ограниченный антиген, такой как овальбумин (называемый здесь «Ova»). Композиции вакцин могут также включать убитые или ослабленные инфекционные агенты. Композиции вакцин, применяемые согласно изобретению, при необходимости включают PBS-57 и антиген. Структура PBS-57 показана ниже:
PBS-57 активирует NKT клетки in vitro и in vivo. PBS-57 содержит амидную группу в положении С6 галактозы и цис-двойную связь в ацильной цепи церамидного звена. Без привязки к теории, считается, что двойная связь в церамидной боковой цепочке облегчает связывание с выемкой молекулы CD1d иувеличивает растворимость гликосфинголипида. Показано также, что PBS-57 индуцирует высвобождение INFγ и IL-4 in vitro.
Композиции вакцин, включающие PBS-57, можно составлять с применением разнообразных препаративных способов и инактивированные ингредиенты известны специалисту в данной области техники. См. Remington's Pharmaceutical Sciences, Mack Publishing Co. (2000), включенный сюда посредством ссылки. Вакцина может также содержать необходимую систему доставки антигена в иммунную клетку. Подходящие системы доставки антигенов известны в данной области техники и включают, не ограничиваясь этим, MVA (модифицированный вирус Анкары), аденовирус, лентивирус, перемещенную (translocated) субъединицу токсина коклюша или токсина дизентерии, или антиген, заключенный в липосомы. Подходящая эффективная доза PBS-57 в композициях вакцин может быть определена специалистом в данной области техники, но обычно находится в интервале от примерно 1 мкг до примерно 10000 мкг на кг веса тела, обычно составляет примерно 1000 мкг или меньше на кг веса тела. В отдельных осуществлениях эффективные дозы находятся в интервале от примерно 10 до примерно 5000 мкг на кг веса тела. В другом осуществлении эффективная доза находится в интервале от примерно 50 до примерно 1000 мкг на кг веса тела. В другом осуществлении эффективная доза находится в интервале от примерно 75 до примерно 500 мкг на кг веса тела. В исследованиях необходимая доза для мышей составляет 1 мкг PBS-57 на 100 мкл доз. Композицию PBS-57 можно вводить в виде однократной дозы или в виде нескольких доз в течение недель или месяцев.
В композицию с PBS-57 можно включать один или более антиген, или их можно включать в независимые составы. Как применяется здесь, антиген относится к молекуле, которая стимулирует иммунный ответ. Понятно, что доза антигена будет зависеть от конкретного антигена, возраста и иммунного статуса субъекта, а также от других релевантных факторов, которые может определить специалист в данной области техники.
При необходимости, антигены получают из ослабленных или убитых инфекционных агентов. Можно применять целые микроорганизмы или их части (например, мембранные тени, грубые мембранные препараты, лизаты и другие препараты микроорганизмов). Подходящие инфекционные агенты, из которых можно получать антиген, включают, не ограничиваясь этим, патогены и микроорганизмы, такие как бактерии, паразиты и вирусы. В конкретном контексте нужные антигены получают или производят из вирусного патогенна, связанного с заболеванием человека, включая, но не ограничиваясь этим, ВИЧ HIV/AIDS (Retroviridae, например, gp120 молекулы, выделенные из HIV-1 и HIV-2, HTLV-I, HTLV-11), вирусы гриппа Orthomyxoviridae, например, типов А, В и С), вирус герпеса (например, вирус простого герпеса, HSV-1 и HSV-2 гликопротеины gB gD и gH), ротавирусные инфекции (Reoviridae), инфекции дыхательных путей (парагрипп и синцитиальные дыхательные вирусы), полиомиелит (Picornaviridae, например, полиовирусы, риновирусы), корь и свинка (Paramixoviridae), краснуха (Togaviridae, например, вирус краснухи), гепатит (например, вирус гепатита типа А, В, С, D, Е и/или G), цитомегаловирус (например, gB и gH), гастроэнтерит (Caliciviridae), желтая лихорадка и лихорадка западного Нила (Flaviviridae), бешенство (Rhabdoviridae), Корейская геморрагическая лихорадка (Bunyaviridae), Венесуэльская лихорадка (Arenaviridae), бородавки (Papillomavirus), вирус иммунодефицита обезьян, вирус энцефалита, вирус ветряной оспы, вирус Эпштейн-Барра и другие семейства вирусов, включая Coronaviridae, Birnaviridae и Filoviridae.
Применимые бактериальные и паразитарные антигены можно также получать или выделять из известных агентов, ответственных за заболевания, включая, но не ограничиваясь этим, дифтерит, коклюш, столбняк, туберкулез, пневмония бактериальной ил грибковой этиологии, средний отит, гонорею, холеру, брюшной тиф, менингит, мононуклеоз, чуму, бактериальную дизентерию или салмонеллез, болезнь легионеров, болезнь Лайма, проказу, малярию, анкилостомоз, онхоцеркоз, шистозомоз, трипанозомоз, лейшманиоз, жиардиаз, амебиаз, филяриатоз, бореллию и трихиноз. Дополнительные антигены можно получать или выделять из нетрадиционных патогенов, таких как агенты, вызывающие куру, болезнь Якоба-Крейтцфельдта (CJD), скрепи, инфекционную энцефалопатию норки и хронические изнурительные болезни или из белковых инфекционных частиц, таких как прионы, связанные с болезнью Якоба-Крейтцфельдта.
Дополнительные конкретные патогены, из которых можно получать антигены, включают M.tuberculosis, Chlamydia, N.gonorrhoeae, Shigella, Salmonella, Vibrio cholerae, Treponema pallidum, Pseudomonas, Bordetella pertussis, Brucella, Fracisella tularensis, Helicobacter pylori, Leptospira interrogans, Legionella pneumophila, Yersinia pestis, Streptococcus (типы А и В), пневмококк, менингококк, Haemophilus influenza (тип b), Toxoplasma gondii, Moraxella catarrhalis, венерическая гранулема и актиномикоз;
грибковые патогены включают кандидоз и аспергиллез; паразитарные патогены включают Таета, трематоду, нематоду, амебиаз, жиардиаз, Cryptosporidium, Schistosoma, Pneumocystis carinii, трихомоноз и трихиноз. Настоящее изобретение можно также применять для предоставления соответсвующего иммунного ответа против многих ветеринарных заболеваний, таких как ящур, коронавирус, Pasteurella muldocida, Helicobacter, Strongylus vulgaris, Actinobaccillus pleuropneumonia, вирус диареи коров (BVDV), Klebsiella pneumoniae, E.Coli и Bordetella pertussis, паракоклюш и brochiseptica.
В других осуществлениях антигены для включения в композиции вакцин, которые можно применять согласно настоящим способам, являются производными опухолевых антигенов или аутологическими или аллогенными целой опухолевой клетке. Соответственно, опухолевый антиген представляет собой специфичный для опухоли антиген (TSA) или связанный с опухолью антиген (ТАА). Ряд опухолевых антигенов и способы их экспрессии известны в данной области техники и могут выбираться на основе типа опухоли, от которой надо лечить. Неограничивающие примеры опухолевых антигенов включают cdk4 (меланома), β-катенин (меланома), каспазу-8 (чешуйчатоклеточная карцинома), MAGE-1 и MAGE-3 (меланома, рак груди, глиома), тирозиназу (меланома) поверхностный IgG идиотип (например, BCR) (лимфома), Her-2/neu (рак груди, яичников), MUC-1 (рак груди, поджелудочной железы) и HPV Е6 и Е7 (карцинома шейки матки). Дополнительные применимые опухолевые антигены включают специфический антиген рака простаты (PSA), сиалил Tn (STn), белки теплового шока и связанные с опухолями пептиды (например, gp96) молекулы ганглиозидов (например, GM2, GD2 и Gd3), онкофетальный антиген (СЕА) и MART-1.
Как понятно специалистам в данной области техники, вакцины являются соответствующим образом составленными, чтобы быть совместимыми с предполагаемым путем введения. Примеры применимых путей введения включают парентеральное, например, внутривенное, внутрикожное, подкожное, внутримышечное, оральное (например, ингаляцию), чрезкожное (топикальное), интраназальное, внутрибрюшинное, трансмукозальное и ректальное введение. Вакцина может также включать физиологически приемлемое средство доставки (носитель). «Физиологически приемлемое» средство доставки означает любое средство доставки, которое подходит для введения in vivo (например, орального, трансдермального или парентерального введения) или применения in vitro, например, в клеточной культуре. Применимые физиологически приемлемые средства доставки для введения in vivo включают среди прочих воду, буферные растворы и растворы глюкозы. Дополнительные компоненты композиций могут при необходимости включать наполнители, такие как стабилизаторы, консерванты, растворители, эмульгаторы или лубриканты в дополнение к физиологически приемлемому средству доставки и антигену. Конкретно, применимые наполнители включают, не ограничиваясь этим, Твин 20, ДМСО, сахарозу, L-гистидин, полисорбат 20 и сыворотку.
Другое осуществление изобретения представляет собой способ стимуляции гуморального иммунного ответа на антиген. Способ включает совместное введение субъекту PBS-57 и антигена, как описано выше. Как применяется здесь, «гуморальный иммунный ответ» представляет собой продукцию антител В-клетками и вспомогательный процесс, сопровождающий это, включая, но не ограничиваясь этим, активацию Th2 и продукцию цитокинов, образование центра размножения и переключение изотипов, созревание сродства и генерацию клеточной памяти. С целью определения того, активирован ли гуморальный иммунный ответ, можно проводить количественное сравнение сигнала в образце от субъекта, вакцинированного антигеном и PBS-57, с образцом от субъекта, вакцинированного одним антигеном. Гуморальный иммунный ответ можно оценивать по эффекторным функциям антител, включая нейтрализацию патогенна или токсина, классическую активацию комплемента и опсоническое облегчение фагоцитоза и уничтожение патогена. Антитела, произведенные в ответ на совместное введение PBS-57 и антигена, могут принадлежать к любому типу, например, IgM, IgA и IgG. Гуморальный иммунный ответ можно измерять с помощью любого известного в данной области техники способа, например, с помощью ELISA, анализа одиночной радиальной иммунодиффузии (SRID), ферментативного иммуноанализа (EIA) или анализа ингибирования гемагглютинации (HAI).
Дополнительным осуществлением изобретения является способ активации CD4+ Т-лимфоцитов у субъекта. Как известно в данной области техники, CD4+ Т-клетки, или «Т-хелперные клетки» представляют собой клетки, которые узнают антигены, представленные классом II основных маркеров тканевой совместимости (МНС) на поверхности представляющих антиген клеток, и секретируют лимфокины для стимуляции как опосредованного клетками, так и опосредованного антителами ответа иммунной системы. Активация CD4+ Т-клеток способствует секреции лимфокинов, переключению изотипов иммуноглобулинов, созреванию сродства ответа антител, активации макрофагов и усилению активности природных убийц (NK) и цитотоксических Т-клеток (CTL). Лимфокины являются белками, секретируемыми лимфоцитами, которые воздействуют на их собственную активность и/или активность других клеток. Лимфокины включают, не ограничиваясь этим, интерлейкины и цитокины, например, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12 или INFγ. Для определения того, активированы ли CD4+ Т лимфоциты, можно проводить количественное сравнение сигнала в образце от субъекта, вакцинированного антигеном и PBS-57, с образцом от субъекта, вакцинированного одним антигеном. Способы измерения активации CD4+ Т-клеток известны в данной области техники.
Другое осуществление изобретения представляет собой способ активации CD8+ Т лимфоцитов у субъекта. CD8+ Т лимфоциты узнают антигены, представленные классом I МНС молекул (присутствующие на всех ядерных клетках). Участие пептидного комплекса МНС класса I приводит к доставке литических гранул в клетку мишень, вызывая лизис клетки мишени. Способы измерения активации CD8+ Т-клеток известны в данной области техники и включают, не ограничиваясь этим, ELISPOT, ELISA и анализ цитотоксичности. Как применяется здесь, модель на мышах применена для отслеживания активации CD8+ Т-клеток с применением флуоресцентного анализа для измерения опосредованной клетками цитотоксичности, как описано в Hermans et al, 2004, J.Immunol. Methods, 285:25-40, включенном посредством ссылки полностью. В этом анализе мышей иммунизируют в 0-вой день вакциной, содержащей или не содержащей PBS-57. Сингенные клетки мишени создают путем выделения клеток селезенки у второго набора мышей и мечения клеток двумя отдельными флуоресцентными красителями или высокой и низкой концентрациями одного и того же флуоресцентного красителя, например, CFSE или CMTMR. Один набор клеток мишеней нагружают антиген-специфичным пептидом, тогда как второй набор клеток мишеней нагружают иррелевантым пептидом. Две популяции клеток мишеней смешивают в равных количествах и инъецируют иммунизированным мышам. Через 24 часа мышей забивают и получают клетки селезенки и образцы крови. Уровни каждого набора клеток мишеней анализируют с помощью проточной цитометрии. Активацию CD8+ лимфоцитов определяют путем сравнения числа клеток мишеней в образце от субъекта, вакцинированного антигеном и PBS-57, с числом клеток мишеней в образце от субъекта, вакцинированного только антигеном.
Другие аспекты изобретения станут понятными при рассмотрении нижеследующих примеров, не предназначенных для ограничения области притязаний изобретения, и приложенных фигур.
ПРИМЕРЫ
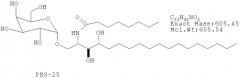
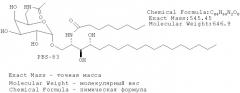
Пример 1. Активация NKT клеток in vitro с помощью PBS-57 Для определения того, способен ли PBS-57 стимулировать NKT клетки в культуре, измеряют распространение NKT клеток в культуре лимфоцитов периферической крови (PBL). Клетки PBL получают от двух здоровых доноров и выращивают на RPMI среде для клеточных культур с 5% АВ сывороткой. Клетки рассевают на 12-луночных планшетах в количестве 2×106 PBL на лунку на 2 мл. Лунки обрабатывают носителем для отрицательного контроля (0,05% Твин 20 и 1% ДМСО в PBS или 0,05% Твин20 и 10% ДМСО в PBS) или тестируемыми адъювантами (αGalCer, PBS-20, PBS-25 или PBS-57) в конечной концентрации 10 нг/мл, 100 нг/мл или 1 мкг/мл. Химические структуры контрольных соединений αGalCer, PBS-20 и PBS-25 приведены ниже:
Ко всем культурам добавляют рекомбинантный человеческий IL2 (rhIL-2) до получения конечной концентрации 100 UI/мл к 1-му дню. Все клетки культивируют в течение 10 дней при 37°С при 5% CO2. На 7-ой день половину культуральной среды (1 мл) отбирают для NKT анализа. Процент NKT клеток в CD3+ популяции детектируют с помощью проточной цитометрии с применением CD1 тетрамеров с флуоресцентной меткой или антител с флуоресцентной меткой (анти-CD3, анти-Vβ11 и анти-NKT). Популяцию NKT идентифицируют с помощью проточной цитометрии как Vp11+, тетрамер+ и TCRαβ+ популяцию. Процент NKT клеток рассчитывают в каждом образце путем вычитания числа (процента ?) клеток Vβ11+PBS-57-тетрамер + TCRαβ+ из числа (процента ?) клеток Vβ11 + пустой-тетрамер + TCRαβ+. На фигуре 1 показано увеличение NKT клеток после обработки PBS-57, αGalCer, PBS-25 и PBS-20. Как показано, обработка PBL с помощью PBS-57 или αGalCer приводит к распространению (увеличению числа) NKT клеток.
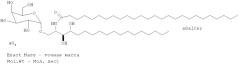
В отдельном эксперименте измеряют способность PBS-57 по сравнению с другими кандидатами гликолипидами индуцировать распространение NKT клеток in vitro. Лимфоциты периферической крови получают от двух здоровых доноров и культивируют на RPMI среде для клеточных культур с 5% АВ сывороткой. Клетки рассевают на 12-луночных планшетах в количестве 2×106 клеток на лунку на 2 мл среды. В одну лунку добавляют носитель (0,05% Твин 20 и 1% ДМСО в PBS) в качестве отрицательного контроля, в лунки для тестирования добавляют αGalCer, PBS-25, PBS-57 или PBS-83 в конечной концентрации 1 нг/мл, 10 нг/мл или 100 нг/мл. Структура PBS-83 приведена ниже:
Все культуры дополняют rhIL-2 до получения конечной концентрации 100 UI/мл к 1-му дню и культивируют в течение 7 дней при 37°С при 5% CO2. На 7-ой день определяют процент NKT клеток с помощью проточной цитометрии. На фигуре 2 показан процент NKT клеток на 7-ой день в случае обработки различными гликолипидами. Обработка PBS-57 приводит по меньшей мере к двукратному увеличению числа NKT клеток по сравнению с обработкой клеток αGalCer.
Пример 2. Распространение NKT клеток в культурах, обработанных PBS-57
Проводят окрашивание NKT на панели из 14-ти образцов здоровых донорских лимфоцитов периферической крови (PBL) или моноцитов периферической крови (РВМС). Клетки PBL получают от 12 субъектов, клетки РВМС получают от 2 субъектов. Каждый образец выделенных клеток разделяют на два образца. Первый образец от каждого донора окрашивают 10 мкл анти-Vβ11 FITC (Beckman Coulter), 10 мкл анти-TCRαβ-РС5 (Beckman Coulter) и 2 мкл РЕ-меченых PBS-57-CD1d-тетрамеров. Второй образец от каждого донора окрашивают с помощью 10 мкл анти-Vβ11, 10 мкл анти-TCRαβ-FITC и 2 мкл РЕ-меченых пустых-CD1d-тетрамеров.
Для определения процента увеличения NKT клеток количество NKT клеток на 7-ой день делят на количество NKT клеток на день 0. Как показано на фигуре 3, инкубация с PBS-57 приводит к значительному увеличению NKT клеток в культурах PBL от людей добровольцев.
Пример 3. Анализ популяций клеток TCRαβ, NKT и созревания дендритных клеток у мышей, получавших PBS-57
Для тестирования адъювантной активности PBS-57 in vivo, мышей инъецируют тестируемыми соединениями и анализируют активацию и увеличение числа клеток через 24 часа. В четырех группах из пяти C57B 1/6J мышей каждой мыши внутривенно вводят физиологический раствор с фосфатным буфером (PBS) с носителем (ДМСО), 0,97 мкг αGalCer, 1,3 мкг PBS-57 или 0,97 мкг PBS-83 в общем объеме 100 мкл PBS. Через 24 часа после введения тестируемого соединения мышей забивают и изолируют образцы крови и клетки селезенки по стандартным способам. Процент NKT клеток в селезенке оценивают с помощью проточной цитометрии с окрашиванием с применением анти-TCRαβ-FITC и РЕ-меченых CD1d-тетрамеров, нагруженных PBS-57 (PBS-57-тетрамер) или без липида (пустой тетрамер). На фигуре 4А показано увеличение процента TCRαβ клеток у мышей, получавших αGalCer или PBS-57, по сравнению с контрольными мышами, получавшими PBS и носитель. Процент NKT клеток определяют путем вычитания процента PBS-57-тетрамер + клеток из процента пустой-тетрамер+клеток в популяции TCRαβ. На фигуре 4В показано уменьшение процента NKT клеток в селезенке мышей, получавших PBS-57 или αGalCer, по сравнению с контролем. Результаты, приведенные на фигурах 4А и 4В, все вместе показывают, что PBS-57 приводит к увеличению числа TCRαβ клеток в селезенке мышей с такой же эффективностью, как αGalCer. Утрата NKT клеток у мышей, которым вводят αGalCer или PBS-57, по отношению к контролю показывает понижение экспрессии TCR на поверхности NKT клеток.
Дендритные клетки (DC) определяют среди клеток селезенки с помощью проточной цитометрии путем окрашивания анти-CD11c R-PE (BD Pharmingen) и анти-CD8α FITC (Beckman Coulter). Далее анализируют два подмножества дендритных клеток, популяции CD11c+CD8α- и CD11c+CD8α+. Уменьшение на 50% обоих подмножеств DC наблюдается у мышей, получавших адъюванты PBS-57 или αGalCer, по сравнению с контролем. Для определения того, индуцирует ли введение гликолипидов созревание обоих подмножеств дендритных клеток, клетки окрашивают с помощью антител анти-CD40 Biotin/Stepta APC (BD Bioscience), анти-CD80 Biotin (BD Pharmmgen)/Stepta APC (BD Bioscience) и анти-CD86 Biotin (BD Pharmmgen)/Stepta APC (BD Biocsience) и анализируют с помощью проточной цитометрии. На фигурах 5А и 5В показан процент положительных по CD40 клеток среди CD11c+CD8α- и среди CD11c+CD8α+ клеток, соответственно. На фигурах 5С и 5D показан процент положительных по CD80 клеток в обеих популяциях CD11c+CD8α- и CD11c+CD8α+ клеток, соответственно. На фигурах 5Е и 5F показан процент положительных по CD86 клеток в обеих популяциях CD11c+CD8α- и CD11c+CD8α+ клеток, соответственно. Горизонтальные линии представляют средние значения. Все вместе данные показывают, что PBS-57 и aGalCer значительно увеличивают процент клеток, экспрессирующих CD40+, CD80+ и CD86+, в обеих популяциях CD11c+CD8α- и CD11c+CD8α+ клеток.
Пример 4. Протокол для тестирования адъювантных свойств PBS-57 в модели на мышах
Модель на мышах применяют для тестирования in vivo специфического цитотоксического ответа Т-клеток (CD8+), вызываемого PBS-57 в комбинации с антигеном. Самок мышей C57B 1/6J CD45.2 иммунизируют на день 0 антигеном (овальбумином. Ova, grade VII, Sigma St.Louis, МО) вместе с адъювантом или без него, только адъювантом или только носителем (контроль) в общем объеме 100 мкл PBS. Тестируемые соединения представляют собой 1 мкг PBS-57, 1 мкг aGalCer, 1 мкг PBS-83 вместе с 50 мкг Ova или без него. Сингенные клетки мишени получают путем выделения клеток селезенки из второго подмножества самок мышей C57B 1/6J CD45.2 и мечения клеток низкой концентрацией (0,6 мкМ в течение 10 мин при 37°С) или высокой концентрацией (6 мкМ в течение 10 мин при 37°С) CFSE (флуоресцентного красителя). Популяцию, меченую высокой концентрацией CFSE, предварительно нагружают 5 мкМ пептидом SIINFEKL (Ova-специфичного пептида, NeoMPS, Inc, San Diego, CA) в течение 60 мин при 37°С. Популяцию, меченую низкими концентрациями CFSE, предварительно нагружают 5 мкл пептида LCMV gp33-41 (не-Ova пептид, NeoMPS, Inc, San Diego, CA) в течение 60 мин при 37°С. Равные количества обеих популяций клеток мишеней смешивают (1×107 клеток, обработанных низкой или высокой концентрацией CFSE, 2×107 всего на 100 мкл) и вводят внутривенно каждой иммунизированной мыши на день 10. Мышей забивают на день 11 и отбирают клети селезенки и образцы крови из глазной пазухи (orbital sinus). Средний процент выживания получивших пептид клеток мишеней (меченых CFSE) рассчитывают относительно контрольной популяции с помощью анализа с проточной цитометрией. На фигуре 6В показаны типичные данные проточной цитометрии, демонстрирующие потерю клеток мишеней, нагруженных Ova-специфичным пептидом. Цитотоксическую активность выражают как процент специфического лизиса, рассчитанный путем вычитания среднего процента выживаемости Ova-специфичных клеток мишеней из 100. На фигуре 7 приведен процент специфического лизиса клеток мишеней в селезенке иммунизированных мышей. Только сочетание Ova и PBS-57 вызывает цитотоксический лизис Ova-специфичных клеток мишеней в селезенке.
Пример 5. Цитотоксический ответ после иммунизации Ova с различными концентрациями αGalCer
Цитотоксичность in vivo, индуцированную ответом CD8+ Т-клеток на клетки мишени, нагруженные Ova-пептидом, оценивают, как описано в примере 4, для различных концентраций αGalCer. Мышей из 11 групп по три мыши внутривенно иммунизируют с применением 100 мкл в общем PBS только, 50 мкг Ova только, 1 мкг αGalCe