Производные имидазолонов, способ получения и биологические применения
Иллюстрации
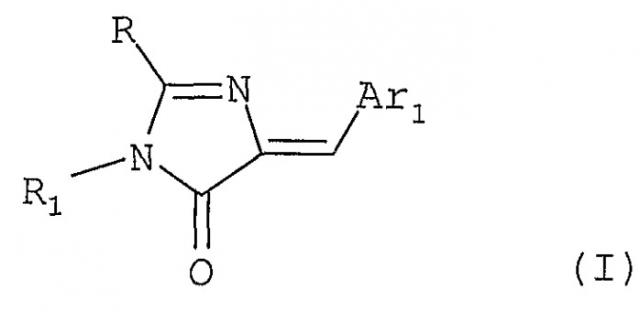
Показать всеДанное изобретение относится к новым производным имидазолонов для применения в качестве лекарственных средств, которые являются ингибиторами киназы, и соответствуют формуле (I)
в которой: R1 представляет C1-C3 алкильный радикал или атом водорода, и/или арильный радикал, Ar1 выбран из
R представляет группу R2-S-, R2 таким образом выбран из радикалов типа T1-(CH2)n, где n=0, 1, 2 или 3, и T1 представляет метильный, винильный, алкильный, алкинильный, нитрильный, C3- или C4-циклоалкильный радикал, hal, Z-O, Z-CO, где Z представляет C1-C3 алкил или hal, hal представляет F, Cl, Br или I, или группу CCl3, или группу R3-NH-, R3 таким образом выбран из радикалов типа T2-(CH2)n, где n=0, 1 или 2, и T2 представляет метильный, винильный радикал, Z-O, Z-CONH-, -CH-(OZ)2, ZCO, где Z представляет H или C1-C4 линейный или разветвленный алкил, NH2, C3-циклоалкил, арил, замещенный арил, или R3 представляет H, или группу R4-CONH-, R4 таким образом выбран из C3-C5 разветвленного алкила, или A r 2 − или Ar2-3-, Ar2 выбран из фенильного радикала, замещенного фенила или бензодиоксолила; и имеют IC50 менее 5 мкМ. Изобретение относится также к фармацевтическим композициям на основе соединений формулы 1 для лечения нейродегенеративных заболеваний и к применению этих соединений в качестве ингибиторов DYRK1A. 6 н. и 5 з.п. ф-лы, 1 ил., 2 табл., 8 пр.
Реферат
Объектом изобретения являются производные имидазолонов. Оно также относится к способу их получения.
Кроме того, оно касается биологических применений этих производных в качестве ингибиторов киназ, в частности, для лечения нейродегенеративных заболеваний (а именно, болезни Альцгеймера, болезни Пика, трисомии 21).
Большинство патологий человека включают в себя аномалии фосфорилирования, часто связанные с аномалиями регуляции некоторых протеинкиназ.
Таким образом, в последние годы поиск эффективных ингибиторов этих киназ стал очень активным.
Опираясь на долгосрочный опыт в отношении киназ CDK, GSK-3 и CK1, авторы изобретения заинтересовались разработкой селективных ингибиторов киназы DYRK1A (Киназа 1А двойной специфичности, регулируемая фосфорилированием тирозина).
Речь идет о ферменте, который аутофосфорилируется по своему тирозину 321 (что приводит к его активации), и который фосфорилирует остатки серина и треонина.
Ген протеинкиназы DYRK1A локализован в очень специфическом отделе хромосомы 21, «критическом отделе синдрома Дауна», который завершает двадцатку генов, отвечающих за трисомический фенотип. Множество аргументов поддерживает гипотезу о существенном вкладе сверхэкспрессии, даже умеренной (×1,5), DYRK1A в аномальное развитие мозга, наблюдаемого при трисомии 21. Кроме того, DYRK1A также представляется сильно вовлеченной в болезнь Альцгеймера (которая систематически и преждевременно возникает у больных трисомией 21 после 40 лет (Kimura R, et al., 2006. The DYRK1A gene, encoded in chromosome 21 Down syndrome critical region, bridges between beta-amyloid production and tau phosphorylation in Alzheimer disease. Hum. Mol. Genet. 16, 15-23; Ferrer I, et al., 2005. Constitutive DYRK1A is abnormally expressed in Alzheimer disease, Down syndrome, Pick disease, and related transgenic models. Neurobiol. Dis. 20, 392-400).
Ингибиторы DYRK1A были найдены путем виртуального отсеивания in silico по структурной модели DYRK1A, основанной на кристаллической структуре GSK-3 (Kim et al., Bioorg. Med. Chem. Lett., 2006 Jul. 15; 16 (14): 3712-6). В данном приближении, из 182 отобранных соединений только 11 молекул проявили ингибиторную активность с IC50, изменяющейся от 2,5 до 50 мкМ.
Работы авторов изобретения по поиску, оптимизации и характеризации фармакологических ингибиторов киназы DYRK1A привели их к обнаружению того, что производные имидазолонов, соответствующие производным или аналогам лейцеттамина В, представляют в этом отношении мощные и селективные фармакологические ингибиторы киназы DYRK1A. Далее, термин «соединения» будет также использован для полного обозначения их производных и аналогов.
Лейцеттамин В является морским алкалоидом, экстрагированным из губки Leucetta microraphis, формулы A
Лейцеттамин В
Расширение поисков привело авторов изобретения к разработке путей синтеза, позволяющих получить семейство соединений, обладающих свойствами в отношении DYRK1A, представляющими большой интерес, с IC50, в большинстве случаев, ниже 50 мкМ, и даже 10 мкМ, вплоть до 1 мкМ.
Таким образом, целью изобретения является применение производных имидазолонов, составляющих аналоги лейцеттамина В, в качестве лекарственных средств.
Оно также рассматривает способ получения этих соединений.
Кроме того, изобретение относится к соединениям, которые соответствуют новым производным имидазолонов, и к их применению в качестве действующих начал лекарственных средств.
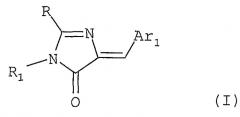
В соответствии с первым аспектом, изобретение относится также к применению в производстве лекарственных средств для лечения нейродегенеративных заболеваний производных имидазолона, соответствующих формуле (I)
в которой:
R1 представляет Н, необязательно замещенный линейный или разветвленный С1-С5 алкильный радикал; арильную группу, или 5- или 6-членную гетероциклическую группу, арильная и гетероциклическая группа необязательно содержат один или более одинаковых или различных заместителей, находящихся в любых положениях;
Ar1 представляет арильную группу с необязательными одним или более заместителями, два соседних заместителя могут образовывать 5- или 6-членный цикл, этот цикл, при необходимости, может быть замещен; или ароматический гетероцикл с гетероатомом, выбранным из N, S и O, с необязательными одним или более заместителями, и/или конденсированный с ароматическим 5- или 6-членным циклом,;
R представляет R2-S-, R3-NH-, R4CONH или Ar2, где
R2 представляет линейный, разветвленный или циклический С1-С5 алкильный радикал; винильный или С1-С5 винилалкильный радикал, нитрильный или С1-С5 нитрилалкильный радикал, арильный или бензильный радикал, указанные радикалы необязательно замещены по одному или нескольким атомам углерода одной или более одинаковыми или различными группами, занимающими любые положения, два соседних заместителя могут образовывать 5- или 6-членный цикл, этот цикл, при необходимости, может быть замещен,
R3 имеет определения, приведенные выше, и, кроме того, может представлять Н;
Ar2 представляет замещенный или незамещенный арильный радикал, два соседних заместителя могут образовывать 5- или 6-членный цикл, этот цикл необязательно может быть замещен.
Изобретение также рассматривает рацемические формы производных, указанных выше, а также их энантиомерные формы, взятые по отдельности.
Как проиллюстрировано примерами, более конкретно, вышеуказанные производные являются селективными ингибиторами киназы DYRK1A с IC50 менее 5 мкМ вплоть до менее 1 мкМ, особенно предпочтительные производные имеют IC50 менее 0,1 мкМ.
В вышеприведенной формуле (I) «арил» представляет фенил или нафтил, а «гетероцикл» представляет 5- или 6-членный цикл с N, O и/или S в качестве гетероатома(ов). Заместители в R1, Ar1, Ar2 и R выбраны из: ОН, OZ, COH, COZ, COOH, COOZ, NH2, NHalc., N(alc)2, NHCOOH, NHCOOZ, Z представляет линейный или разветвленный С1-С5 алкильный радикал, бензил, арил или замещенный бензил, бензодиоксолил, один или более галогенов и/или группу CCl3, и alc. представляет С1-С3 алкильный радикал.
Изобретение преимущественно имеет целью применение в качестве лекарственных средств производных имидазолонов, имеющих IC50 менее 5 мкМ и соответствующих вышеуказанной формуле I, в которой:
R1 представляет С1-С3 алкильный радикал или атом водорода, и/или арильный радикал
Ar1 выбран из
R представляет
группу R2-S-, R2 таким образом выбран из радикалов типа Т1-(CH2)n, где n=0, 1, 2 или 3, и Т1 представляет метильный, винильный, алкильный, алкинильный, нитрильный, С3- или С4-циклоалкильный радикал, Z-O, Z-CO, где Z представляет С1-С3 алкил или hal, hal представляет F, Cl, Br или I, или группу CCl3,
или
группу R3-NH-, R3 таким образом выбран из радикалов типа Т2-(CH2)n, где n=0, 1 или 2, и Т2 представляет метильный, винильный радикал, Z-O, Z-CONH-, -CH-(OZ)2, ZCO, где Z представляет Н или С1-С4 линейный или разветвленный алкил, NH2, С3-циклоалкил, арил, замещенный арил, или R3 представляет Н,
или
группу R4-CONH-, R4 таким образом выбран из С3-С5 разветвленного алкила,
или
R представляет Ar2, Ar2 выбран из фенильного радикала, замещенного фенила или бензодиоксолила.
Предпочтительно изобретение относится к применению в качестве лекарственных средств производных имидазолонов, имеющих IC50 менее 1 мкМ и соответствующих вышеуказанной формуле I, в которой:
R1 представляет Н или СН3
Ar1 выбран из
R представляет
группу R2-S-, R2 таким образом выбран из радикалов типа Т1-(CH2)n, где Т1 представляет метильный, алкинильный, нитрильный радикал, hal, СН3О, циклопропил или циклобутил, n=0, 1, 2 или 3, «hal» представляет атом галогена или группу CCl3,
или
группу R3-NH-, R3 таким образом выбран из радикалов типа Т2-(CH2)n, где Т2 представляет С3-алкил, ОН, циклопропил, n=0, 1 или 2, фенил, фенил, замещенный ОН, ОСН3, СООН и ОН, СН2ОН, С(СН3, ОН), СН2-СН2ОН, СН2-СООН, бензодиоксолил, или R3 представляет Н,
или
группа Ar2 выбрана из пара-гидроксифенильной или бензодиоксолильной группы.
В предпочтительной группе производных имидазолона формулы (I)
R представляет R2S, R3HN или Ar2;
R1 представляет Н или линейный или разветвленный С1-С5 алкильный радикал;
R2 представляет Н или линейный или разветвленный С1-С5 алкильный радикал, при необходимости замещенный одним или более радикалами ОН, С1-С5 алкокси, (СН2)n-OH или (СН2)n-СООН; или представляет циклический радикал, при необходимости, типа -(CH2)n-циклоалкил, циклоалкильный радикал имеет 3-5 членов и n=1-5, циклический радикал, при необходимости, замещен С1-С5 алкилом; или представляет С1-С5 алкиленнитрильный радикал; С1-С5 алкиленвинил; С1-С5 алкинил;
R3 представляет линейный или разветвленный С1-С5 алкильный радикал, при необходимости замещенный одним или более радикалами С1-С5 алкокси, ОН или СООН; или представляет циклический радикал, при необходимости, типа -(CH2)n-циклоалкил; или представляет фенильный радикал, при необходимости, замещенный одним или более -ОН, (CH2)n-OH; алкокси или СООН; или бензодиоксолильный радикал; или представляет циклический радикал, при необходимости, типа -(CH2)n-циклоалкил, циклоалкильный радикал имеет 3-5 членов и n=1-5; NH2;
Ar1 представляет бензодиоксолильный радикал;
Ar2 представляет бензодиоксолильный радикал или фенил, последний при необходимости замещен одним или несколькими -ОН, алкокси.
В другой предпочтительной группе производных имидазолона формулы (I)
R представляет R2S, R3HN или Ar2;
R1 представляет Н или линейный или разветвленный С1-С5 алкильный радикал;
R2 представляет линейный или разветвленный С1-С5 алкильный радикал, при необходимости замещенный одним или более радикалами ОН, С1-С5 алкокси, (СН2)n-OH; или представляет циклический радикал, при необходимости, типа -(CH2)n-циклоалкил, циклоалкильный радикал имеет 3-5 членов и n=1-5; или представляет С1-С5 алкиленнитрильный радикал; С1-С5 алкиленвинил;
R3 представляет фенильный радикал, при необходимости, замещенный одним или более -ОН, (CH2)n-OH; алкокси; или бензодиоксолильный радикал; или представляет циклический радикал, при необходимости, типа -(CH2)n-циклоалкил, циклоалкильный радикал имеет 3-5 членов и n=1-5; NH2;
Ar1 представляет бензодиоксолильный радикал;
Ar2 представляет бензодиоксолильный радикал или фенил, последний при необходимости замещен одним или несколькими -ОН.
В особо выгодном случае, производные имидазолонов, применяемые в соответствии с изобретением, выбраны из следующих соединений, в которых в формуле (I)
R представляет R2S
R2 представляет СН2С≡СН; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет СН2С≡N; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет СН2СH2Сl; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH3; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2CH3; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2CH2CH3; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH(CH3)2; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет СН2С≡N; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2(CH2)2CH3; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2CH2OCH3; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2T1, где T1 представляет циклопропил; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R2 представляет CH2T1, где T1 представляет циклобутил; R1 представляет H; Ar1 представляет 1,3-бензодиоксол-5-ил;
R представляет R3NH
R3 представляет CH2CH3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет CH2CH2ОН; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет CH2T1, где T1 представляет циклопропил; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет CH2CH3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет о-НО-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет С6Н5; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-НО-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-НО-м-НО2С-С6Н3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-м-ОСН2О-С6Н3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-СН3-С6Н3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет НОСН2СНОНСН2; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-м-ОСН2СН2О-С6Н3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-СН3О-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет м-НОСН2-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет м-НОСН(СН3)-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-НОСН2СН2-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-НО2ССН2О-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет СН2СН2СН3; R1 представляет Н; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет CH2T1, где T1 представляет циклопропил; R1 представляет Н; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет С6Н5; R1 представляет Н; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет п-НО-С6Н4; R1 представляет Н; Ar1 представляет 1,3-бензодиоксол-5-ил;
R3 представляет Н; R1 представляет Н; Ar1 представляет п-НО-м-МеО-С6Н3;
R представляет Ar2
Ar2 представляет п-НО-С6Н4; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил;
Ar2 представляет п-м-ОСН2О-С6Н3; R1 представляет Ме; Ar1 представляет 1,3-бензодиоксол-5-ил.
В соответствии с другим аспектом, изобретение рассматривает новые производные имидазолонов.
Действительно, за исключением производных, указанных ниже, вышеуказанные производные формулы I являются новыми производными, и в этом качестве входят в объем изобретения.
Таким образом, в качестве новых продуктов изобретение рассматривает производные имидазолона, отличающиеся тем, что они соответствуют формуле I по п.1 формулы изобретения, за исключением производных, в которых
R представляет R2S, и
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет СН3, и R2 представляет СН3, СН3СН2, СН2=СН-СН2, СН≡С-СН2, СН3-СН2-ОСО-СН2, С6Н4-СН2;
Ar1 представляет п,м-ОСН3; R1 представляет СН3, и R2 представляет СН3СН2;
Ar1 представляет м,м'-ОСН3-С6Н4; R1 представляет СН3, и R2 представляет СН3СН2;
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет н-бутил; R2 представляет СН3, СН3-СН2, СН2=СН-СН2, СН≡СН2, С6Н4-СН2; п-NO2-С6Н4-СН2, СН3СН2ОСО-СН2;
Ar1 представляет 1,3-бромбензодиоксол-5-ил; R1 представляет н-бутил; R2 представляет СН3-СН2;
Ar1 представляет п,м-ОСН3-С6Н4; R1 представляет н-бутил; и R2 представляет СН3СН2;
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет СН3; R2 представляет С6Н6 или п-ОН-С6Н4;
R представляет R3HN и
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет СН3; R2 представляет Н, СН3-(СН2)2, СН3-(СН2)3, п-СООН-С6Н4СН2;
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет СН3-(СН2)3; R2 представляет СН3-(СН2)2 или СН3-(СН2)3;
Ar1 представляет 1,3-бензодиоксол-5-ил; R1 представляет С6Н5; R2 представляет СН3-(СН2)2;
Ar1 представляет п-ОН-м-ОСН3-С6Н4 или м,п-ОН-С6Н4; R1 представляет Н, и R2 представляет Н.
Эти новые производные в их применении в качестве лекарственных средств также входят в объем изобретения.
Таким образом, изобретение относится к фармацевтическим композициям, включающим терапевтически эффективное количество производных формулы (I), определенных выше.
Как показывают значения IC50, приведенные в примерах, соединения, определенные выше, являются мощными ингибиторами киназы DYRK1A, и в этом качестве полезны одновременно как фармакологические средства для фундаментальных исследований, так и как терапевтические агенты для лечения нейродегенеративных заболеваний, в частности, болезни Альцгеймера и других таупатий, болезни Пика и трисомии 21.
Производные формулы I, или новые производные в соответствии с изобретением, действительно представляют средства, позволяющие изучать функции DYRK1A в различных клеточных моделях, и последствия ее экспресии и аномальной активности. Они представляют действующие начала лекарственных средств для противостояния эффектам сверхэкспрессии/аномальной активации DYRK1A при вышеуказанных патологиях.
При производстве лекарственных средств, действующие начала, применяемые в терапевтически эффективных количествах, смешивают с фармацевтически приемлемыми носителями для выбранного способа введения.
Так, для орального введения лекарственные средства готовят в форме желатиновых капсул, таблеток, драже, капсул, пилюль, капель и тому подобного. Такие лекарственные средства могут содержать от 1 до 100 мг действующего начала в единичной дозе.
Для инъекционного введения (внутривенного, подкожного, внутримышечного) лекарственные средства представлены в форме стерильных или стерилизуемых растворов. Дозы для разового приема могут изменяться от 1 до 50 мг действующего начала. Ежедневную дозировку выбирают таким образом, чтобы достичь конечной концентрации аналога или производного имидазолона в крови подвергаемого лечению пациента не более 100 мкМ.
В соответствии с еще одним аспектом, настоящее изобретение также относится к способу получения производных имидазолона формулы I, определенных выше. Этот способ отличается тем, что он включает применение арилиденового производного тиогидантоина, соответствующего формуле 3
в которой
R1, R2, Ar1 определены выше.
Согласно способу осуществления, относящемуся к получению производных имидазолона формулы I, в которой R представляет R2S, способ изобретения включает реакцию производного тиогидантоина 3 с галогенпроизводным 3' формулы
где Х представляет Cl, Br или I,
в условиях, позволяющих получить производное имидазолона 4 по следующей схеме 4
Выгодно проводить реакцию между соединениями 3 и 3' в органическом растворителе при температуре от 70 до 100ºС, а именно от 80ºС, в присутствии карбоната.
Для получения более конкретных производных формулы (I), в которых R2 является арильным радикалом, способ изобретения включает реакцию производного тиогидантоина 3 с арилбороновой кислотой 7' формулы
в условиях, позволяющих перейти к производным формулы 8 по схеме 1'
Удовлетворительные условия соответствуют реакции при микроволновом облучении тиогидантоина с бороновой кислотой в присутствии Cu(AcO)2 (где Ас представляет ацетил) и фенантролина в органическом растворителе, таком как дихлорэтан.
Смесь облучают 50-100 минут, а именно от 60 до 90 минут, при 70-90ºС, а именно при 80ºС, при максимальной мощности приблизительно 300 Ватт.
Согласно способу осуществления, относящемуся к получению производных имидазолона формулы I, в которой R представляет R3NH, способ изобретения включает
либо реакцию производного имидазолона 4, как указано выше, с амином 4' формулы
в условиях, позволяющих получить по схеме 2, приведенной ниже, производное имидазолона 5 формулы
либо реакцию производного гидантоина 3, как указано выше, с амином 4' по следующей схеме 3
Предпочтительно, реакцию по схеме 3 проводят на масляной бане или при микроволновом облучении. В способе проведения на масляной бане реакционную смесь нагревают до температуры, ниже температуры кипения амина.
Когда работают с микроволнами, смесь выгодно облучать от 10 до 100 минут до подходящей температуры при подходящей мощности.
Реакцию по схеме 3 выгодно проводить в растворителе, таком как метанол, в присутствии гидропероксида.
Согласно способу осуществления, относящемуся к получению производных имидазолона формулы I, в которой R представляет R4CONH, способ изобретения включает реакцию производного имидазолона 5 формулы
с хлорангидридом кислоты 5' формулы
в условиях, позволяющих получить производное имидазолона 6 по следующей схеме 4:
Заместители в этих различных формулах определены выше.
Подходящие условия для проведения реакции между этими производными включают добавление триэтиламина, затем хлорангидрида кислоты (5') к раствору производного имидазолона 5 в органическом растворителе, таком как ТГФ.
Эту реакцию выгодно проводить при температуре порядка 20-25ºС.
Для получения производных имидазолона формулы I, в которой R представляет Ar2, способ изобретения включает реакцию производного тиогидантоина формулы 3 с бороновой кислотой 7'
в условиях, позволяющих получить производное имидазолона 7 по следующей схеме 5
Эту реакцию выгодно проводить в присутствии катализатора, такого как Pd(PPh3)4 и CuTC (тиофенкарбоксилат меди) в безводном органическом растворителе, таком как безводный ТГФ. Эту реакцию выгодно проводить при температуре порядка 55-65ºС.
Особенно предпочтительным образом производное тиогидантоина 3 получают реакцией производного тиогидантоина 2 формулы
с производным альдимина формулы 2'
заместители определены выше, и «alk» представляет С3-С5 алкильный радикал, по следующей схеме 6
Реакцию выгодно проводить на масляной бане или при облучении микроволнами.
В способе выполнения на масляной бане реагенты перемешивают в органическом растворителе, и реакционную смесь выдерживают при кипячении с обратным холодильником. Вязкое масло, которое быстро кристаллизуется, выделяют после фильтрации и при желании очищают.
Среди подходящих органических растворителей указан ацетонитрил.
В способе выполнения при облучении микроволнами смесь тиогидантоина формулы 2 и альдимина формулы 2' помещают в микроволновой реактор, помещенный в микроволновую печь, в которой смесь облучают, затем, по завершении реакции и охлаждении до температуры окружающей среды, выделяют продукт реакции.
Подходящие условия включают обработку в течение приблизительно 1 часа при 70-100ºС, а именно при 80ºС, при максимальной мощности 80-100 Ватт, более конкретно 90 Ватт.
Альдимин 2' получают, например, исходя из альдегида 2'' Ar1-CH=O и пропиламина 2''' CH3-(CH2)2-NH2. Эту реакцию выгодно проводить в микроволновом реакторе при мощности 300 Ватт, например при 20-80ºС, а именно 25-60ºС, в течение 2-5 минут, а именно 3 минут, затем при 60-80ºС при пониженной мощности порядка 10-30%, а именно 20%.
Производное тиогидантоина 2 получают реакцией гидрохлорида метилглицината 1
с изотиоцианатом 1' формулы
по следующей схеме 7
Удовлетворительные условия реакции включают реакцию 1 и 1' в присутствии триэтиламина, в растворителе, таком как эфир, при кипячении с обратным холодильником.
Промежуточные соединения в этих различных стадиях осуществления являются новыми, и в этом качестве также входят в область изобретения.
Другие характеристики и преимущества изобретения приведены в примерах, которые, следуя способу осуществления изобретения, направлены на получение производных имидазолона по изобретению.
В качестве иллюстрации, экспериментальные условия реакций, обозначенных А-Н, показанных на фиг.1, приведены в последующей экспериментальной части.
Значения IC50 соединений по изобретению в мкМ в отношении DYRK1A даны далее в Таблице 2 в части, относящейся к активности киназы DYRK1A.
Экспериментальная часть
Таблица 1
РЕАКЦИЯ А:
Общий способ осуществления: Смесь, состоящую из 7 ммоль изотиоцианата (R1N=C=S), 7 ммоль (0,88 г) гидрохлорида метилглицината 1, 7 ммоль (0,97 г) триэтиламина в 15 мл эфира кипятят в течение 14 часов с обратным холодильником при интенсивном перемешивании магнитной мешалкой. После охлаждения реакционной среды до температуры окружающей среды растворитель удаляют при пониженном давлении на роторном испарителе. Гидрохлорид триэтиламина высаживают этилацетатом. После фильтрации на фильтре из спеченного стекла с пористостью № 4 фильтрат концентрируют на роторном испарителе при пониженном давлении и получают ожидаемый продукт 2. Последний затем применяют без дополнительной очистки.
Пример соединения 2:
3-Метил-2-тиоксо-имидазолидин-4-он (R1 представляет Ме).
Выход 95%. Т. пл. 170-172ºС. 1Н ЯМР (200 МГц, CDCl3, ТМС) δ: 3,27 (с, 3Н, NCH3); 4,11 (с, 2Н, -СН2-); 7,64 (ушир.с, 1Н, NH). 13С ЯМР (75 МГц, CDCl3, ТМС) δ: 27,5 (NCH3); 48,6 (-СН2-); 171,6 (С=О); 185,4 (C=S).
РЕАКЦИЯ B:
Общий способ осуществления на масляной бане: В сосуд, снабженный магнитной мешалкой, последовательно загружают дихлорметан (20 мл), 6,9 ммоль тиогидантоина 2, затем 6,9 ммоль свежеперегнанного альдимина (*). Реакционную смесь затем кипятят с обратным холодильником в дихлорметане, и реакцию контролируют хроматографией в тонком слое на силикагеле 60F 254 (Merck). Как только реакция завершается, реакционную среду охлаждают до температуры окружающей среды, затем сушат над безводным MgSO4. После фильтрации через складчатый бумажный фильтр растворитель из фильтрата удаляют выпариванием при пониженном давлении и получают вязкое масло, которое быстро кристаллизуется при температуре окружающей среды. Очистку выполняют или перекристаллизацией из пентана, или необязательно тонкослойной хроматографией на силикагеле 60 F 254 (Merck) в подходящем растворителе.
Общий способ осуществления при микроволновом облучении: Смесь, состоящую из 10 ммоль тиогидантоина 2 и 10 ммоль (1 эквивалент) альдимина (*), помещают в микроволновый реактор в форме цилиндра (⌀ 4 см). Затем реактор помещают в микроволновую печь Syntheware 402 (производитель Prolabo, группа Merck-Eurolab), оснащенную лопастной системой перемешивания. Смесь облучают в течение 1 часа при 80°С (ступенчато, по 3 минуты) максимальной мощностью 90 Ватт (микроволновая печь Prolabo). После охлаждения до температуры окружающей среды реакционную смесь затем концентрируют на роторном испарителе. К остатку после выпаривания добавляют смешанный раствор хлороформ/пентан (1/2). После обработки этой смеси отфильтровывают нерастворимое твердое вещество на фильтре из спеченного стекла с пористостью № 4, после чего сушат при пониженном давлении.
Пример соединения 3:
(5Z)-5-(1,3-Бензодиоксол-5-илметилен)-3-метил-2-тиоксоимидазолидин-4-он (Ar1 представляет 1,3-бензодиоксол-5-ил, R1 представляет Ме)
Выход 87%. Желтый порошок, т. пл. 253-255°С. 1Н ЯМР (200 МГц, ДМСО-d6) δ: 3,18 (с, 3Н, NCH3); 6,09 (с, 2Н, ОСН2О); 6,54 (с, 1Н, С=СН); 6,96 (д, 1Н, J=8,1 Гц, Н-5); 7,27 (д, 1Н, J=8,1 Гц, Н-6); 7,45 (с, 1Н, Н-2); 12,22 (ушир.с, 1Н, NH). 13С ЯМР (75 МГц, ДМСО-d6) δ: 27,6 (NCH3); 102,1 (ОСН2О); 109,1 (С-5); 109,8 (С-2); 113,7 (С=СН); 125,1 (С=СН); 126,9 (С-6); 126,9 (С-1); 148,4 (С-4); 149,0 (С-3); 164,6 (С=О); 179,0 (C=S). МСВР, m/z: 262,0409 (вычислено для C12H10N2O3S: 262,0412).
(*) Общий способ осуществления для синтеза альдиминов: 20 ммоль альдегида и 40 ммоль (3,28 мл) пропиламина последовательно вливают в кварцевый реактор. Эту реакционную среду нагревают в микроволновом реакторе Synthewave (Pmax = 300 Ватт, производитель Prolabo, группа Merck-Eurolab) по следующей программе (от 25 до 60°С в течение 3 минут, затем при 60°С в течение 30 минут при мощности 20%). Избыток пропиламина удаляют на роторном испарителе при частичном разрежении, затем остаток выпаривания (твердая фаза) переводят в раствор в дихлорметане (10 мл/г продукта); органический раствор затем сушат над MgSO4, фильтруют через бумажный фильтр. Фильтрат концентрируют на роторном испарителе при пониженном давлении.
Пример альдимина:
N-[(1,3)-бензодиоксол-5-илметилен]-N-припиламин (Ar1 представляет 1,3-бензодиоксол-5-ил):
Выход 97%. Желтый порошок. 1Н ЯМР (200 МГц, CDCl3) δ: 0,90 (т, 3Н, J=7,3 Гц, NCH2CH2CH3); 1,64 (т, 2Н, J=7,2 Гц, NCH2CH2CH3); 3,47 (т, 2Н, J=6,9 Гц, NCH2CH2CH3); 5,90 (с, 2Н, ОСН2О); 6,71 (д, 1Н, J=7,9 Гц, Н-5), 7,02 (дд, 1Н, J=1,3; 7,9 Гц, Н-6); 7,37 (д, 1Н, J=1,4 Гц, Н-2); 8,10 (с, 1Н, N=CН). 13С ЯМР (75 МГц, CDCl3) δ: 12,2 (CH3); 24,5 (СН2СН3); 63,7 (NCH2); 101,8 (ОСН2О); 107,0 (С-3); 108,4 (С-6); 124,5 (С-2); 131,6 (С-1); 148,6 (С-5); 150,0 (С-4); 160,3 (N=CН).
РЕАКЦИЯ С:
Общий способ осуществления: В сосуд последовательно загружают 5-арилидентиогидантоин 3 (3,1 ммоль, 1 экв.), 20 мл ацетонитрила, галогенпроизводное R2X, где X представляет Cl, Br, I (3,1 ммоль, 1 экв.), и 0,21 г К2СО3 (1,5 ммоль 0,5 экв.). Реакционную смесь нагревают при 80°С в течение 14 часов при интенсивном перемешивании магнитной мешалкой. После охлаждения до температуры окружающей среды ацетонитрил удаляют на роторном испарителе при пониженном давлении. В реакционную среду добавляют 20 мл эфира. После отфильтровывания при частичном разрежении нерастворимых неорганических продуктов через фильтр из спеченного стекла с пористостью № 4 фильтрат сушат над сульфатом магния, затем фильтруют через складчатый бумажный фильтр. Растворитель фильтрата удаляют на роторном испарителе при пониженном давлении и получают ожидаемый имидазолон 4 в форме порошка.
Пример соединения 4:
[(Z)-(4-бензо[1,3]диоксол-5-илметилен-1-метил-5-оксо-4,5-дигидро-1Н-имидазол-2-илсульфанил)]этилацетат (Ar1 представляет 1,3-бензодиоксол-5-ил, R1 представляет Ме, R2 представляет CH2CO2Et)
Выход 92%. Желтый порошок, т.пл. 172-174°С. 1Н ЯМР (300 МГц, CDCl3) δ: 1,26 (т, 3Н, J=7,1 Гц, ОСН2СН3); 3,12 (с, 3Н, NMe); 4,02 (с, 2Н, SCH2); 4,23 (кв, 2Н, J=7,1 Гц, ОСН2СН3); 5,96 (с, 2Н, ОСН2О); 6,80 (д, 1Н, J=8,1 Гц); 6,84 (с, 1Н, =СН); 7,52 (дд, 1Н, J=8,1; 1,3 Гц); 7,96 (д, 1Н, J=1,3 Гц). 13С ЯМР (75 МГц, CDCl3) δ: 14,1 (кв.м, J=128 Гц, ОСН2СН3); 26,6 (кв, J=144 Гц, NMe); 32,9 (т, J=144 Гц, SCH2); 62,3 (т.кв, J=148 Гц; 4,6 Гц, ОСН2); 101,5 (т, J=174 Гц, ОСН2О); 108,4 (д, J=165 Гц); 110,8 (дт, J=168 Гц; 6,9 Гц); 124,6 (дт, J=156 Гц; 4,1 Гц); 128,4 (дт, J=162 Гц; 6,0 Гц); 128,9 (д, J=7,6 Гц); 136,6 (с); 148,0 (м, =С-О); 149,3 (м, =С-О); 162,0 (м, С-2); 168,0 (м, С=О(CO2Et)); 169,7 (м, С-4). МСВР, m/z: 348,0791 (вычислено для С16Н16N2O5S: 348,0780).
РЕАКЦИЯ D:
Общий способ осуществления при микроволновом облучении: Смесь, состоящую из (5Z)-5-арилиден-2-алкилтио-3,5-дигидроимидазол-4-она 4 (4 ммоль, 1 экв.) и 5-20 ммоль аминоспирта R3-NH2 (от 1,5 до 5 эквивалентов) помещают в микроволновый реактор в форме цилиндра (⌀ 4 см). Затем реактор помещают в микроволновую печь Synthewave 402 (производитель Prolabo, группа Merck-Eurolab), снабженную лопастной системой перемешивания. Смесь облучают в течение от 15 минут до 90 минут при подходящей температуре и мощности. После охлаждения до температуры окружающей среды реакционную смесь затем концентрируют на роторном испарителе. К остатку от выпаривания прибавляют этанол (1 мл/г продукта). После растирания смеси с этанолом нерастворимые твердые вещества отфильтровывают на фильтре из спеченного стекла с пористостью №4, после сушат при пониженном давлении. Полученное необязательно перекристаллизовывают из этанола.
Способ осуществления на масляной бане: Суспензию, состоящую из (5Z)-5-арилиден-2-алкилтио-3,5-дигидроимидазол-4-она 4 (4 ммоль, 1 экв.) и алифатического амина (40 ммоль, 10 эквивалентов) смешивают при интенсивном перемешивании магнитной мешалкой и нагревают при температуре, которая на 10°С ниже или равна температуре кипения этого амина (Тэксп.=Ткип.амина-10°С), в течение от 3 до 7 дней. После охлаждения до температуры окружающей среды летучие продукты удаляют при пониженном давлении, и в реакционную среду добавляют эфир (~ 10 мл). Затем, продукты, нерастворимые в эфире, отделяют фильтрацией на фильтре из спеченного стекла с пористостью № 4. Растворитель, оставшийся в соединении 5, удаляют при частичном разрежении в эксикаторе в течение 2 часов, и получают ожидаемый 2-амино-имидазолон 5 в виде желтого порошка.
Пример 2-амино-имидазолона 5:
(5Z)-5-бензо[1,3]диоксол-5-илметилен-1-метил-2-пропиламино-3,5-дигидроимидазол-4-он (Ar1 представляет 1,3-бензодиоксол-5-ил, R1 представляет Ме, R3 представляет CH2CН2СН3)
Выход 48%. Желтый порошок, т.пл. 190-192°С. 1Н ЯМР (300 МГц, CDCl3) δ: 1,02 (т, 3Н, J=7,4 Гц); 1,74 (секст, 2Н, J=7,3 Гц, NHCH2CH2); 3,11 (с, 3Н, NMe); 3,54 (т, 2Н, J=6,2 Гц, NHCH2C2H5); 4,95 (ушир.с, 1Н, NH); 5,98 (с, 2Н); 6,62 (с, 1Н, =СН); 6,81 (д, 1Н, J=8,1 Гц); 7,34 (дд, 1Н, J=8,1 Гц; 1,4 Гц); 7,99 (д, 1Н, J=1,2 Гц). 13С ЯМР (75 МГц, CDCl3) δ: 11,5 (кв. т, J=126; 4,0 Гц, NС2Н4Me); 22,8 (т.кв, J=135; 3,7 Гц, NСН2СН2); 25,2 (кв, J=140 Гц, NMe); 43,7 (т.кв, J=122 Гц; 7,0 Гц, NНСН2); 101,1 (т, J=173 Гц, C-7'); 108,4 (д, J=164 Гц, C-2'); 110,3 (дт, J=166; 7,1 Гц; С-6); 116,8 (дт, J=157 Гц; 3,5 Гц); 126,1 (дт, J=163; 6,2 Гц; С-6'); 130,2 (д, J=7,8 Гц; С-5'); 138,1 (с, С-5); 147,6 (м, С-3'); 147,7 (м, С-4'); 157,2 (м, С-4); 170,4 (с.м, С-2). МСВР, m/z: 287,1279 (вычислено для С15Н17N3О3: 287,1270).
РЕАКЦИЯ Е:
Общий способ осуществления: К раствору 0,2 ммоль 2-амино-имидазола 5 (R3 представляет Н, R1 представляет Ме) в ТГФ (2 мл) добавляют при 0°С триэтиламин (2 эквив