Вакцина против цитомегаловируса и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области вакцинологии и клеточной биологии. Предложен способ получения вакцины против цитомегаловируса за счет выбора клеточного типа, в котором реилицируется этот вирус, вакцина и способ иммунизации особи против ЦМВ. 4 н.п. и 15 з.п. ф-лы, 6 ил, 6 табл., 1 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области разработки вакцин. А именно, настоящее изобретение относится к способам увеличения диверсификации вакцин против цитомегаловируса за счет выбора клеточного типа, в котором реплицируется этот вирус, и применению цитомегаловируса, полученного этими способами, в разработке композиций вакцин.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Различные публикации, включая патенты, опубликованные заявки, технические и научные статьи цитируются на протяжении всего данного описания. Каждая из цитируемых публикаций включена в данный документ путем ссылки во всей полноте. Полные цитаты публикаций, указанных номерами ссылок в скобках или не цитируемых полностью в рамках данного описания, приведены в конце данного описания.
Цитомегаловирус представляет собой герпесвирус, в классификации отнесенный к членам бета-подсемейства герпесвирусов. Согласно Центру по контролю и профилактике инфекционных заболеваний цитомегаловирусная инфекция распространена у человека практически повсеместно, при этом по расчетам в США этим вирусом инфицировано 40-80% населения. Вирус распространяется преимущественно через биологические жидкости и часто передается от беременных женщин плоду или новорожденному. У большинства людей цитомегаловирусная инфекция протекает в латентной форме, хотя активация вируса может проявляться высокой лихорадкой, ознобами, повышенной утомляемостью, головной болью, тошнотой и спленомегалией.
Хотя большинство случаев цитомегаловирусных инфекций у человека протекают бессимптомно, у лиц с незрелой иммунной системой или иммунодефицитом, таких как новорожденные, ВИЧ-положительные, пациенты, перенесшие аллотрансплантацию, и онкологические пациенты, цитомегаловирусные инфекции могут вызывать проблемы. Цитомегаловирусная инфекция у таких лиц может вызывать тяжелые осложнения, включая пневмонию, гепатит, энцефалит, колит, увеит, ретинит, слепоту и нейропатию среди других пагубных последствий. Кроме того, цитомегаловирус является ведущей причиной врожденных аномалий. В настоящее время терапевтической или профилактической вакцины против цитомегаловирусной инфекции не существует.
Проникновение герпесвирусов в клетки представляет собой сложный процесс, который запускается адсорбцией и связыванием рецептора с последующим слиянием оболочки вируса с клеточной мембраной. Слияние происходит либо на плазматической мембране, либо на эндосомальной мембране. Например, вирус Эпштейна-Барр (ВЭБ) проникает преимущественно в В-лимфоциты путем эндоцитоза, опосредованного рецептором (1, 2), Однако он инфицирует эпителиальные клетки или трансформированные В-лимфоциты путем слияния оболочки вируса с плазматической мембраной (1). Вирус простого герпеса сливается с плазматической мембраной некоторых клеточных типов, а у других проникает путем эндоцитоза (3-6). Человеческий цитомегаловирус инфицирует различные клеточные типы in vivo, включая эпителиальные клетки, эндотелиальные клетки и фибробласты (7). Он сливается с плазматическими мембранами фибробластов (8), но в клетки пигментного эпителия сетчатки и эндотелиальные клетки пупочной вены он проникает путем эндоцитоза (9, 10).
Механизм, с помощью которого герпесвирусы «выбирают» путь проникновения, остается неясным. Принято считать, что пути проникновения в основном определяются клеткой хозяина, но имеются и данные о роли гликопротеинов вириона, определяющих тропизм (11). Вирионы ВЭБ содержат два gH-комплекса, gH/gL и gH/gL/gp42 (12, 13), которые обладают взаимоисключающими функциями (11). Слияние с плазматической мембраной В-лимфоцитов опосредовано gH/gL/gp42 (14-16). Но проникновение в эпителиальные клетки запускается gH/gL (11, 12, 17). Клеточный тип, в котором реплицируется ВЭБ, может менять его тропизм. Вирионы ВЭБ - производные В-лимфоцитов - содержат меньше gH-gL-gp42, чем вирионы - производные эпителиальных клеток. В итоге вирус, генерируемый В-лимфоцитами, является более инфекционным для эпителиальных клеток, а вирус - производное эпителиальных клеток - обладает тропизмом к В-лимфоцитам (18).
Человеческий цитомегаловирус также кодирует два gH/gL-комплекса: gH/gL/gO и gH/gL/pUL128/pUL130/ pUL131 (19, 20). gO-содержащий комплекс достаточен для инфицирования фибробластов, в то время как pUL128/pUL130/pUL131-содержащий комплекс необходим для инфицирования эндотелиальных и эпителиальных клеток (19-21). Лабораторный штамм AD 169 содержит только gH/gL/gO-комплекс в вирионах (19). Отсутствие второго gH/gL-комплекса обусловливает потерю тропизма к эпителиальным и эндотелиальным клеткам у лабораторных штаммов человеческого цитомегаловируса (19-22).
Имеется потребность в разнообразии и диверсификации вакцины против цитомегаловируса, а также в эффективных средствах контроля распространения и активации вируса, особенно у лиц с иммунодефицитом и беременных женщин. Настоящее изобретение отвечает этой потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один аспект настоящего изобретения относится к способу получения вакцин против цитомегаловируса. Этот способ включает культивирование вируса или изолятов цитомегаловируса в клеточных культурах отдельных клеточных типов с получением таким образом цитомегаловируса, кондиционированного клеточным типом, и получение вакцины против цитомегаловируса из цитомегаловируса, кондиционированного клеточным типом. В некоторых вариантах штамм или изолят цитомегаловируса является штаммом или изолятом человеческого цитомегаловируса. Для данного способа пригодны разнообразные клеточные типы, включая, но не ограничиваясь перечисленным, эпителиальные клетки, эндотелиальные клетки, фибробласты, нейроны, гладкомышечные клетки, макрофаги, дендритные клетки и стромальные клетки. В конкретном варианте выбранный клеточный тип представляет собой эпителиальную клетку.
Вышеупомянутый способ может дополнительно включать получение цитомегаловируса, кондиционированного клеточным типом или двумя или больше различными выбранными клеточными типами и комбинирование этих цитомегаловирусов для получения вакцины против цитомегаловируса. Иначе или дополнительно данный способ включает две или больше культуры клеток, содержащих выбранный клеточный тип или два или больше различных клеточных типа, и комбинирование всех полученных цитомегаловирусов для получения вакцины против цитомегаловируса.
В некоторых вариантах данный способ включает получение живой аттенуированной вакцины против цитомегаловируса. В других вариантах он включает получение инактивированной или убитой вакцины против цитомегаловируса. Еще в других вариантах он включает получение комбинированных вакцин, содержащих один или несколько живых аттенуированных вирусов, инактивированных вирусов и другие иммуногенные компоненты, например, иммуногенные белки и пептиды цитомегаловируса и им подобные.
Вакцины против цитомегаловируса, которые получают вышеупомянутыми способами, также входят в объем настоящего изобретения.
Другой аспект настоящего изобретения относится к набору для осуществления способов настоящего изобретения. Такие наборы обычно включают упаковку, в которой содержатся один или несколько штаммов или клинических изолятов цитомегаловируса, клеточных культур одного или нескольких выбранных клеточных типов и инструкции по использованию клеточных культур и штаммов или изолятов цитомегаловируса для получения кондиционированного клеточным типом цитомегаловируса для применения в вакцине против цитомегаловируса.
Другой аспект настоящего изобретения включают композицию вакцин, включающую популяцию цитомегаловируса или компоненты вирионов данной популяции, смешанные с соответствующим фармацевтическим носителем или адъювантом, где популяцию цитомегаловируса выделяют из клеточной культуры выбранного клеточного типа. В одном варианте выбранный клеточный тип представляет собой эпителиальный клеточный тип. В одном варианте композиция вакцины включает человеческий цитомегаловирус.
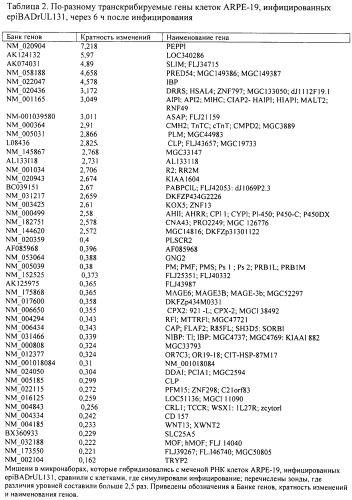
В различных вариантах композиции вакцин популяция цитомегаловируса, выделенная из культуры эпителиальных клеток, характеризуется одним или несколькими особенностями в инфицированных впоследствии клетках хозяина, включая, но не ограничиваясь перечисленным: а) проникновение в клетки хозяина путем слияния с плазматическими мембранами клеток хозяина; б) более выражение слияние клеток хозяина, опосредованное вирионом, по сравнению с эквивалентной популяцией цитомегаловируса, выделенного из культуры фибробластов; в) ускоренную репликацию вируса в клетках хозяина по сравнению с эквивалентной популяцией цитомегаловируса, выделенного из культуры фибробластов; г) индукцию клеточного ответа, включающего изменение экспрессии не менее чем в 2,5 раза генах, число которых примерно на две трети меньше чем при ответе, вызванном эквивалентной популяцией цитомегаловируса, выделенного из культуры фибробластов через 10 часа после инфицирования; или д) индукцию клеточного ответа, включающую изменение экспрессии одного или нескольких генов, как показано в таблице 2 и таблице 4 данного документа, при этом последние представлены в Банке генов под входящими номерами; АК094860, NM_145023, NM-133492, NM_001039580. NM_001004301, NM-001034, А1369525, АК123066, NM_005345, NM_020731, BC071797, NM-003414, NM_000800, NM_138467, AK090803, AL133118, NM-00165, BG001037, NM_024861, NM-001043, NM-016239, NM-001018084, NM-001037442, NM-017600, NM_022097, NM-175868, NM_032266, NM_003841, NM_005039, NM_14505 1, NM_004294, AW856073, NM_024050, AF085968, NM-080927, NM_022115, AK056703, NM_000808, NM-012377, NM_006793, NM_031466, NM_005185, NM-139173, BX360933, NM-016125, NM_002104, NM-032188, NM_004185, NM-004843 или NM-173550.
В некоторых вариантах композиция вакцины включает популяцию цитомегаловируса или компоненты его вириона, выделенные из клеточной культуры одного или нескольких выбранных клеточных типов. Например, популяция цитомегаловируса может быть выделена из эпителиальных клеток и клеток другого клеточного типа, такого как клеточный тип фибробластов. В других вариантах популяция цитомегаловируса включает два или несколько штаммов или клинических изолятов цитомегаловируса, выращенного в выбранном клеточном типе. Некоторые варианты могут включать множество штаммов или клинических изолятов цитомегаловируса, выращенного в клеточных культурах множества различных клеточных типов.
В одном варианте композиция вакцины включает живую аттенуированную вакцину против цитомегаловируса. В другом варианте она включает инактивированную вакцину против цитомегаловируса. Еще в других вариантах композиция вакцины может быть комбинацией вакцин, включающей один или несколько штаммов живого аттенуированного вируса или его компонентов, инактивированный вирус или его компоненты и (или) другие иммуногенные пептиды или белки цитомегаловируса.
Другой аспект настоящего изобретения включает способ иммунизации субъекта против цитомегаловируса, включающий введение данному субъекту композиции вакцины против цитомегаловируса, произведенной вышеупомянутыми способами и (или) включающими вышеупомянутые свойства. В одном варианте субъектом, которого предстоит иммунизировать, является человек.
Другие особенности и преимущества настоящего изобретения будут понятны из рисунков, подробного описания и примеров, приведенных ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1. Кинетика экспрессии IE1 человеческого цитомегаловируса в клетках ARPE-19. А) Инфицированные клетки (0,1 БОЕ/клетку) смешали в указанные сроки и окрасили на IE1 (зеленый цвет на цветной фотографии, светло-серый цвет на черно-белой фотографии), Sp100 (красный цвет на цветной фотографии, очень темный цвет на черно-белой фотографии) и ДНК (синий цвет на цветной фотографии, темно-серый цвет на черно-белой фотографии). Б) В различные сроки после инфекции (0,1 БОЕ/клетку) подсчитали процент IE1 - экспрессирующих клеток; результаты показаны на диаграмме.
Фиг.2. Электронно-микроскопический анализ проникновения человеческого цитомегаловируса в клетки ARPE-19. Частицы epiBADrUL131 или fibroBADrUL131 (50 БОЕ/клетку) связывали с клетками при 4°С, а затем оставляли при 37°С на 15 мин, чтобы обеспечить интернализацию. Представлены репрезентативные рисунки.
Фиг.3. Влияние ингибиторов окисления эндосом и источника вириона на проникновение человеческого цитомегаловируса в клетки ARPE-19. Эксперименты проводили в трех копиях и подсчитывали число положительных клеток после обработки лекарственным средством в сравнении с необработанными культурами. А) Клетки предварительно обрабатывали NH4Cl или бафломицином А (БФА) в течение 1 ч, инокулировали epiBADrUL131 или fibroBADrUL131 (1 БОЕ/клетку) и через 16 ч окрашивали на IE1. Б) Клетки предварительно обрабатывали 50 моль NH4Cl или 40 мМоль БФА в течение 1 ч, инокулировали BADrUL131 (0,1 БОЕ/клетку) или FIXwt (0,01 БОЕ/клетку) и через 16 ч окрашивали на IE1.
Фиг.4. Слияние клеток ARPE-19, индуцированное вирусом - производным эпителиальных клеток. А) Клетки инокулировали epiBADrUL131 или fibroBADrUL131 (20 БОЕ/клетку) и затем держали в среде, содержащей 200 мкг/мл БФА. Через 16 ч после инфицирования получали фазовоконтрастные изображения. Б) Смесь репортерных и эффекторных клеток инфицировали epiBADrUL131 или fibroBADrUL131 (20 БОЕ/клетку) при 4°С в течение 1 ч. Затем культуру держали при 37°С в течение 6 ч, после чего измеряли относительную активность люциферазы.
Фиг.5. Влияние pUL130-специфичного нейтрализующего антитела на инфекцию и проникновение человеческого цитомегаловируса. А) Вирусы - производные эпителиальных клеток или фибробластов - инкубировали с различными концентрациями антитела к pUL130 и определяли остаточную инфективность. Б) Частицы вирусов - производных эпителиальных клеток или фибробластов - предварительно обрабатывали антителом к pUL130 в конечной концентрации 20 мкг/мл или фосфатным буфером, а затем адсорбировали на клетках ARPE-19 при 4°С в течение 1 ч. Клетки дважды отмывали холодным фосфатным буфером и экстрагировали вирусную ДНК, связанную с клетками, чтобы определить относительное число частиц, связанных в клетками. Или клетки оставляли при 37°С на 2 ч, чтобы обеспечить проникновение вируса. Вирионы, не проникшие в клетки, удаляли с помощью обработки ЭДТК-трипсином. Интернализованную вирусную ДНК впоследствии измеряли с помощью ПЦР в режиме реального времени.
Фиг.6. Модуляция транскритома ARPE-19 человеческим цитомегаловирусом, полученным в эпителиальных клетках и фибробластах. А) Диаграмма Венна отображает распределение генов, регулируемых различным образом, через 6 ч или 10 ч после инфицирования epiBADrUL131 или fibroBADrU1131 (3 БОЕ/клетку) по сравнению с симуляцией инфекции. Б) Изменения относительных концентраций РНК, измеренных с помощью ПЦР в режиме реального времени. Исследованные гены представляют собой ген гидрометилбилансинтазы (HMBS, NM_000190), ген 1, связанный с патогенезом GLI (глиома) (GIiPR, NM_006851), ген, связанный с пентраксином, быстро индуцируемый ИД-1 бета (РТХ3, NM_002852), ген 2'-5'-олигоаденилатсинтетазы 3 (OAS3, NM_006187), ген белка 44, индуцируемого интерфероном (IFI44, NM_006417), гомолог В вирусного онкогена, связанного с ретикулоэндотелиозом, ген-энхансер ядерного фактора легкой цепи полипептида 3 в В-лимфоцитах (relB, NM_006509) и АТФ-связывающую кассету, подсемейство С (CFTR/MRP), член 3 (MRP3, NM_003786).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В тексте данного описания и формулы изобретения используются различные термины, связанные со способами и другими аспектами настоящего изобретения. Если не указано иначе, все технические и научные термины, использующиеся в данном документе, имеют то же значение, что обычно понимает специалист в данной области техники, к которой относится настоящее изобретение. Хотя на практике для тестирования настоящего изобретения можно использовать любые способы и материалы, схожие или эквивалентные тем, что описаны в данном документе, предпочтительны материалы и способы, описанные в данном документе. В описании настоящего изобретения и формуле изобретения будет использоваться следующая терминология. Следует понимать, что терминология, использующаяся в данном документе, предназначена только для описания определенных вариантов и не налагает каких-либо ограничений.
Определения:
Согласно использованию в данном описании и приложенной формуле изобретения существительные в единственном числе включают и соответствующее множественное число, если содержание документа ясно не указывает иначе. Таким образом, например, термин «клетка» включает комбинацию двух или более клеток и так далее.
«Примерно», согласно использованию в данном документе, при употреблении в отношении измеряемой величины, такой как количество, длительность или так далее, означает колебания ±20%, или ±10%, или более предпочтительно ±5%, и даже более предпочтительно ±1%, и еще более предпочтительно ±0,1% от указанной величины, так как такие колебания приемлемы для осуществления описанных способов.
Термины «амплификация», «репликация» и «культивирование» в данном документе используются взаимозаменяемо и означают общий процесс введения вируса в клеточные культуры или инфицирование клеток вирусов в условиях, обеспечивающих репликацию вируса в клетках в соответствии с методиками, хорошо известными вирусологам и медико-биологам. В частности, эти термины используются в данном документе, для обозначения этапа способа, являющего предметом изобретения, при котором цитомегаловирус «кондиционируют» путем культивирования в выбранном клеточном типе в качестве этапа, предшествующего использованию кондиционированного цитомегаловируса в получении вакцины.
«Биомолекулы» включают белки, полипептиды, нуклеиновые кислоты, липиды, полисахариды и все фрагменты, аналоги, гомологи, конъюгаты и производные перечисленных соединений.
«Клеточная культура» обычно означает клетки, взятые из живого организма и выращенные при контролируемых условиях («в культуре» или «культивированные»). «Первичная клеточная культура» представляет собой культуру клеток, тканей или органов, взятых непосредственно из организма(ов) до получения первой субкультуры. «Клеточная линия» означает культуру клеток, образованную путем получения одной или нескольких субкультур из первичной клеточной культуры.
«Кодирующий район» гена состоит из остатков нуклеотидов в кодирующей цепи гена и нуклеотидов некодирующей цепи гена, гомологичных или комплементарных соответственно кодирующему району молекулы мРНК, которая получается при транскрипции этого гена.
«Кодирующий район» молекулы мРНК также состоит из остатков нуклеотидов молекулы мРНК, комплементарных району антикодона молекул транспортной РНК в ходе трансляция молекулы мРНК, или кодирующих стоп-кодом. Таким образом, кодирующий район может включать остатки нуклеотидов, соответствующие аминокислотным остаткам, которые отсутствуют в зрелом белке, кодируемом этой молекулой мРНК (например, аминокислотные остатки в последовательности экспорта сигнала белка).
Термины «кондиционированный вирус», «кондиционированный клеточным типом вирус», «кондиционированный цитомегаловирус» или «кондиционированный клеточным типом цитомегаловирус» означает цитомегаловирус, который был культивирован к выбранном клеточном типе до его применения в получении вакцины, согласно способам, описанным в данном документе. Эти термины употребляются как аналоги термина «кондиционированная среда», который описывает питательную среду, в которой выращен определенный клеточный тип или клеточная линия, после чего этот тип или линия были удалены, и которая содержит компоненты или факторы, вырабатывающиеся клетками, что таким образом меняет функциональные свойства среды. В рамках настоящей заявки термин «кондиционированный вирус» также означает вирус, который культивировали в выбранном клеточном типе и затем отделили от этих клеток, где этот вирус впоследствии проявляет одно или несколько измененных функциональных свойств в результате культивирования в этом клеточном типе.
«Кодирующий» означает естественное свойство определенных последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить матрицей для синтеза других полимеров и макромолекул в биологических процессах, при этом «кодирующий» имеет определенную последовательность нуклеотидов (т.е. рРНК, тРНК или мРНК) или определенную последовательность аминокислот и биологические свойства, обусловленные этой последовательностью. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей данному геному, приводит к образованию белка в клетке или другой биологической системе. И кодирующую цепь, нуклеотидная последовательность, которой идентична последовательности мРНК и обычно приводится в перечислении последовательностей, и некодирующую цепь, использующуюся как матрица для транскрипции гена или кДНК, можно назвать кодирующей белок или другие продукты данного гена или кДНК. Если не указано иначе, «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, являющиеся вырожденными вариантами друг друга и кодирующими одну и ту же аминокислотную последовательность. Нуклеотидные последовательности, которые кодируют белки и РНК, могут включать интроны.
«Эффективное количество» или «терапевтически эффективное количество» употребляются в данном документе взаимозаменяемо, и эти термины означают количество соединения, состава, материала или композиции согласно описанию в данном документе, эффективное для достижения определенного биологического результата. Такие результаты могут включать, но не ограничиваться перечисленным, торможение вирусной инфекции согласно определению каким-либо методом, приемлемым для данной области техники.
Согласно употреблению в данном документе, «эндогенный» означает любой материал из или вырабатывающийся в организме, клетке, ткани или системе. «Экзогенный» означает любой материал, введенный извне или вырабатывающийся вне организма, клетки, ткани или системы.
Термин «экспрессия» согласно употреблению в данном документе означает транскрипцию и (или) трансляцию определенной нуклеотидной последовательности, запускающуюся промотором.
Согласно употреблению в данном документе «иммунизация» или «вакцинация» взаимозаменяемы и применяются в отношении профилактической иммунизации или вакцинации. «Терапевтическая вакцинация» означает вакцинацию пациента с цитомегаловирусной инфекцией.
«Выделенный» означает измененный или извлеченный из естественного состояния. Например, нуклеиновую кислоту или пептид, присутствующий естественным образом у живого животного, не «выделяют», но ту же самую нуклеиновую кислоту или пептид, частично или полностью отделенный от сопутствующих материалов в его естественном состоянии, «выделяют». Выделенная нуклеиновая кислота или белок могут существовать в значительно очищенной форме или могут существовать в окружении, отличающемся от естественного, таком как, например, клетка хозяина. Если в данном документе не указано иначе, белки, комплексы вирионов, антитела и другие биологические молекулы, относящиеся к предмету настоящего изобретения, являются выделенными или могут быть выделены.
Термин «пациент», «субъект», «особь» и так далее употребляются в данном документе взаимозаменяемо и означают какое-либо животное или его клетки, in vitro или in situ, которые можно инфицировать цитомегаловирусом. В некоторых вариантах, не налагающих ограничений, пациент, субъект или особь является человеком.
«Парентеральное» введение иммуногенной композиции или композиция вакцин включает, например, подкожное (п/к), внутривенное (в/в), внутримышечное (в/м) или внутригрудинное (в/г) введение или пути введения.
Термин «полинуклеотид» согласно употреблению в данном документе определен как цепь нуклеотидов. Кроме того, нуклеиновые кислоты - это полимеры нуклеотидов. Таким образом, нуклеиновые кислоты и полинуклеотиды согласно употреблению в данном документе являются взаимозаменяемыми. Специалист в данной области техники знает, что нуклеиновые кислоты являются полинуклеотидами, которые можно гидролизовать на мономерные «нуклеотиды». Мономерные нуклеотиды можно гидролизовать до нуклеозидов. Согласно употреблению в данном документе полинуклеотиды включают, но не ограничиваются перечисленным, все последовательности нуклеиновых кислот, которые получают любым путем, известным в данной области техники, включая, но не ограничиваясь перечисленным, рекомбинантные методики, например, клонирование последовательности нуклеиновой кислоты из рекомбинантной библиотеки или клеточного генома с использованием методик клонирования или амплификации и им подобным и путем синтеза.
Согласно употреблению в данном документе термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и означают соединение, состоящее из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по крайней мере две аминокислоты, и на максимальное число аминокислот, которые могут входить в белковую или пептидную последовательность, не налагается никаких ограничений. Полипептиды включают любой пептид или белок, состоящий из двух или более аминокислот, соединенных друг с другом пептидными связями. Согласно употреблению в данном документе этот термин означает и короткие цепочки, которые также обычно называют пептидами, олигопептидами и олигомерами в данной области техники, например, и длинные цепи, которые в данной области техники обычно называют белками, к которым относится множество типов. «Полипептиды» включают, например, биологически активные варианты полипептидов, модифицированные полипептиды, производные, аналоги, гибридные белки, среди прочих. Полипептиды включают естественные пептиды, рекомбинантные пептиды, синтетические пептиды и комбинации перечисленных.
«Фармацевтически приемлемый» означает те свойства и (или) вещества, которые приемлемы для пациента с фармацевтической и (или) токсикологической точки зрения и для фармацевтического химика, занимающего производством, с физической и (или) химической точки зрения в отношении композиции, формы выпуска, стабильности, приемлемости для пациента и биодоступности. «Фармацевтически приемлемый носитель» означает среду, которая не влияет на эффективность или биологическую активность активного ингредиента(ов) и не является токсичным для хозяина, которому его вводят.
Термин «разовая упаковка» означает, что компоненты набора физически связаны в или с одной или несколькими емкостями и считаются единицей для производителя, дистрибьютора, продавца или потребителя. Емкости включают, но не ограничиваются перечисленным, пакеты, коробки, флаконы, упаковки в целлофановой оболочке, штемпелированные или прикрепленные другим путем компоненты или комбинации перечисленного. «Разовая упаковка» может также включать виртуальные компоненты. Например, набор может содержать краткие физические инструкции, имеющиеся в физической упаковке, и инструкции по доступу к более подробным инструкциям из виртуальной среды, такой как, например, Интернет-сайт.
Термин «терапевтический» согласно употреблению в данном документе означает лечение и (или) профилактику. Терапевтический эффект получают путем избежания, отсрочки, подавления, ремиссии или излечения патологического состояния, связанного с цитомегаловирусной инфекцией.
Термин «лечение» согласно употреблению в контексте настоящего изобретения означает терапевтическое вмешательство, а также профилактические или сдерживающие меры в отношении заболевания или нарушения. Таким образом, например, термин «лечение» включает введение какого-либо агента до начала или после начала какого-либо заболевания или нарушения, что тем самым предупреждает или устраняет все симптомы заболевания или нарушения. В качестве другого примера введение этого агента после появления клинических проявлений заболевания для устранения симптомов включает «лечение» этого заболевания. Оно включает, например, предупреждение распространения цитомегаловируса в неинфицированных клетках организма. Фраза «подавление цитомегаловирусной инфекции» иногда используется в данном документе и означает метод, который включает снижение уровня инфекции у пациента цитомегаловирусом, как определяют средствами, известными врачам.
Описание:
Цитомегаловирус инфицирует множество клеточных типов in vivo, включая эпителиальные клетки, эндотелиальные клетки и фибробласты. Как суммировано выше в материале о предпосылках, в различных исследованиях сообщается, что вирус сливается с плазматическими мембранами фибробластов, но проникает в клетки пигментного эпителия сетчатки и эндотелиальные клетки пупочной вены путем эндоцитоза. Из-за относительной простоты культивирования цитомегаловируса в культуре фибробластов по сравнению с культурами эпителиальных или эндотелиальных клеток исследования, такие как суммированные выше, проведены с использованием штаммов цитомегаловируса, культивированного в фибробластах. Также культура фибробластов - типичный наилучший клеточный тип для культивирования цитомегаловируса для клинических целей, таких как получение аттенуированных штаммов вируса для вакцин.
На сегодняшний день в соответствии с настоящим изобретением установлено, что клеточный тип, в котором образуются частицы цитомегаловируса, существенно влияет на поведение последующих циклов инфекции. Так, например, хотя выше указано, что цитомегаловирус проникает в эпителиальные клетки путем эндоцитоза, авторы настоящего изобретения продемонстрировали этот путь проникновения цитомегаловируса, культивированного в фибробластах, но не цитомегаловируса, выращенного в культуре эпителиальных клеток. Цитомегаловирус, выращенный в эпителиальных клетках, проникает в эпителиальные клетки преимущественно путем слияния с плазматической мембраной. Такой особый путь проникновения влечет ряд физиологических последствий: он влияет на кинетику, с которой распространяется инфекция, и значительно влияет на клеточный ответ на инфекцию. Например, вирус, выращенный в эпителиальных клетках, вызывает резко сниженный клеточный ответ по сравнению с клетками, инфицированными вирусом, выращенным в фибробластах. Многие клеточные антивирусные гены, экспрессирующиеся после инфекции вирусом, выращенным в фибробластах, не экспрессируются после инфекции, вызванной вирусом, выращенным в эпителиальных клетках. В результате цитомегаловирус, выращенный в эпителиальных клетках, должен теоретически вести себя иначе, чем вакцина, произведенная из цитомегаловируса, выращенного в фибробластах, что предлагает новый и неожиданный источник диверсификации в получении вакцины против цитомегаловируса. Аналогично культивирование цитомегаловируса в других клеточных типах, таких как эндотелиальные клетки или специализированные клеточные типы, которые цитомегаловирус способен инфицировать (например, нейроны, другие клетки центральной или периферической нервной системы, гладкомышечные клетки, гепатоциты, стромальные клетки, макрофаги или дендритные клетки), должно давать дополнительные новые источники диверсификации в получении вакцины против цитомегаловируса.
Итак, один аспект настоящего изобретения относится к способам получения вакцин против цитомегаловируса, где используется вариабельность, связанная с выбором клеточного типа, в котором предстоит культивировать вирус. Второй аспект относится к набору для осуществления вышеописанных способов. Другой аспект настоящего изобретения относится к композиции вакцин для профилактики или лечения цитомегаловирусной инфекции и способам иммунизации особи с использованием таких композиций. Различные варианты этих аспектов настоящего изобретения изложены ниже.
Способы получения вакцин против цитомегаловируса:
Эти способы согласно одному аспекту настоящего изобретения включают: 1) получение штамма или изолята цитомегаловируса; 2) культивирование этого штамма или изолята в клеточной культуре выбранного клеточного типа, и 3) извлечение вирионов цитомегаловируса, полученного путем выращивания в этом клеточном типе (называемом в данном документе как «кондиционированный клеточным типом цитомегаловирус») для использования в получении вакцины против цитомегаловируса.
Клеточный тип, выбранный для культивирования цитомегаловируса до его использования в получении вакцины, может быть любой клеточной линией, восприимчивой к цитомегаловирусной инфекции и продуцирующей какое-либо количество вирусных частиц. Эти вирусные частицы могут быть высокоинфекционными в некоторых анализах, или эти частицы могут проявлять низкую инфективность или не проявлять инфективность вовсе во многих анализах. Подходящие клеточные типы включают, но не ограничиваются перечисленным: 1) линии эпителиальных клеток, такие как ARPE-19, которая приведена в данном документе в качестве примера, и другие линии пигментного эпителия сетчатки, например, линия эпителиальных клеток К-1034 (Ando, Y.. et al. 1997, Arch. Virol. 142(8): 1645-1658); HCMC - производное нормальной слизистой толстой кишки человека (Smith, JD, 1986, J Virol. 60(2): 583-588); клетки кишечного эпителия Сасо-2 (Esclatine. A., et al.. 2000, J. of Virol. 74 (1): 513-51); SW480, HCT1 16, HeLa, H 1299 и MCF-7 (в отношении последних пяти см. Wang. D. & Т. Shenk, 2005. J.Virol. 79: 10330); 2) линии эндотелиальных клеток, такие как НМЕС-I - линия эндотелиальных клеток микрососудов человека, иммортализованных с помощью большого Т-антигена вируса SV-40 (Guetta. Е.. et al., 2001, Cardiovascular Research 50: 538-546); HUVEC и LMVEC (в отношении последних- двух см. Wang. D. & Т. Shenk, 2005, J. Virol. 79: 10330); 3) нейроны, такие как SK-N-SH, SK-N-AS и IMR-32 (см. Wang, D. & Т. Shenk, 2005. J. Virol. 79: 10330), а также первичные эпителиальные, эндотелиальные, гладкомышечные клетки, макрофаги и дендритные клетки - производные различных тканей и органов.
Любой цитомегаловирус или комбинация цитомегаловирусов, приемлемая для разработки в качестве вакцины, пригодны для использования как источник цитомегаловируса для данного способа постольку, поскольку их можно культивировать по крайней мере в одном выбранном клеточном типе. В одном варианте цитомегаловирус является человеческим цитомегаловирусом, или изолятом, которые был выделен ранее и охарактеризован, или новым изолятом человеческого цитомегаловируса, или вирусом, подобным человеческого цитомегаловирусу. В другом варианте цитомегаловирус происходит от другого примата, включая, но не ограничиваясь перечисленным, шимпанзе (Davison, AJ et al. 2003, J. Gen. Virol. 84: 17-28) и макак-резус (Hansen. SG et al. 2003. J. Virol. 77:6620-36: Rivailler. P et al. 2006. J.Virol. 80:4179-82). Этот цитомегаловирус может быть немодифицированным вирусом из выбранного источника, или он может быть химерным вирусом, полученным путем генетической модификации элементов двух или больше различных штаммов или изолятов цитомегаловируса.
Методики получения химерных вирусов известны в данной области техники. В этом отношении по крайней мере шесть штаммов человеческого цитомегаловируса клонированы как инфекционные бактериальные искусственные хромосомы (БИХ) и секвенированы (Murphy. Е et al. 2003. Proc. Natl. Acad. Sci. USA 100: 14976-14981. Последовательности БИХ имеются в Банке генов под входящими номерами АС146999 (лабораторный штамм AD169, из которого получен вариант BADrUL131, описанный в данном документе); АС146851 (лабораторный штамм Towne); АС146904 (клинический изолят РН); АС146905 (подобный клиническому изоляту Toledo); АС 146906 (клинический изолят TR); и АС146907 (клинический изолят FIX). По крайней мере два штамма человеческого цитомегаловируса секвенированы без предварительного клонирования в БИХ и имеются в Банке генов под входящими номерами ВК000394 (лабораторный штамм AD 169) и AY446894 (клинический изолят Merlin). Весь геном штамма цитомегаловирус шимпанзе имеется в Банке генов под входящим номером AF480884. Также имеется геномная последовательность двух штаммов цитомегаловируса макак-резус (входящие номера AY186194 и DQ205516). Используя идеи, изложенные в настоящей заявке, специалист в данном области техники сможет использовать любую из вышеупомянутых последовательностей, или любую другую общедоступную последовательность цитомегаловируса для получения химерных цитомегаловирусов или цитомегаловируса, измененного каким-либо генетическим путем.
В соответствии с настоящим изобретением продемонстрировано, что лабораторные, штаммы цитомегаловируса, которые были многократн