Выделенная нуклеиновая кислота, кодирующая оперативно слитый интрамолекулярный димер белка killerred, кассета экспрессии, клетка, продуцирующая химерный белок и содержащая кассету экспрессии, выделенный химерный белок
Иллюстрации
Показать всеИзобретение относится к области к области молекулярной биологии и генной инженерии. Предложена выделенная нуклеиновая кислота, кодирующая интрамолекулярный димер KillerRed, оперативно слитый с гистоном, а также кассета экспрессии с данной нуклеиновой кислотой, содержащая ее клетка и белок, кодируемый ею. Изобретение может быть использовано в качестве инструмента прицельной фотоинактивации белков, нуклеиновых кислот и клеток в медицинских целях. 4 н.п. ф-лы, 2 ил.
Реферат
Данное изобретение относится к области биологии и химии. В частности, изобретение направлено на флуоресцентные белки.
Флуоресцентные белки, включая зеленый флуоресцентный белок (Green Fluorescent Protein, GFP), его мутанты и гомологи, в настоящее время широко известны благодаря их интенсивному использованию в качестве флуоресцентных маркеров in vivo в биомедицинских исследованиях, что детально рассмотрено Lippincott-Schwartz и Patterson в Science, 2003 300 (5616):87-91.
Флуоресцентные белки - это белки, которые способны к флуоресценции при облучением светом подходящей длины волны. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков, формирующих хромофор, а не флуоресценцией какого-либо одного аминокислотного остатка.
GFP гидромедузы Aequorea aequorea (синоним A. victoria), описан Johnson et al. в J Cell Comp Physiol, 1962, 60:85-104, как часть биолюминесцентной системы медузы, где GFP играет роль вторичного эммитера, преобразовывающего синий свет от фотобелка экворина в зеленый свет.кДНК, кодирующая A. victoria GFP была клонирована Prasher et al. (Gene, 1992, 111(2):229-33). Оказалось, что этот ген может быть гетерологично экспрессирован в практически любом организме благодаря уникальной способности GFP автокаталитически образовывать хромофор (Chalfie et al., Science 263, 1994, 802-805). Эти сведения открыли широкие перспективы для использования GFP в клеточной биологи, в качестве генетически кодируемой флуоресцирующей метки.
GFP был использован в широком спектре приложений, включая исследование экспрессии генов и локализацию белков (Chalfie et al., Science 263, 1994, 802-805, and Heim et al. in Proc. Nat. Acad. Sci., 1994, 91: 12501-12504), как инструмент для визуализации внутриклеточного распределения органелл (Rizzuto et al., Curr. Biology, 1995, 5: 635-642), для визуализации транспорта белков по секреторному пути (Kaether and Gerdes, FEBS Letters, 1995, 369: 267-271).
Проведены многочисленные исследования для улучшения свойств avGFP (Aequorea victoria GFP) и для получения вариантов GFP, пригодных и оптимизированных для различных исследовательских целей. Была проведена оптимизация генетического кода avGFP (codon usage) для повышения уровня экспрессии в клетках млекопитающих ("гуманизированный" GFP, Haas, et al., Current Biology, 1996, 6: 315-324; Yang, et al., Nucleic Acids Research, 1996, 24: 4592-4593). Были получены различные мутанты GFP, в том числе "усиленный зеленый флуоресцентный белок" (EGFP), имеющий две аминокислотные замены: F64L и S65T (Heim et al., Nature 373, 1995, 663-664). Другие мутанты являются синим, голубым и желто-зеленым спектральными вариантами avGFP и содержат замены аминокислотных остатков, формирующих хромофор, и/или остатков, формирующих окружение хромофора.
В 1999 г., гомологи GFP были клонированы из небиолюминесцентных видов Anthozoa (Matz et al., Nature Biotechnol, 1999, 17: 969-973). Это открытие продемонстрировало, что эти белки не являются обязательно компонентом биолюминесцентной системы. GFP-подобные белки из Anthozoa обладали большим спектральным разнообразием и включали циановые, зеленые, желтые, красные флуоресцентные белки и фиолетово-синие нефлуоресцентные хромопротеины (CPs) (Matz et al., Bioessays, 2002, 24(10): 953-959). В дальнейшем кДНК GFP-подобных белков были клонированы из ряда гидроидных медуз и из копепод (Shagin et al., Mol Biol Evol, 2004, 21(5): 841-850). Сегодня семейство GFP-подобных белков включает сотни флуоресцентных и окрашенных гомологов GFP. Сходство этих белков с GFP варьирует от 80-90% до менее, чем 25% идентичности аминокислотной последовательности.
Получены кристаллические структура avGFP дикого типа, GFP S65T мутанта и ряда гомологов GFP (Ormo et al. Science, 1996, 273: 1392-1395; Wall et al. Nat Stmct Biol, 2000, 7: 1133-1138; Yarbrough et al. Proc Nati Acad Sci USA, 2001, 98: 462-467; Prescott et al. Structure (Camb), 2003, 11: 275-284; Petersen et al. J Biol Chem (2003), 278: 44626-44631; Wilmann et al. J Biol Chem, 2005, 280: 2401-2404; Remington et al. Biochemistry, 2005, 44, 202-212; Quillin et al. Biochemistry, 2005, 44: 5774-5787). Было постулировано, что все члены семейства обладают общей 3D структурой, представляющей собой так называемый бочонок из 11 бета-слоев, образующих компактную встречно-параллельную структуру, внутри которой располагается альфа-спираль, содержащая хромофор. Хромофор формируется путем окислительной циклизации трех консервативных аминокислотных остатков в центральном регионе альфа-спирали (Cody et al., Biochemistry, 1993, 32, 1212-1218). Положения аминокислотных остатков, формирующих хромофор, соответствует Ser65-Tyr66-Gly67 региону avGFP. Эти аминокислотные остатки легко могут быть идентифицированы у любого GFP-подобного белка путем выравнивания его последовательности с последовательностью avGFP.
Процесс автокаталитического формирования хромофора белков с различными спектральными свойствами подробно описан в ряде статей и включает несколько химических реакций (Heim et al. Proc Nati Acad Sci USA. 1994; 91:12501-12504; Ormo et al. Science, 1996;273:1392-1395; Yang et al. Nat Biotechnol, 1996, 14: 1246-1251; Brejc et al. J. Proc Natl Acad Sci USA, 199, 94: 2306-2311; Palm et al. Nat Stmct Biol, 1997, 4:361-365; Gurskaya et al., BMC Biochem, 2001, 2:6; Gross et al. Proc Nati Acad Sci USA, 2000, 97:11990-11995; Wall et al. Nat Stmct Biol, 2000, 7:1133-1138; Yarbrough et al., J. Proc Nati Acad Sci USA. 2001, 98:462-467; Pakhomov, A.A. and Martynov, V.I. Chem. Biol, 2008, 15, 755-764; Quillinet al, 2005 Biochemistry, 44, 5774-5787; Yampolsky et al, 2005, Biochemistry, 44, 5788-5793; Shu et al. 2006, Biochemistry 45, 9639-9647; Kikuchi et al, 2008, Biochemistry 47, 11573-11580; Yampolsky et al., Biochemistry, 2009,48 (33), p.8077).
Показано, что флуоресцентный белок KillerRed обладает фототоксическими свойствами, что позволяет использовать его для прицельного уничтожения клеток и биологических молекул (белков, ДНК) непосредственно в живых организмах (Bulina et al., Nat Biotechnol, 2006, Jan, 24(1): 95-9; Bulina et al., Nat Protoc, 2006, 1(2): 947-53).
Пространственная организация мономера KillerRed представляет собой типичный для флуоресцентных белков β-бочонок, образованный 11-ю β-сегментами, с центральной α-спиралью, содержащей хромофор, полученный в результате посттрансляционной модификации хромофор-образующей последовательности Gln65-Ty66-Gly67 (Pletnev et al., J Biol Chem, 2009, 284(46): 32028-32039). В белке KillerRed GFP-подобный домен (β-бочонок) составляют аминокислотные остатки в положениях с 6 по 225, соответствующие положениям с 6 по 229 последовательности avGFP.
Хромофор KillerRed в активной флуоресцентной форме представляет собой планарную бициклическую систему сопряженных двойных связей, состоящую из пятичленного имидазолинонового и фенольного циклов. Фенольный цикл Туr66б принимает цис- ориентацию по отношению к связи Сα-N(66), отвечающую активному флуоресцентному состоянию белка. Эта ориентация стабилизируется двумя водородными связями с Asn145 и через молекулу воды с Thr201. В процессе формирования хромофора Сα атом первого остатка Gln65 принимает sp2 гибридизацию, характеризующуюся плоским тригональным расположением примыкающих связей. При этом, образующаяся частично двойная N-ацилиминная связь N=Cα (Gln65) приводит к расширению сопряженной π-электронной системы, вызывающему сдвиг максимумов длин волн возбуждения и эмиссии в красную область спектра. Ближайшее окружение хромофора сформировано из боковых цепей 17-ти остатков, включая каталитические Arg94 и Glu218. Большинство этих остатков вовлечено в развитую систему водородных связей, как непосредственно, так и через молекулы воды.
Уникальной особенностью пространственной структуры KillerRed является наличие заполненного водой канала, идущего от торца (3-цилиндрической архитектуры белка к центральной области хромофора. Этот канал может облегчать доступ кислорода к хромофору, способствовать выходу активных форм кислорода из белка наружу, а также служить проводником протонов или электронов при фотовозбуждении хромофора. Эта особенность, по-видимому, является одним из ключевых структурных факторов наблюдаемых фототоксических свойств белка.
Белок KillerRed имеет ряд недостатков, затрудняющих его широкое использование. Так, KillerRed является димерным белком. В то же время известно, что димеризация флуоресцентных белков может негативно сказываться на функционировании связанных с ними (закодированных в одной рамке считывания) химерных белков. Таким образом, это свойство ограничивает использование белка KillerRed как инструмента прицельной фотоинактивации химерных белков, а также опосредованной химерными белками фотоинактивации нуклеиновых кислот. Кроме того, фототоксичность KillerRed существенно уступает фототоксичности известных химических фотосенсибилизаторов.
Предлагаемый в настоящей заявке подход направлен на решение этих проблем.
Предлагаемое изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующие химерные белки, включающие два оперативно слитых белка, по существу сходных с белком KillerRed (так называемый KillerRed-tandem). Нуклеиновые кислоты настоящего изобретения получены с помощью рекомбинантных технологий. В предпочтительных воплощениях, нуклеиновые кислоты настоящего изобретения кодируют химерные белки, обладающие фототоксическими свойствами.
Белок, состоящий из двух тандемно соединенных копий белка по существу сходных с белком KillerRed, проявляет свойства мономера и, следовательно, может быть использован для мечения широкого круга целевых белков. Это, в свою очередь, делает возможным осуществление непосредственного контакта KillerRed с клеточными структурами, чувствительными к воздействию окислительного стресса.
Выделенные нуклеиновые кислоты настоящего изобретения кодируют два белка, по существу сходных с белком KillerRed, которые соединены между собой с помощью белкового линкера (KillerRed-tandem).
В некоторых воплощениях, KillerRed-tandem оперативно слит с гистоном. В преимущественных воплощениях, это гистон Н2 В. При экспрессии, белки, слитые с гистоном, локализуются в ядре клетки-хозяина, включаются в состав хроматина и при облучении светом оказывают на него повреждающее действие.
Нуклеотидная последовательность, кодирующая гистон (например, H2B), соединена своим 3'-концом с 5'-концом последовательности, кодирующей два белка, по существу сходных с белком KillerRed. В некоторых воплощениях, между нуклеотидными последовательностями, кодирующими гистон H2B и два белка, по существу сходные с белком KillerRed, присутствует линкерная последовательность, кодирующая несколько аминокислотных остатков.
В некоторых воплощениях, обеспечивается выделенные нуклеиновые кислоты, которые кодируют химерные белки показанные в SEQ ID NO:02, 04, 06 и 08. В некоторых воплощениях, обеспечивается выделенные нуклеиновые кислоты, которые имеют последовательность SEQ ID NO:01, SEQ ID NO:03, SEQ ID NO:05 и SEQ ID NO:07.
Молекулы нуклеиновых кислот, которые отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода так же входят в рамки настоящего изобретения.
В других воплощениях также обеспечиваются векторы, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, настоящее изобретение обеспечивает кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения и регуляторные элементы, необходимые для экспрессии нуклеиновой кислоты в выбранной клетке-хозяине. Кроме того, также обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения.
В других воплощениях обеспечиваются функциональные флуоресцентные белки настоящего изобретения, которые кодируются нуклеиновыми кислотами указанными выше.
Кроме того, обеспечиваются набор, содержащий нуклеиновые кислоты или векторы или экспрессионные кассеты, включающие указанные нуклеиновые кислоты настоящего изобретения.
Краткое описание чертежей
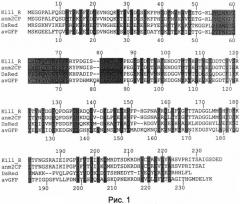
На рис.1 показано выравнивание белка KillerRed (Kill_R, SEQ ID NO:09) и других флуоресцентных белков - хромобелка anm2CP (SEQ ID NO:10) из антомедузы, на основе которого был получен KillerRed, красного флуоресцентного белка DsRed (SEQ ID NO:11) из кораллового полипа Discosoma, и зеленого флуоресцентного белка avGFP (SEQ ID NO:12) из медузы Aequorea victoria. Аминокислотные остатки, формирующие хромофор, подчеркнуты. Аминокислотные остатки, чьи боковые цепи погружены внутрь белковой глобулы, показаны на сером фоне.
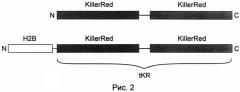
На рис.2 показана схема строения химерных белков. Вверху - тандемный KillerRed (tKR), внизу - гистон H2B, слитый с тандемным KillerRed (H2B-tKR). N- и С-концы белков обозначены буквами N и С. Линией обозначены линкерные последовательности.
Подробное описание изобретения
Как указано выше, настоящее изобретение направлено на молекулы нуклеиновых кислот, которые кодируют химерные белки, включающие два оперативно слитых белка, по существу сходных с белком KillerRed. Нуклеиновые кислоты настоящего изобретения получены с помощью рекомбинантных технологий. В предпочтительных воплощениях, нуклеиновые кислоты настоящего изобретения кодируют химерные белки, обладающие фототоксическими свойствами, которые превышают фототоксические свойства белка KillerRed. Также обеспечиваются векторы и кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения.
В других воплощениях обеспечиваются функциональные флуоресцентные белки настоящего изобретения, которые кодируются нуклеиновыми кислотами, указанными выше.
Указанные белковые и нуклеотидные композиции применяются во многих различных приложениях и методах, в частности, в приложениях прицельного уничтожения клеток или блокирования пролиферации клеток с помощью облучения светом определенной длины волны. Наконец, обеспечиваются наборы для их использования в таких методах и приложениях.
Определения
Различные термины, относящиеся к биологическим молекулам настоящего изобретения, используются выше и также в описании и в формуле изобретения.
Используемый здесь, термин "флуоресцентный белок" означает белок, относящийся к семейству GFP-подобных белков, который обладает способностью к флуоресценции; например, он может проявлять низкую, среднюю или интенсивную флуоресценцию при облучении светом с подходящей для возбуждения длиной волны. Флуоресцентное свойство этих белков представляет собой такое свойство, которое является результатом работы хромофора, образующегося путем автокаталитической циклизации трех или более аминокислотных остатков в полипептидной цепи. Как таковые флуоресцентные белки настоящего изобретения не включают белки, которые обладают флуоресценцией за счет отдельных флуоресцирующих остатков, таких как триптофан, тирозин и фенилаланин. Используетмый здесь, термин "avGFP" относится к зеленому флуоресцентному белку из медузы Aequorea victoria, включая варианты avGFP, известные из уровня техники, сконструированные для обеспечения большей флуоресценции или флуоресценции в других цветовых областях. Последовательность дикого типа avGFP была раскрыта в Prasher et al. (1992, Gene 111: 229-33).
Термин "гуманизированный" относится к изменению нуклеотидной последовательности флуоресцентного белка, сделанной для оптимизации генетического кода кодонов для экспрессии в клетках млекопитающих (Yang et al., Nucleic Acids Research, 1996, 24: 4592-4593).
Как здесь используется, термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
Как здесь используется, термин "мутант" или "производное" относятся к белку, раскрытому в настоящем изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делегированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин "мутант" относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин "мутант" здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
Как здесь используется, "гомология" это термин, использующийся для описания взаимосвязи последовательностей нуклеотидов или аминокислот с другими последовательностями нуклеотидов или аминокислот, которая определена степенью идентичности и/или сходства между указанными сравниваемыми последовательностями.
Как здесь используется, аминокислотная или нуклеотидная последовательности "по существу сходны" или "по существу такие же как референсная последовательность, если аминокислотная или нуклеотидная последовательности имеют по крайней мере 85% идентичности с указанной последовательностью внутри выбранного для сравнения региона. Таким образом, по существу сходные последовательности включают те, которые имеют, например, по крайней мере, 85% идентичности, по крайней мере, 90% идентичности, по крайней мере, 95% идентичности или по крайней мере, 96%б 97%б 98% или 99% идентичности. Две последовательности, которые идентичны одна другой, также по существу сходны.
Для целей настоящего изобретения длина сравниваемых последовательностей флуоресцентных белков соответствует длине GFP-домена. GFP-домен может быть идентифицирован с помощью анализа кристаллической структуры флуоресцентного белка или с помощью выравнивания аминокислотной последовательности белка с avGFP. GFP-домен может быть идентифицирован так же с помощью программ для анализа доменной организации белков, таких как Conserved Domain Database (CDD) (http://www.ncbi.nlm.nih.gov/Stmcture/cdd/) и SMART (a Simple Modular Architecture Research Tool, http://smart.embl-heidelberg.de/). Было показано, что в состав домена, формирующего "бочонок" входят аминокислотные остатки, соответствующие положениям с 6 по 229 последовательности avGFP, где позиции соответствующих аминокислотных остатков определяются с помощью выравнивания аминокислотной последовательности белка с avGFP (рис.1). Для белка KillerRed в состав домена входят аминокислотные остатки, соответствующие положениям с 6 по 225. Было показано, что аминоксилотные фрагменты, не входящие в состав GFP-домена, могут содержать делеции, инсерции и замены аминокислотных остатков; при этом не происходит существенного изменения спектральных свойств флуоресцентного белка (Shimozono et al., Biochemistry, 2006,45, 6267-6271; Crameri et al., Nat Biotechnol, 1996, 14: 315-319). Процент идентичности последовательностей определяется на основании референсной последовательности. Алгоритмы для анализа последовательности известны в данной области, такие как BLAST, описанный в Altschul et al., J. Mol. Biol., 1990, 215, pp.403-10). Для целей настоящего изобретения сравнение нуклеотидных и аминокислотных последовательностей производимое с помощью пакета программ Blast, предоставляемого National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/blast) с использованием содержащего разрывы выравнивания со стандартными параметрами, может быть использовано для определения уровня идентичности и сходства между нуклеотидными последовательностями и аминокислотными последовательностями.
Как здесь используется, термин "подобные флуоресцентные белки" или "по существу сходные флуоресцентные белки" относится к флуоресцентным белкам, которые имеют GFP-домены, идентичные, по крайней мере, на 85%, как правило, идентичные на 90% или более, чаще всего идентичные, по крайней мере, на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%).
В некоторых воплощениях, термин "подобные флуоресцентные белки" или "по существу сходные флуоресцентные белки" относится к флуоресцентным белкам, которые имеют аминокислотные последовательности целого белка идентичные, по крайней мере, на 85%, как правило идентичные на 90% или более, чаще всего идентичные по крайней мере на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%).
Как здесь используется, термин "функциональный" означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи. Термин "функциональный", используемый для описания KillerRed и химерного белка настоящего изобретения, означает, что белок имеет фототоксические свойства.
Как здесь используется, "биохимические свойства" относятся к белковому фолдингу (сворачиванию) и скорости созревания, времени полужизни, способности к агрегации, способности к олигомеризации, рН и температурной стабильности, и другим подобным свойствам.
Как здесь используется, "флуоресцентные свойства" или "спектральные свойства " относятся к коэффициенту молярной экстинкции, при подходящей длине волны, к квантовому выходу флуоресцентции, форме спектра возбуждения флуоресценции или спектра испускания, длине волны, соответствующей максимуму возбуждения флуоресценции, и длине волны, соответствующей максимуму испускания, отношению амплитуды возбуждения флуоресценции при двух разных длинах волн, отношению амплитуды испускания при двух разных длинах волн, времени жизни возбужденного состояния, и анизотропии оптических свойств. Измеряемая разница может быть определена как количество любого количественного флуоресцентного свойства, например, интенсивность флуоресцентции при определенной длине волны, или интегральная флуоресценция на всем спектре испускания.
Как здесь используется, термины "фототоксические свойства" или "фототоксичность" относятся к способности белка вызывать повреждение близлежащих молекул, например близлежащих белков, нуклеиновых кислот, и/или липидов, что в свою очередь может вызывать гибель клеток, остановку клеточных делений или нарушение клеточной дифференцировки и/или пролиферации. Для сравнения фототоксических свойств может быть использована бактериальная система. Например, белки могут быть экспрессированы в клетках бактерий (например, Е.coli) путем транефекции подходящими экспрессирующими векторами, кодирующими указанные белки под контролем промотора, обеспечивающего экспрессию белка в данных бактериальных клетках. Колонии выращивают в течение ночи при 37°C и далее чашки инкубируют при 4°C до полного созревания белков. Для каждого белка отбирают единичную колонию, которую суспендируют в 0.1 мл буфера PBS, после чего половину объема 30 мин облучают активирующим светом определенной интенсивности, а половину оставляют в темноте в качестве контроля. Полученные суспензии клеток высеивают на чашки Петри в различных разведениях и после ночного роста при 37°С подсчитывают число выросших колоний.
Как здесь используется, "агрегация" относится к склонности или способности экспрессированного белка формировать нерастворимый осадок (агрегаты). "Агрегация" должна быть отличаема от "олигомеризации". В частности, мутанты с уменьшенной способностью к агрегации, например, с увеличенной растворимостью, не обязательно имеют уменьшенную способность к олигомеризации.
Как здесь используется, "олигомеризация" относится к сколонности или способности экпрессированного белка формировать комплексы (олигомеры) в результате специфического взаимодействия двух или более полипептидов. Указанное специфическое взаимодействие наблюдается в специальных условиях, например, в физиологических условиях, и относительно стабильно в этих условиях. Ссылка на "способность" белков олигомеризоваться означает, что белки могут формировать димеры, триммеры, тетрамеры или подобные комплексы в специальных условиях. Как правило, флуоресцентные белки обладают способностью к олигомеризации в физиологических условиях, хотя, как здесь описано, флуоресцентные белки могут также олигомеризоваться при других, например, pН, нежели pН при физиологических условиях. Условия, при которых флуоресцентные белки формируют олигомеры или проявляют склонность к олигомеризации могут быть определены с помощью хорошо известных методов, таких как гель-фильтрация или иным способом известным в данной области.
Ссылка на нуклеотидную последовательность "кодирующую" полипептид означает, что с нуклеотидной последовательности в ходе трансляции и транскрипции мРНК продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин также включает любые вырожденные нуклеотидные последовательности кодирующие одинаковую аминокислотную последовательность. Нуклеотидная последовательности кодирующие полипептид включают последовательности, содержащие интроны.
Термин "оперативно связанный" или ему подобный при описании химерных белков относится к полипептидным последовательностям, которые находятся в физической и функциональной связи одна с другой. В наиболее предпочтительных воплощениях, функции полипептидных компонентов химерной молекулы не изменены по сравнению с функциональными свойствами выделенных полипептидных компонентов. Например, белок KillerRed или KillerRed-тандем настоящего изобретения может быть сшит с представляющим интерес партнером слияния. В этом случае химерный белок сохраняет фототоксические свойства белка KillerRed, а представляющий интерес полипептид (например гистон H2 B) сохраняет его оригинальную биологическую активность. Как очевидно для любого специалиста в данной области техники, нуклеотидные последовательности, кодирующие химерный белок, включающий "оперативно связанные" компоненты (белки, полипептиды, линкерные последовательности, белковые домены и т.д.), состоят из фрагментов, кодирующих указанные компоненты, где эти фрагменты ковалентно связаны таким образом, что в ходе трансляции и транскрипции нуклеотидной последовательности продуцируется полноразмерный химерный белок. Иными словами, фрагменты соединены таким образом, что в местах их соединения отсутствуют 'сбойки' рамки считывания и стоп-кодоны.
Молекулы нуклеиновых кислот
Настоящее изобретение обеспечивает молекулы нуклеиновых кислот кодирующие химерный белок, имеющий аминокислотную последовательность, выбранную из SEQ ID NO:02, 04, 06 и 08 и его варианты.
Как здесь используется, молекула нуклеиновой кислоты это молекула ДНК, такая как геномная ДНК или кДНК молекула, или молекула РНК, такая как молекула мРНК. Как здесь используется, термин "кДНК" относится к нуклеиновым кислотам, которые обладают размещением элементов последовательности найденным в нативных зрелых видах мРНК, где элементы последовательности - это экзоны и 5' и 3' некодирующие области.
Молекула нуклеиновой кислоты, кодирующая химерный белок согласно данному изобретению может быть синтезирована из подходящих нуклеозидтрифосфатов. Метод хорошо описан в известных в данной области протоколах. Например, доступность информации о последовательности аминокислот (например, SEQ ID NO:02, 04, 06 или 08.) или информации о нуклеотидной последовательности (например, SEQ ID NO:01, 03, 05 или 07) дает возможность изготовить выделенные молекулы нуклеиновых кислот настоящего изобретении с помощью олигонуклеотидного синтеза. В случае информации о последовательности аминокислот, несколько нуклеиновых кислот отличающихся друг от друга вследствие вырожденности генетического кода может быть синтезировано. Методы выбора вариантов кодонов для требуемого хозяина хорошо известны в данной области.
Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью методов хорошо известных в данной области, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или других методов как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., 1989, Cold Spring Harbor Press, Cold Spring Harbor, NY, и по инструкции, описанной в, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research. Длинные двухцепочечные молекулы ДНК настоящего изобретения могут быть синтезированы за следующие стадии: несколько меньших фрагментов с необходимой комплементарностью, которые содержат подходящие концы способные к когезии с соседним фрагментом, могут быть. Соседние фргменты могут быть сшиты с помощью ДНК-лигазы или метода, основанного на ПЦР.
В некоторых воплощениях, молекула нуклеиновой кислоты настоящего изобретения - это ДНК (или кДНК) молекула, содержащая открытую рамку считывания, которая кодирует химерный белок настоящего изобретения и способна в подходящих условиях (например, физиологические внутриклеточные условия) быть использована для экспрессии белка в клетке-хозяине. Настоящее изобретение так же охватывает нуклеиновые кислоты, которые гомологичны, по существу сходны, идентичны, или получены из нуклеиновых кислот, кодирующих белки настоящего изобретения. Указанные нуклеиновые кислоты находятся в среде, отличной от среды, в которой они находятся в естественных условиях, например, они выделены, представлены в увеличенном количестве, находятся или экспрессированы в системах in vitro или в клетках или организмах, отличных от тех, в которых они находятся в естественных условиях.
Изменения или различия в нуклеотидной последовательности между высокосходными нуклеотидными последовательностями могут представлять нуклеотидные замены в последовательности, которые возникают в процессе нормальной репликации или дупликации. Другие замены могут быть специально рассчитаны и вставлены в последовательность для определенных целей таких, как изменение кодонов определенных аминокислот или нуклеотидной последовательности регуляторного региона. Такие специальные замены могут быть произведены in vitro с помощью различных технологий мутагенеза или получены в организмах-хозяевах, находящихся в специфических селекционных условиях, которые индуцируют или отбирают эти изменения. Такие специально полученные варианты последовательности могут быть названы "мутантами" или "производными" исходной последовательности.
Нуклеиновая кислота, кодирующая химерный белок, в состав которой входит последовательность, кодирующая интромолекулярный димер мутантного белка KillerRed также обеспечивается настоящим изобретением. Для нужд данного изобретения мутантный вариант белка KillerRed должен обладать фототоксичностью, не меньшей, чем белок KillerRed, и обладать сходными способностями к олигомеризации. В большинстве случаев, мутантный вариант белка KillerRed имеет GFP-домен, который по крайней мере на 85% идентичен (чаще по крайней мере на 90% идентичен, как правило по крайней мере на 95% идентичен) GFP-домену белка KillerRed. Например указанный GFP-домен может быть по крайней мере на 96%, 97%, 98%, 99%, или 100% идентичен GFP-домену белка KillerRed.
Мутантные или производные нуклеиновые кислоты могут быть получены на матричной нуклеиновой кислоте, выбранной из вышеописанных нуклеиновых кислот, путем модификации, делеции или добавления одного или более нуклеотидов в матричной последовательности или их комбинации, для получения варианта матричной нуклеиновой кислоты. Модификации, добавления или делеции могут быть выполнены любым способом, известным в данной области (см. например Gustin et al., Biotechniques, 1993, 14: 22; Barany, Gene, 1985, 37: 111-123; и Colicelli et al., Mol. Gen. Genet, 1985, 199: 537-539, Sambrook et al., Molecular Cloning: A Laboratory Manual, 1989, CSH Press, pp.15.3-15.108), включая подверженный ошибкам ПЦР (error-prone PCR), shuffling, олигонуклеотид-направленный мутагенез, ПЦР со сборкой, парный ПЦР мутагенез, мутагенез in vivo, кассетный мутагенез, рекурсивный множественный мутагенез, экспоненциальный множественный мутагенез, сайт-специфический мутагенез, случайный мутагенез, генная реассемблирование (gene reassembly), генный сайт-насыщающий мутагенез (GSSM), искусственное перестройку с лигированием (SLR) или их комбинации. Модификации, добавления или делеции могут быть также выполнены методом, включающим рекомбинацию, рекурсивную рекомбинацию последовательностей, фосфотиоат-модифицированный мутагенез ДНК, мутагенез на урацил-содержащей матрице, мутагенез с двойным пропуском, точечный восстановительный по рассогласованию мутагенез, мутагенез штамма, дефицитного по восстановлениям, химический мутагенез, радоактивный мутагенез, делетационный мутагенез, рестрикционно-избирательный мутагенез, рестрикционный мутагенез с очисткой, синтез искусственных генов, множественный мутагенез, создание химерных множественных нуклеиновых кислот и их комбинации. В некоторых воплощениях флуоресцентные белки, кодируемые мутантными или производными нуклеиновыми кислотами имеют те же самые флуоресцентные или биохимические свойства как флуоресцентный белок дикого типа. В других воплощениях, мутантные или производные нуклеиновые кислоты кодируют флуоресцентные белки с измененными свойствами.
Кроме того, также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют белки настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности, вырожденные варианты нуклеиновых кислот создаются, чтобы увеличить экспрессию в клетке-хозяине. В этом воплощении, кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту. Особенный интерес представляют гуманизированные версии нуклеиновых кислот настоящего изобретения. Как здесь используется, термин "гуманизированный" относится к заменам, сделанным в последовательности нуклеиновой кислоты для оптимизации кодонов для экспрессии белка в клетках млекопитающих (челвека) (Yang et al., Nucleic Acids Research, 1996, 24: 4592-4593). См. также Патент США №5795737, который описывает гуманизацию белков, раскрытие которого здесь включено ссылкой. Примеры вырожденных вариантов, представляющих интерес, описаны более подробно в экспериментальной части, ниже.
Нуклеиновые кислоты, кодирующие укороченные и удлиненные варианты белков настоящего изобретения так же входят в рамки настоящего изобретения. Как здесь используется, эти варианты белков содержат аминокислотные последовательности с измененными С-, N-, или обоими концами. В удлиненных вариантах, С- или N-конец белка может содержать дополнительные аминокислотные остатки. В укороченных вариантах одна или более (обычно до 11, чаще до 7 и преимущественно до 5) аминокислотных остатков могут быть удалены из последовательности или заменены на любые другие аминокислотные остатки. Такие модификации не изменяют по существу свойства белков, но могут облегчать белковый фолдинг в клетке-хозяине, снижать способность к агрегации или модулировать другие биохимические свойства белков, например, полупериод распада. В некоторых воплощениях, эти модификации не изменяют биохимические свойства белка. Все виды модификаций и мутаций, указанные выше, осуществляются на уровне нуклеиновой кислоты.
Заявленные нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. По существу очищенная форма означает, что нуклеиновые кислоты являются по меньшей мере приблизительно на 50% чистыми, обычно по меньшей мере приблизительно на 90% чистыми и обычно являются "рекомбинантными", то есть, фланкированы одним или более нуклеотидов, - с которыми она обычно не связана в хромосоме, встречающейся в природе в ее естественном организме-хозяине.
Также обеспечиваются вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты. Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д., последовательности нуклеиновой кислоты настоящего изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области, и много таких векторов доступны коммерчески. Для приготовления конструкции, полноразмерная нуклеиновая кислота или ее часть обычно вставляются в вектор посредством прикрепления ДНК-лигазой к расщепленному ферментами рестрикции сайту в векторе. Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляются лигированием олигонуклеотидов или полимеразной цепной реакцией, с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности.
Также обеспечиваются кассеты экспрессии или системы, использованные inter alia для получения заявленных хромогенных или флуоресцентных белков или химерных белков на их основе или для репликации заявленных молекул нуклеиновой кислоты. Кассета экспрессии может существовать как внехромосомный элемент или может быть включена в геном клетки в результате