Наноэмульсия
Иллюстрации
Показать всеГруппа изобретений относится к наноэмульсии для доставки активного агента, способу ее получения, композициям, ее содержащим, и к применению наноэмульсии для производства фармацевтических композиций для местного нанесения и косметических композиций для нанесения на кожу. Заявленная наноэмульсия содержит водный компонент и носитель, который включает липофильный компонент в количестве 0,1%-15% масс., ПАВ и изопропиловый и/или 1-пропиловый спирт. Средний диаметр эмульгированных частиц составляет менее 100 нм. Способ приготовления наноэмульсии включает смешивание водного компонента и носителя, содержащего липофильный компонент, ПАВ и изопропиловый и/или 1-пропиловый спирт, для образования наноэмульсии при температуре 50-60°С. Изобретение также относится к композиции для фотодинамической терапии, которая содержит указанную наноэмульсию и активный агент, представляющий собой 5-аминолевулиновую кислоту, ее производное, предшественник и/или метаболит. Указанная композиция применяется для производства лекарственного средства для фотодинамической терапии или для лечения старческого кератоза. Также заявлена диагностическая композиция для обнаружения пролиферирующих клеток, которая содержит наноэмульсию и 5-аминолевулиновую кислоту. Изобретение также относится к набору для фотодинамической терапии, который содержит композицию для фотодинамической терапии и один компонент, выбранный из фоторезистентного покрытия, средства для прикрепления указанного покрытия или средства для нанесения композиции. Изобретение обеспечивает улучшение стабильности и усиление проникновения наноэмульсии в клетки и ткани. 10 н. и 15 з.п. ф-лы, 6 ил., 9 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к наноэмульсии, содержащей, по меньшей мере, один водный компонент и носитель, где носитель содержит, по меньшей мере, один липофильный компонент, по меньшей мере, одно ПАВ и, по меньшей мере, один спирт. Настоящее изобретение также относится к композиции, содержащей указанную наноэмульсию и активный агент. В частности, композиция представлена в виде геля и активным агентом является 5-аминолевулиновая кислота (ALA), ее производное, предшественник и/или метаболит. Дополнительно, изобретение относится к получению указанной наноэмульсии и/или композиции и к ее применению для лечения кожных болезней, вирусных заболеваний, а также заболеваний, связанных с клеточной пролиферацией, а именно, онкологических заболеваний и/или псориаза. Настоящее изобретение дополнительно относится к применению указанной наноэмульсии в косметических средствах.
Предшествующий уровень техники
Наноэмульсии представляют собой коллоидную систему. Коллоидные системы включают мицеллы, липосомы, виросомы, наносуспензии, микроэмульсии и полимерные растворы. Наноэмульсии, исходя из их физических и химических характеристик, принадлежат к группе микроэмульсий. Микроэмульсии являются водными дисперсиями, состоящими из гомогенных, микроразмерных частиц, составляющих липидное ядро, окруженное ПАВом и соединенными с ПАВом монослоями. Наноэмульсии характеризуются средним размером частиц (средний диаметр) менее 200 нм, часто менее 100 нм, и узким монодисперсным распределением частиц по размерам. Дополнительно, наноэмульсии прозрачны и немного матовые. Обычно, их изготавливают путем механической фрагментации масляной фазы в водной фазе в присутствии ПАВа. Очень маленький размер масляных частиц часто достигается посредством, по меньшей мере, одного пропускания через гомогенизатор высокого давления или ультразвуковое устройство. Для получения наноэмульсии, описываемых здесь, не требуется применения таких устройств с большими усилиями сдвига. Маленький размер глобул и их высокая гомогенность придают им свойства, пригодные для использования в косметологии, которые отличают их от традиционных эмульсий: они прозрачны и проявляют новую текстуру. Дополнительно, они могут переносить активные агенты более эффективно и, следовательно, становятся чрезвычайно значимыми в области медицины и фармации.
Микроэмульсии, называемые нанодисперсиями, известны из уровня техники и содержат a) мембрано-образующую молекулу, напр., соевый лецитин, b) ко-эмульгатор, c) липофильный компонент, напр., каприловый и/или каприновый триглицерид (Miglyol 812 или Myritol 318) и, необязательно, d) спирт, в частности, этанол (EP 0956853). Эти нанодисперсии применяются в фармацевтических составах в качестве носителя для фармацевтически активных агентов.
Однако применение этанола в наноэмульсиях имеет некоторые недостатки.
Во-первых, применение этанола в качестве ко-ПАВа приводит к образованию более крупных наночастиц, чем при использовании спиртов с более длинными углеродными цепями. Более крупные частицы являются причиной уменьшения области межклеточного контакта между кожей и наноэмульсией, приводя к уменьшению скорости проникновения. Во-вторых, этанол имеет относительно низкую вязкость, равную 1,10 ср, которая не является оптимальной для стабильности микроэмульсий. Дополнительно, вследствие относительно низкой гидрофобности этанола, проникновение наноэмульсий через липофильные физиологические мембраны кожи может замедляться. В результате, стабильность наноэмульсий, а также ее биологическая доступность, т.е. проникновение в ткани, снижается. Дополнительно, этанол очень дорогой спирт, по сравнению с другими видами спирта, такими как изопропиловый спирт. В дополнении, этанол подлежит к обложению специальным налогом на алкоголь при определенных условиях в некоторых странах.
Таким образом, целью настоящего изобретения являлось обеспечение наноэмульсий, которая преодолеет те недостатки, которые упоминались в уровне техники, и которая, в частности, проявляет оптимальные физические свойства, которые могут улучшить стабильность, а также проникновение в клетки и ткани, при этом, в то же время, оставаясь менее дорогой, чем наноэмульсий из существующего уровня техники.
Указанная цель достигается, согласно изобретению, путем обеспечения наноэмульсий, содержащей a) по меньшей мере, один водный компонент и b) носитель, который содержит i) по меньшей мере, один липофильный компонент, ii) по меньшей мере, одно ПАВ и iii) по меньшей мере, один спирт, где, по меньшей мере, один спирт имеет, по меньшей мере, три атома углерода.
Изобретатели сейчас раскрывают, что наноэмульсия изобретения имеет оптимально низкий средний размер частиц вместе с узким распределением частиц по размерам. Снижение размера частиц обеспечивает повышенную стабильность и лучшее проникновение в клетки и ткани наноэмульсий.
Содержание компонента i) носителя, т.е. липофильного компонента, предпочтительно составляет в количестве от 0,1% по массе до 15% по массе, более предпочтительно от 1% по массе до 8% по массе и наиболее предпочтительно от 3% по массе до 4% по массе, исходя из общей массы наноэмульсии. Содержание компонента ii) носителя, т.е. ПАВа или ПАВ, предпочтительно находится в количестве от 1% по массе до 30% по массе, более предпочтительно от 2% по массе до 15% по массе и наиболее предпочтительно от 4% по массе до 6% по массе, исходя из общей массы наноэмульсии. Содержание компонента iii) носителя, т.е. спирта, предпочтительно составляет от 0,1% по массе до 10% по массе, более предпочтительно от 0,5% по массе до 5% по массе и наиболее предпочтительно от 1% по массе до 2% по массе, исходя из общей массы наноэмульсии.
Водный компонент предпочтительно присутствует в наноэмульсии в количестве от 50% по массе до 98% по массе, более предпочтительно от 70% по массе до 95% по массе и наиболее предпочтительно от 88% по массе до 92% по массе, исходя из общей массы наноэмульсии. Преимущественно, такой специфичный состав наноэмульсии обеспечивает наноэмульсию, которая является хорошо переносимой для кожи и не вызывает ощущения липкости при нанесении на кожу, что, помимо прочего, достигается благодаря относительно низкого содержания ПАВ и липофильных компонентов.
В предпочтительном воплощении настоящего изобретения, наноэмульсия содержит в качестве ПАВа мембрано-образующее ПАВ и O/W - эмульсие-образующее ко-ПАВ. Массовое соотношение мембрано-образующего ПАВа: O/W - эмульсие-образующего ко-ПАВа варьирует от 0,1:1 до 10:1, предпочтительно от 0,2:1 до 0,8:1, более предпочтительно от 0,4:1 до 0,6:1.
Предпочтительным спиртом, имеющим, по меньшей мере, 3 атома углерода, в объеме настоящего изобретения, является спирт, имеющий 3-10 атома углерода, предпочтительно 3-7 атома углерода, более предпочтительно 3-5 атома углерода и наиболее предпочтительно 3 атома углерода. В частности, пригодными спиртами, имеющими 5 атомов углерода, являются 1-пентанол и/или 4-метил-2-пентанол. Suitable спиртами, имеющими 4 атома углерода, являются 1-бутиловый спирт, трет-бутиловый спирт (2-метил-2-пропанол) и/или втор-бутиловый спирт (2-бутанол). Наиболее предпочтительными являются спирты, имеющие 3 атома углерода, а именно 1-пропиловый спирт и изопропиловый спирт, где изопропиловый спирт является предпочтительным. При использовании C3-спирта, в особенности, изопропилового спирта, в изобретательской наноэмульсии, настоящие изобретатели обнаружили, что наноэмульсия показывает уменьшенный размер частиц и более узкое распределение частиц по размеру, а также повышенную стабильность и улучшенное проникновение в ткани, по сравнению с наноэмульсиями из существующего уровня техники, используя этанол в качестве спирта. Это было неожиданным, поскольку изопропанол и этанол очень схожи по их физиологическим и химическим признакам.
Если в качестве спирта в изобретательской наноимульсии применяется изопропанол, то размер эмульгированных частиц составляет меньше по сравнению с применением этанола. Благодаря результирующему увеличению контактной поверхности наноэмульсий с кожей, способности проникновения повышаются. Уменьшение размера частиц также имеет решающее значение для повышенной стабильности наноэмульсий, поскольку известно, что уровень агглютинации частиц, в конечном счете, приводящий к фазовому разделению, повышается вместе с размером частиц. Предпочтительные эффекты изопропанола могут наблюдаться благодаря его немного большей гидрофобности, которая может повлечь за собой лучшую способность проникновения через липофильные физиологические мембраны. Дополнительно, изопропанол имеет более высокую вязкость (ср при 25°C составляет 2,32) по сравнению с этанолом (вязкость/ср, 25°C, 1,10). Указанная более высокая вязкость изопропанола может служить для лучшего механизма стабилизации в наноэмульсиях, так как вязкость снижает подвижность молекул. Дополнительное преимущество изопропанола по сравнению с этанолом состоит в том, что он доступен при относительно низкой стоимости, которая составляет около 1/3 от стоимости этанола, и не облагается дополнительным налогом на алкоголь.
Предпочтительно, по меньшей мере, один липофильный компонент носителя изобретательской наноэмульсий представляет собой жир, растительное масло и/или животное масло. Пригодными жирами, согласно настоящему изобретению, являются физиологически пригодные жиры, такие как церамид, моно-, ди- и триацилглицерин (триглицериды), в частности, каприловый и/или каприновый триглицерид и/или смесь из них, особенно предпочтителен Miglyol (такой как Miglyol 812 или Myritol 318, доступный, напр., от Henkel). Пригодными растительными и животными маслами, напр., являются подсолнечное масло, соевое масло, арахисовое масло, рапсовое масло, рыбий жир и/или спермацет.
Пригодным мембрано-образующим ПАВом является фосфолипид, лизофосфолипид, церамид и/или смесь из них. Предпочтительно, фосфолипидом является лецитин или цефалин из соевых бобов или куриных яиц, более предпочтительно лецитин представляет собой соевый лецитин.
Предпочтительно, лецитин содержит фосфатидилхолиновую долю в количестве, по меньшей мере, 80% по массе, более предпочтительно, по меньшей мере, 90% по массе, и наиболее предпочтительно, по меньшей мере, 94% по массе. Изобретатели обнаружили, что качество лецитина, а именно его фосфатидилхолинового содержимого, играет значимую роль для размера частиц наноэмульсии. Чем больше содержание фосфатидилхолина в лецитине, тем меньше размер частиц наноэмульсии.
В качестве ко-ПАВа, образующего эмульсию О/W (т.е. масло в воде), пригодными являются анионные, неионные, катионные и/или амфотерные ПАВа, а также блок-сополимеры. Пригодными анионными ПАВами являются мыла, алкилбензоловые сульфонаты, алкансульфонаты, алкилсульфаты и/или сульфаты алкилового эфира. Пригодными катионными ПАВами являются соединения четвертичного аммония, предпочтительно имеющие одну или две гидрофобные группы (напр., цетилтриметиламмония бромид и цетилтриметиламмония хлорид) и/или соли первичные амины с длинной цепью. Пригодным амфотерным ПАВом является N-(ациламидоалкил)бетаин, N-алкил-β-аминопропионат и/или амин-N-оксид. Пригодным блок-сополимером, например, является оксид пропилена. В объеме настоящего изобретения, неионное ПАВ в особенности предпочтительно, как ко-ПАВ, образующее эмульсию О/W. Пригодное неионное ПАВ выбирается из группы, состоящей из полигликолевого эфира жирного спирта, алкилфенолполигликолевого эфира, алкилполиглюкозида, клюкамида жирной кислоты, полигликолевого эфира жирной кислоты, блок-сополимера этиленоксида и пропиленоксида, сложного эфира жирных кислот с полиглицерином, алканоламида жирной кислоты и (этоксилированньш) эфира сорбита и жирной кислоты (сорбитан). В особенности предпочтительным этоксилированньш эфиром сорбита и жирной кислоты является моноолеат сорбитана полиоксиэтилена, наиболее предпочтительным Полисорбат 80.
Водный компонент наноэмульсии настоящего изобретения предпочтительно содержит слабую буферную систему с низким содержанием соли, более предпочтительно от 5 мМ до 30 мМ фосфатный буфер и наиболее предпочтительно 10 мМ фосфатный буфер. Значение pH фосфатного буфера предпочтительно варьирует от pH 4 до pH 8, более предпочтительно от pH 5 до pH 7, и наиболее предпочтительно от pH 5,5 до pH 6,5. Вода, используемая для приготовления фосфатного буфера, является предпочтительно стерильной деионизированной водой и/или водой для инъекций, более предпочтительно водой для инъекций.
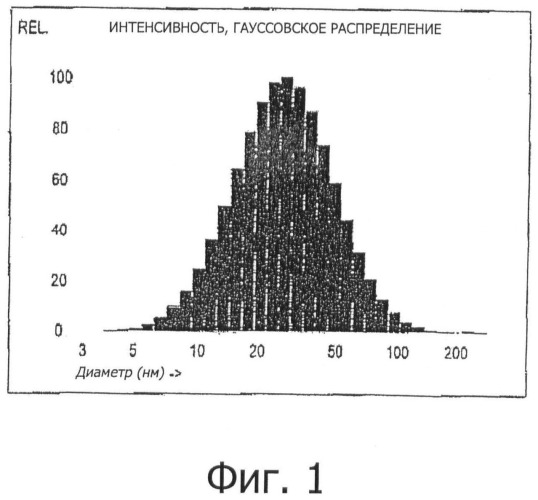
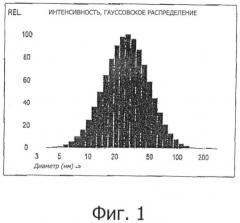
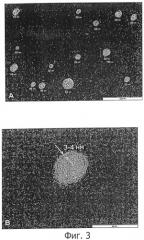
Средний диаметр эмульгированных частиц в наноэмульсии (наносомы) составляет от 5 нм до 500 нм, предпочтительно от 10 нм до 200 нм, более предпочтительно менее 100 нм, особенно, до 90 нм, предпочтительно до 70 нм, еще более предпочтительно от 10 нм до 50 нм и наиболее предпочтительно от 15 нм до 35 нм. Распределение наночастиц по размерам является предпочтительно монодисперсным и подчиняется гауссовскому распределению. Диаметр эмульгированных частиц изобретения определяется способами определения распределений частиц по размерам, которые измеряются с помощью способа динамического рассеяния света (DLS) (также называемого фотонно-корреляционной спектроскопией (PCS)). Статистический анализ распределения частиц осуществляется с помощью способа, называемого взвешенное распределение частиц, в соответствие с настоящим изобретением.
Дополнительным предметом настоящего изобретения является способ приготовления наноэмульсии изобретения, содержащий следующие стадии: a) обеспечение водного компонента, b) обеспечение носителя, содержащего, по меньшей мере, один липофильный компонент, по меньшей мере, одно ПАВ и, по меньшей мере, один спирт, где, по меньшей мере, один спирт имеет, по меньшей мере, три атома углерода, и c) смешивание водного компонента из стадии a) с носителем из стадии b). При приготовлении наноэмульсии, компоненты носителя обеспечиваются в водном компоненте, и смесь превращается наноэмульсию при интенсивной или легкой гомогенизации. Гомогенизация может осуществляться, например, с помощью коммерчески доступных гомогенизаторов. После приготовления наноэмульсии, дополнительно могут вводиться добавки и эксципиенты, присутствие которых не целесообразно во время гомогенизации.
Процесс приготовления наноэмульсии предпочтительно выполняется в асептических условиях, напр., с использованием ламинарного шкафа.
Изобретатели обнаружили, что, кроме композиции, некоторые стадии процесса приготовления имеют значение для конечного размера и распределения частиц по размеру эмульгированных частиц в наноэмульсии. А именно, температура и условия гомогенизации во время стадии c) играют решающую роль. Стадия c) осуществляется при температуре между 50 и 60°C. Все ингредиенты предварительно нагревают до этой температуры. Контейнер и миксер также должны быть оптимизированы для получения очень быстро гомогенизирующейся смеси компонентов (за секунды), избегая образования пены. См. пример 1 для иллюстрирования данной процедуры. Альтернативно, гомогенизация не требует применения устройств с большими усилиями сдвига, таких как ультразвуковые устройства или гомогенизаторы высокого давления.
Дополнительным аспектом настоящего изобретения является фармацевтическая и/или косметическая композиция, содержащая изобретательскую наноэмульсию. Изобретательская наноэмульсия пригодна в области косметологии, напр., в качестве агента от старения кожи, поскольку она обеспечивает элегантный, светопроницаемый и прозрачный носитель, который может применяться для различных видов продуктов. Наноэмульсия обеспечивает систему с очень точным балансом, который имеет относительно низкое содержание эмульгаторов, которые, как считается, являются раздражителями. Изобретательская наноэмульсия поддерживает желаемую прозрачность и светопроницаемость, она способна обеспечивать приемлемое количество добавок, таких как ароматизаторы или увлажнители, при этом оставаясь устойчивой, легкой и мягкой на коже пользователя, благодаря низкому содержанию эмульгаторов. Для предполагаемого использования конечного продукта в случае косметологии, является возможным добавление нетерапевтических или неактивных агентов, таких как смягчителей, ароматизаторов, красителей, отдушек, загустителей, сгустителей, солнцезащитных агентов и подобных, которые расширяют конечное использование продукта, в особенности для местных косметических целей, и определенное внимание уделяется предупреждению выбора компонентов, которые будут вредить чистоте продукта. Конечный продукт может принимать вид молочка, крема, лосьона, геля, сыворотки или жидкого спрея, среди прочего. В случае средств от загара наноэмульсий изобретения могут включать один или более солнцезащитных агентов, таких как бензофеноны, авобензоны, циннаматы, салицилаты и подобные.
Наноэмульсий могут также использоваться в фармацевтических композициях, в особенности, они могут применяться для производства местных лекарственных средств для лечения дерматологических заболеваний, таких как не йродерматит, псориаз, кератоз, в особенности, старческий кератоз, и заболеваний, связанных с клеточной пролиферацией, как, например, онкологические заболевания. Предпочтительно, онкологическое заболевание выбирается из группы, состоящей из базальноклеточной карциномы, плоскоклеточного рака, болезни Боуэна, интраэпителиальной неоплазии вульвы (VIN) или ракового заболевания узлов и подкожной клетчатки. Дополнительно, наноэмульсия является пригодной для лечения заболеваний, связанных с вирусной инфекцией, вызванных вирусом папилломы человека, таким как Остроконечные кондиломы. Посредством включения липофильного компонента наноэмульсий, трансдермальная потеря воды может оказывать преимущественное влияние, т.е. барьерная функция кожи может быть усилена и, как следствие, кожные заболевания, такие как дерматит, могут поражать преимущественно.
Дополнительный аспект настоящего изобретения относится к композиции, содержащей изобретательскую наноэмульсию и активный агент. При этом композиция в особенности является пригодной в качестве фармацевтической и/или косметической композиции, напр., для нанесения на кожу или волосы. Наноэмульсии изобретения, содержащиеся в указанных композициях, обеспечивают очень эффективную систему доставки для широкого спектра активных агентов. Примеры активных агентов, которые могут быть пригодными, включают агенты для устранения старческих пятен, кератозов и морщин, анальгетики, анестетики, агенты против акне, антибактериальные агенты, антидрожжевые агенты, антигрибковые агенты, противовирусные агенты, агенты против перхоти, агенты против дерматита, противозудные агенты, противорвотные, агенты против укачивания, противовоспалительные агенты, агенты против кератолиза, агенты против сухости кожи, антиперсперанты, агенты против псориаза, агенты против себореи, кондиционеры для волос и агенты для лечения волос, агенты от старения, агенты против морщин, противоастматические агенты и бронходилататоры, агенты от загара, антигистаминные агенты, отбеливающие кожу агенты, депигментирующие агенты, витамины, кортикостероиды, гормоны, ретиноиды, такие как ретиноевая кислота и ретинол, местные сердечнососудистые агенты, клотримазол, кетоконазол, миконазол, гризеофульвин, гидроксизин, дифенгидрамин, прамоксин, лидокаин, новокаин, мепивакаин, ионобензон, эритромицин, тетрациклин, клиндамицин, канамицин, меклоциклин, гидрохинон, миноциклин, напроксен, ибупрофен, теофилин, кромолин, альбутерол, стероиды для местного применения, такие как гидрокортизон, гидрокортизона 21-ацетат, гидрокортизона 17-валерат и гидрокортизона 17-бутират, бетаметазона валерат, бетаметазона дипропионат, триамцинолона ацетонид, флюоцинонид, клобетазола пропионат, перекись бензоила, кротамитон, пропранолол, прометазин, витамина A пальмитат, витамина E ацетат и смеси из них.
В предпочтительном воплощении настоящего изобретения активный агент выбирается из группы, состоящей из 5-аминолевулиновой кислоты, ее производного, предшественника и/или метаболита. Под "производным" необходимо понимать то, в частности, которое было подвергнуто этерификации по аминогруппе 5-аминолевулиновой кислоты, замещенной одним или двумя алкильными группами, в особенности предпочтительно одной метальной группой. Наиболее предпочтительными производным является метиламинолевулиновая кислота. Получение производных может пониматься также как получение комплексов из солей и дополнительных соединений, а также алкилированных соединений. Под "предшественником" и "метаболитом" понимаются субстанции, превращенные в клетке в протопорфирин IX. Активный агент 5-аминолевулиновой кислоты или его производное являются особенно предпочтительными.
5-Аминолевулиновая кислота применяется как пролекарство в области фотодинамической терапии. Фотодинамическая терапия является перспективным способом лечения различных предраковых и раковых заболеваний, которые связаны с клеточной пролиферацией (Taylor EL and Brown SB, 2002, Journal of Дерматологической treatment, 13, Suppl. 1, S3-11 и Peng Q. et al., 1997, Cancer, 79, S2282- 2308). Принцип фотодинамической терапии основывается на введении так называемого фотосенсибилизирующего агента в пораженную ткань и последующем облучении излучением соответствующей длины волны для преобразования агента в цитотоксически активный агент, который, в свою очередь, вызывает деструкцию клетки. Избирательность этого способа обусловливается повышенным содержанием сенсибилизирующего агента в быстро-пролиферирующих или пораженных клетках по сравнению с нормальной тканью. Кроме того, облучение фотосенсибилизатора of the обуславливает характеристики флуоресцентного излучения, которое может применяться в диагностических целях, например, для обнаружения пролиферирующих клеток.
5-Аминолевулиновая кислота является эндогенным веществом, которое синтезируется из глицина и сукцинил-CoA в клетках. В объеме биосинтеза гема, протопорфирин IX, который фотоактивен в высокой степени, образуется из 5-аминолевулиновой кислоты (5-ALA) и затем превращается в гем. Этот контрольный механизм нарушается путем экзогенного введения синтетически полученной 5-аминолевулиновой кислоты, тем самым обуславливая увеличенную продукцию фотопорфирина IX. Поскольку разрушение фотопорфирина IX дополнительно ингибируется природным контрольным механизмом, это соединение накапливается в клетках. При облучении светом, фотопорфирин IX подвергается реакции фотохимического окисления и в результате действует как фотосенсибилизатор для фотодинамической терапии.
Системные применения 5-аминолевулиновой кислоты связаны с рядом побочных эффектов, которые можно избежать при местном применении лекарства. Ряд исследований с использованием местно применяемых композиций из 5-аминолевулиновой кислоты известны из уровня техники. Хотя эти исследования имеют между собой общим то, что 5-аминолевулиновая кислота используется в форме эмульсии масло-в-воде, различия имеются относительно других параметров, таких как период проникновения, период лечения, тип применяемого излучения и доза применяемого излучения.
B.Thiele et al. (H+G, Vol.69, No.3, pp.161-164 (1994)) описывают исследования, которые включают применение 20% 5-аминолевулиновой кислоты в виде эмульсии масло-в-воде, с периодом проникновения от 5 до 6 ч и дальнейшим облучением аргонно-ионным лазером на красителях (пик излучения 630 нм), обеспечивая накопленную общую дозу от 50 до 100 Дж/см2.
Wolf et al. (Journal of the American Academy of Dermatology, Vol.28, pp.17-21, 1993) описывает исследования, которые включают применение 20% 5-аминолевулиновой кислоты в виде эмульсии масло-в-воде, с периодом проникновения от 4, 6 или 8 ч, и облучением нефильтрованным светом или красным светом, обеспечивая малую дозу от 30 Дж/см2 до 100 Дж/см2.
Хотя исследования, описываемые в предшествующем уровне технике, ясно демонстрируют перспективный потенциал фотодинамической терапии с использованием 5-аминолевулиновой кислоты, известные эмульсии масло-в-воде до сих пор страдают от ряда недостатков.
Например, M.Novo Rodriguez et al. (SPIE, Vol.2371, pp.204-209) показали, что в высоких концентрациях, необходимых для клинического применения, аминолевулиновая кислота не устойчива в водных растворах при значении pH от нейтрального до основного. В период 25-часового периода исследования, удовлетворительные результаты получились только для концентрации 3% и при pH 5, которые являются специфичными условиями для водных растворов 5-аминолевулиновой кислоты. Для клинического применения, однако, в целом будет необходимо обеспечивать также композиции в большем диапазоне концентраций. Кроме того, для использования в коммерческих целях, растворы 5-ALA должны обладать устойчивостью на время, которое измеряется неделями и месяцами.
V.von Arx et al. (J. Pharm. Pharmacol. 49: 652-656, 1997) описал исследования, относящиеся к местному нанесению 5-аминолевулиновой кислоты в составе различных гелей. В данной публикации изложено, что наилучшим составом для поддержания устойчивости 5-аминолевулиновой кислоты является комбинация с Novion AA-1, полиакриловой кислотой, при pH<6.
Hurlimann et al. (Dermatology, Vol.197, No.3, 1998, pp.248-254) описывает наноколлоидные лосьоны, содержащие 5-аминолевулиновую кислоту, а также применение их в фотодинамической терапии, без дополнительного определения эмульсии.
WO 00/28971 описывает композиции, содержащее наноэмульсию и 5-аминолевулиновую кислоту, где наноэмульсия состоит из яичного лецитина (83% фосфатидилхолин), Miglyol 812 (триглицерид) и полисорбата 80 в 20 мМ фосфатном буфере (см. пример 1 из WO 00/28971), но спирт не используется в качестве растворителя. Наноколлоидные составы, содержащие яичный лецитин в качестве эмульгатора, тем не менее, страдают недостатком, а именно, они значительно сильнее окрашиваются, чем наноэмульсий из 5-аминолевулиновой кислоты, содержащие соевый лецитин в качестве эмульгатора. Изменение окраски в составе коррелирует с образованием продукта распада активного агента 5-аминолевулиновой кислоты. Из этого следует заключить, что наноэмульсионные составы, содержащие яичный лецитин, включают значительно сниженную устойчивость 5-аминолевулиновой кислоты по сравнению с составами, содержащими соевый лецитин в качестве эмульгатора.
Другой недостаток известных эмульсий масло-в-воде с 5-аминолевулиновой кислотой состоит в том, глубина проникновения фотосенсибилизатора в пораженную ткань не оптимальна. В результате, больная ткань восприимчива к фотодинамической терапии только в ее верхних слоях, хотя глубина проникновения излучения, использующегося для активации фотосенсибилизатора, будет также позволять обрабатывать более глубоколежащие слои.
Таким образом, дополнительной целью настоящего изобретения являлось обеспечить композиции, содержащие 5-минолевулиновую кислоту, которые, по меньшей мере, частично, преодолеют известные недостатки существующего уровня техники.
Согласно настоящему изобретению, данная цель достигается путем обеспечения композиции, содержащей изобретательскую наноэмульсию и 5-аминолевулиновую кислоту, ее производное, предшественник и/или метаболит в качестве активного агента. В этих композициях, вышеуказанные преимущественные свойства относительно устойчивости, проникновения в ткани, а также стоимость изобретательской наноэмульсий, могут использоваться для доставки 5-аминолевулиновой кислоты к объектным участкам тканей.
Специфичное взаимодействие было обнаружено между аминолевулиновой кислотой и наночастицами эмульсии. А именно, 5-аминолевулиновая кислота, ее производное, предшественник и/или метаболит, прикрепляется на внешней стороне монослоя из наночастиц наноэмульсий. Таким образом, аминолевулиновая кислота переносится частицами, при этом не содержится в ядре частиц. Точнее, аминолевулиновая кислота располагается снаружи ядра частиц, благодаря взаимодействиям между аминолевулиновой кислотой и внешнему монослою. В традиционных наноэмульсиях, в отличие от этого, лекарственное средство содержится внутри липидного ядра частиц наноэмульсий.
С удивлением было обнаружено, что устойчивость 5-аминолевулиновой кислоты может значительно повышаться, если 5-аминолевулиновая кислота составляется с изобретательской наноэмульсией, содержащей, по меньшей мере, один спирт, который имеет, по меньшей мере, три атома углерода. Хотя причины этого не известны, но предполагается, что микроокружение, созданное наносомами, оказывает особенно подходящее действие на устойчивость 5-аминолевулиновой кислоты.
Также выяснилось, неожиданно, что улучшенное клеточное и тканевое проникновение может достигаться при помощи наноэмульсии изобретения, проникая к более глубоко лежащим поражениям и/или поражениям с толщиной верхних слоев, также становящихся доступными для лечения. Большие глубины проникновения удивили, в особенности потому, что до этого считалось, вследствие их маленького размера, 5-аминолевулиновая кислота будет в любом случае быстро проникать через пораженный эпидермис, который присутствует, например, в ткани, связанной с воспалениями, предраковыми стадиями и опухолями.
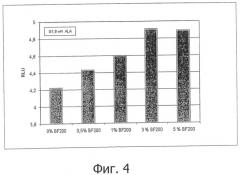
Третье неожиданное преимущество состояло в том, что при составлении с наносомами изобретения, 5-аминолевулиновая кислота поглощается явно очень эффективно из клеток. Это в первую очередь улучшает нацеливание; во-вторых, это означает, период проникновения, т.е. время между применением композиции и облучением пораженной ткани светом, может быть снижено, что означает явное облегчение для пациента. Как можно понять из примера 4, фиг.5, 5-аминолевулиновая кислота поглощается культивируемыми клетками, и преобразование аминолевулиновой кислоты в PpIX в клетках усиливается с увеличением концентраций изобретательской наноэмульсии с постоянной концентрацией аминолевулиновой кислоты.
Устойчивость при хранении, также, может повышаться посредством применения наноэмульсии изобретения, которая содержит спирт, имеющий, по меньшей мере, 3 атома углерода в качестве растворителя в носителе.
Согласно изобретению композиция предпочтительно содержит активный агент, который выбирается из 5-аминолевулиновой кислоты, или ее производного, предшественника и/или метаболита. Под "производным" необходимо понимать то, в частности, которое было подвергнуто этерификации по аминогруппе 5-аминолевулиновой кислоты, замещенной одним или двумя алкильными группами, в особенности предпочтительно одной метальной группой. Наиболее предпочтительной является 5-аминолевулиновая кислота или 5-метиламинолевулиновая кислота. Получение производных может пониматься также как получение комплексов из солей и дополнительных соединений, а также алкилированных соединений.
Под "предшественником" и "метаболитом" понимаются субстанции, превращенные в клетке в протопорфирин IX. Активный агент 5-аминолевулиновой кислоты или его производное являются особенно предпочтительными.
Размер эмульгированных частиц в наноэмульсии (наносомах) представлен выше. Размер частиц, который в каждом случае оптимальный, зависит от дополнительных параметров, таких как вязкость композиции. Например, хорошие результаты были получены с наноэмульсией, имеющей вязкость от 1 до 10 мПас при среднем диаметре частиц менее 100 нм.
Количество активного агента, предпочтительно 5-аминолевулиновой кислоты, в композиции главным образом зависит от предназначенного применения. В предпочтительном воплощении, присутствует около от 1 до 30 масс.% активного агента, исходя из общей массы композиции. Более высокие и низкие дозы, однако, также являются пригодными. Доказано, что количество предпочтительно от 3 до 15 масс.% пригодно для применения в сочетании с фотодинамической терапии.
Изобретательская композиция предпочтительно может дополнительно содержать, по меньшей мере, один стабилизатор и, по меньшей мере, один растворитель.
В особенно предпочтительном воплощении, композиция составлена в виде геля. Агенты, формирующие гель, представляют собой образующие матрицу агенты, предпочтительно ксантан. Если размер частиц наноэмульсий в форме геля составляет предпочтительно менее 100 нм, то вязкость будет значительно выше, напр., 500-2000 мПас.
Дополнительный аспект настоящего изобретения состоит в фармацевтической, косметической и/или диагностической композиции, которая содержит изобретательскую композицию. В данном случае, композиция может дополнительно содержать косметически и/или фармацевтически пригодные добавки и/или эксципиенты, в особенности, субстанции, обычно применяемые в косметологии и фармации. Примерами таких субстанций являются буферы, стабилизаторы, дополнительные эмульгаторы, загустители и др. Дополнительно, композиция не содержит составляющих, которые фармацевтически или диагностически непригодны, и предпочтительно не содержит составляющие, которые, например, провоцируют излучение и/или искажают диагностику. В дополнении к носителям, которые уже упоминались, фармацевтический и/или диагностический препарат может содержать дополнительно адъюванты и/или добавки, которые являются пригодными и предпочтительно хорошо переносятся.
Предпочтительно, композиция представлена в виде жидкости или полутвердого вещества. Пригодные жидкости в объеме настоящего изобретения выбираются из группы, состоящей из раствора, предпочтительно капель, спрея, аэрозоли, эмульсии или лосьона. Пригодные полутвердые вещества в объеме настоящего изобретения выбираются из группы, состоящей из мази, крема (O/W эмульсия), жирного крема (W/O эмульсия), геля, лосьона, пены, пасты и/или суспензии.
Для дерматологических и гинекологических применений, препарат предпочтителен в форме, которая является пригодной для местного применения, в особенности геля. Свойства, которыми обладает препарат, напр., вязкость и реология, которые благоприятны для соответствующей формы применения, необходимы для того, чтобы убедиться, что после нанесения препарата, наносомы, загруженные 5-аминолевулиновой кислотой, проникают в достаточном объеме к ткани-мишени. Указанные свойства вязкости и реологии могут регулироваться путем добавления загустителей, таких как эфиры полиэтиленгликоля и стеарилового спирта, полиэтиленгликоля стеараты и/или полисахариды, такие как полисахарид B-1459, например.
В особенно предпочтительном воплощении, изобретательская композиция представлена в виде геля. Гели проявляют улучшенные медицинские свойства по сравнению с вышеупомянутыми составами. Изобретательский гелевый состав показывает лучшую адгезивность, устойчивость, высвобождение активного агента и переносимость кожей и слизистым оболочками. Изобретательский гель предпочтительно содержит от 0,01% по массе до 50% по массе, более предпочтительно от 0,5% по массе до 30% по массе и наиболее предпочтительно от 1% по массе до 20% по массе активного агента, от 1% по массе до 60% по массе, более предпочтительно от 15% по массе до 50% по массе, наиболее предпочтительно от 10% по массе до 30% по массе наноэмульсии, от 0,01% по массе до 4% по массе, более предпочтительно от 1% по массе до 3% по массе, по меньшей мере, одного наполнителя, от 1% по массе до 3% по массе, по меньшей мере, одного стабилизатора, исходя из общей массы композиции, и баланс поддерживает, по меньшей мере, один растворитель.
Дополнительный аспект настоящего изобретения состоит в способе приготовления изобретательской композиции, содержащей следующие стадии:
a) обеспечение водного компонента,
b) обеспечение носителя, содержащего, по меньшей мере, один липофильный компонент, по меньшей мере, одно ПАВ и, по меньшей мере, один спирт, где, по меньшей мере, один спирт имеет, по меньшей мере, три атома углерода,
c) смешивание водного компонента из стадии a) с носителем из стадии b), для формирования наноэмульсии,
d) добавление активного агента перед и/или после формирования указанной наноэмульсии из стадии c), и
e) необязательно добавление дополнительных добавок и/или эксципиентов в стадии d).
В особенности предпочтительно, активный агент в стадии d) добавляется после формирования указанной наноэмульсии из стадии c).
Способ предпочтительно осуществляется при асептических условиях, напр., при использовании ламинар