Способ получения высокодисперсного ибупрофена
Иллюстрации
Показать всеИзобретение относится области химико-фармацевтической промышленности, в частности к способам получения высокодисперсных лекарственных форм ибупрофена, имеющего широкое применение в медицине. Предложен способ быстрым охлаждением растворов путем распыления раствора в емкость с жидким азотом с последующим удалением растворителей нагревом, при котором в качестве исходного вещества используют ибупрофен, а в качестве растворителя - систему 1,4-диоксан-вода или ацетон-вода, при этом диапазон концентраций ибупрофена в исходной смеси - 80-95% от растворимости ибупрофена в данной смеси растворителей при заданной температуре, причем в системе 1,4-диоксан-вода содержание воды не должно превышать 30 масс.%, а в системе ацетон-вода содержание воды составляет 30-50 масс.%, сублимацию получившейся твердой смеси осуществляют ступенчатым повышением температуры от -196°C до +30°C в вакуумированном термостатируемом сосуде. 2 з.п. ф-лы, 3 пр., 8 ил.
Реферат
Изобретение относится к области химико-фармацевтической промышленности, в частности к способам получения высокодисперсных лекарственных форм ибупрофена, имеющего широкое применение в медицине.
Ибупрофен - нестероидное противовоспалительное средство (НПВС), обладающее анальгезирующим, противовоспалительным и жаропонижающим действием [Регистр лекарственных средств. Ибупрофен. Описание. http://www.rlsnet.ru/mnn_index_id_100.htm]. Для лекарственных препаратов, имеющих в своем составе активный ингредиент II класса BCS [Amidon G.L., Lennemas H., Shah V.Р., Crison J.R. "A theoretical basis for a biopharmaceutics drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability" // Pharm. Res., 1995, 12, p.413-420], высвобождение лекарственного вещества из лекарственной формы является лимитирующей стадией попадания их в системный кровоток [Lindenberg M., Kopp S., Dressman J. "Classification of orally administered drugs on the World Health Organization Model list of Essential Medicines according to the biopharmaceutics classification system" // Eur. J. Pharm. Biopharm., 2004, 58, p.265-278]. Эти вещества являются классическими объектами исследований с целью создания улучшенных лекарственных форм, поскольку именно для них наибольшее значение имеют кристаллическое состояние, размер и морфология частиц исходной субстанции.
Ибупрофен обладает плохой прессуемостью, и при таблетировании необходимо использовать стадию влажного гранулирования и использовать наполнители. Вследствие добавления большого количества фармацевтических вспомогательных веществ для таблетирования концентрация активного вещества в твердых лекарственных препаратах ограничена до значения приблизительно от 30 до 40 мас.%. Это приводит к высокой стоимости продукта на единицу активного вещества и неудобству приема, твердые лекарственные препараты с высоким содержанием вспомогательных веществ вследствие их размеров едва могут проглатываться.
Пример подобного препарата представлен в патенте RU 2254854. В нем описывается анальгезирующий, жаропонижающий, противоепалительный препарат и способ получения твердой лекарственной формы в виде таблетки, включающей ядро состоящее из ибупрофена, крахмала картофельного, кальция стеарата, покрытое оболочкой. Массу для ядра увлажняют, гранулируют, сушат, проводят сухую грануляцию, опудривают, прессуют гранулят в таблетки-ядра. Затем наносится маскирующая неприятный вкус оболочка ядра, при этом оболочка содержит: сахар, магния карбонат основной, поливинилпирролидон, аэросил, тальк, титана двуокись, желатин, ванилин, кислотный красный, воск пчелиный.
Известно, что уменьшение размеров частиц и, таким образом, увеличение площади поверхности, позволяет улучшить динамику растворения плохо растворимых в воде лекарственных препаратов [Dokoumetzidis A., Macheras P. "A century of dissolution research: From Noyes and Whitney to the Biopharmaceutics Classification System" // Int. J. Pharm., 2006, 321(1-2), p.1-11]. Форма кристаллов может оказывать заметное воздействие на физические свойства фармацевтических порошков. Изменение формы частиц приводит к варьированию площади контактов между ними и силы взаимодействия. Например, призмаподобные и пластинчатые кристаллы парацетамола показали улучшенную способность к прессованию, чем другие, как и частицы ибупрофена в виде пластинок прессовались лучше, чем игольчатые. [Crystal habit and tableting behavior. Norbert Rasenack, Bemd W. Muller // International Journal of Pharmaceutics 244 (2002) 45-5 7].
В работе [Norbert Rasenack, Bemd W. Müller, Ibuprofen crystals with optimized properties// International Journal of Pharmaceutics 245 (2002) 9-24] представлен способ получения микрокристаллов ибупрофена методом кристаллизации с заменой растворителя с различными наполнителями. Авторы к раствору ибупрофена в изопропиловом спирте, добавляли водный раствор гидрофильных добавок, затем проводили кристаллизацию. Полученные образцы ибупрофена показали улучшенную текучесть, имели форму, близкую к пластинкам, морфология краев пластинок зависела от выбранной добавки или смеси наполнителей. Порошок ибупрофена, полученный кристаллизацией с декстраном и сахарозой монолауратом, показал лучшую способность к прессованию, поверхность таблетки была ровная и гладкая. Авторы утверждают, что данный порошок может использоваться для производства таблеток прямым прессованием с содержанием ибупрофена до 85%. Их эксперименты по определению динамики растворения показали, что уже на 2 минуте достигается 100% выход в раствор при использовании композиций ибупрофена с сахарозой монолауратом и гидрофильными добавками, в то время как 100% выхода в раствор при использовании контрольного образца наблюдалась на 20 минуте теста. Для всех полученных образцов характерно сравнительно небольшое увеличение удельной площади поверхности-максимальное 0,331 м2/г против 0,112 м2/г - контрольного образца, что еще не может оказать заметного влияния на скорость растворения получаемых образцов (для сравнения: удельная площадь поверхности образцов субстанции ибупрофена, используемой для приготовления гранулята для таблети-рования, предоставленной ОАО «Татхимфармпрепараты» - 0,05±0,01 м2/г.); другими словами, увеличение скорости растворения в данном случае обусловлено вводимыми добавками.
В литературе описаны инструментальные методы получения высокодисперсных образцов лекарственных препаратов, основанные на распылительной, либо лиофильной сушке (Hu J., Johnston K.R, Williams R.O. // Drug Dev. Ind. Pharm. 2004, 30(3), 233-245.). При этом, использование больших скоростей охлаждения с образованием аморфных фаз с последующим удалением растворителей сублимацией позволяет избежать укрупнения образующихся кристаллитов вследствие отсутствия контакта с жидкой фазой.
Данный способ по техническим приемам наиболее близок к предлагаемому изобретению.
Известно, что существенное увеличение растворимости многих гидрофобных лекарственных веществ достигается при использовании в качестве растворителя двухкомпонентной смеси легкокипящая жидкость (1,4-диоксан, этанол, ацетон) - вода. Дополнительным аргументом в пользу использования систем с диоксаном и ацетоном является образование клатратных гидратов [Dyadin Yu.A., Bondaryuk I.V., Zhurko F.V. Clathrate hydrates at high pressures. Inclusion compounds, V. 5, Eds. J.L. Atwood, J.E.D. Davies and D.D. MacNicol, Oxford University Press, Oxford. 1991, 214-275.] (молярное отношение легкокипящая жидкость-вода 1:17) в этих системах при низких температурах, вследствие чего имеется возможность проводить эксперимент таким образом, чтобы в условия пониженного давления в широком интервале концентраций и температур сосуществовали только твердые фазы.
Задачей настоящего изобретения является разработка простого и эффективного способа получения высокодисперсной формы ибупрофена, обладающей лучшей динамикой растворения и пригодной для непосредственного таблетирования без использования наполнителей.
Поставленная задача была решена использованием в качестве растворителей систем 1,4-диоксан-вода и ацетон-вода, быстрым охлаждением растворов распылением раствора в емкость с жидким азотом, с последующим удалением растворителей нагревом (ступенчатым повышением температуры от -196°С до +30°С) получившейся твердой смеси в вакуумированном термостатируемом сосуде при давлении <5·10 мм.рт.ст. В таком случае, при указанных условиях эксперимента, происходит удаление компонентов используемой смеси растворителей сублимацией.
В работе использовали поликристаллическую субстанцию ибупрофена, ацетон квалификации «хроматографически чистый», очищенный от перекисей 1,4-диоксан и дистиллированную воду.
Были проведены следующие предварительные эксперименты:
К началу нашего исследования полностью отсутствовали литературные данные как о составе фаз, образующихся при быстром замораживании растворов ибупрофена в предлагаемых к использованию смесях растворителей, так и о процессах, протекающих при отжиге образующихся в данной системе аморфных фазах. Эти сведения были абсолютно необходимы как для ответа на вопрос, возможно ли использование данных смеси растворителей для поставленной нами задачи, так и подбора температурных режимов сублимационной сушки.
С целью идентификации фаз, образующихся при быстром замораживании растворов и регистрации фазовых превращений, происходящих при отжиге замороженных растворов в системах ибупрофен-ацетон-вода и ибупрофен-1,4-диоксан-вода, были записаны порошковые дифрактограммы (порошковый дифрактометр Bruker D8 Advance, оборудованный низкотемпературной приставкой ТТК 450 Anton Paar, с ячейкой для исследований в условиях вакуума до 10-3 мм рт.ст.) в температурном интервале от -140 до 20°C при атмосферном и при пониженном давлении (Р<5·10-2 мм.рт.ст.).
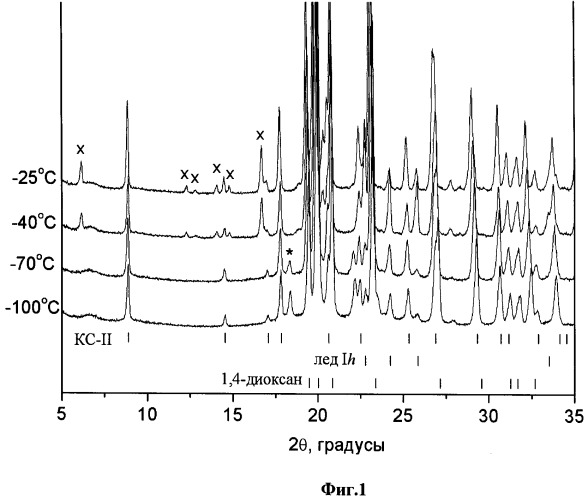
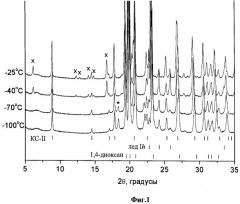
Дифракционный эксперимент, проведенный с образцом замороженного раствора ибупрофен-1,4-диоксан-вода (~10 масс.% ибупрофена в растворе, содержащем 70 масс.% 1,4-диоксана и 30 масс.% воды) (Фиг.1, Дифрактограммы замороженных растворов ибупрофен-1,4-диоксан-вода при различных температурах. Рассчитанные на основании монокристальных данных положения рефлексов клатратного гидрата 1,4-диоксана KC-II, гексагонального льда и высокотемпературной полиморфной модификации 1,4-диоксана приведены внизу рисунка; * - обозначен наиболее сильный рефлекс низкотемпературной полиморфной модификации 1,4-диоксана. x - обозначены рефлексы ибупрофена в области малых углов) показал, что при температурах ниже -70°С, на дифрактограммах присутствуют рефлексы клатратного гидрата 1,4-диоксана KC-II, гексагонального льда и высокотемпературной полиморфной модификации 1,4-диоксана (также присутствует некоторое количество метастабильной в данных условиях низкотемпературной полиморфной модификации 1,4-диоксана). Отсутствие на дифракто-граммах при температурах ниже -70°C рефлексов, относящихся к ибупрофену, говорит о том, что при использовании данного способа охлаждения происходит аморфицазия ибупрофена. При дальнейшем повышении температуры происходит кристаллизация ибупрофена из аморфной фазы. Таким образом, дифракционный эксперимент показал, что при отжиге стеклообразной фазы, образовавшейся при быстром охлаждении раствора ибупрофена в смеси 1,4-диоксан-вода не происходит образования ибупрофен-содержащих промежуточных фаз (например, сольватов или метастабильых полиморфных модификаций ибупрофена). Таким образом, основным требованием к температурному режиму сушки является удаление остаточного количества непрореагировавшей воды (в виде гексагонального льда), с целью недопущения пересечения фигуративной точкой системы линии метастабильной эвтектики (-19°C), что может привести к появлению в системе жидких фаз.
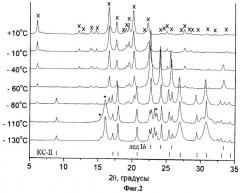
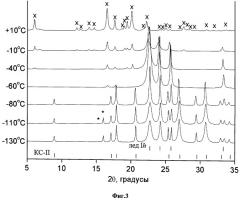
Дифракционный эксперимент, проведенный с образцами замороженных растворов ибупрофен-ацетон-вода (1. ~10 масс.% ибупрофена в растворе, содержащем 70 масс.% ацетона и 30 масс.% воды; 2. ~10 масс.% ибупрофена в растворе, содержащем 50 масс.% ацетона и 50 масс.% воды) (Дифрактограммы замороженных растворов ибупрофен-ацетон-вода (~10 масс.% ибупрофена в растворе, содержащем 70 масс.% ацетона и 30 масс.% воды; Фиг.2; ~5 масс.% ибупрофена в растворе, содержащем 50 масс.% ацетона и 50 масс.% воды; Фиг.3;) при различных температурах. Рассчитанные на основании монокристальных данных положения рефлексов клатратного гидрата ацетона KC-II, гексагонального льда приведены внизу рисунка; * - обозначены наиболее сильные рефлексы низкотемпературной полиморфной модификации ацетона. x - рефлексы ибупрофена) показал, что при температурах ниже температуры плавления эвтектики в двойной системе ацетон-вода, наблюдались рефлексы, отвечающие фазам низкотемпературной полиморфной модификации ацетона, гидрата ацетона KC-II и льда Ih, несмотря на то, что исходя из состава используемой нами смеси ацетон-вода, в данных условиях эксперимента должны были наблюдаться рефлексы гидрата ацетона KC-II, и низкотемпературной полиморфной модификации ацетона.
Таким образом, в используемых нами условиях охлаждения раствора (распыление раствора в емкость с жидким азотом), не происходит полного превращения всего льда Ih в гидрат ацетона KC-II,. Достаточно быстрое снижение интенсивностей наиболее интенсивных рефлексов низкотемпературной полиморфной модификации ацетона свидетельствует об удалении ацетона из исследуемой смеси сублимацией. При дальнейшем повышении температуры происходит кристаллизация ибупрофена из аморфной фазы, без образования ибупрофен-содержащих промежуточных фаз (например, сольватов или метастабильных полиморфных модификаций ибупрофена).
Итак, температурные режимы и давление для предлагаемого способа получения высокодисперсного ибупрофена были подобраны на основании полученных нами экспериментальных данных о процессах, происходящих при отжиге замороженных растворов в системах ибупрофнен-1,4-диоксан-вода и ибупрофнен-ацетон-вода в температурном интервале от -196°C до +30°C (и в условиях пониженного давления), а также известных литературных данных по диаграммам плавкости систем 1,4-диоксан-вода и ацетон-вода, и положению кривых сублимаций льда, 1,4-диоксана и ацетона на соответствующих фазовых диаграммах.
Таким образом, экспериментально было установлено:
1. В случае использования в качестве растворителей системы 1,4-диоксан-вода, температура основной стадии сушки во всем диапазоне концентраций 1,4-диоксана лимитируется температурой метастабильной эвтектики (-19°C). Вторая стадия сушки проводится при температуре +30°C и имеет целью удаление следовых количеств воды за счет большего давления паров воды при этой температуре, согласно фазовой диаграмме воды.
2. В случае использования в качестве растворителей системы ацетон-вода лимитирующей стадией сушки становится удаление аморфного ацетона сублимацией при температурах ниже температуры плавления эвтектики в двойной системе ацетон-вода (-100°C), поскольку неполное удаление ацетона сублимацией при этих температурах приводит к образованию жидкой фазы ацетон-вода с содержанием до 5% масс. воды при температуре -80°C, что приводит к повышению растворимости ибупрофена, его последующей кристаллизации при испарении смеси растворителей и, как следствие, появлению мелких хорошо ограненных кристаллов. Следующая стадия сушки, выполняемая при температуре порядка -20°C, имеет целью разложение гидрата ацетона KC-II, и удаление льда Ih сублимацией. Заключительная стадия сушки проводится при температуре +30°C и имеет целью удаление следовых количеств воды за счет большего давления паров воды при этой температуре, согласно фазовой диаграмме воды.
3. а) Оптимальный для данного метода диапазон концентраций используемого раствора 1,4-диоксан-вода - не более 30 масс.% воды. При большем содержании воды в используемых растворах резко уменьшается растворимость ибупрофена и увеличивается относительная доля льда, который необходимо удалять сублимацией, что приведет к большому росту энергозатрат на единицу массы продукта.
б) Оптимальный для данного метода диапазон концентраций используемого раствора ацетон-вода - от 30 до 50 масс.% воды. При большем содержании воды в используемых растворах существенно уменьшается растворимость ибупрофена и увеличивается относительная доля льда, который необходимо удалять сублимацией, а при концентрации воды в исходном растворе <30% сильно увеличивается относительное количество непрореагировавшего ацетона, который необходимо удалять сублимацией при температурах ниже температуры плавления эвтектики в системе ацетон-вода.
4. Оптимальный для данного метода диапазон концентраций ибупрофена в исходной смеси - 80-95% от известной на основании известных данных равновесной растворимости ибупрофена в данной смеси растворителей при заданной температуре (с образованием гомогенного однородного раствора, не допуская появления расслаивания жидкостей). При концентрациях ибупрофена >95% необходимо либо подогревание раствора до температуры порядка +50°С, либо длительное перемешивание, что приводит к испарению используемых легколетучих растворителей с соответствующим понижением растворимости ибупрофена в получившейся смеси и увеличению времени подготовки раствора, также необходимости подогревать форсунку (в случае, если применяемый для охлаждения раствора способ заключается в распылении раствора в емкость с жидким азотом) для предотвращения кристаллизации ибупрофена из раствора в подводящем капилляре. При концентрациях ибупрофена <80% увеличивается относительная доля растворителей, которые необходимо удалить, что приводит к увеличению времени сушки и энергозатрат на единицу массы продукта.
Примеры реализации способа
Пример 1.
В 15 г раствора 1,4-диоксан - вода с содержанием воды от 20.0 до 20.5 масс % при перемешивании растворяли от 9.9 до 10.2 масс % ибупрофена. Раствор распыляли через пульверизатор (диаметр подводящего капилляра 0,4 мм., избыточное давление распыляющего газа 1.5 атм.) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота массивный держатель (масса держателя и подставки > массы смеси примерно в 3 раза), который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до Р<2 Па. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -20°C. Сушку проводили в токе сухого азота (Т ~ -20°C, Р ~ 102 Па) до падения давления в камере до Р<2 Па (~4 часа) при постоянном откачивании. Затем температуру теплоносителя повышали до -7°C, выдерживали при постоянном откачивании до падения давления в камере до Р<2 Па (~4 часа). После температуру теплоносителя повышали +50°C, с выдерживанием в течение 3 часов при этой температуре. Давление в камере повышали до Р=1 атм. заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Рентгенофазовый анализ показал, что полученные во всех экспериментах образцы представляет собой чистый ибупрофен.
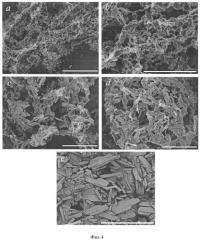
По данным сканирующей электронной микроскопии, они представляют собой совокупность плоских (толщиной менее 300 нм) частиц размерами 1-10 мкм, объединенных в агломераты размерами 30-100 мкм.
Пример 2.
Выполнен по примеру 1. отличается от примера 1 тем, что масса раствора составляла от 20.5 до 28.9 г, а содержание ибупрофена от 14.4 до 22.2 масс %.
Рентгенофазовый анализ показал, что полученные во всех экспериментах образцы представляет собой чистый ибупрофен.
По данным сканирующей электронной микроскопии, они представляют собой совокупность плоских (толщиной менее 300 нм) частиц размерами 1-10 мкм, объединенных в агломераты размерами 30-100 мкм.
Пример 3
К от 20.7 до 25.1 г раствора ацетон-вода с содержанием воды от 28.4 до 31.2 масс % при перемешивании растворяли от 13.6 до 21.7 масс % ибупрофена. Раствор распыляли через пульверизатор (диаметр подводящего капилляра 0,4 мм., избыточное давление распыляющего газа 1.5 атм.) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота массивный держатель (масса держателя и подставки > массы смеси примерно в 3 раза), который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до Р<2 Па. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -20°C. Сушку проводили в токе сухого азота (Т ~ -20°C, Р ~ 102 Па) до падения давления в камере до Р<2 Па при постоянном откачивании. Затем температуру теплоносителя повышали до -5°C, выдерживали при постоянном откачивании до падения давления в камере до Р<2 Па (~4 часа). После температуру теплоносителя повышали +30°C с выдерживанием в течение 3 часов при этой температуре. Давление в камере повышали до Р=1 атм. заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Рентгенофазовый анализ показал, что полученные во всех экспериментах образцы представляет собой чистый ибупрофен.
По данным сканирующей электронной микроскопии, они представляют собой совокупность плоских (толщиной менее 300 нм) частиц размерами 1-10 мкм, объединенных в агломераты размерами 30-100 мкм.
Характеристики получаемого продукта.
Образцы ибупрофена, полученные по нашему способу, представляют собой чрезвычайно легкие пушистые порошки. Удельная площадь поверхности образцов ибупрофена, вычисленная по сорбции/десорбции N2, оказалась равной: полученный нами - 2,6±0,1 м2/г., исходная субстанция - 0.05±0.01 м2/г,.
По данным сканирующей электронной микроскопии, они представляют собой совокупность плоских (толщиной менее 300 нм) частиц размерами 1-10 мкм, объединенных в агломераты размерами 30-100 мкм (Фиг.4, Образцы высокодисперсного ибупрофена (а-d), полученные по предложенному способу, в сравнении с поликристаллическим образцом исходной субстанции (е). Масштабный отрезок: а - 100 мкм.; b - 50 мкм; с - 30 мкм.; d - 50 мкм.; е - 500 мкм.). Дифракционный эксперимент, проведенный с использованием синхротронного излучения с регистрацией дифракционной картины на двумерном запоминающем рентгеновском экране, показал отсутствие преимущественной ориентации кристаллитов в плоских частицах ибупрофена, полученных в данной работе (Фиг.5. Дифракционный эксперимент, подтверждающий отсутствие преимущественной ориентации кристаллитов в частицах ибупрофена, полученных в данной работе (а, b - дифракционные картины образцов порошка высокодисперсного ибупрофена и исходной субстанции).
Проведенные в 2001 году в научном центре Simbec Research (Великобритания) сравнительные исследования «Нурофена» (ибупрофен очень мало растворим в воде) в таблетках и его растворимой формы подтвердили, что уровень абсорбции при использовании шипучих таблеток ибупрофена выше, чем при использовании обычных таблеток [И.И. Баранов, В.Н. Серов. Нурофен в купировании менструальных болей. // Русский медицинский журнал, сентябрь 2005]. Таким образом, у пациентов, предпочитающих лекарства в растворимой форме, теперь появилась новая возможность воспользоваться преимуществами ибупрофена. Однако, несмотря на эти преимущества, широко рекламируемые «шипучие таблетки» имеют ряд ограничений: их применение может вызвать осложнения у лиц с заболеваниями ЖКТ; их нельзя давать маленьким детям (отдельно отметим, что для этой группы пациентов (и их родителей) особенно важна скорость растворения и усвоения, а значит, и быстрое действие болеутоляющего/жаропонижающего средства). Эту нишу на рынке лекарственных форм ибупрофена занимают суспензии (обычно содержащие ~100 мг ибупрофена в 5 мл), наиболее удобные для приема внутрь самыми маленькими пациентами: их легко дозировать, терапевтическая доза лекарственного средства содержится в сравнительно малом объеме «носителя», наличие маскирующих вкус добавок. Однако оказывается (Фиг.6. Сравнение размеров частиц ибупрофена, содержащихся в лекарственной форме в виде суспензии «Нурофен» («БСМ Лтд», Великобритания) (а), исходной субстанции (b) и образцах высокодисперсного ибупрофена, приготовленных по нашему методу (из различных смесей растворителей) (с-d).), что размер частиц ибупрофена, входящих в состав суспензии (напр., производства «БСМ Лтд», Великобритания), ничем не отличается от исходных субстанций, используемых для приготовления лекарственных форм в виде таблеток! Таким образом, положительным моментом использования подобных суспензий на основе немикронизированных субстанций является, в основном, простота их приема маленькими детьми, и некоторое увеличение скорости растворения (и усвоения) препарата, которое может быть обусловлено только отсутствием склеивающих добавок (крахмал и т.д.), используемых при изготовлении гранулята для таблетирования. Однако звестно, что уменьшение размеров частиц и, таким образом, увеличение площади поверхности, позволяет улучшить динамику растворения плохо растворимых в воде лекарственных препаратов [Dokoumetzidis A, Macheras P. A century of dissolution research: From Noyes and Whitney to the Biopharmaceutics Classification System. // Int. J. Pharm., 2006, 321 (1-2), p.1-11]. Поэтому предлагаемый нами метод микронизации ибупрофена представляет собой практически единственное решение данной проблемы.
В экспериментах по определению динамики растворения (Изучение сравнительной динамики растворения проводили в дистиллированной воде. Условия растворения: аппарат - Varian 705 DS, температура - 37,5°C, скорость вращения лопасти - 100 об/мин, объем среды растворения - 250 мл. Последовательный отбор проб проводили через 5, 10, 15, 20, 30, 45, 75, 120, 180, 240 мин по 5 мл, причем такой же объем раствора добавлялся в среду растворения для сохранения объема. Полученные пробы охлаждали при комнатной температуре в течение 20-30 мин, затем фильтровали через бумажный фильтр «синяя лента». Для получения статистически достоверных результатов исследование проводили 4 раза для каждого образца. Количественный анализ проводили методом УФ-спектрофотометрии. Оптическую плотность проб измеряли на спектрофотометре Varian, оснащенной программой для обработки данных, при длине волны 222 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали среду растворения [Изучение сравнительной кинетики растворения лекарственных средств ибупрофена / И.Е. Шохин, Г.В. Раменская, Г.Ф. Василенко, Е.А. Малашенко // Вестник ВГУ, серия: Химия. Биология. Фармация. 2009. №2. с.198-201]) показано, что образцы, полученные предложенным методом, обладают более высокой скоростью растворения (Фиг.7, Динамика растворения образцов ибупрофена, полученных в данной работе, и исходной субстанции.), чем исходные субстанции, используемые в фармацевтической промышленности для приготовления гранулята для таблетирования, сиропов и суспензий.
В то же время образцы полученного нами высокодисперсного ибупрофена продемонстрировали существенно лучшую способность к прессованию (Эксперименты по определению способности к прессованию проводились с использованием испытательной машины Zwick/Roell Z010 (максимальное усилие на траверсе 10 kH). Все эксперименты проводились с использованием предварительного уплотняющего усилия 200 Н; скорость перемещения траверса 10 мм./мин. Диаметр пресс-формы 6 мм., масса образца 100±5 мг. Диапазон использовавшихся уплотняющих усилий: 100-300 МПа; в каждой серии проводилось не менее 3 измерений (обычно 5-8).
Сразу же после выхода из пресс-формы таблетку обеспыливали, взвешивали на аналитических весах с точностью 0.0001 г.; толщину и диаметр измеряли с помощью микрометра с плоскими губками (Mitutoyo, Japan) с точностью 0,01 мм.
Силу, необходимую для разрушения таблетки поставленной на ребро, определяли сразу же после снятия размеров таблеток с использованием испытательной машины Zwick/Roell Z010. Прочность таблеток (МПа) рассчитывалось согласно
Q=2H/πdh, где H - сила (Н), необходимая для разрушения таблетки, d - диаметр (мм.), h - толщина таблетки (мм.).) по сравнению с поликристаллическими образцами 2-х исходных субстанций ибупрофена, используемыми для приготовления твердых лекарственных форм (Фиг.8, Зависимость прочности таблеток от давления прессования (1, 2 - исходные субстанции, 2, 3 - образцы высокодисперсного ибупрофена, полученные с использованием смесей растворителей ацетон-вода и 1,4-диоксан-вода, соответственно).
Таким образом, предложенный метод впервые позволил решить задачу получения высокодисперсной формы ибупрофена, характеризующийся улучшенной динамикой растворения по сравнению с исходными субстанциями, используемых как для приготовления гранулята для таблетирования, так и суспензий. Кроме того, получаемая по данному способу высокодисперсная форма ибупрофена пригодна для прямого прессования без наполнителей в таблетки, сочетающие устойчивость при хранении и высокую механическую прочность. Предлагаемый способ прост в осуществлении, сравнительно легко может быть преобразован в технологический процесс промышленного масштаба.
1. Способ получения высокодисперсного ибупрофена путем быстрого охлаждения раствора исходного вещества в двухкомпонентной смеси легкокипящая жидкость - вода до температуры жидкого азота и удаления растворителя сублимацией, отличающийся тем, что в качестве исходного вещества используют ибупрофен, а в качестве растворителя - систему 1,4-диоксан - вода или ацетон - вода, при этом диапазон концентраций ибупрофена в исходной смеси - 80-95% от растворимости ибупрофена в данной смеси растворителей при заданной температуре, причем в системе 1,4-диоксан - вода содержание воды не должно превышать 30 мас.%, а в системе ацетон - вода содержание воды составляет 30-50 мас.%, сублимацию получившейся твердой смеси осуществляют ступенчатым повышением температуры от -196°С до +30°С в вакуумированном термостатируемом сосуде.
2. Способ по п.1, отличающийся тем, что температура основной стадии сушки при использовании системы 1,4-диоксан - вода во всем диапазоне концентраций не превышает -19°C, а вторую стадию сушки для удаления следовых количеств воды проводят при температуре +30°C.
3. Способ по п.1, отличающийся тем, что основную стадию сушки для удаления аморфного ацетона сублимацией осуществляют при температуре -100°C, следующую стадию сушки для разложения гидрата ацетона КС-II выполняют при температуре порядка -20°C, удаление льда Ih сублимацией осуществляют при температуре порядка -5°C, заключительную стадию сушки для удаления следовых количеств воды проводят при температуре +30°C.