Лигнан, обладающий анальгетическим действием
Иллюстрации
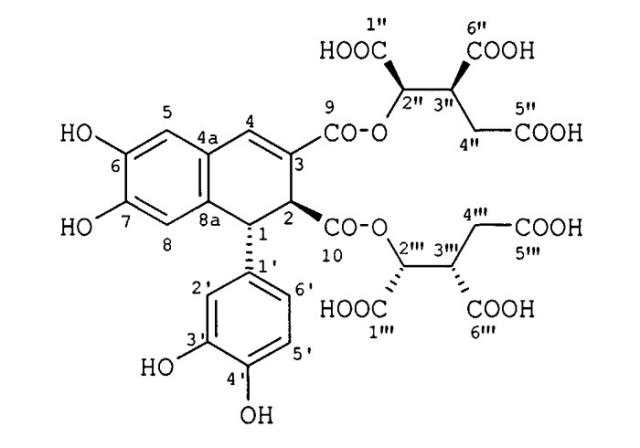
Показать всеИзобретение относится к фармацевтической промышленности, а именно к биологически активному соединению, обладающему анальгетическим действием. Лигнан, обладающий анальгетическим действием, структура которого описывается как (1R,2S)-1-[(1R,2S)-1-(3,4-дигидроксифенил)-6,7-дигидрокси-3-[(1R,2S)-1,2,3-трикарбоксипропокси] карбонил-1,2-дигидронафтален-2-карбонил]оксипропан-1,2,3-трикарбоксиловая кислота:
Вышеописанный лигнан имеет направленное действие на протон-управляемый ионный канал ASIC3, который инициирует нейрональный ответ при болевых стимулах. 7 ил., 8 пр.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным низкомолекулярным соединениям органической природы, обладающим анальгетическим или противовоспалительным действием, которые могут найти применение в медицине, ветеринарии или научных исследованиях.
В настоящее время одной из основных причин обращения людей за врачебной помощью является боль. Патологическая боль, появляющаяся при различных состояниях, представляет собой нежелательное явление, резко снижающее качество жизни, работоспособность и вызывающее страдания. До 40% взрослого населения развитых стран страдает от хронической боли. Наиболее широко в качестве анальгетических препаратов традиционно используются: нестероидные противовоспалительные средства, опиоиды и разнообразные вещества неспецифического действия (антиконвульсанты, антидепрессанты). Несмотря на большой ассортимент анальгетических средств различной химической природы, некоторые типы болевых состояний, например, различные нейропатии, практически нечувствительны к этим агентам. Кроме того, практически все вышеперечисленных веществ в ряде случаев из-за неспечифичности действия вызывает нежелательные побочные эффекты, что сильно ограничивает возможность их применения.
Важную роль во многих патологических процессах играет семейство протон-чувствительных ионных каналов (ASICs), включающих разнообразные комбинации субъединиц ASIC1a, ASIC1b, ASIC2a и ASIC3 [Krishtal О. The ASICs: signaling molecules? Modulators? // Trends Neurosci. 2003. V.26. P.477-483]. ASICs каналы экспрессируются многими типами нервных клеток, главным образом, периферическими и сенсорными нейронами центральной нервной системы (ЦНС), в том числе нейронами, чувствительными к болевым стимулам. Эти каналы выполняют важную функцию сигнальной трансдукции при изменении рН в межклеточном пространстве. Большинство типов ASIC каналов ответственно за ощущение боли, сопровождающейся ацидозом ткани при мышечной, сердечной, мозговой ишемии, эпилепсии, различных воспалительных и инфекционных процессах, повреждении роговицы и других патологиях [Ugawa S., Ueda Т., Ishida Y., Nishigaki M., Shibata Y., Shimada S. Amiloride-blockable acid-sensing ion channels are leading acid sensors expressed in human nociceptors // J. Clin. Invest. 2002. V.110, P.1185-1190]. Установлено, что одну из ключевых ролей в генерации высокоинтенсивных болевых стимулов и Н+-индуцированных патологических процессов играют ASIC3 каналы [Deval Е., Noel J., Lay N., Alloui A., Diochot S., Friend V., Jodar M., Lazdunski M., Lingueglia E. ASIC3, a sensor of acidic and primary inflammatory pain // Embo J. 2008. V.27, P.3047-3055; Deval E., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. 2010. V.128, P.549-558; Deval E., Noel J., Gasull X., Delaunay A., Alloui A., Friend V., Eschalier A., Lazdunski M, Lingueglia E. Acid-sensing ion channels in postoperative pain // J. Neurosci. 2011. V.31, P.6059-6066].
В настоящее время набор используемых в практике активных лигандов-модуляторов ASIC3 каналов ограничен в основном амилоридными и нестероидными противовоспалительными средствами, действующими как ингибиторы [Voilley N., de Weille J., Mamet J., Lazdunski M. Nonsteroid anti-inflammatory drugs inhibit both the activity and the inflammation-induced expression of acid-sensing ion channels in nociceptors // J. Neurosci. 2001. V.21, P.8026-8033], и нейропептидами млекопитающих NPRF и NPSF, активирующими ASIC3 каналы [Lingueglia Е., Deval Е., Lazdunski М. FMRFamide-gated sodium channel and ASIC channels: a new class of ionotropic receptors for FMRFamide and related peptides // Peptides. 2006. V.27, P.1138-52].
Общеизвестно, что применение наркотических анальгетиков приводит к привыканию и ослаблению действия, что требует увеличения дозы препарата. При использовании современных ненаркотических анальгетиков также возникают побочные явления, такие как развитие эрозивно-язвенных поражений желудочно-кишечного тракта, угнетение процессов кроветворения, нефротоксическое и гепатотоксическое действие.
Важной задачей для раскрытия молекулярных механизмов восприятия боли и, в частности, вовлеченности ASIC3 каналов в патологические процессы является поиск, получение и использование высокоспецифичных фармакологических инструментов - принципиально новых обезболивающих средств, действующих с минимальными побочными эффектами.
Пока среди селективных соединений известно два активных компонента взаимодействующих с ASIC каналами. Прежде всего это полипептид из яда тарантула Psalmopoeus cambridgei, Psalmotoxin 1 (PcTx1) [Escoubas P., De Weille J.R., Lecoq A., Diochot S., Waldmann R., Champigny G., Moinier D., Menez A., Lazdunski M. Isolation of a tarantula toxin specific for a class of proton-gated Na+ channels // J. Biol. Chem. 2000a. V.275, P.25116-25121], который является высокоспецифичным и мощным ингибитором гомомерных каналов типа ASIC1a [Chen X., Kalbacher Н., Grunder S. The Tarantula Toxin Psalmotoxin 1 Inhibits Acid-sensing Ion Channel (ASIC) 1a by Increasing Its Apparent H+ Affinity // J. Gen. Physiol. 2005. V.126. P.71-79]. Второе вещество - это полипептид из морской анемоны Anthopleura elegantissima, названный APETx2. Он селективно ингибирует гомомерные ASIC3 каналы и с меньшей селективностью - гетеромерные ASIC1a+3, ASIC1b+3 и ASIC2b+3 каналы [Deval Е., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. 2010. V.128. P.549-558; Deval E., Noel J., Gasull X., Delaunay A., Alloui A., Friend V., Eschalier A., Lazdunski M., Lingueglia E. Acid-sensing ion channels in postoperative pain // J. Neurosci. 2011. V.31, P.6059-6066].
Несмотря на то, что ASIC1a, частично, также участвует в восприятии воспалительных процессов, модификация его проводимости с помощью различных фармацевтических средств, с практической точки зрения, имеет существенно меньший терапевтический потенциал по сравнению с поиском и внедрением фармацевтических агентов на ASIC3.
Недостатком АРЕТх2 является его неполное ингибирующее действие на рецепторы ASIC3. Известно, что этот канал имеет сложную динамику работы, из-за чего в электрофизиологических экспериментах разделяют общий проходящий через этот рецептор ток на быструю и продолжительную (стационарную) составляющую. Быстрый ток имеет большую амплитуду и длится менее 3 секунд. Продолжительный ток при не столь большой амплитуде и медленной скорости увеличения в итоге превосходит быстрый ток по суммарному количеству пропущенных через мембрану катионов. Селективность действия АРЕТх2 такова, что полипептид может ингибировать только быструю составляющую общего тока канала ASIC3, поэтому биологический эффект от снижения меньшей части тока через ASIC3 рецепторы не столь значим. Больший анальгетический эффект можно ожидать от соединений, эффективно снижающих оба компонента тока.
Изобретение решает задачу расширения арсенала анальгетических и противовоспалительных лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень, а именно, на протон-управляемый ионный канал ASIC3, участвующий в восприятии, обработке и передаче сигналов, связанных с изменением величины рН внеклеточной среды в ЦНС.
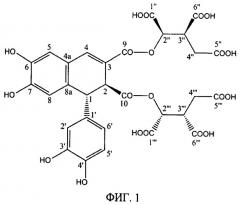
Поставленная задача решается за счет молекулы растительного лигнана из экстракта тимьяна Thymus armeniacus, имеющего химическую формулу: С30Н26О20 или 9,10-диизолимонный эфир эпифиловой кислоты, структура которого описывается как (1R,2S)-1-[(1R,2S)-1-(3,4-дигидроксифенил)-6,7-дигидрокси-3-[(1R)-1,2,3-трикарбоксипропокси]карбонил-1,2-дигидронафтален-2-карбонил]оксипропан-1,2,3-трикарбоксиловая кислота, (фиг.1 см. стр.11).
Заявляемый лигнан с расчетной средней молекулярной массой 706,52 Да может быть выделен хроматографическими методами из уксуснокислого экстракта молодых побегов тимьяна (фиг.2) или синтезирован химическим путем.
Заявляемый лигнан имеет спектр поглощения в ультрафиолетовой области с характерными максимумами поглощения при длине волны 212, 254 и 340 нм и имеет неярко выраженную желтоватую окраску (фиг.3).
Заявляемый лигнан, также именуемый «севанол», проявляет анальгетическую активность на млекопитающих, что было показано в тестах на мышах линии CD-1: как для модели тепловой гиперчувствительности после введения адъювант Фрейнда (фиг.4), так и на модели стимуляции «уксусных корчей» (фиг.5).
Заявляемый лигнан оказывает выраженный блокирующий эффект на быструю составляющую и на продолжительную составляющую тока через ASIC3 канал (фиг.6 и 7).
Заявляемый лигнан может быть использован как анальгетический агент для облегчения болевых состояний, обусловленных участием ASIC3 каналов в патологических процессах передачи болевых Н+-индуцированных стимулов, прежде всего связанных с ацидозом тканей, а также для выяснения топологии и молекулярных механизмов функционирования ASIC3.
Класс растительных лигнанов представляет собой достаточно широкий класс органических молекул, включающий в себя производные коричной кислоты и связан с биохимическим циклом метаболизма фенилаланина. Наиболее близок к структуре севанола - 2',7'-циклолигнан. Лигнаны - очень интересный класс молекул, которые проявляют разнообразный спектр биологической активности, поэтому считается, что они очень перспективны для разработки новых препаратов.
Наиболее близким аналогом является использование растения тимьян в виде отваров или порошка в традиционной медицине для лечения радикулита или зубной боли. Многие биологически активные препараты изготавливаются из этого растения для применения в качестве противоглистных, дезинфицирующих и болеутоляющих средств (http://oblepiha.com/lekarstvennye_rasteniya/94-timyan-polzuchij.html), однако анальгетическое действие отдельных компонентов тимьяна показано не было.
Изобретение иллюстрируют фигуры:
ФИГ.1. Структура севанола.
ФИГ.2. Основные стадии выделения лигнана из растительного сырья. (А) Схема последовательной экстракции севанола из гомогенизированного растительного сырья. (Б) Разделение супернатанта, полученного после 3 стадии экстракции на обращено-фазной колонке Luna C18 (4.6×150 мм) в 0.1% ТФУ при скорости потока 1 мл/мин в линейном градиенте концентрации ацетонитрила. (В) Заключительная стадия очистки на обращено-фазной колонке Luna PFP(2) (4.6×250 мм) в 0.1% ТФУ при скорости потока 0.5 мл/мин в линейном градиенте концентрации ацетонитрила. Стрелки обозначают времена элюирования активного компонента.
ФИГ.3. Спектр поглощения севанола в ультрафиолетовой и видимой области, измеренный при концентрации 70 мкМ в 0.1% растворе ТФУ для кюветы длиной 1 см.
ФИГ.4. Исследование влияния севанола на тепловую гиперчувствительность вызванную введением полного адьюванта Фрейнда (CFA) n=7. По оси ординат показано время отдергивания соответствующей лапы от горячей пластины (t=53°С). Для контрольной группы животных не проводят введение полного адьюванта Фрейнда. Внутримышечное введение севанола в различных концентрациях проводили за 30 минут до начала измерения. Статистически значимые различия от группы контроль отмечены *(р<0,01); *** - р<0.001.
ФИГ.5. Исследование влияния севанола на внутрибрюшинное введение уксусной кислоты в животной модели «Уксусные корчи» n=7. По оси ординат показано количество корчей, измеренное сразу после введения кислоты за 15 минутный интервал. Внутрибрюшинное введение севанола в различных концентрациях проводили за 30 минут до начала измерения. Статистически значимые различия от группы физ. р-р отмечены *** - р<0.001.
ФИГ.6. Влияние севанола на быструю составляющую токов ASIC3, регистрируемых методом двухэлектродной фиксации потенциала (-50 мВ) на X. laevis ооцитах. Приведены записи токов до добавления лигнана, при 10 секундной инкубации и после отмывки. Селективный ток через ASIC3 вызывали резким закислением среды 7.8->4.0 односекундным импульсом. По величине снижения амплитуды регистрируемого тока от использования различных концентраций по сравнению с амплитудой контрольного тока строили кривую ингибирования n=5.
ФИГ.7. Влияние севанола на продолжительную составляющую токов ASIC3, регистрируемых методом двухэлектродной фиксации потенциала (-50 мВ) на Х. laevis ооцитах. Приведены записи токов до добавления лигнана, при совместной аппликации с активационным буферным раствором и после отмывки. Селективный ток через ASIC3 вызывали резким закислением среды 7.3->4.0 пятисекундным импульсом. По величине снижения амплитуды регистрируемого тока от использования различных концентраций по сравнению с амплитудой контрольного тока строили кривую ингибирования n=5.
Изобретение иллюстрируют примеры.
Пример 1.
Выделение лигнана из растительного сырья.
Молодые побеги Thymus armeniacus гомогенизируют в первом экстрагирующем растворе, состоящем из 70% раствора этилового спирта, титрованного NaOH, до рН 8,0 из расчета 80 мл экстрагирующего раствора на 2 г сухого материала (фиг.2А). Полученную взвесь инкубируют в течение 1 часа при 24°С с постоянным перемешиванием, после чего центрифугируют 10000 g 20 мин и удаляют супернатант. Полученный осадок 1 ресуспендируют в 80 мл 70% раствора этилового спирта, титрованного до рН 4,0 уксусной кислотой, инкубируют в течение 1 часа при 24°С с постоянным перемешиванием, после чего центрифугируют 10000g 20 мин и удаляют супернатант. Полученный осадок 2 ресуспендируют в 80мл раствора 10% уксусной кислоты, содержащего 10мМ ЭДТА и 1мМ PMSF (фенилметилсульфонилфторид). Заключительную экстракцию проводят 1 час при 24°С с постоянным перемешиванием, после чего центрифугируют 10000g 20 мин и собирают супернатант 3. Полученный супернатант лиофилизуют и хранят при -20°С до первой стадии хроматографического разделения.
Выделение севанола из уксусного экстракта проводят по разработанной схеме, включающей две стадии хроматографии на обращенно-фазовых сорбентах. Первоначально растворяют 1 мг высушенного супернатанта 3 в воде в небольшом объеме и наносят на колонку Luna С18 (Phenomenex, 150×4,6мм, 5мкм), после чего разделяют на компоненты, используя линейный градиент концентрации 0 до 60% (v/v) ацетонитрила, в присутствии 0,1% раствора ТФУ (фиг.2Б). Используют постоянную скорость потока 1 мл/мин, и проточный УФ-спектрофотометр с длинами волн 210нм и 260нм для обнаружения элюируемых с колонки соединений.
Основная фракция, со временем удерживания чуть менее 15 минут, после удаления органического растворителя путем частичного упаривания под вакуумом далее разделяется на колонке Luna PFP(2) (Phenomenex, 250×4,6мм, 3мкм) (фиг.2В). Используется линейный градиент концентрации 15 до 55% (v/v) ацетонитрила в присутствии 0,1% раствора ТФУ, постоянная скорость потока 1мл/мин, и измерение спектра УФ-поглощения при длинах волн 210нм и 260нм для обнаружения элюируемых с колонки соединений. Полученный компонент лиофилизуют и хранят при -20°С.
Пример 2.
Определение чистоты выделенного вещества.
Чистоту полученного севанола подтверждают масс-спектрометрическим анализом конечной хроматографической фракции в диапазоне молекулярных масс 0,5-10кДа. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора используют стандартную смесь белков и пептидов с диапазоном молекулярных масс 700-66000Да (Sigma, США). Измеренная средняя молекулярная масса природного севанола [М+Н]+составляет 707,1 Да.
Пример 3.
Определение концентрации севанола.
Концентрацию севанола в растворах определяют по спектру поглощения (фиг.3) на основании коэффициента молярной экстинкции при длине волны 254 нм ε=4860 л×моль-1×см-1, который рассчитывают на основании экспериментальных данных. Для расчета коэффициента молярной экстинкции измеряют в 1 см кювете 9 различных концентраций севанола в 0,1% растворе ТФУ, используя 5 независимых повторов.
Пример 4.
Тестирование анальгетической активности севанола в тесте тепловой гиперчувствительности.
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Мышей делят на 5 групп по 7 в каждой. Воспаление у мышей, кроме контрольной группы, вызывают введением в подушечку задней лапы воспалительного агента, представляющего собой 20 мкл смеси полного адьюванта Фрейнда/физраствор 1:1 (v/v). Для контрольной группы животных (фиг.4 группа без CFA) вводят только 20 мкл физиологического раствора. Через 24 часа внутривенно вводят 200 мкл физиологического раствора животным групп «без CFA» и «физ. р-р», остальным группам внутривенно вводят 200 мкл растворов тестируемых образцов в стерильном физиологическом растворе в дозе 10, 1 и 0,1 мг/кг. Измерение проводят через 30 мин после внутривенного введения. Фиксируют латентное время отдергивания лапы, подвергшейся действию воспалительного агента, от горячей пластины (t=53°С). Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной группы определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект измеряют по увеличению времени, прошедшего от момента посадки животного на пластину до момента отдергивания воспаленной лапы (фиг.4).
Пример 5.
Тестирование анальгетической активности севанола в тесте кислотной стимуляции боли.
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Мышей делят на 4 группы по 10 в каждой. Севанол растворяют в стерильном физиологическом растворе и вводят по 100 мкл раствора внутрибрюшинно за 30 мин до введения раствора уксусной кислоты. Используют три дозы препарата 10,1 и 0,1 мг/кг. Для контрольной группы животных вводят просто 100 мкл физиологического раствора (фиг.5). Анальгетический эффект определяют на основании подсчета корчей, вызываемых внутрибрюшинной инъекцией 100 мкл раствора 1% уксусной кислоты за 15 минут наблюдения. Корчи - специфическая болевая реакция, сопровождающаяся характерными движениями животных, которые включают сокращения брюшных мышц, чередующиеся с их расслаблением, вытягивание задних конечностей и изгибание спины. Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной группы определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект измеряют по снижению болевой чувствительности к висцеральному и воспалительному типу боли, что выражается в снижении количества корчей за измеряемый промежуток времени.
Пример 6.
Электрофизиологические измерения токов через каналы ASIC3.
Каналы ASIC3 получают в результате их экспрессии в мембранах ооцитов лягушки Xenopus laevis. Для этого выделенные из яичника самки ооциты обрабатывают коллагеназой типа I или типа II (Sigma-Aldrich, США) в концентрации 1мг/мл в течение 2 часов для снятия фолликулярной оболочки. Дефолликулированные ооциты помещают в стерильную среду ND96 (NaCl 96 мМ, KCl 2 мМ, CaCl2 1.8 мМ, MgCl2 1 мМ, HEPES 5 мМ титрованный NaOH до значения рН 7,8) и выдерживают ночь при температуре 15-16°С. Инъекцию 2,5-10нг мРНК канала ASIC3 человека (AJ272063) производят под бинокулярным микроскопом МБС-10 (Россия) с помощью микроинъектора Eppendorf 5242 (Германия). После инъекции ооциты хранят в течение 2-3 дней при температуре 19°С, а затем до 7 дней при температуре 15°С в ND-96 среде, которую предварительно титруют NaOH до рН 7,4 и в которую дополнительно добавляют антибиотик гентамицин до концентрации 50 мкг/мл и пируват до концентрации 5 мМ.
Измерение ионных токов через ASIC3 каналы проводят при частоте 100Гц методом двухэлектродной фиксации мембранного потенциала на уровне -50мВ, используя усилитель GeneClamp 500 (Axon Instruments, США) в рабочей камере со свободным объемом 45мкл. Данные фильтруют при частоте 20Гц и оцифровывают при помощи АЦП L780 (LCard, Россия), используя самодельные программы. Микроэлектроды заполняют 3 М раствором KCl.
Пример 7.
Измерение ингибирующей активности севанола на быструю составляющую токов ASIC3.
Измерение тока проводят в ламинарном потоке раствора ND96 (рН 7,8) со скоростью 1мл/мин. ASIC3 каналы активируют резким изменением рН среды от 7,8 до 4,0 за счет быстрой замены рабочего раствора в камере на раствор со значением рН 4,0, в котором в качестве буфера вместо 5мМ HEPES применяют 10мМ уксусную кислоту. Длина импульса изменения значения рН составляет 1 секунду. Для уменьшения неспецифического связывания с каналом навески тестируемых образцов растворяют в буферных растворах, содержащих 0,1% BSA. Аппликацию тестируемого образца начинают за 5 сек до подачи в измерительную камеру активационного буфера. Всего используют 6 различных концентраций севанола не менее чем в трех повторах, для которых измеряют амплитуду быстрой составляющей тока через ASIC3 (фиг.6). Процент ингибирования наблюдаемых токов вычисляют как отношение пиковой амплитуды тока при аппликации токсина к усредненной амплитуде пика контрольных токов до и после аппликации токсина. Ингибирование обратимо, что проявляется в полном восстановлении амплитуды вызванных закислением токов через каналы ASIC3 после полной отмывки севанола. Для быстрой компоненты тока наблюдают 100% ингибирование при концентрации 2 мМ.
По результатам измерений всех концентраций строят кривую зависимости % тока быстрого компонента относительно контроля к концентрации севанола. На основании этой кривой определяют значения 50% ингибирующей концентрации IC50 353±23 мкМ и коэффициент Хилла 2,2±0,28.
Пример 8.
Измерение ингибирующей активности севанола на продолжительную составляющую токов ASIC3
Измерение тока проводят в ламинарном потоке раствора ND96 (рН 7,3) со скоростью 1 мл/мин. ASIC3 каналы активируют резким изменением рН среды от 7,3 до 4,0 за счет быстрой замены рабочего раствора в камере на раствор со значением рН 4,0, в котором в качестве буфера вместо 5мМ HEPES применяют 10мМ уксусную кислоту. Длина импульса изменения значения рН составляет 5 секунд. Для уменьшения неспецифического связывания с каналом навески тестируемых образцов растворяют в буферных растворах, содержащих 0,1% BSA. Аппликацию тестируемого образца начинают одновременно с подачей активационного буфера в измерительную камеру. Всего используют 7 различных концентраций севанола не менее чем в трех повторах, для которых измеряют амплитуду продолжительной составляющей тока через ASIC3, которая достигает своего максимального значения через 3-4 сек после активации каналов (фиг.7). Процент ингибирования наблюдаемых токов вычисляют как отношение максимальной амплитуды тока при аппликации токсина к усредненной максимальной амплитуде контрольных токов до и после аппликации токсина. Ингибирование обратимо, что проявляется в полном восстановлении амплитуды вызванных закислением токов через каналы ASIC3 после полной отмывки севанола. Для продолжительной компоненты тока наблюдают не более чем 45% ингибирование при концентрации 2 мМ и выше.
По результатам измерений всех концентраций строят кривую зависимости % тока продолжительного компонента относительно контроля к концентрации севанола. На основании этой кривой определяют значения 50% ингибирующей концентрации IC50 234±53 мкМ и коэффициент Хилла 1,8±0,61.
Лигнан, обладающий анальгетическим действием, структура которого описывается как (1R,2S)-1-[(1R,2S)-1-(3,4-дигидроксифенил)-6,7-дигидрокси-3-[(1R,2S)-1,2,3-трикарбоксипропокси]карбонил-1,2-дигидронафтален-2-карбонил]оксипропан-1,2,3-трикарбоксиловая кислота.