Искусственная твердая мозговая оболочка и способ ее производства
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой искусственную твердую мозговую оболочку, изготовленную из электропряденых слоев при помощи технологии электропрядения, при этом электропряденый слой, состоит, по крайней мере, из гидрофобного электропряденого слоя, который изготовлен из одного или нескольких гидрофобных полимеров, выбранных из полимолочной кислоты и поликапролактона. Изобретение обеспечивает создание искусственной твердой мозговой оболочки, обладающей хорошей тканевой совместимостью, антиадгезионностью, возможностью введения лекарственных средств, предотвращения вытекания спинномозговой жидкости во время регенерации собственной твердой мозговой оболочки человека. 2 н.п., 28 з.п. ф-лы, 7 пр. 11 ил.
Реферат
Область техники изобретения
Изобретение направлено на изучение искусственных биопленок, а именно искусственных твердых мозговых оболочек, и способы их производства.
Уровень техники
Повреждение твердой мозговой оболочки - это общая проблема в нейрохирургии. Открытые черепно-мозговые травмы (полученные на производстве, в результате ДТП или военных действий), инвазия опухоли, врожденные повреждения мягких мозговых оболочек или другие заболевания черепа могут привести к повреждению твердой мозговой оболочки. Такие повреждения твердой мозговой оболочки требуют своевременного лечения, чтобы предотвратить истечение цереброспинальной жидкости, образования грыжи головного мозга и нагрузок от воздействия атмосферного давления. В ином случае это может угрожать жизни.
В настоящее время, несмотря на то, что существует большое количество заменителей твердой мозговой оболочки, материалы, используемые в заменителях, можно разделить на четыре типа: аутологическая фасция, аллотрансплантат, натуральное или искусственное вещество, а также ксенотрансплантат. Однако применение данных материалов в медицинской практике неизбежно ведет к таким проблемам, как высокий уровень инфекций. По статистике уровень инфекций при краниотомии составляет 4%; твердая мозговая оболочка, изготовленная из слизистой оболочки свиного тонкого кишечника, дает уровень инфекций 3,4%; а твердая мозговая оболочка, изготовленная из коллагена, - уровень инфекций 3,8%. Ввиду гематоэнцефалического барьера, как только происходит внутричерепное заражение, невозможно будет обеспечить требуемую концентрацию противоинфекционных препаратов в мозговой плазме, при этом инфекцию будет, трудно контролировать. Также, существующие искусственные заменители твердой мозговой оболочки не имеют возможности доставки лекарственных средств в мягкие мозговые оболочки. Следовательно, послеоперационный контроль инфекции часто не эффективен.
Более того, одна из основных причин необходимости восстановления твердой мозговой оболочки с использованием трансплантата твердой мозговой оболочки - это повреждения мягких мозговых оболочек из-за инвазии опухоли. Более половины случаев опухоли головного мозга не могут быть полностью удалены хирургическим путем и поэтому после операции необходима химиотерапия. Многие химиотерапевтические препараты токсичны и не могут преодолеть гематоэнцефалический барьер, поэтому невозможно достичь эффективной концентрации препаратов, что приводит к снижению результатов химиотерапии.
Существующие искусственные заменители твердой мозговой оболочки обычно не содержат представляющих интерес лекарственных средств. Например, ввиду плотной структуры невозможно обеспечить введение препаратов в аутологическую фасцию естественным путем, также сложно ввести препараты в аллотрансплантат или ксенотрансплантат. Однако заменители твердой мозговой оболочки на основе синтетического материала ввиду их хорошей эластичности могут быть легко заполнены препаратами. С другой стороны, из-за ограничения способов введения препарата, также нелегко ввести препарат в искусственную твердую мозговую оболочку, а также обеспечить возможность освобождения препарата после пересадки для достижения терапевтических целей. На сегодняшний день основной способ введения противоинфекционного препарата в искусственный заменитель твердой мозговой оболочки - пропитывание заменителя препаратом. При использовании данного метода большая часть лекарственного средства остается на поверхности искусственной твердой мозговой оболочки, при этом ее сложно контролировать, что затрудняет достижение регулируемого высвобождения.
В заключение необходимо отметить, что существующие искусственные заменители твердой мозговой оболочки имеют такие недостатки, как высокий уровень инфекций, низкая биосовместимость, неполная всасываемость, трудность с введением лекарственного средства и контролем его эффективного высвобождения.
Описание изобретения
Для решения хотя бы одной из технических проблем, описанных выше, согласно настоящему изобретению предусмотрена искусственная твердая мозговая оболочка, которая отличается отличной тканевой совместимостью, идеальной антиадгезионностью, полным всасыванием, хорошими механическими свойствами, низким уровнем инфекций и возможность введения лекарственных средств.
Кроме того, предусмотрен способ изготовления искусственной твердой мозговой оболочки.
Согласно изобретению, искусственная твердая мозговая оболочка состоит из электропряденых слоев. Вышеупомянутые электропряденые слои состоят, по крайней мере, из одного гидрофобного электропряденого слоя, который изготавливается из одного или нескольких гидрофобных полимеров методом электропрядения. Вышеупомянутый гидрофобный полимер выбирается из группы, состоящей из гидрофобного алифатического полиэфира, полиэфир-эфирного сополимера, полиортоэфира, полиуретана, полиангидрида, полифосфазена, полиаминокислоты, сополимеров, а также их смесей.
Также, гидрофобный алифатический полиэфир является, по крайней мере, одним веществом, выбранным из группы, состоящей из полимолочной кислоты, полигликолида, поликапролактона и полигидроксибутирата (PHB). Вышеупомянутый полиэфир-эфирный сополимер является, по крайней мере, одним веществом, выбранным из группы, состоящей из полидиоксанона (PDO), сополимера гликоль-молочной кислоты и сополимера полибутилен терефталата/гликоля. Вышеупомянутый полиангидрид является, по крайней мере, одним веществом, выбранным из группы, состоящей из полиангидрида полисебациновой кислоты (PSPA)-цетанового двукислотного ангидрида, полиангидрида типа-I, полиангидрида типа-II, полиангидрида типа-III и полиангидрида типа-IV.
Искусственная твердая мозговая оболочка, состоящая из гидрофобного слоя, имеет прочность, аналогичную прочности твердой мозговой оболочки человека. Она может герметизировать мозговые повреждения и предотвратить истечение цереброспинальной жидкости во время регенерации собственной твердой мозговой оболочки человека. Гидрофобный слой неблагоприятен для перемещения и связывания клеток, посредством чего может быть достигнута цель антиадгезии. Фактически можно использовать несколько гидрофобных слоев с тем, чтобы обеспечить соответствие различным требованиям к прочности.
Кроме того, согласно изобретению в искусственной твердой мозговой оболочке, по крайней мере, один гидрофильный электропряденый слой может быть размещен на вышеупомянутом гидрофобном электропряденом слое. Вышеупомянутый гидрофильный слой подготовлен методом электропрядения, с помощью одного или нескольких типов гидрофильных полимеров, выбранных из группы, состоящей из хондроитин сульфата, гепарина, агара, глюкана, альгина, целлюлозы, модифицированной целлюлозы, альгината натрия, крахмала, желатина, фибриногена, протеина шелка, полимер-пептида имитации эластина, коллагена, хитозана, модифицированного хитозана, гидрофильного полиуретана, полиэтиленгликоля, полиметилметакрилата, полиметилметакрилата, гидроксибутират со-гидроксивалерата, РНВННх (полигидроксибутират-со-гидроксигексаноат), поливинилалкоголя, полилактида, а также их смесей.
При трансплантации твердой мозговой оболочки в мозг гидрофобный слой, играющий роль антиадгезионного вещества, размещается близко к поверхности мозга, в то время как гидрофильный слой, обеспечивающий тонкий нановолоконный скаффолд для адгезии, перемещения, разрастания, а также дифференциации клеток, находится далеко от мозга. Так как гидрофильный слой изготавливается из гидрофильных материалов хорошей биосовместимости, он может значительно усилить процессы перемещения и разрастания стволовых клеток и фибробластов, и, следовательно, способствовать росту аутологической твердой мозговой оболочки. Фактически можно использовать несколько гидрофобных слоев с тем, чтобы обеспечить соответствие различным требованиям.
Согласно одному из вариантов осуществления изобретения, обладающая признаками изобретения твердая мозговая оболочка может также иметь переходный слой между гидрофобным и гидрофильным слоями. Переходный слой изготавливается методом электропрядения с использованием одного или нескольких полимеров, при этом он обладает гидрофильностью, которая постепенно возрастает от стороны, ближайшей к вышеупомянутому гидрофобному электропряденому слою, к стороне, ближайшей к вышеупомянутому гидрофильному электропряденому слою. Наличие переходного слоя может улучшить гидрофильность между гидрофобным и гидрофильным слоями.
Согласно другому варианту осуществления изобретения каждый из гидрофобных, гидрофильных, а также переходных слоев можно смешать с цитокином и/или лекарственным средством. Смешивающиеся слои могут обеспечить высвобождение цитокина и/или лекарственного средства в мозг при трансплантации, наряжу с всасыванием скаффолда полимера. Затем цитокин и/или лекарственное средство могут достичь цели предотвращения местной инфекции, адгезии и/или рецидива опухоли или способствовать восстановлению аутологической твердой мозговой оболочки.
Согласно еще одному варианту осуществления изобретения сцепление гидрофобного и гидрофильного слоев можно обеспечить при помощи цитокина и/или лекарственного средства.
Цитокин, упомянутый в изобретении, - это фактор, играющий важную роль в адгезии, перемещении, разрастании и дифференциации фибробластов, который выбирается из группы, состоящей из интерлейкина, колониестимулирующего фактора, фактора некроза опухоли, тромбоцитарного фактора роста, основного фактора роста фибробластов и их комбинаций. Цитокин может ускорить процесс восстановления поврежденной твердой мозговой оболочки.
Лекарственное средство, упомянутое в изобретении, - это одно или несколько веществ, выбранных из группы, состоящей из антибиотиков, кровоостанавливающих средств, антиадгезионных веществ и противоопухолевых препаратов. Данные лекарственные средства помещаются на искусственной твердой мозговой оболочке в соответствии с фактической потребностью. После трансплантации искусственной твердой мозговой оболочки лекарственные средства постепенно высвобождаются так, чтобы обеспечить выполнение лечебной цели во время распада полимеров и регенерации поврежденной твердой мозговой оболочки. Таким образом, преодолен гематоэнцефалический барьер к лекарственному средству.
Кроме того, цитокин и/или лекарственное средство можно заключить в гидрогель. Ввиду эффектов адгезии и фиксации гидрогеля в соответствии с положением на месте лекарственное средство может высвобождаться равными порциями или особым образом. Вышеупомянутый гидрогель состоит из одной или нескольких веществ, выбранных из группы, состоящей из полисахаридного полимера, полипептидного полимера и синтетического гидрофильного высокомолекулярного полимера.
Согласно одному из вариантов осуществления изобретения гидрофобный электропряденый слой вышеупомянутой искусственной твердой мозговой оболочки состоит из волокон диаметром 50-1000 нм. Согласно одному из вариантов осуществления изобретения гидрофобный электропряденый слой состоит из пор, размер которых меньше 3 мкм, в то время как гидрофильный электропряденый слой состоит из волокна диаметром 5-200 мкм и размером пор 20-200 мкм. Размер пор в значительной степени зависит от диаметра волокна. Если диаметр волокна уменьшается, размер пор также уменьшается. Таким образом, контроль диаметра волокна может осуществлять контроль размера пор электропряденого слоя. Средний диаметр клеток человека составляет 10-50 мкм. Мягкие мозговые оболочки главным образом состоят из фибробластов и коллагеновых волокон, выделяемых из фибробластов. Большинство фибробластов имеют диаметр 20-30 мкм. Размер пор гидрофобного слоя менее 3 мкм, что может предотвратить проникновение клетки и адгезию между твердой мозговой оболочкой и мозговой тканью. Гидрофильный слой состоит из пор, размер которых равен или больше, чем средний диаметр клетки, что может способствовать проникновению и перемещению клетки.
Согласно другому аспекту изобретения способ получения искусственной твердой мозговой оболочки также включает следующие этапы:
A) растворение гидрофобного полимера в растворителе в целях получения гидрофобного раствора для электропрядения, в котором вышеупомянутый гидрофобный полимер выбирается из группы, состоящей из гидрофобного алифатического полиэфира, полиэфир-эфирного сополимера, полиортоэфира, полиуретана, полиангидрида, полифосфазена, полиаминокислот, сополимеров, а также их смесей;
B) изготовление путем электропрядения гидрофобного электропряденого слоя типа пленки (или типа полотна) из вышеупомянутого гидрофобного раствора для электропрядения, тем самым изготавливая вышеупомянутую искусственную твердую мозговую оболочку.
Кроме того, вышеупомянутый гидрофобный алифатический полиэфир является, по крайней мере, одним веществом, выбранным из группы, состоящей из полимолочной кислоты, полигликолида, поликапролактона и полигидроксибутирата. Вышеупомянутый полиэфир-эфирный сополимер является, по крайней мере, одним веществом, выбранным из группы, состоящей из полидиоксанона (PDO), сополимера гликоль/молочной кислоты и сополимера полибутилен терефталата терефталевой кислоты/гликоля. Вышеупомянутый полиангидрид является, по крайней мере, одним веществом, выбранным из группы, состоящей из полиангидрида полисебациновой кислоты-цетанового двукислотного ангидрида, полиангидрида типа I, полиангидрида типа II, полиангидрида типа III и полиангидрида типа IV.
Способ, применимый к принципу электропрядения, создает искусственную твердую мозговую оболочку с помощью определенного полимера. Твердая мозговая оболочка может эффективно предотвратить его адгезию с мозговой тканью.
Для дальнейшего предотвращения адгезии искусственной твердой мозговой оболочки с мозговой тканью необходимо контролировать диаметр волокон, и в результате также обеспечивается контроль размера пор скаффолда. Таким образом можно остановить перемещение клеток. Диаметр волокон гидрофобного электропряденого слоя можно контролировать в диапазоне 50-1000 нм. Согласно одному из вариантов осуществления изобретения размер пор гидрофобного электропряденого слоя менее 3 мкм.
В способе, описанном выше, в пункте В), вышеупомянутое электропрядение выполняется с помощью микровпрыскивающего насоса, работающего с производительностью 0,1-5,0 мл/ч, и генератора высокого напряжения, работающего с напряжением 5-40 кВ и расстоянием подачи 5,0-30,0 см.
Для достижения лучшего эффекта в клинической терапии изобретение также предусматривает способ, подобный электропрядению для создания гидрофильного электропряденого слоя на вышеупомянутом гидрофобном слое, который включает следующие этапы:
а') Растворение гидрофильного полимера в растворителе для получения гидрофильного раствора для электропрядения, при котором вышеупомянутый гидрофильный полимер выбирается из группы, состоящей из хондроитин сульфата, гепарина, агара, глюкана, альгина, модифицированной целлюлозы, альгината натрия, крахмала, целлюлозы, желатина, фибриногена, протеина шелка, полимер-пептида имитации эластина, коллагена, хитозана, модифицированного хитозана, гидрофильного полиуретана, полиэтиленгликоля, полиметилметакрилата, полиметилметакрилата, гидроксибутират со-гидроксивалерата, РНВННх (полигидроксибутират-со-гидроксигексаноат), поливинилалкоголь полилактида.
b') Размещение вышеупомянутого гидрофильного раствора для электропрядения путем электропрядения на вышеупомянутом гидрофобном слое для создания вышеупомянутого гидрофильного электропряденого слоя.
Гидрофильный элекгропряденый слой устанавливается на большом расстоянии от поверхности мозга, чтобы способствовать перемещению клеток и регенерации твердой мозговой оболочки. Для облегчения проникновения клеток гидрофильный электропряденый слой состоит из волокон диаметром 5-200 мкм и пор, размер которых составляет 20-200 мкм.
В пункте b'), создание гидрофильного электропряденого слоя, вышеупомянутое электропрядение выполняется с помощью микровпрыскивающего насоса, работающего с производительностью 0,1-20,0 мл/ч и генератора высокого напряжения, работающего с напряжением 10-40 кВ, и с расстоянием подачи 5,0-30,0 см.
В процессе электропрядения обычно гидрофобный и гидрофильный полимеры необходимо растворить в соответствующих растворителях соответственно для того, чтобы создать электропряденые растворы. Часто, вышеупомянутые растворители являются летучими органическими растворителями, которые включают в себя, помимо прочего, метановую кислоту, уксусную кислоту, этиловый спирт, ацетон, диметилформамид, диметилацетамид, дигидрофуран, диметилсульфоксид, гексафторизопропиловый спирт, трифторэтиловый спирт, дихлорметан, трихлорметан, метиловый спирт, этиловый спирт, хлороформ, диоксан, трифторэтан, трифторэтиловый спирт и их смеси. Летучие органические растворители быстро улетучатся во время процесса создания электропряденых слоев, при этом финальные электропряденые слои не буду содержать или будут содержать в незначительной степени остаточный органический растворитель, который можно удалить на более поздних этапах. В некоторых случаях в качестве растворителя может быть использована вода, котораая затем может быть удалена путем нагревания в печи или естественного высыхания после создания электропряденых слоев.
Кроме того, способ изготовления искусственной твердой мозговой оболочки, предусмотренный в настоящем изобретении, также включает, создание, до изготовления вышеупомянутого гидрофильного электропряденого слоя, переходного слоя путем электропрядения между вышеупомянутым гидрофильным и гидрофобным слоями, при этом вышеупомянутый переходный слой обладает гидрофильностью, которая постепенно возрастает от стороны, ближайшей к вышеупомянутому гидрофобному электропряденому слою, к стороне, ближайшей к вышеупомянутому гидрофильному электропряденому слою. Материалы, растворители и параметры электропрядения для изготовления переходного слоя можно определить, исходя из фактической ситуации и необходимости. Наличие переходного слоя может улучшить гидрофильность между гидрофильным и гидрофобным слоями.
В одном варианте осуществления изобретения во время создания каждого электропряденого слоя путем электростатического прядения в соответствующие растворы для электропрядения можно добавить цитокин и/или лекарственное средство. При использовании техники смешивания смешанные слои полимеров и цитокин и/или лекарственное средство лучше подходят для клинического применения и обладают лучшим терапевтическим эффектом.
Способ изготовления искусственной твердой мозговой оболочки, представленный в настоящем изобретении, также включает распределение цитокина и/или лекарственного средства на вышеупомянутом гидрофобном электропряденом слое и/или вышеупомянутом гидрофильном электропряденом слое путем биопечати. Биопечать - это технология печати цитокина и/или лекарственного средства на биобумаге, состоящей из скаффолдов вышеупомянутых гидрофобных электропряденых слоев и/или вышеупомянутых гидрофильных электропряденых слоев.
Для того чтобы равномерно распределить вышеупомянутый цитокин и/или лекарственное средство и зафиксировать их в определенной точке на слоях, можно заключить цитокин и/или лекарственное средство в гидрогель.
В частности, вышеупомянутая биопечать состоит из следующих этапов:
а'') смешивание раствора гидрогеля с цитокином и/или лекарственным средством для создания раствора;
и
b'') печать вышеупомянутого раствора на вышеупомянутых гидрофобных электропряденых слоях и/или гидрофильных электропряденых слоях при помощи технологиии биопечати.
Вышеупомянутый раствор гидрогеля в изобретении состоит из водных растворов полисахаридного полимера, полипептидного полимера, синтетического гидрофильного полимера или их смесей. При этом вышеупомянутый полисахаридный полимер включает, помимо прочего, крахмал, целлюлозу, альгинат натрия, гиалуроновую кислоту и хитозан. Вышеупомянутый полипептидный полимер включает, помимо прочего, коллаген, поли-L-лизин и сополимер молочной и гликолевой кислот (PLGA). Вышеупомянутый синтетический гидрофильный полимер включает, помимо прочего, акриловую кислоту, полиметакриловую кислоту, полиакриламид и N-изопропилакриламид.
При нормальных условиях гидрогель жидкий. При соответствующей температуре или при определенных условиях он может на короткое время превратиться в гель, при этом он обладает хорошей адгезией. Согласно изобретению для участия в реакции некоторые гидрогели требуют наличия перекрестносшивающего агента. Следовательно, способ также включает обработку вышеупомянутых гидрофобного и/или гидрофильного слоев раствором, содержащим перекрестносшивающий агент до биопечати. При обработке вышеупомянутым раствором, содержащим перекрестносшивающий агент, перекрестносшивающий агент прилипает к слою или слоям. После этого цитокин и/или лекарственное средство будут добавлены в раствор гидрогеля, а смешанный раствор будет помещен в печатающую головку. Во время печати, когда раствор гидрогеля с цитокином и/или лекарственным средством достигает электропряденых слоев, он затвердевает и прилипает к слоям.
При равномерной и стабильной печати можно обеспечить равномерное высвобождение цитокина и/или лекарственного средства. В то время как при индивидуальной печати с различными скоростями и положениями в частном случае можно обеспечить высвобождение цитокина и/или лекарственного средства на конкретном участке. Выбор перекрестносшивающего агента зависит от типа гидрогеля. Например, если гидрогель - это альгинат натрия, перекрестносшивающий агент представляет собой хлористый кальций; если гидрогель - это фибриноген, перекрестносшивающий агент представляет собой тромбин.
По сравнению с известным уровнем техники изобретение обладает следующими преимуществами:
(1) Его механические свойства отвечают требованию прочности при растяжении и эластичности, кроме того, он влагостойкий и обладает антиадгезионными свойствами.
(2) Материалы, состоящие из оболочек, нетоксичны и безвредны для человеческого организма, обладают хорошей совместимостью, обеспечивают полное всасывание после пересадки, что позволяет избежать появление опухоли или рака.
(3) При изготовлении оболочки не используются ткани животных, следовательно можно избежать таких рисков, как иммунное отторжение, распространения вирусов и заражение.
(4) Предусмотренные двойные слои могут предотвратить адгезию, способствовать росту аутологичных клеток, которые, в свою очередь способствуют своевременному восстановлению твердой мозговой оболочки.
(5) При помощи технологии биопечати лечебные вещества могут быть введены в оболочку и могут высвобождаться после пересадки регулируемым способом.
(6) Материалы, представленные в большом количестве в документе, недорогие и удобные при транспортировке и хранении.
(7) Способ получения включает в себя простые процедуры, характеризуется низкими расходами и является простым для промышленной реализации.
(8) Несложное применение в медицинской практике, возможно также индивидуальное применение для пациента.
Дополнительные аспекты и преимущества изобретения будут представлены в дальнейшем описании. По прочтении и применении на практике некоторые вопросы станут более очевидными.
Краткое описание сопроводительных чертежей
Вышеприведенные и/или дополнительные аспекты и преимуществами или дополнительные аспекты и преимуществами настоящего изобретения станут более очевидными, и их будет легче понять по прочтении следующего описания совместно с чертежами и вариантами осуществления, в которых:
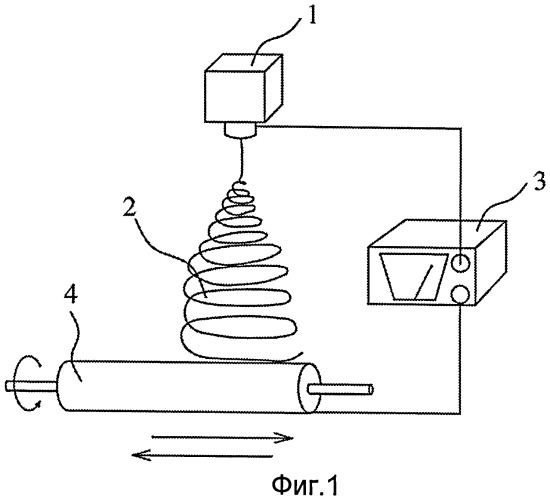
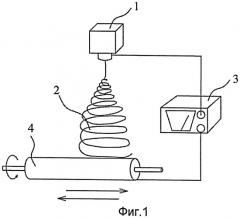
Фигура 1 - изображение процесса электропрядения для изготовления искусственной твердой мозговой оболочки согласно настоящему изобретению.
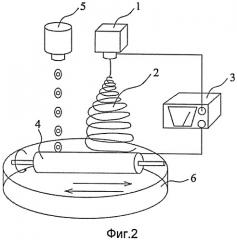
Фигура 2 - изображение процесса приготовления искусственной твердой мозговой оболочки согласно настоящему изобретению, который сочетает в себе электропрядение и биопечать.
Фигура 3 - изображение искусственной твердой мозговой оболочки согласно настоящему изобретению, состоящей из вышеупомянутого гидрофобного электропряденого слоя (слоев).
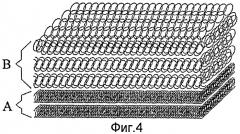
Фигура 4 - изображение искусственной твердой мозговой оболочки согласно настоящему изобретению, состоящей из вышеупомянутого гидрофобного электропряденого слоя и вышеупомянутого гидрофильного электропряденого слоя.
Фигура 5 - изображение искусственной твердой мозговой оболочки согласно настоящему изобретению, состоящей из гидрофобного, гидрофильного и переходного слоев.
Фигура 6А - изображение вышеупомянутой смешанной искусственной твердой мозговой оболочки согласно настоящему изобретению, состоящей из гидрофобного электропряденого слоя и гидрофильного электропряденого слоя.
Фигура 6В - увеличенное изображение вида I на Фигуре 6А.
Фигура 7А - изображение вышеупомянутой смешанной искусственной твердой мозговой оболочки согласно настоящему изобретению, состоящей из гидрофобного электропряденого слоя, гидрофильного электропряденого слоя и переходного слоя.
Фигура 7В - увеличенное изображение вида II на Фигуре 7А.
Фигура 8А - изображение вышеупомянутой искусственной твердой мозговой оболочки согласно изобретению, полученной в сочетании с технологией биопечати.
Фигура 8В - увеличенное изображение вида III на Фигуре 8А.
Позиции на фигурах означают следующее:
1. Электропрядильный распылительный аппарат;
2. Прядильные волокна;
3. Источник питания высокого напряжения;
4. Приемное устройство;
5. Биопечатающая головка;
6. Сосуд;
7. Гидрофобное прядильное волокно;
8. Лекарственное средство;
9. Гидрофильные прядильные волокна;
10. Цитокин или лекарственное средство;
11. Прядильные волокна переходного слоя;
А. Гидрофобный электропряденый слой;
В. Гидрофильный электропряденый слой;
С. Переходный слой.
Лучший вариант осуществления изобретения
Теперь рассмотрим примеры осуществления изобретения более подробно. Примеры будут проиллюстрированы на прилагаемых чертежах, на которых один и тот же номер представляет одинаковые элементы. Примеры, описанные со ссылкой на чертежи, являются лишь изображениями, которые предназначены для объяснения изобретения и не обозначают ограничения изобретения.
Теперь вместе с Фигурами с 1 по 8 перейдем к описанию искусственной твердой мозговой оболочки согласно настоящему изобретению и способу ее производства.
Изображение процесса электропрядения для получения искусственной твердой мозговой оболочки показано на Фигуре 1, электропрядильный распылительный аппарат 1 содержит полимерный раствор, конец высокого напряжения источника питания высокого напряжения 3 соединен с распылительным аппаратом 1. Приемное устройство 4 имеет цилиндрическую форму, и его можно перемещать влево и/или вправо по оси цилиндра или направлению штока длинной оси цилиндра. Перемещение приемного устройства 4 можно установить с помощью компьютерной программы так, что формируемый электропряденый слой будет иметь одинаковую толщину. Фактически приемное устройство можно установить как ровную поверхность, а посредством перемещения влево и вправо или вперед и назад можно обеспечить равномерный прием. Приемное устройство 4 соединено с концом низкого напряжения источника питания высокого напряжения 3, так что между распылительным аппаратом 1 и приемным устройством 4 существует большая разность напряжений.
Прежде чем начать электропрядение, необходимо подготовить соответствующий полимерный раствор для электропрядения.
Можно выбрать раствор гидрофобного полимера для электропрядения, такой раствор изготавливается путем растворения гидрофобного полимера в растворителе. При этом вышеупомянутый гидрофобный полимер включает, помимо прочего, гидрофобный алифатический полиэфир (включающий полимолочную кислоту, полигликолид, поликапролактон и полигидроксибутират), полиэфир-эфирный сополимер (например, полидиоксанон), полиортоэфир, полиуретан, полиангидрид (например, полиангидрид полисебациновой кислоты-цетановый двукислотный ангидрид), полифосфазен, полиаминокислота и их смеси.
В зависимости от исполнения, если гидрофильный электропряденый слой необходим после того, как гидрофобный электропряденый слой будет закончен, необходимо приготовить раствор гидрофильного полимера для электропрядения. При этом вышеупомянутый гидрофильный полимер включает, помимо прочего, хондроитин сульфат, гепарин, агар, тоюкан, альгин, модифицированную целлюлозу, альгинат натрия, крахмал, целлюлозу, желатин, фибриноген, протеин шелка, полимер-пептида имитации эластина, коллаген, хитозан, модифицированный хитозан, гидрофильный полиуретан, полиэтиленгликоль, полиметилметакрилат, полиметилметакрилат, гидроксибутират со-гидроксивалерат, полигидроксибутират-со-гидроксигексаноата (РНВННх), поливинилалкоголь и полилактид. Исходя из фактических потребностей можно установить несколько распылительных аппаратов 1, в которых соответственно помещаются вышеупомянутый гидрофобный полимерный раствор и вышеупомянутый гидрофильный полимерный раствор. Или можно заменить раствор в распылительном аппарате 1 после того, как будет выполнен гидрофобный слой.
Растворителем раствора для электропрядения может быть вода или летучий органический растворитель, который включает, помимо прочего, метановую кислоту, уксусную кислоту, этиловый спирт, ацетон, диметилформамид, диметилацетамид, диметилсульфоксид, гексафторизопропиловый спирт, трифторэтиловый спирт, дихлорметан, трихлорметан, метиловый спирт, этиловый спирт, хлороформ, диоксан, трифторэтан и трифторуксусную кислоту.
Как только раствор для электропрядения будет готов, необходимо установить параметры. После этого, включается питание, и электропрядильное устройство активируется. Так как прядильные волокна 2 формуются прядением из распылительного аппарата 1, приемное устройство 4 будет перемещаться в установленном порядке так, чтобы создать однородную структуру электропряденой оболочки.
Параметры процесса создания вышеупомянутого гидрофобного электропряденого слоя устанавливаются следующие: микровпрыскивающий насос, работающий с производительностью 0,1-5,0 мл/ч, генератор высокого напряжения, работающий с напряжением 5-40 кВ, и расстояние подачи 5,0-30,0 см. Вышеупомянутый гидрофобный электропряденый слой состоит из волокна, диаметр которого можно контролировать в диапазоне от 50 до 1000 мкм, и пор, размер которых меньше 3 мкм.
Параметры процесса создания вышеупомянутого гидрофильного электропряденого слоя устанавливаются следующие: микровпрыскивающий насос, работающий с производительностью 0,1-20,0 мл/ч, генератор высокого напряжения, работающий с напряжением 10-45 кВ, и расстояние подачи 5,0-30,0 см. Вышеупомянутый гидрофильный электропряденый слой состоит из волокна, диаметр которого можно контролировать в диапазоне от 5 до 200 мкм, и пор, размер которых составляет 20-200 мкм.
Фактически процедуры, описанные выше, можно повторить, чтобы создать многослойные гидрофобные слои и/или многослойные гидрофильные слои, как показано на Фигурах 3 и 4.
На Фигуре 3 изображена искусственная твердая мозговая оболочка с тремя гидрофобными слоями, прочность которых аналогична прочности твердой мозговой оболочки человека. Так как слои сформированы гидрофобными материалами, они не подходят для перемещения и связывания клеток. Вместе с тем, что материалы безопасносны, нетоксичны и всасываются человеческим организмом, они обеспечивают достижение антиадгезии.
На Фигуре 4 изображена искусственная твердая мозговая оболочка, состоящая из двух гидрофобных слоев (А) и трех гидрофильных слоев (В). При трансплантации твердой мозговой оболочки в мозг, антиадгезивные гидрофобные слои (А) размещаются недалеко от поверхности мозга, в то время как гидрофильные слои (В) размещаются далеко от поверхности мозга, обеспечивая тонкий нановолоконный скаффолд для адгезии, перемещения, разрастания и дифференциации клеток. Так как гидрофильные слои изготавливают из гидрофильных материалов, которые обеспечивают хорошую биосовместимость и имеют больший размер пор, который подходит для перемещения стволовых клеток и фибробластов, который, следовательно, благоприятен для роста аутологической твердой мозговой оболочки.
Как только электропряденые слои будут созданы, их необходимо высушить в печи или естественным образом, в зависимости от состава раствора. Если растворитель раствора для электропрядения - летучий органический растворитель, такой как гексафторизопропиловый спирт, процедурой высыхания можно пренебречь, так как растворитель полностью улетучивается, в то время как прядильные волокна 2 изготавливаются выдавливанием в приемном устройстве 4, а также разность напряжений.
Так как гидрофобный слой очень сильно отличается от гидрофильного слоя в том, что касается гидрофильности, сохранить устойчивость структуры на практике непросто. Для разрешения такого проблематичного увеличения гидрофильности между двумя этими слоями, необходимо использовать переходный слой. Вышеупомянутый переходный слой обладает гидрофильностью, которая постепенно возрастает со стороны, ближайшей к вышеупомянутому гидрофобному электроспряденому слою, к стороне, ближайшей к вышеупомянутому гидрофильному электропряденому слою. Фактически раствор для электропрядения вышеупомянутого переходного слоя может содержать один или несколько полимеров и соответствующий растворитель, которые определяются, исходя из требований к гидрофильности. Затем вышеупомянутым способом раствор помещают в распылительный аппарат для получения вышеупомянутого переходного слоя до вышеупомянутого гидрофильного слоя. Параметры процесса создания переходного слоя устанавливаются следующие: микровпрыскивающий насос, работающий с производительностью 0,1-5,0 мл/ч, генератор высокого напряжения, работающий с напряжением 5-40 кВ и расстояние подачи 5,0-30,0 см.
Искусственная твердая мозговая оболочка с переходным слоем изображена на Фигуре 5. На данной фигуре вышеупомянутый гидрофобный слой состоит из двух слоев, вышеупомянутый гидрофильный слой состоит из трех слоев. Между вышеупомянутыми гидрофобными слоями (А) и вышеупомянутыми гидрофильными слоями (В) предусмотрен переходный слой, состоящий из двух слоев (С), слой, ближайший к вышеупомянутым гидрофобным слоям (А), обладает более слабой гидрофильностью, чем слой, ближайший к вышеупомянутым гидрофильным слоям.
Кроме того, для добавления цитокина и/или лекарственного средства в искусственную твердую мозговую оболочку можно воспользоваться смешивающим электропрядением. В частности, цитокин и/или лекарственное средство можно смешать с каким-либо одним или несколькими слоями вышеупомянутыми гидрофобными, гидрофильными и переходными слоями. Цитокин и/или лекарственное средство необходимо поместить в соответствующий раствор. После этого проводится электропрядение и цитокин и/или лекарственное средство будут смешены с прядильными волокнами 2 по мере формирования прядильных волокон. Структура оболочки будет сформирована на приемном устройстве 4. Кроме того, данную процедуру можно повторить. Цитокин и/или лекарственное средство, добавляемые каждый раз, могут быть одинаковыми или разными. Полученная искусственная твердая мозговая оболочка показана на Фигуре 6. На Фигуре 6А гидрофобный слой имеет двухслойную структуру, а гидрофильный слой имеет трехслойную структуру. На Фигуре 6В гидрофобное прядильное волокно 7 содержит лекарственное средство 8, а гидрофильное прядильное волокно 9 смешивается с цитокином 10.
Фигура 7А имеет два переходных слоя С на основании Фигуры 6. Один из них, ближайший к вышеупомянутому гидрофобному слою А, обладает более слабой гидрофильностью, чем слой, ближайш