Композиции для лечения рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению популяции Tr1-клеток, направленных против антигена, ассоциированного с рассеянным склерозом, и может быть использовано в медицине. Выделяют популяцию Tr1-клеток, направленных против антигена, ассоциированного с рассеянным склерозом, и имеющих в покое фенотип CD4+CD25-FoxP3-. Полученную популяцию Tr1-клеток в комбинации с одним или несколькими фармацевтически приемлемыми носителями либо в комбинации с одним или более фармацевтическим средством, применяемым для лечения рассеянного склероза, выбираемым из группы, включающей интерферон-бета, глатимера ацетат, митоксантрон, циклофосфамид, метотрексат, азиатропин или натализумаб, используют в составе фармацевтических композиций для лечения рассеянного склероза. Изобретение позволяет получить эффективное средство для лечения рассеянного склероза. 3 н. и 8 з.п. ф-лы, 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к лечению аутоиммунного заболевания, такого как рассеянный склероз. В особенности оно касается лекарственного средства, включающего Tr1-клетки, направленные против связанного с рассеянным склерозом антигена.
Уровень техники
Рассеянный склероз представляет собой демиелинизирующее и хроническое воспалительное заболевание центральной нервной системы. Гистопатологические признаки заболевания включают очаговую инфильтрацию как CD4+, так и CD8+ Т-клеток вместе с другими воспалительными клетками в белом веществе и демиелинизацию с явлением некоторого поражения аксона. Считается, что миелиновые белки, представляющие собой мишень иммунного ответа при рассеянном склерозе, включают основной белок миелина (MBP), протеолипидный белок (PLP), миелин-ассоциированный гликопротеин (MAG) и миелиновый гликопротеин олигодендроцитов (MOG).
В настоящее время имеется множество терапевтических подходов для лечения рассеянного склероза у людей. Однако для рассеянного склероза не существует способа лечения. Хотя ряд соединений, включая кортикостероиды и модифицированный бета-интерферон, могут снизить некоторые симптомы рассеянного склероза, подтверждено, что они обладают серьезными побочными эффектами или, по-другому, было показано, что они нежелательны для долговременного применения.
Один из многообещающих способов лечений рассеянного склероза был описан в патенте WO 02/077025, который раскрывает применение пептидных аналогов основного белка миелина (MBP). Сообщалось, что композиции, включающие эти аналоги, способны смягчать симптомы MS без чрезмерных побочных эффектов. Кроме того, было также показано, что применение пептидных аналогов к миелиновым конститутивным белкам эффективно при лечении симптомов экспериментального аллергического энцефаломиелита (EAE), органоспецифического иммунного нарушения, часто применяемого в качестве модели MS на мышах. Однако несколько клинических испытаний на фазе II были остановлены из-за плохой толерантности измененного MBP-пептида, взятого в тестируемых дозах (Bielekova et al., nature medicine, 2000, (6) 10: 1167 et Kappos et al., nature medicine, 2000, (6) 10: 1176).
Другое перспективное лечение рассеянного склероза также описано в патенте EP 0587735. Указанное лечение основано на том, что иммунологическое воздействие на пептид близко напоминает то, как аутореактивный TCR-фрагмент усиливает премирование/распознавание Th2-клеток, и, таким образом, помогает поддерживать регуляторный контроль цитокинов над Th1-опосредуемым воспалением. Клинические испытания показали приемлемую безопасность и переносимость этого лечение для пациентов; однако это лечение было эффективно только у 50% иммунизированных пациентов.
Патент US 2004/0087018 описывает способ лечения рассеянного склероза у нуждающегося в этом пациента, включающий введение указанному пациенту вместе с растворимым антигеном клеток, продуцирующих антиген-специфический IL-10, предпочтительно, одновременно.
Авторы неожиданно обнаружили, что введение Tr1-клеток, направленных против связанного с рассеянным склерозом антигена, без совместного введения растворимого антигена драматически ингибирует развитие ЕАЕ у иммунизированных мышей.
Следовательно, цель заявителя заключается в обеспечении другого типа лечения для рассеянного склероза, основанного на применении Tr1-клеток.
Раскрытие изобретения
Настоящее изобретение направлено на композицию, включающую, по меньшей мере, одну популяцию Tr1-клеток, направленных против связанного с рассеянным склерозом антигена. Указанный связанный с рассеянным склерозом антиген предпочтительно выбирают из группы, включающей основной белок миелина, миелин-ассоциированный гликопротеин, миелиновый белок олигодендроцитов, протеолипидный белок, миелиновый олигопротеин олигодендроцитов, миелин-ассоциированный основной белок олигодендроцитов, специфический белок олигодендроцитов, белки теплового шока, специфические белки олигодендроцитов NOGO A, гликопротеин Po, периферический миелиновый белок 22,3'-фосфодиэстераза 2'3'-циклических нуклеотидов.
Другая цель настоящего изобретения заключается в обеспечении лекарственного средства или фармацевтической композиции, включающих композицию изобретения.
Настоящее изобретение также имеет отношение к способу лечения рассеянного склероза у нуждающегося в этом субъекта, включающему введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения. В предпочтительном воплощении лекарственное средство или фармацевтическая композиция, которые предполагается ввести субъекту, который в этом нуждается, включают Tr1-клетки, аутологические клеткам указанного субъекта.
В другом воплощении настоящего изобретения способ лечения рассеянного склероза у нуждающегося в этом субъекта включает введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения в комбинации с другим терапевтическим средством, применяемым для лечения рассеянного склероза.
Краткое описание фигур
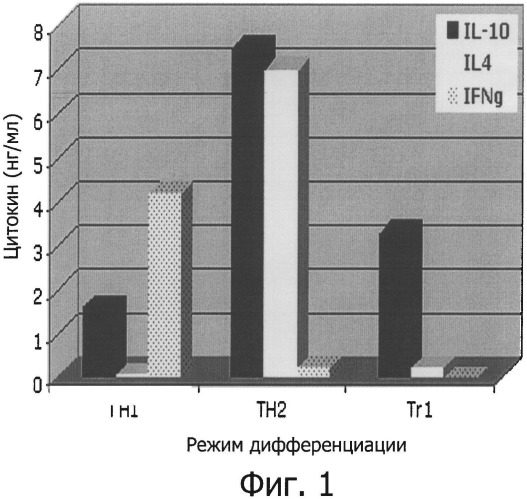
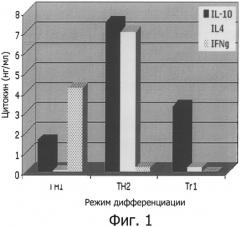
Фиг.1 - профиль секреции цитокинов дифференцированными клетками.
Необученные CD4+ клетки, введенные в режим дифференцировки, активируются моноклональными антителами анти-CD3+ анти-СВ28 в течение 48 часов. Культуральные супернатанты затем анализируют методом ELISA на присутствие IL-4, IL-10 и IFN-гамма.
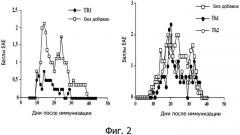
Фиг.2 - влияние введения анти-MOG35-55 CD4+ T-клеток на предрасположенных к EAE мышей.
Осуществление изобретения
Определение
Термин «Tr1-клетки», так как применен в этом документе, имеет отношение к клеткам, которые имеют в покое следующий фенотип CD4+CD25-FoxP3- и способны секретировать высокий уровень IL-10, и от низкого до умеренного уровня TGF-P при активации. В особенности, Tr1-клетки характеризуются своим уникальным профилем цитокинов: они продуцируют высокий уровень IL-10, значительный уровень TGF-R и промежуточный уровень IFN-γ, но низкие уровни IL-4 или IL-2 или не продуцируют их совсем. Продукцию цитокинов обычно оценивают в культурах клеток после активации поликлональными активаторами T-лимфоцитов, такими как анти-CD3+ анти-CD28 антитела или интерлейкин-2, PMA + иономицин. Альтернативно, продукция цитокинов возрастает в культурах клеток после активации специфическим антигеном Т-клеток, презентируемым антиген-презентирующими клетками. Высокий уровень IL-10 соответствует, по меньшей мере, примерно 500 пг/мл, обычно выше, чем примерно 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, или 20 тысяч пг/мл или более. Значительный уровень TGF-β соответствует, по меньшей мере, примерно 100 пг/мл, обычно выше, чем примерно 200, 300, 400, 600, 800 или 1000 пг/мл или более. Промежуточный уровень IFN-γ соответствует концентрациям включительно от 0 пг/мл и, по меньшей мере, до 400 пг/мл, обычно выше, чем примерно, до 600, 800, 1000, 1200, 1400, 1600, 1800 или 2000 пг/мл или более. Низкие уровни IL-4 или IL-2 или отсутствие их продукции соответствует менее чем примерно 500 пг/мл, предпочтительно менее чем примерно 250, 100, 75, или 50 пг/мл, или еще меньше.
Термин «антиген», так как применен в этом документе, имеет отношение к белку, или пептиду, связанному с определенным заболеванием, для модуляции которого применяют клетки этого изобретения, или для применения в любом из способов этого изобретения. В одном из воплощений термин "антиген" может иметь отношение к полученной синтетическим способом молекуле, или к полученной из природных источников молекуле, которая обладает гомологией в последовательности с представляющим интерес антигеном, или структурной гомологией с представляющим интерес антигеном, или их комбинацией. В одном из воплощений антиген может представлять собой мимеотоп. Термин "фрагмент" антигена имеет отношение к любой совокупности антигенов, представляющих собой более короткий пептид. Термин "вариант" антигена имеет отношение к молекуле, существенным образом сходной как с собственного антигеном, так и с его фрагментом. Варианты антигена могут быть получены общепринятыми способами с помощью прямого химического синтеза варианта пептида, с помощью способов, хорошо известных в этой области техники.
Термин «субъект», так как применен в этом документе, имеет отношение к млекопитающему, в особенности, к человеку.
Термин «эффективное количество», так как применен в этом документе, имеет отношение к количеству, достаточному для того, чтобы вызвать положительный или желаемый клинический результат (например, улучшение в клинических условиях).
Термин «клон» или «популяция клона», так как применен в этом документе, имеет отношение к популяции дифференцированных клеток, полученных из единственной дифференцированной клетки.
Термин «подвергать лечению» или «лечение», так как применен в этом документе, обычно имеет отношение к клиническому вмешательству с целью изменения естественное течение болезни индивидуума, подвергаемого лечению, и может быть проведено в курсе клинической патологии. Желаемые эффекты включают, но не ограничиваются, смягчение симптомов, подавление, снижение или ингибирование любых прямых или опосредованных патологических последствий заболевания, снижение скорости прогрессирования заболевания, улучшение или временное ослабление состояния заболевания, и приведение к состоянию ремиссии или улучшенный прогноз.
Термин «аутоиммунное заболевание», так как применен в этом документе, имеет отношение к иммунному ответу, направленному против собственного антигена.
Пациенты, которые имеют рассеянный склероз, могут быть идентифицированы с помощью критерия установления диагноза, установленного в клинических условиях рассеянного склероза. Коротко, индивидуум, с установленным в клинических условиях рассеянным склерозом, уже имел два приступа и клинические данные или о двух очагах повреждения или клинические данные об одном очаге повреждения и параклинические данные о другом отдельном очаге повреждения. Установление рассеянного склероза может быть диагностировано путем регистрации двух приступов и по олигоклональным полосам IgG в спинномозговой жидкости или путем комбинации наличия приступа, клинических данных о двух очагах повреждения и олигоклональной полосе IgG в спинномозговой жидкости. Критерий МакДональда также может быть применен для диагностирования рассеянного склероза. Критерий МакДональда включает применение данных MRI о поражении CNS на протяжении времени для применения при диагностировании рассеянного склероза, в отсутствии множественных приступов болезни. Эффективность лечения рассеянного склероза может быть оценена несколькими различными способами. Следующие параметры могут быть применены для оценки эффективности лечения. Два типичных критерия включают: EDSS (Расширенная шкала оценки состояния инвалидности) и признаки обострений болезни по данным MRI (магнитная резонансная томография). EDSS представляет собой способ установить степень клинического поражения вследствие рассеянного склероза. Для установления типа и тяжести неврологического поражения оценивают восемь функциональных систем. Коротко, перед лечением пациентов оценивают на наличие поражения в следующих системах: корково-спинномозговой, мозжечке, стволовой части мозга, сенсорной, кишечнике и мочевом пузыре, зрительной, церебральной и других. Повторные исследования проводят с определенной частотой. Шкала варьирует от 0 (норма) до 10 (смерть из-за рассеянного склероза). Снижение на одну полную ступень служит показателем эффективности лечения.
Обострения болезни определяют как появление нового симптома, который может быть отнесен к рассеянному склерозу и сопровождается характерным новым неврологическим нарушением. Кроме того, обострение болезни может длиться, по меньшей мере, 24 часа с предшествующей стабилизацией или улучшением, по меньшей мере, в течение 30-ти дней. Коротко, пациенты получают стандартное неврологическое обследование от врачей-клиницистов. Обострения болезни представляют собой как слабые, умеренные, так и тяжелые обострения в соответствии с изменениями в Шкале оценки неврологических заболеваний. Определяют ежегодную скорость обострения и долю пациентов, не претерпевших обострение.
Терапия может считаться эффективной, если существует статистически значимое различие в скорости или в доли не претерпевших обострение или безрецидивных пациентов между группой, получавшей лечение, и группой, получавшей плацебо, для любого из этих измерений. Кроме того, может быть также измерено время до первого обострения, длительность и тяжесть обострения. Мера эффективности терапии в этом отношении представляет собой статистически значимое различие во времени до первого обострения или длительности и тяжести обострения в группе, получавшей лечение, по сравнению с контрольной группой. Период без обострений или безрецидивный период, продолжительностью более чем один год, 18 месяцев или 20 месяцев особенно заслуживает внимания.
Клинические изменения включают скорость наступления рецидива с интервалом в один и два года, и изменение в EDSS, включая время до прогрессии от базовой линии, равное 1,0 единицы, по шкале EDSS, которое сохраняется в течение шести месяцев. Наличие задержки в устойчивой прогрессии в нарушении функций на кривой Каплан-Мейера демонстрирует эффективность. Другой критерий включает изменение в площади и объеме T2-изображений на MRI, и число и объем повреждений, определенных с помощью усиленных гадолинием изображений. MRI может быть применено для измерения активных повреждений с помощью получения изображений, усиленных гадолинием-DTPA, или местоположения и степень повреждений, с помощью методик Т2-взвешенных изображений. Коротко, получают базовую линию для MRI. Ту же плоскость изображения и положение пациента применяют для каждого последующего исследования. Положение и последовательность полученных изображений могут быть выбраны так, чтобы максимизировать определение повреждения и способствовать слежению за повреждением. Те же самые положения и последовательность полученных изображений могут быть применены при последующих исследованиях. Наличие, локализация и степень развития повреждения при рассеянном склерозе могут быть определены врачом-рентгенологом. Площади повреждений могут быть очерчены и суммированы слой за слоем для получения полной площади повреждения. Могут быть выполнены три анализа: обнаружение нового повреждения, скорость появления активных повреждений, изменения в процентах в площади повреждения. Улучшение в результате проведения терапии могут быть установлены с помощью статистически значимого улучшения у индивидуального пациента по сравнению с базовой линией или в группе, получавшей лечение, по сравнению с группой, получавшей плацебо.
Каждые случай рассеянного склероза демонстрирует один из нескольких образцов презентации и последующего течения болезни. Чаще всего, рассеянный склероз впервые проявляется как серия приступов с последующей полной или частичной ремиссией, поскольку симптомы непонятным образом ослабевают, только для того, чтобы позднее, после периода стабильности, вернуться. Это явление называют возвратно-ремиттирующий (RR) рассеянный склероз.
Первично-прогрессирующий (PP) рассеянный склероз характеризуется постепенным клиническим снижением без явных ремиссий, хотя могут иметь место периоды неизменного состояния болезни или незначительное ослабление симптомов.
Вторично-прогрессирующий (SP) рассеянный склероз начинается с течения болезни по возвратно-ремиттирующему типу с последующим изменением на первично-прогрессирующий тип протекания болезни. Изредка пациенты могут иметь прогрессирующий-рецидивирующий (PR) тип протекания болезни, при котором заболевание протекает по прогрессирующему пути, прерываемому острыми приступами.
PP, SP, и PR иногда объединяют и называют хроническим прогрессирующим рассеянным склерозом. Некоторые пациенты страдают от злокачественного рассеянного склероза, определяемого как стремительное и неослабевающее снижение, приводящее к значительной инвалидности или даже смерти вскоре после начала заболевания.
Настоящее изобретение
Настоящее изобретение имеет отношение к композиции, включающей, по меньшей мере, одну популяцию Tr1 -клеток, направленную против связанного с рассеянным склерозом антигена.
В одном из воплощений изобретения, Tr1-клетки могут быть получены путем
a) изолирования популяции клеток-предшественников из субъекта,
b) получения популяции дендритных клеток путем культивирования указанной популяции клеток-предшественников в присутствии IL-10,
c) взаимодействие клеток стадии b) с популяцией CD4+ T-лимфоцитов, изолированных из указанного субъекта в присутствии связанного с рассеянным склерозом антигена для того, чтобы позволить дифференциацию CD4+ T-клеток, направленных на указанный антиген, в популяцию Tr1-клеток, и
d) извлечение популяции Tr1-клеток стадии c).
На стадии b) IL-10 присутствует в культуральной среде в концентрации от 50 до 250 Ед./мл, предпочтительно в концентрации, равной 100 Ед./мл. Указанный способ получения Tr1-клеток описан в работе Wakkach et al (Immunity 2003 May; 18(5): 605-17).
Указанный способ также может быть выполнен с применением дексаметазона и витамина D3, или толерогенированных или незрелых клеток DC вместо клеток DC стадии b).
В другом воплощении настоящего изобретения, Tr1-клетки могут быть получены путем:
a) культивирования популяции CD4+ T-клеток, направленных на связанный с рассеянным склерозом антиген, изолированных из субъекта в среде с подходящим количеством IFN-α, и
b) извлечения популяцию Tr1-клеток.
IFN-α предпочтительно находится в среде в концентрации, равной 5 нг/мл. На стадии а), стадия может дополнительно включать подходящее количество IL-10, предпочтительно в концентрации, равной 100 Ед./мл.
На стадии b), популяцию Tr1-клеток культивируют в среде, включающей IL-15 для того, чтобы позволить пролиферацию, IL-15 присутствует, предпочтительно, в концентрации, равной 5 нг/мл в среде. Указанный способ получения Tr1-клетки описан в патенте US 6746670.
В еще одном воплощении изобретения, Tr1-клетки могут быть получены путем:
a) in vitro активации популяции CD4+ Т-клеток в присутствии связанного с рассеянным склерозом антигена, презентируемого искусственными антиген-презентирущими клетками, и
b) извлечения активированных CD4+ Т-клеток, включающих, по меньшей мере, 10% Tr1-клеток.
Предпочтительно, искусственные антиген-презентирующие клетки экспрессируют молекулу системы HLA II и молекулу LFA-3 человека и не экспрессируют молекулы совместной стимуляции В7-1, В7-2, В7-Н1, CD40, CD23 и ICAM-1.
Указанный способ получения Tr1-клеток описан в патентной заявке WO 02/092793.
В еще одном воплощении изобретения, Tr1-клетки могут быть получены путем:
a) in vitro активации популяции CD4+ Т-клеток в присутствии связанного с рассеянным склерозом антигена и подходящего количества IL-10; и
b) извлечения популяции Tr1-клеток.
Предпочтительно, IL-10 присутствует в среде в концентрации, равной 100 Ед./мл. Указанный способ описан в работе Groux et а1. (Nature 1997, 389(6652): 737-42).
В еще одном воплощении изобретения антиген-специфические Tr1-клетки могут быть получены путем:
a) стимуляции популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) с помощью связанного с рассеянным склерозом антигена,
b) извлечения антиген-специфической популяции Tr1-клеток из стимулированной популяция,
c) необязательно, размножения указанной антиген-специфической популяции Tr1-клеток.
Термин лейкоциты охватывает несколько типов клеток, которые характеризуются своей значимостью, своим распределением, своим числом, своим временим жизни и своими потенциальными возможностями. Это следующие типы: многоядерные или гранулярные лейкоциты, среди которых отмечают эозинофильные, нейтрофильные и базофильные лейкоциты, и мононуклеарные клетки, или мононуклеарной клетки периферической крови (РВМС), которые представляют собой крупные белые клетки и состоят из клеток иммунной системы (лимфоцитов и моноцитов). Лейкоциты или клетки РВМС могут быть выделены из периферической крови с помощью любого из способов, известных специалистам в этой области техники. Для отделения клеток РВМС удобно применять центрифугирование, предпочтительно центрифугирование в градиенте плотности, предпочтительно центрифугирование в ступенчатом градиенте плотности. Альтернативно можно применить специфические моноклональные антитела. В некоторых воплощениях РВМС обычно изолируют из цельной крови посредством Ficoll-Hypaque, применяя стандартные процедуры. В других воплощениях клетки РВМС извлекают с помощью лейкафереза.
Указанный способ описан в патентной заявке WO 2007/010406.
В еще одном воплощении, Tr1-клетки могут быть получены путем:
a) культивирования популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) с мезенхимальными стволовыми клетками в присутствии связанного с рассеянным склерозом антигена,
b) извлечения популяции Tr1-клеток.
Указанный способ также может быть осуществлен с необученными Т-клетками или Т-клетками памяти, вместо клеток РВМС или лейкоцитов.
Популяция Tr1-клеток, полученная таким способом, может дополнительно быть увеличена путем культивирования в присутствии цитокинов, таких как интерлейкин-2 и интерлейкин-4. Альтернативно, интерлейкин-15 и интерлейкин-13 также могут быть применены для размножения культур Tr1-клеток.
В описанных выше способах Tr1-клетки могут быть охарактеризованы с помощью способа идентификации, описанного в патентной заявке WO 2005/000344. Указанный способ идентификации Tr1-клеток основан на определении одновременного присутствия продуктов экспрессии генов, кодирующих молекулу CD4, и молекул из группы, включающей CD18 и/или CD11a и CD49b. Tr1-клетки могут быть идентифицированы и/или очищены с помощью метода Elisa, способами проточной цитометрии или иммуноаффинной очистки, с помощью антител к указанным маркерам.
Tr1-клетки также могут быть обогащены с помощью положительного отбора или негативного отбора, с помощью проточной цитометрии или магнитных микроносителей. Такие способы также описаны в патентной заявке WO 2005/000344.
В другом воплощении настоящего изобретения Tr1-клетки, направленные на связанный с рассеянным склерозом антиген, могут быть размножены с помощью in vitro способа, описанного в патентной заявке WO 2006/108882. Указанный способ включает:
a) культивирование при температуре Т1 ниже 35°С, в культуральной среде Mf, клетки фидерного слоя, такие как фидерные клетки насекомых, указанная температура Т1 позволяет происходить пролиферации фидерных клеток и указанные фидерные клетки экспрессируют факторы, которые взаимодействуют со следующими белками клеточной поверхности:
- комплекс CD3/TCR,
- белок CD28,
- рецептор IL-2,
- белок CD2,
- рецептор IL-4,
b) взаимодействие фидерных клеток, полученных на стадии а), отмытых или не или отмытых от их культуральной среды Mf, с популяцией Tr1-клеток, которые содержатся в культуральной среде Mp, в которой указанная культуральная среда Mp исходно не содержит факторы, перечисленные на стадии а), с целью получить смесь, содержащую популяцию Tr1-клеток, фидерные клетки и культуральную среду Мр,
c) культивирование смеси, полученной на стадии b) при температуре T2, которая равна, по меньшей мере, 35°C, указанная температура, выбранная так, чтобы в популяции Tr1-клеток происходила пролиферация, а фидерные клетки не пролиферировали,
d) извлечение популяции Tr1-клеток, размноженных таким способом.
Примеры факторов, которые взаимодействуют с перечисленными выше белками клеточной поверхности, включают:
- модифицированное анти-CD3 антитело, в котором анти-CD3 цитоплазматический домен тяжелой цепи CD3 замещают трансмембранным доменом,
- белок CD80 или CD86,
- IL-2, секретируемый фидерными клетками,
- белок CD58,
- интерлейкин, который выбирают из группы, включающей IL-4 и IL-13.
В предпочтительном воплощении настоящего изобретения указанные Tr1-клетки, направленные на ассоциированный с рассеянным склерозом антиген, могут быть клонированы с помощью общепринятых способов, применяемых для клонирования Т-клеток.
В предпочтительном воплощении настоящего изобретения указанная композиция, включающая, по меньшей мере, одну популяцию Tr1-клеток, направленных против связанного с рассеянным склерозом антигена, или, по меньшей мере, один клон Tr1-клеток, направленных против связанного с рассеянным склерозом антигена, может быть заморожена для хранения.
В предпочтительном воплощении настоящего изобретения указанный связанный с рассеянным склерозом антиген выбирают из группы, включающей основной белок миелина (МВР), миелин-ассоциированный гликопротеин (MAG), белок миелина олигодендроцитов (MOG), протеолипидный белок (PLP), олигопротеин миелина олигодендроцитов (OMGP), миелин-ассоциированный основной белок олигодендроцитов (МОВР), специфического белок олигодендроцитов (OSP/Клаудин 11), белки теплового шока, специфические белки олигодендроцитов (OSP), NOGO А, гликопротеин Ро, периферический белок миелина 22 (РМР22), 3'-фосфодиэстеразу 2'3'-циклических нуклеотидов (CNPase), их фрагменты, варианты и смеси.
Предпочтительно, чтобы указанный связанный с рассеянным склерозом антиген представлял собой антиген, который выбирают из группы, включающей основной белок миелина (МВР), протеолипидный белок (PLP) и белок миелина олигодендроцитов (MOG), их пептиды и фрагменты, варианты и смеси.
Более предпочтительно, указанный связанный с рассеянным склерозом антиген представлял собой антиген, который выбирают из группы, включающей МВР 82-98, МВР 83-99, МВР 151-170 для HbA-ОК2-положительных субъектов.
Более предпочтительно, чтобы указанный связанный с рассеянным склерозом антиген представлял собой антиген, который выбирают из группы, включающей MOG 35-55, MOG 21-40, MOG 41-60, MOG 71-90, MOG 81-100, MOG 111-130, MOG 63-37 для HLA-DR2-положительных субъектов.
Более предпочтительно, указанный связанный с рассеянным склерозом антиген представлял собой антиген, который выбирают из группы, включающей MBP 111-129, MBP 116-123 для HLA-DR4-положительных субъектов.
Более предпочтительно, указанный связанный с рассеянным склерозом антиген представлял собой антиген, который выбирают из группы, включающей MOG 21-40, MOG 97-108, MOG 71-90, MOG 181-200 для HLA-DR4-положительных субъектов.
Другая цель настоящего изобретения заключается в обеспечении лекарственного средства, включающего композицию, такую как была описана выше в этом документе.
Настоящее изобретение также намерено обеспечит фармацевтическую композицию, включающую композицию, такую как была описана выше в этом документе, в комбинации с одним или более фармацевтически приемлемым носителем.
Фармацевтически приемлемые носители, применяемые в этом документе, представляют собой общепринятые носители. В руководстве Remington's Pharmaceutical Sciences 16' edition, Osol, A. Ed. (1980) описаны композиции и составы, подходящие для фармацевтической доставки композиции настоящего изобретения. В общем, природа носителя будет зависеть от способа применяемого введения. Например, составы для парентерального введения обычно включают жидкости для инъекций, которые включают в качестве носителей фармацевтически и физиологически приемлемые жидкости, такие как вода, физиологический солевой раствор, сбалансированный солевой раствор, водный раствор декстрозы, сезамовое масло, глицерин, этанол, их комбинации, или им подобные. Носитель и композиция могут быть стерильными, и состав подходит для способа введения. В дополнение к биологически нейтральным носителям, фармацевтические композиции, которые предполагается вводить, могут содержать минорное количество не токсических вспомогательных веществ, таких как увлажняющие или эмульгирующие средства, консерванты и средства, представляющие собой pH-буферы, и им подобные, например, ацетат натрия или сорбитанмонолаурат. Композиция может быть жидким раствором, суспензией, эмульсией.
В одном из воплощений изобретения указанное лекарственное средство или фармацевтическая композиция, такие как описаны выше в этом документе, в основном, состоит, по меньшей мере, из одной популяции Tr1-клеток, направленных против связанного с рассеянным склерозом антигена.
В другом воплощении изобретения указанное лекарственное средство или фармацевтическая композиция, такие как описаны выше в этом документе, в основном, состоит, по меньшей мере, из одного клона популяции Tr1-клеток, направленных против связанного с рассеянным склерозом антигена.
Так как применен в этом документе, термин «в основном, состоит из» имеет отношение к лекарственному средству или фармацевтической композиции, в которых, по меньшей мере, 70%, предпочтительно 75%, 80%, 85% или 90% клеток, присутствующих в лекарственном средстве или фармацевтической композиции представляют собой Tr1-клетки, направленные против связанного с рассеянным склерозом антигена.
В другом воплощении изобретения указанное лекарственное средство или фармацевтическая композиция, такие как описаны выше в этом документе, в основном, состоит, по меньшей мере, из одной популяции Tr1-клеток, направленных против связанного с рассеянным склерозом антигена, или, по меньшей мере, одного клона популяции Tr1-клеток, направленных против связанного с рассеянным склерозом антигена.
Настоящее изобретение имеет отношение применение композиции, такой как была описана выше в этом документе, получения лекарственного средства или фармацевтической композиции для лечения рассеянного склероза.
Цель настоящего изобретения также представляет собой способ лечения рассеянного склероза у нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества лекарственного средства, такого как описано выше в этом документе, или фармацевтической композиции, такой как описана выше в этом документе.
В соответствии с изобретением фармацевтическая композиция или лекарственное средство, такие как описаны выше в этом документе, представляют собой фармацевтическую композицию или лекарственное средство для лечения рассеянного склероза.
В соответствии с изобретением фармацевтическую композицию или лекарственное средство, такие как описаны выше в этом документе, применяют при лечении рассеянного склероза.
В соответствии с изобретением указанную фармацевтическую композицию или указанное лекарственное средство не применяют в комбинации с растворимым связанным с рассеянным склерозом антигеном.
В соответствии с изобретением указанную фармацевтическую композицию или указанное лекарственное средство не вводят субъекту вместе с растворимым связанным с рассеянным склерозом антигеном или в комбинации с ним.
В соответствии с изобретением не существует необходимости в совместном лечении с растворимым связанным с рассеянным склерозом антигеном, на который направлены Tr1-клетки.
Композиция может быть составлена для парентерального, внутримышечного, внутривенного, внутрибрюшинного введения, инъекции, интраназальной ингаляции, легочной ингаляции, внутрикожного, внутрисуставного, интратекального введения или для введения через пищеварительный тракт.
Предпочтительно лекарственное средство или фармацевтическая композиция изобретения могут быть введены с помощью внутримышечной, внутрибрюшинной или внутривенной инъекции, или с помощью прямой инъекции в лимфатические узлы пациента, предпочтительно с помощью внутривенной инъекции.
Количество Tr1-клеток, направленных на ассоциированный с рассеянным склерозом антиген, эффективное при лечении рассеянного склероза, будет зависеть от природы рассеянного склероза, и может быть определено с помощью стандартных клинических методик. Точная доза, которую следует ввести в композицию, будет также зависеть от пути введения, и тяжести заболевания или нарушения, и должна быть определена в соответствии с рекомендацией практикующего врача и в соответствии с обстоятельствами каждого индивидуума. Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных в экспериментах in vitro или в модельных тест-системах на животных.
В одном из воплощений настоящего изобретения субъекту вводят клетки, в количестве от 104/кг до 109/кг клеток. Предпочтительно субъекту вводят от 105/кг до 107/кг клеток и более, предпочтительно, примерно 106/кг клеток.
В одном из воплощений изобретения субъекту вводят лекарственное средство в момент, когда по клиническому состоянию субъекта регистрируют спад во внезапном обострении болезни или в момент, когда воспалительные повреждения могут быть визуализированы, например, с помощью MRI в рамках центральной нервной системы.
В одном из воплощений изобретения субъекту однократно вводят лекарственное средство или фармацевтическую композицию настоящего изобретения.
Во втором воплощении изобретения субъекту вводят один раз в месяц лекарственное средство или фармацевтическую композицию настоящего изобретения.
В третьем воплощении изобретения субъекту вводят один раз в квартал лекарственное средство или фармацевтическую композицию настоящего изобретения.
В четвертом воплощении изобретения субъекту вводят от одного до двух раз в год лекарственное средство или фармацевтическую композицию настоящего изобретения.
В другом воплощении настоящего изобретения лекарственное средство или фармацевтическая композиция, которые предполагается ввести субъекту, который в этом нуждается, включают Tr1-клетки, аутологические клеткам указанного субъекта.
Это означает, что вводят Tr1-клетки того же субъекта, от которого они были получены, или что клетки-предшественники, примененные для получения Tr1-клеток, получают от того же субъекта, которому эти Tr1-клетки предполагается ввести.
В другом воплощении настоящего изобретения способ лечения рассеянного склероза у нуждающегося в этом субъекта включает введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения в комбинации с одним или более терапевтическим средством, применяемым для лечения рассеянного склероза.
Настоящее изобретение имеет отношение к применению фармацевтической композиции или лекарственного средства изобретения, в котором введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения проводят в комбинации с одним или более терапевтическим средством, применяемом для лечения рассеянного склероза.
Примеры терапевтических средств, традиционно применяемых для лечения рассеянного склероза, приведены далее:
- интерфероны, например интерферон бета-1a человека (например, AVONEX(R) или Rebif(R)) и интерферон бета-1b (BETASERON(TM); интерферон-бета человека, замещенный в положении 17; Berlex/Chiron);
- глатирамер ацетат (называемый также Copolymer I, Cop-1; COPAXONE(TM); Teva Pharmaceutical Industries, Inc.); и производные,
- фумараты, например диметилфумарат (например, Fumaderm(R));
- Rituxan(R) (ритуксимаб) или другое анти-CD20 антитело, например, такое, которое конкурирует с ритуксимабом или связывается с перекрывающимся эпитопом с ритуксимабом;
- митоксантрон (NOVANTRONE(R), Lederle);
- химиотерапевтических, например кладрибин (LEUSTATIN(R)), азатиоприн (IMURAN(R)), циклофосфамид (CYTOXAN(R)), циклоспорин-A, метотрексат, 4-амидопирин и тизанидин;
- кортикостероид, например метилпреднизолон (MEDRONE(R), Pfizer), преднизон;
- иммуноглобулин, например Rituxan(R) (ритуксимаб); CTLA4 Ig; алемтузумаб (MabCAMPATH(R)) или даклизумаб (антитело, которое связывает CD25);
- статины;
- иммуноглобулин G внутривенно (IgGIV),
- натализумаб (тисабри), антитело против альфа-4 интегрина,
- антагонист рецептора 1 орального CC хемокина ВХ471 (ZK811752),
- FTY720 (финголимод),
- антитела или антагонисты цитокинов или факторов роста человека, например TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-17, IL-18, IL-23, EMAP-I1, GM-CSF, FGF и PDGF.
- антитела к молекулам клеточной поверхности, такие как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды.
- FK506, рапамицин, микофенолата мофетил, лефлуномид, нестероидные антивоспалительные лекарственные средства, например ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ин