Способ оценки активности системы эксцизионной репарации нуклеотидов млекопитающих
Иллюстрации
Показать всеИзобретение относится к области биохимии и молекулярной биологии. Предложен способ оценки активности системы эксцизионной репарации нуклеотидов млекопитающих, включающий получение модельной ДНК и ее инкубацию с белками экстракта млекопитающего в присутствии матричного олигонуклеотида, содержащего вставку на основе амидофосфита, а также олиго дГ тракт на 5', с последующим детектированием получившихся в результате полимеразной реакции радиоактивных продуктов длиной 25-36 нуклеотидов с помощью секвенирующего гель-электрофореза в денатурирующих условиях, при этом оценку активности системы эксцизионной репарации нуклеотидов делают на основе относительной интенсивности полос, соответствующих радиоактивным продуктам длиной 25-36 нуклеотидов. Благодаря высокой чувствительности способ может быть использован в медицине для оценки активности системы репарации повреждений, вызванных воздействием физических и химических факторов внешней среды, химиотерапевтических препаратов, в экстрактах нормальных и опухолевых клеток. 3 з.п. ф-лы, 4 ил., 4 пр.
Реферат
Изобретение относится к биохимии и молекулярной биологии и может быть использовано в медицине для оценки активности системы эксцизионной репарации нуклеотидов (ДНК), направленной на исправление объемных повреждений, вызванных воздействием физических и химических факторов внешней среды, химиотерапевтических препаратов, в экстрактах нормальных и опухолевых клеток.
Система эксцизионной репарации нуклеотидов (ЭРН) с высокой эффективностью удаляет из ДНК объемные аддукты, формируемые УФ-излучением, различными мутагенами окружающей среды, а также препаратами, используемыми для химиотерапии. Если повреждения ДНК не могут быть удалены (либо потому, что их слишком много, либо потому, что соответствующая система отсутствует), то клетка гибнет, или же накапливает мутации и может трансформироваться в раковую клетку. Для онкологических больных мониторинг активности этих систем позволит выбрать оптимальную стратегию лечения и оценить его перспективность.
Актуальность исследования механизмов репарации объемных повреждений обусловлена ростом числа и разнообразия таких ДНК-аддуктов, как следствия усиления давления и расширения спектра неблагоприятно воздействующих на клеточную ДНК факторов. Кроме того, большинство используемых в клинике противоопухолевых агентов, например ионизирующая радиация, платиновые производные, алкирующие агенты, антрамицин, митомицин C и другие, также реализуют свою цитотоксичность, повреждая ДНК. Однако вследствие высокой адаптивности, характерной для репаративной машины ЭРН, ферменты репарации препятствуют сохранению повреждений в ДНК-мишенях, а следовательно, и лечебному действию препаратов. Мониторинг активности системы ЭРН позволит выбрать оптимальную стратегию лечения онкологических больных и оценить его перспективность и в результате повысить эффект противоопухолевой терапии.
Известно, что для эффективного протекания ЭРН в клетке человека требуется координированное действие ~30 полипептидов, входящих в состав последовательно образующихся в ходе процесса исправления повреждения ДНК мультисубъединичных комплексов [Gillet and Scharer, Chem Rev, 2006, 106, 253-76]. Ключевой стадией этого многостадийного процесса является удаление (эксцизия) из ДНК участка, содержащего поврежденное звено (24-32 нуклеотида), за которым следует восстановление нуклеотидной последовательности и целостности молекулы с использованием неповрежденной цепи ДНК, как матрицы для репаративного синтеза и лигирования [Scharer, Angew Chem Int Ed Engl, 2003, 42, 2946-74; Dip, Camenisch et al., DNA Repair (Amst), 2004, 3, 1409-23]. Белковые комплексы, осуществляющие ключевые начальные стадии процесса ЭРН, настроены, прежде всего, на распознавание изменений в регулярной структуре двухцепочечной ДНК (дцДНК), что обуславливает системе ЭРН невероятно широкую субстратную специфичность и способность адаптироваться к удалению новых типов повреждений. Различные по структуре повреждения могут удаляться с разной эффективностью. При этом, в зависимости от целого ряда факторов, включающих, среди прочих, последовательность фланкирующих повреждение участков ДНК, ее структуру и протяженность, могут существенно различаться скорости репарации близких или даже одинаковых повреждений.
Эффективными инструментами изучения процесса эксцизионной репарации нуклеотидов являются модельные ДНК-дуплексы - аналоги субстратов эксцизионной репарации нуклеотидов (далее - модельные ДНК), содержащие модельное повреждение в заданной позиции молекулы.
К настоящему моменту известно использование модельных ДНК, содержащих в качестве повреждения производные пуриновых нуклеотидов. Известно использование модельной ДНК, содержащей тиминовый моноаддукт 4′-гидроксиметил-4,5′,8-триметилпсоралена, либо тимидин, в который по C5-положению через линкерный фрагмент введен остаток флуоресцеина [Smith and Taylor, J Biol Chem, 1993, 268, 11143-51; Reardon and Sancar, Genes Dev, 2003, 17, 2539-51; Petruseva, Tikhanovich et al., Biochemistry (Mosc), 2009, 74, 491-501].
Известно также использование модельных ДНК, содержащих в качестве повреждения ненуклеозидные вставки на основе холестерина. С использованием такого типа модельных ДНК проводились исследования как про-, так и эукариотической системы ЭРН [Verhoeven, Е.Е., et al., Architecture of nucleotide excision repair complexes: DNA is wrapped by UvrB before and after damage recognition. EMBO J, 2001. 20(3): p.601-11.].
Таким образом, одним из условий возможности использования модельных ДНК для оценки активности системы ЭРН, являются их хорошие субстратные свойства.
Наиболее близким к заявляемому способу-прототипом, является способ оценки активности системы эксцизионной репарации нуклеотидов (Gillet, Alzeer et al., Nucleic Acids Res, 2005, 33, 1961-9), заключающийся в следующем. Предварительно получают модельную ДНК, содержащую в заданной позиции ненуклеозидную вставку. В качестве модельной ДНК используют плазмидную ДНК, содержащую в заданной позиции ацетиламинофлуореновое производное дГ. Далее готовят реакционную смесь, включающую плазмидную ДНК, содержащую в заданной позиции ацетиламинофлуореновое производное, экстракт клеток HeLa, а также буферный раствор, содержащий 25 мМ трис-HCl, рН 7,8, 45 MMNaCl, 4,4 мМ MgCl2, 0,1 мМ ЭДТА, 4 мМ АТФ. Смесь инкубируют в течение 30-60 минут при 30°C. При этом из состава плазмидной ДНК удаляются олигонуклеотиды длиной 24-32 нуклеотида, содержащие повреждение.
Удаленные из состава плазмидной ДНК олигонуклеотиды длиной 24-32 нуклеотида сплавляют с комплементарной матрицей, содержащей олиго дГ тракт на 5′ конце. Далее смесь нагревают до 95°C для остановки реакции и добавляют в реакционную смесь матричный олигонуклеотид, комплементарный продуктам специфической эксцизии, содержащий олиго дГ тракт на 5′ конце. Затем смесь медленно охлаждают до комнатной температуры, для сплавления удаленных из состава модельной ДНК олигонуклеотидов с матричным олигонуклеотидом. Радиоактивную метку вводят в состав удаленных из состава ДНК-дуплекса олигонуклеотидов с использованием [α-P32]-дЦТФ в качестве субстрата для ДНК-полимеразы. Получившиеся в результате полимеразной реакции радиоактивные продукты длиной 25-36 нуклеотидов детектируют с помощью секвенирующего гель-элекрофореза в денатурирующих условиях. Недостатками прототипа являются:
1. Низкая чувствительность способа, связанная с низкой субстратной активностью используемой модельной ДНК, содержащей в качестве ненуклеозидной вставки ацетиламинофлуорен.
2. Сложность и невысокая продуктивность процесса получения препаратов субстратов ЭРН на основе плазмидной ДНК, что существенно ограничивает возможность их использования для регулярных измерений активности.
Технической задачей изобретения является повышение чувствительности способа.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем.
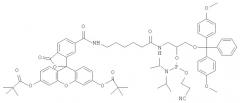
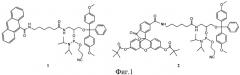
Для осуществления способа предварительно получают реагент: модельную ДНК, содержащую объемное повреждение в заданной позиции, представляющую собой линейный ДНК-дуплекс, содержащий ненуклеозидную вставку на основе амидофосфита (1) или амидофосфита (2). Структурные формулы амидофосфита (1) и (2) представлены на фиг.1.
Для получения модельной ДНК проводят следующие стадии.
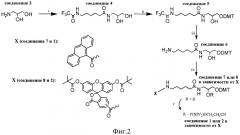
1. Синтезируют амидофосфиты (1) или (2) с использованием N,N,N′,N′-тетраизопропил-(2-циано)этилфосфодиамидита (общая схема синтеза амидофосфитов (1) и (2) представлена на фиг.2);
2. проводят синтез коротких модифицированных олигонуклеотидов по стандартной методике [Agrawal, S. Ed. Protocols for Oligonucleotides and Analogs. Synthesis and Properties. In Methods in Molecular Biology. Totowa. NJ: Humana Press. 1993];
3. короткие модифицированные олигонуклеотиды включают в состав протяженных цепей ДНК при помощи ферментативного лигирования, катализируемого Т4 полинуклеотидлигазой;
4. получают модельную ДНК путем гибридизации полученной на предыдущей стадии протяженной модифицированной оцДНК с комплементарной немодифицированной оцДНК.
Оценку активности системы эксцизионной репарации нуклеотидов млекопитающих проводят следующим образом:
Готовят реакционную смесь, включающую 0,5-5,0 пмоль модельной ДНК, 0,3-10,0 мг/мл белков клеточного экстракта, а также буферный раствор, содержащий 25 мМ трис-HCl, рН 7,8, 45 MMNaCl, 4,4 мМ MgCl2, 0,1 мМ ЭДТА, 4 мМ АТФ. Затем к реакционной смеси добавляют матричный олигонуклеотид, комплементарный продуктам специфической эксцизии, содержащий олиго дГ тракт на 5′ конце, до концентрации 0,5-5,0 цМ и смесь инкубируют в течение 15-90 минут при 30°C. При этом из состава модельной ДНК удаляются олигонуклеотиды длиной 24-32 нуклеотида, содержащие ненуклеозидную вставку. Далее смесь нагревают до 95°C для остановки реакции, и медленно охлаждают до комнатной температуры для сплавления удаленных из состава модельной ДНК олигонуклеотидов с матричным олигонуклеотидом. Радиоактивную метку вводят в состав удаленных из состава ДНК-дуплекса олигонуклеотидов с использованием [α-Р32]-дЦГФ в качестве субстрата для ДНК-полимеразы. Получившиеся в результате полимеразной реакции радиоактивные продукты длиной 25-36 нуклеотидов детектируют с помощью секвенирующего гель-элекрофореза в денатурирующих условиях. Оценку активности системы ЭРН делают на основе относительной интенсивности полос, соответствующих радиоактивным продуктам длиной 25-36 нуклеотидов.
Определяющими отличиями предлагаемого способа, по сравнению с прототипом, являются:
1. В качестве модельной ДНК используют ДНК-дуплекс, содержащий в заданной позиции ненуклеозидную вставку на основе амидофосфита (1) или амидофосфита (2), что позволяет повысить чувствительность способа в 4 раза.
2. Матричный дезоксиолигонуклеотид, комплементарный продуктам специфической эксцизии, добавляют в реакционную смесь перед инкубацией ДНК-субстрата с белками клеточного экстракта, что позволяет защитить продукты эксцизии от действия неспецефических нуклеаз, действующих на одноцепочечную ДНК, тем самым в 5-10 раз повысить чувствительность способа.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Получение модельной ДНК, содержащей ненуклеозидную вставку на основе амидофосфита (1)
Схема синтеза амидофосфита (1) представлена на фиг.2.
3-амино-1,2-пропандиол (700 мг, 7.68 моль) растворяли в 5 мл ДМФА, добавляли триэтиламин (1.33 мл, 9.6 ммоль), затем раствор N-гидроксисукцинимидного эфира N-трифторацетиламиногексановой кислоты (3.11 г, 9.6 ммоль) в ДМФА (10 мл). Через 48 часов реакционную смесь упаривали. Маслообразный остаток 2 раза упарвали с сухим пиридином, растворяли в 10 мл сухого пиридина и прибавляли при перемешивании 4,4′-диметокситритилхлорид (2.6 г, 7.68 ммоль). Через 24 часа реакционную смесь упаривали, растворяли в хлористом метилене (50 мл) и промывали органический слой 5% раствором NaHCO3, затем насыщенным раствором NaCl. Органический слой сушили над безводным Na2SO4, упаривали. Остаток растворяли в хлористом метилене и наносили на колонку с силикагелем. Продукт элюировали в градиенте концентрации этанола в хлористом метилене (0->5%) с добавлением 0.1% пиридина. Целевые фракции упаривали, продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. Выход соединения 5: 2.57 г (55.5%).
Соединение 5 (2.57 г, 4.26 ммоль) растворяли в пиридине (10 мл) и добавляли концентрированный водный аммиак (9 мл). Реакционную смесь перемешивали в течение 3 суток при 24°C. В реакционную смесь дважды добавляли концентрированный водный аммиак по 5 мл. Через 3 суток реакционную смесь упарвали, остаток растворяли в хлористом метилене (50 мл) и промывали органический слой 5% раствором NaHCO3, затем насыщенным раствором NaCl. Органический слой сушили над безводным Na2SO4. Растворитель удаляли на ротационном испарителе. Продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. Выход соединения 6: 1.63 г (75.3%).
9-антраценкарбоновую кислоту (600 мг, 2.7 ммоль) и N-гидроксибензотриазол (437.4 мг, 3.24 ммоль) растворяли в 10 мл CH2Cl2, добавляли раствор ДЦК (667.4 мг, 3.24 ммоль) в 4 мл CH2Cl2. Перемешивали реакционную смесь при 24°C. Через 4 часа отфильтровывали выпавший осадок. Фильтрат упаривали и использовали продукт в следующей реакции без дополнительной очистки.
Соединение 6 (1.32 г, 2.6 ммоль) растворяли в 10 мл CH2Cl2 (+0.1% пиридина), добавляли триэтиламин (362 мкл, 2.6 ммоль), затем раствор активированного эфира 9-антраценкарбоновой кислоты (916 мг, 2.7 ммоль) в 10 мл CH2Cl2. Перемешивали реакционную смесь 24 часа при комнатной температуре. По окончании реакции реакционную смесь упаривали. Остаток растворяли в хлористом метилене и наносили на колонку с силикагелем. Продукт элюировали в градиенте концентрации этанола в хлористом метилене (0->5%) с добавлением 0.1% пиридина. Целевые фракции упаривали, продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. Выход соединения 7: 1.53 г (82.8%).
К раствору соединения 7 (750 мг, 1.05 ммоль) и тетразолид диизопропиламмония (90 мг, 0.525 ммоль) в свежеперегнанном CH2Cl2 (10 мл) при перемешивании добавляли N,N,N′,N′-тетраизопропил-(2-циано)этилфосфодиамидит (501 мкл, 1.575 ммоль). Через 2 часа реакционную смесь упаривали, к остатку добавляли гексан (30 мл) и оставляли на ночь. Затем гексан декантировали, остаток растворяли в CH2Cl2 и наносили на колонку с силикагелем в петролейном эфире с 10% триэтиламина. Элюировали ступенями: петролейный эфир с 1% триэтиламином; CH2Cl2:петролейный эфир (1:1) с 1% триэтиламином; CH2Cl2 с 1% триэтиламином. Целевые фракции объединяли и упаривали, продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. В результате получили N-[6-(9-антраценилкарбамоил)гексаноил]-O1-(4,4′-диметокситритил)-O2-[(диизопропил амино)(2-цианоэтокси)-фос-фино]-3-амино-1,2-пропандиол (амидофосфит (1) с выходом: 720 мг (74.9%).
Олигодезоксирибонуклеотид 5′-atccagggAgacggtg, где A - ненуклеозидная вставка на основе амидофосфита (1), синтезировали твердофазным автоматическим амидофосфитным методом, используя стандартный протокол для введения нуклеозидных звеньев (Protocols for Oligonucleotides and Analogs. Synthesis and Properties in methods in molecular biology, ed. S.Agrawal. 1993, Totowa. NJ: Humana Press). Для введения ненуклеозидного звена (A) использовали 0.1 М раствор амидофосфита (1), время конденсации увеличили до 5 мин. Удаление синтезированного олигодезоксирибонуклеотида с полимера и деблокирование проводили обработкой концентрированным аммиаком при 60°C в течение ночи. Выделение модифицированного олигодезоксирибонуклеотида проводили с помощью микроколонок с обращено-фазовым сорбентом (ChemGenes, RP-cartridge). Гомогенность модифицированного олигодезоксирибонуклеотида тестировали с помощью электрофореза в 20%-ом денатурирующем ПААГ с последующей окраской нуклеотидного материала красителем Stains-all. MALDI-MS [М+Н]+: 5129.0 (расч 5129.8).
Для введения объемных повреждений в середину цепи 137-звенного олигонуклеотида (ОНТ) использовали реакцию ферментативного лигирования, катализируемую Т4 полинуклеотидлигазой. Реакцию проводили в буфере, содержащем 70 мМтрис-HCl рН 7.6, 10 мМ MgCl2, 5 мМ дитиотрейтол. Кроме того, реакционная смесь объемом 50 мкл содержала 100 пкмоль предварительно гибридизованных олигонуклеотидов:
Реакцию проводили при 16°C в течение 2-х часов. 137-звенный модифицированный олигонуклеотид выделяли из реакционной смеси электрофорезом в 10% полиакриламидном геле (19:1) в денатурирующих условиях (7М мочевина). Целевой олигонуклеотид выделяли методом электроэлюции. Для этого участок геля, содержащий 137-мер, вырезали и осуществляли электроперенос на DEAE-бумагу DE-81 в ячейке для электроэлюции (электродный буфер для электропереноса - 0,5-кратный ТВЕ (50 мМ трис-HCl pH 8,3, 50 мМН3ВО3, 0,5 мМ ЭДТА), напряженность поля ≈20 В/см). С DEAE-бумаги олигонуклеотид элюировали тремя порциями по 30 мкл горячего (75°C) 3 М раствора LiClO4 в H2O и осаждали реакционную смесь 10-ю объемами ацетона (выдерживали при -40°C в течение 40 мин). После центрифугирования (10 MHH, 6700 g), осадок промывали ацетоном, высушивали на воздухе при комнатной температуре и растворяли в ТЕ-буфере (10 мМтрис-HCl pH 7,8, 1 мМ ЭДТА).
Для получения модельной ДНК, содержащей ненуклеозидную вставку на основе амидофосфита (1) смешивали 1 мкМ модифицированного 137-звенного олигонуклеотида, и 5 мкМ комплементарного 137-звенного олигонуклеотида (5′-aattgctaacgcagtcaggcaccgtgtatgaaatctaacaatgcgctcatcgtcatcctcggcaccgtcaccctggat.gctgtaggcataggcttggttatgccggtactgccgggcctcttgcgggatatcgtcca-3′) в ТЕ-буфере. Конечный объем смеси составлял 100 мкл. Пробирку помещали в термостат с температурой 97°C, после 5-минутной инкубации при этой температуре отключали нагрев термостата, позволяя реакционной смеси медленно остыть до комнатной температуры. От оцДНК целевую модельную ДНК отделяли методом электрофореза в неденатурирующих условиях и последующей электроэлюцией. Электроэлюцию ДНК из геля проводили как описано выше.
Пример 2. Получение модельной ДНК, содержащей ненуклеозидную вставку на основе амидофосфита (2)
Схема синтеза амидофосфита (2) представлена на фиг.2.
Соединение 6 было получено, как описано в примере 1.
5(6)-карбокси-3′,6′-O-дипивалоилфлуоресцеин (3 г, 5.5 ммоль) и N-гидроксисукцинимид (695.7 мг, 6.05 ммоль) растворяли в CH2Cl2 (20 мл) и добавляли раствор ДЦК (1.25 г, 6.05 ммоль) в 5 мл CH2Cl2. Перемешивали реакционную смесь на льду в течение 2 ч. Затем отфильтровывали выпавший осадок. Фильтрат упаривали и использовали продукт в следующей реакции без дополнительной очистки.
Соединение 6 (2.66 г, 5.25 ммоль) растворяли в 15 мл CH2Cl2 (+0.1% пиридина), добавляли триэтиламин (876 мкл, 6.3 ммоль), затем раствор N-гидроксисукцинимидного эфира 5(6)-карбокси-3′,6′-O-дипивалоилфлуоресцеина (3.36 г, 5.25 ммоль) в 10 мл CH2Cl2. Перемешивали реакционную смесь 24 часа при 24°C. Реакционную смесь разбавляли 25 мл CH2Cl2 (+0.1% пиридина), промывали 30 мл 1 М KH2PO4-буфером (рН 7.0), затем насыщенным раствором NaCl. Органический слой сушили над безводным Na2S04, упаривали. Остаток растворяли в CH2Cl2 и наносили на колонку с силикагелем. Продукт элюировали в градиенте концентрации этанола в CH2Cl2 (0->10%) с добавлением 0.1% пиридина. Целевые фракции упаривали, продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. Выход соединения 8: 3.12 г (57.8%).
К раствору соединения 8 (1,08 г, 1.05 ммоль) и тетразолида диизопропиламмония (90 мг, 0.525 ммоль) в свежеперегнанном CH2Cl2 (10 мл) при перемешивании добавляли N,N,N′,N′-тетраизопропил-(2-циано)этилфосфодиамидит (501 мкл, 1.575 ммоль). Через 2 часа реакционную смесь упаривали, к остатку добавили гексан (30 мл) и оставляли на ночь. Затем гексан декантировали, остаток растворяли в CH2Cl2 и наносили на колонку с силикагелем в петролейном эфире с 10% триэтиламина. Элюировали ступенями: петролейный эфир с 1% триэтиламином; CH2Cl2:петролейный эфир (1:1) с 1% триэтиламином; CH2Cl2 с 1% триэтиламином. Целевые фракции объединяли и упаривали, продукт осаждали из раствора в хлористом метилене 10-кратным объемом гексана. В результате получили N-[6-(9-антраценилкарбамоил)гексаноил]-O1-(4,4′-диметокситритил)-O2-[(диизопропиламино)(2-цианоэтокси)-фосфино]-3-амино-1,2-пропандиол (амидофосфит (2) со следующим выходом: 835 мг (64.5%).
Олигодезоксирибонуклеотид 5′-atccagggFgacggtg, где F-ненуклеозидная вставка на основе амидофосфита (2), синтезировали, как описано в примере 1, за исключением того, что при введении ненуклеозидного звена использовали амидофосфит 2.
Для введения объемных повреждений в середину цепи 137-звенного ОНТ использовали реакцию ферментативного лигирования, катализируемую Т4 полинуклеотидлигазой. Реакцию проводили, как описано в примере 1, за исключением того, что на стадии ферментативного лигирования использовали олигонуклеотид 5′-atccagggFgacggtg, где F-ненуклеозидное звено на основе амидофосфита (2).
Стадии дальнейшего синтеза проводили, как описано в примере 1.
Пример 3. Оценка активности системы ЭРН с использованием модельной ДНК, содержащей ненуклеозидную вставку на основе амидофосфита 1.
Эффективность удаления участка ДНК, содержащего амидофосфит 1, определяли с использованием [α-P32]-дЦТФ и ДНК-полимеразной реакции. Реакционные смеси объемом 30 µ1, содержащие однократный ЭРН-буфер (25 мМтрис-HCl, рН 7,8, 45 MMNaCl, 4,4 мМ MgCl2, 0,1 мМ ЭДТА, 4 мМ АТФ), 0,5 пмоль модельной ДНК и 0,3 мг/мл белков ЭРН-компетентного клеточного экстракта (экстракты клеток получали согласно методике, подробно описанной в [Gillet and Scharer, Chem Rev, 2006, 106, 253-76]), a также 0,5 µM матричного дезоксиолигонуклеотида 5′-gggggctcggcaccgtcaccctggatgctgtagg-p-3′, инкубировали 45 минут при 30°C. Смеси нагревали до 95°C и медленно охлаждали до комнатной температуры, после чего добавляли 5 единиц активности Taq ДНК-полимеразы и α-[32Р] дЦТФ (500 Bq) и 3 µл буферного раствора, содержащего 750 мМ трис-HCl рН 9, 0,2 mM (NH4)2SO4 и 0,1% Tween-20, и выдерживали 5 минут при 37°C. Затем добавляли 1,2 µл дНТФ-микса (100 µМ дАТФ, дГТФ, дТТФ и 50 µМ дЦТФ) и инкубировали еще 15 минут. Полимеразную реакцию останавливали путем добавления 4 µг протеиназы K. После 30 минут протеиназной обработки реакционные смеси осаждали двумя объемами этилового спирта. Пробы анализировали с помощью секвенирующего гель-элекрофореза в денатурирующих условиях.
Радиоавтограф геля после электрофоретического разделения продуктов реакции с белками клеточных экстрактов HeLa, C33A и SiHa представлен на фиг.4, панель A, дорожки 3, 6, 9, 12.
На радиоавтографе геля после электрофореза имеется мажорная полоса меченых продуктов с длинами, близкими к 34 нуклеотидам, соответствующая меченым продуктам эксцизии, содержащим повреждение (фиг.3, 4). Путем сравнения интенсивности соответствующих полос (методом денситометрическго анализа, фиг.4, панель Б), можно сделать вывод о высоком уровне активности системы ЭРН в различных клеточных экстрактах. Таким образом, из данных, представленных на фиг.4, следует, что используемый способ применим для оценки активности системы ЭРН. Кроме того, добавление матричного олигонуклеотида в начале реакции, а не после ее завершения, позволяет дополнительно увеличить чувствительность метода до 10 раз (фиг.3).
Пример 4. Оценка активности системы ЭРН с использованием модельной ДНК, содержащей ненуклеозидную вставку на основе амидофосфита (2)
Эффективность удаления участка ДНК, содержащего ненуклеозидную вставку на основе амидофосфита (2), определяли способом, описанным в примере 3, за исключением того, что реакционные смеси объемом 50 µл содержали 5,0 пмоль модельной ДНК, 10 мг/мл белков ЭРН-компетентного клеточного экстракта и 5,0 µM матричного олигонуклеотида. Радиоавтограф геля после электрофоретического разделения продуктов реакции с белками клеточных экстрактов HeLa, C33A и SiHa представлен на фиг.4, панель A, дорожки 2, 5, 8, 11. Оценку уровня активности системы ЭРН в различных клеточных экстрактах осуществляли аналогично примеру 3.
Использование предлагаемого способа позволит с высокой чувствительностью проводить оценку уровня активности системы ЭРН в экстрактах клеток различного происхождения, через неограниченное время после отбора образцов, в достаточно широком интервале условий.
Оценка уровня активности системы ЭРН (репаративного статуса) отдельного человека может быть учтена при выборе способа персонализированной этологической коррекции работы системы ЭРН. Предлагаемый способ может найти применение в широком диапазоне исследований, требующих оценки активности системы ЭРН, включая анализ результатов воздействия факторов внешней среды (токсинов, пищевых факторов, фармацевтических препаратов), а также ряда физиологических процессов, которые могут быть связаны с риском возникновения онкологических заболеваний и проявлением других патологий.
1. Способ оценки активности системы эксцизионной репарации нуклеотидов млекопитающих, включающий получение модельной ДНК, инкубацию последней с белками экстракта клеток млекопитающего в присутствии матричного олигонуклеотида, комплементарного продуктам специфической эксцизии, содержащего олиго дезоксигуанозин (дГ) тракт на 5' конце и буферного раствора при 30°C, нагревание реакционной смеси до 95°C для остановки реакции, последующее медленное охлаждение смеси до комнатной температуры для сплавления удаленных из состава модельной ДНК олигонуклеотидов с матричным олигонуклеотидом, введение радиоактивной метки в удаленные олигонуклеотиды с последующим детектированием получившихся в результате полимеразной реакции радиоактивных продуктов с помощью секвенирующего гель-электрофореза в денатурирующих условиях, отличающийся тем, что в качестве модельной ДНК используют линейный ДНК-дуплекс, содержащий ненуклеозидную вставку на основе амидофосфита общей формулы (I): или амидофосфита общей формулы (2): а матричный олигонуклеотид, комплементарный продуктам специфической эксцизии, содержащий олиго дГ тракт на 5' конце добавляют в реакционную смесь до начала инкубации смеси, при этом оценку активности системы эксцизионной репарации нуклеотидов делают на основе относительной интенсивности полос, соответствующих полученным радиоактивным продуктам.
2. Способ по п.1, отличающийся тем, что реакционная смесь содержит 0,5-5,0 пмоль линейного ДНК-дуплекса, 0,3-10,0 мг/мл белков клеточного экстракта и 0,5-5,0 цмоль матричного олигонуклеотида в присутствии буферного раствора.
3. Способ по п.1, отличающийся тем, что буферный раствор содержит 25 мМ трис-HCl, рН 7,8, 45 мМ NaCI, 4,4 мМ MgCl2, 0,1 мМ ЭДТА, 4 мМ АТФ.
4. Способ по п.1, отличающийся тем, что инкубацию реакционной смеси осуществляют в течение 10-90 мин.