Способ анализа онкологических заболеваний молочной железы
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, конкретно к способу анализа онкологических заболеваний молочной железы, и может быть использовано в медицине. Способ включает определение статуса геномного метилирования динуклеотидов CpG в каждой последовательности из группы последовательностей SEQ ID NO.1-SEQ ID NO.10, полученных из образцов человеческой ткани молочной железы, введение одного или нескольких результатов теста на определение статуса метилирования в классификатор, полученный исходя из диагностической поливариативной модели, построенной на основе базы данных по молочной железе и группы последовательностей SEQ ID NO.1-10. Затем рассчитывают вероятность того, получен ли образец из нормальной ткани или ткани рака молочной железы, и рассчитывают ассоциированную величину р для достоверности в прогнозе. Матрица содержит не более 100 различных молекул нуклеиновой кислоты и включает нуклеиновые кислоты с последовательностями, которые идентичны последовательностям ДНК, соответствующим SEQ ID NO.1-SEQ ID NO.10. Изобретение позволяет эффективно идентифицировать, диагностировать, лечить и наблюдать клеточно-пролиферативные заболевания молочной железы, а также определять предрасположенность к клеточно-пролиферативным заболеваниям молочной железы. 2 н. и 7 з. п. ф-лы, 3 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биологии и химии, более конкретно к области молекулярной биологии и генетики человека. Изобретение относится к области идентификации метилированных сайтов в ДНК человека, в частности метилированных сайтов в некоторых определенных последовательностях, которые при метилировании указывают на рак молочной железы.
Уровень техники
Во всем мире рак молочной железы занимает пятое место среди самых распространенных причин смерти от рака (после рака легких, рака желудка, рака печени и рака толстого кишечника). В 2005 рак молочной железы был причиной смерти 502000 пациентов (7% летальных исходов от рака; почти 1% всех летальных исходов) во всем мире. Среди женщин во всем мире рак молочной железы представляет собой самую распространенную форму рака и самую частую причину летального исхода от рака.
В Соединенных Штатах Америки рак молочной железы занимает третье место среди самых распространенных причин смерти от рака (после рака легких и рака толстого кишечника). Считается, что в 2007 в США рак молочной железы явился причиной 40910 летальных исходов (7% летальных исходов от рака; почти 2% всей смертности). Среди женщин в США рак молочной железы является самой распространенной формой рака и второй из самых частых причин смерти от рака (после рака легких). Женщины в США имеют риск развития инвазивного рака молочной железы 1 на 8 и риск рака молочной железы, приводящего к их летальному исходу, 1 на 33.
Рак молочной железы диагностируется с помощью патологической (микроскопической) оценки ткани молочной железы, удаленной хирургическим путем. Ткань или клетки могут быть получены большим числом способов перед окончательной обработкой для гистологической или цитологической оценки. К таким способам относятся аспирационная диагностическая пункция, аспираты из сосков, протоковый лаваж, толстоигольная биопсия и локальная биопсия, осуществляемая хирургическим путем. Эти диагностические стадии при сочетании с радиографическим изображением, как правило, точны в диагностике поражения молочной железы, такого как рак. Иногда предхирургические способы, такие как аспирационная диагностическая пункция, могут не дать достаточного количества ткани для постановки диагноза или могут совсем не распознать рак. Для детекции метастаза иногда используют тесты с получением изображения, к ним относятся рентген грудной клетки, остеосцинтиграфия, СТ, MRI и PET-сканирование. Несмотря на то, что исследования с получением изображения можно использовать в определении наличия метастазирующего заболевания, их не используют для этого, и они сами по себе не диагностируют рак. Лишь с помощью микроскопической оценки биопсийного образца можно поставить диагноз рака. Са 15.3 (углеводный антиген 15.3, эпителиальная слизь) представляет собой маркер опухоли, определяемый в крови, который может быть использован для отслеживания активности заболевания с течением времени после окончания лечения. Тестирование маркера опухоли, присутствующего в крови, как правило, не осуществляют для скрининга рака молочной железы, и оно обладает неудовлетворительными рабочими показателями для этой цели.
Поэтому было бы полезно иметь способ анализа онкологических заболеваний молочной железы, который был бы быстрым, достоверным и мог быть теоретически осуществлен необученным персоналом. Такой способ теоретически не требовал бы анализа обученным врачом.
Сущность изобретения
Настоящее изобретение относится к способу анализа онкологических заболеваний молочной железы, включающему определение в панели последовательностей ДНК статуса геномного метилирования одного или нескольких динуклеотидов CpG в каждой последовательности, где последовательности ДНК выбирают из группы SEQ ID NO.1-100, в частности из группы последовательностей, соответствующих SEQ ID NO.1-SEQ ID NO.10 и SEQ ID NO.50-SEQ ID NO.60.
Представляющие интерес области приведены в таблице 1А и таблице 1В («начало» и «конец»).
Области CpG представляют собой области с большим числом цитозина и гуанина, прилегающих друг к другу в скелете ДНК (т.е. связанных фосфодиэфирными связями). Они расположены внутри и около примерно 40% промоторов генов млекопитающих (около 70% в промоторах человека). Под «р» в обозначении CpG понимают фосфодиэфирную связь между цитозином и гуанином.
Длина области CpG обычно составляет 300-3000 пар оснований. Эти области отличаются содержанием динуклеотидов CpG, равным или большим, чем можно было бы предположить статистически (≈6%), тогда как остальная часть генома имеет гораздо меньшую частоту встречаемости CpG (≈1%), явление, называемое супрессией CG. В отличие от сайтов CpG в кодирующей области гена в большинстве случаев сайты CpG в областях CpG промоторов неметилированы при экспрессии генов. Эта находка привела к предположению, что метилирование сайтов CpG в промоторе гена может ингибировать экспрессию гена. Метилирование является основой импринтинга наряду с модификациями гистонов. Принятое формальное определение области CpG - это область по меньшей мере из 200 п.н. и с процентом GC больше 50% и с соотношением обнаруженные/ожидаемые CpG больше 0,6.
В рамках изобретения динуклеотид CpG представляет собой динуклеотид CpG, который может быть обнаружен в метилированном и неметилированном состоянии in vivo, в частности, у человека.
Изобретение относится к способу, в котором первичный рак детектируют, используя паттерн метилирования одной или нескольких последовательностей, описанных в настоящем описании, а также в котором полученный паттерн метилирования используют для прогнозирования терапевтического ответа на лечение рака молочной железы.
В рамках изобретения под индивидуумом понимают всех людей, пациентов, животных, вне зависимости от того, наблюдаются ли у них или нет патологические изменения. В рамках изобретения образцом диагностического пациента может быть любой образец, собранный из клеток, тканей, органов, организмов или подобного. В предпочтительном варианте осуществления пациентом по изобретению является человек. В дополнительном предпочтительном варианте осуществления изобретения пациентом является человек, предположительно страдающий заболеванием, выбранным из следующей группы: первичный рак молочной железы, вторичный рак молочной железы, поверхностная эпителиально-стромальная опухоль, опухоль стромы полового тяжа яичников, опухоль из герминативных клеток.
Способ используется в улучшенной диагностике, лечении и мониторинге клеточно-пролиферативных заболеваний молочной железы, например, содействуя улучшенной идентификации и дифференциации между подклассами указанного заболевания и определению генетической предрасположенности к указанным заболеваниям. Изобретение представляет улучшения существующего уровня техники в том, что оно дает возможность высокоспецифичной классификации клеточно-пролиферативных заболеваний молочной железы, таким образом, содействуя улучшенному и информированному лечению пациентов.
В рамках изобретения заявленные последовательности также охватывают последовательности, которые обратно комплементарны указанным последовательностям.
Краткое описание чертежей
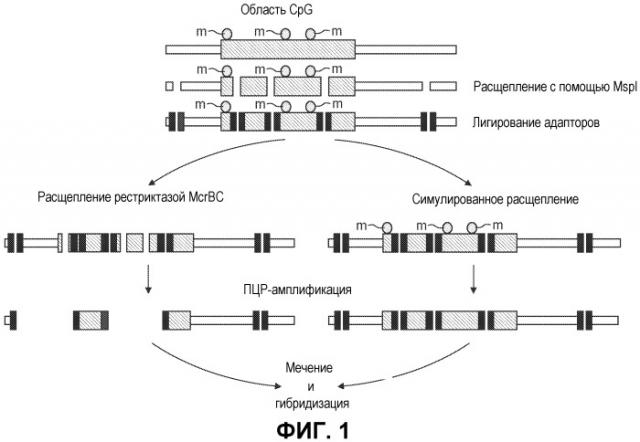
На фиг.1 представлен способ определения дифференциально метилированных областей генома. Это более подробно изложено в примерах.
На фиг.2 показаны сгруппированные образцы (колонки) против локусов метилирования (ряды). Показатели метилирования могут различаться между опухолями (левая часть полосы сверху) и нормальной тканью (правая часть полосы сверху).
На фиг.3 показано группирование способа построения изобретения и его характерные особенности. Собирают образец пациента и определяют статус метилирования специфических последовательностей любым из предпочтительных вариантов осуществления. Затем результаты вводят в классификатор, такой как машина опорных векторов, которая классифицирует как опухолевый образец или нормальный образец и дает величину р.
Подробное описание вариантов осуществления
Авторы изобретения неожиданно обнаружили, что для анализа онкологических заболеваний молочной железы можно использовать небольшую селекцию последовательностей ДНК. Это осуществляют, определяя статус геномного метилирования одного или нескольких динуклеотидов CpG в какой-либо из последовательностей, описанных в настоящем описании, либо обратно комплементарной ей. В целом идентифицировали около 900 последовательностей, которые подходят для такого анализа. Оказалось, что особенно подходят 100 последовательностей.
На основе лишь 10 последовательностей, таких как верхние десять элементов из таблицы 1А или 1В (величина р 0,0001), возможно достичь точности классификации 94% (суммарное правильное прогнозирование в отношении вопроса, получен ли данный образец из опухоли молочной железы или нет, по сравнению со всем осуществленным прогнозированием 49/52). Чувствительность детекции опухоли составляла 92,5% (37/40), специфичность детекции опухоли=100%. Увеличение количества элементов до 50 дает коэффициент классификации 96% (50/52 классифицировано правильно).
Последовательности могут быть обнаружены в генах, как можно видеть в таблице 1А ниже.
| Таблица 1A | ||||||
| SEQ ID NO. | ID | Хромосома | Начало | Конец | Величина p | Название гена |
| 1 | ID173583 | chr8 | 125810238 | 125810819 | 0,0000217 | MTSS1 |
| 2 | ID135122 | chr4 | 9040795 | 9041453 | 0,000058 | DUB3 |
| 3 | ID59231 | chr15 | 87711410 | 87711904 | 0,0000000747 | hsa-mir-9-3 |
| 4 | ID135160 | chr4 | 9459627 | 9459776 | 0,0000000115 | DRD5 |
| 5 | ID123222 | chr22 | 43445548 | 43445907 | 0,000000192 | PRR5 |
| 6 | ID41349 | chr12 | 105476974 | 105477298 | 0,000000362 | RFX4 |
| 7 | ID146518 | chr5 | 140703634 | 140703867 | 0,000000443 | PCDHGA3 |
| 8 | ID66687 | chr16 | 65169983 | 65170374 | 0,000000574 | AY862139 |
| 9 | ID11596 | chr1 | 146066973 | 146067308 | 0,000000872 | AK123662 |
| 10 | ID112724 | chr20 | 22514937 | 22515431 | 0,0000012 | FOXA2 |
| 11 | ID56406 | chr15 | 50874380 | 50874668 | 0,00000131 | ONECUT1 |
| 12 | ID11658 | chr1 | 146486000 | 146486341 | 0,00000157 | AK123662 |
| 13 | ID114005 | chr20 | 39198472 | 39198934 | 0,00000162 | PLCG1 |
| 14 | ID41387 | chr12 | 105851242 | 105851742 | 0,00000276 | MGC17943 |
| 15 | ID130737 | chr3 | 138963266 | 138963653 | 0,0000029 | SOX 14 |
| 16 | ID27050 | chr11 | 3819507 | 3820119 | 0,00000306 | RHOG |
| 17 | ID98568 | chr19 | 63407518 | 63407732 | 0,00000467 | ZNF274 |
| 18 | ID160851 | chr7 | 35070796 | 35071213 | 0,0000062 | TBX20 |
| 19 | ID9698 | chr1 | 92126308 | 92126790 | 0,00000624 | BRDT |
| 20 | ID35001 | chr11 | 124134059 | 124134403 | 0,0000129 | AY189281 |
| 21 | ID188098 | chrX | 113641444 | 113641884 | 0,0000135 | BC028688 |
| 22 | ID41218 | chr12 | 103034912 | 103035336 | 0,0000139 | NFYB |
| 23 | ID4450 | chr1 | 23416592 | 23417362 | 0,0000151 | HNRPR |
| 24 | ID97179 | chr19 | 56695742 | 56696075 | 0,0000166 | SIGLEC12 |
| 25 | ID137603 | chr4 | 89285337 | 89285745 | 0,0000208 | PKD2 |
| 26 | ID77777 | chr17 | 55854004 | 55854719 | 0,0000242 | LOC124773 |
| 27 | ID146531 | chr5 | 140715120 | 140715429 | 0,0000303 | PCDHGB2 |
| 28 | ID76724 | chr17 | 44159203 | 44159574 | 0,0000679 | PRAC |
| 29 | ID135120 | chr4 | 9006410 | 9006713 | 0,0000874 | DUB3 |
| 30 | ID135121 | chr4 | 9017069 | 9017727 | 0,0000911 | AY509884 |
| 31 | ID71929 | chr17 | 7695823 | 7696284 | 0,000130076 | LOC92162 |
| 32 | ID11593 | chr1 | 146066575 | 146066841 | 0,000154186 | AK123662 |
| 33 | ID120446 | chr22 | 20546877 | 20547317 | 0,0001669 | MAPK1 |
| 34 | ID146484 | chr5 | 140601695 | 140601937 | 0,000192752 | PCDHB15 |
| 35 | ID103546 | chr2 | 86334450 | 86334476 | 0,000264959 | MRPL35 |
| 36 | ID161220 | chr7 | 43853299 | 43853383 | 0,00030013 | DBNL |
| 37 | ID11654 | chr1 | 146485690 | 146485868 | 0,000310651 | AK123662 |
| 38 | ID146595 | chr5 | 140777723 | 140778009 | 0,000318226 | PCDHGA11 |
| 39 | ID173389 | chr8 | 121206506 | 121207025 | 0,000396103 | COL14A1 |
| 40 | ID160133 | chr7 | 26919212 | 26919376 | 0,000432818 | HOXA2 |
| 41 | ID118279 | chr21 | 42946007 | 42946287 | 0,000498108 | PDE9A |
| 42 | ID68965 | chr16 | 86694584 | 86695293 | 0,000498402 | AK126852 |
| 43 | ID16024 | chr1 | 224770811 | 224771150 | 0,000548832 | BC043916 |
| 44 | ID91933 | chr19 | 18831977 | 18832267 | 0,000607126 | AK125797 |
| 45 | ID146581 | chr5 | 140768066 | 140768556 | 0,000680057 | PCDHGA10 |
| 46 | ID61023 | chr16 | 954593 | 954879 | 0,000792141 | AK127296 |
| 47 | ID146570 | chr5 | 140757958 | 140758452 | 0,000996446 | PCDHGA9 |
| 48 | ID171504 | chr8 | 65454257 | 65455748 | 0,000953039 | hsa-mir-124a-2 |
| 49 | ID168737 | chr8 | 9798186 | 9798550 | 0,000137444 | hsa-mir-124a-1 |
| 50 | ID12521 | chr1 | 153203369 | 153203671 | 0,000101994 | hsa-mir-9-1 |
Последовательности могут быть обнаружены в межгенных областях, как можно видеть в таблице 1В.
| Таблица 1B | |||||
| SEQ ID NO. | ID | Хромосома | Начало | Конец | Величина p |
| 51 | ID33426 | chr11 | 89160048 | 89160322 | 1,14E-10 |
| 52 | ID90896 | chr19 | 15148984 | 15149357 | 1,14E-10 |
| 53 | ID29499 | chr11 | 49026728 | 49027002 | 4,06E-10 |
| 54 | ID169777 | chr8 | 24827761 | 24828171 | 6,48E-10 |
| 55 | ID109204 | chr2 | 220021958 | 220022344 | 8,65E-10 |
| 56 | ID103749 | chr2 | 91295935 | 91296161 | 1,82E-09 |
| 57 | ID99161 | chr2 | 2812784 | 2813304 | 1,82E-09 |
| 58 | ID45297 | chr13 | 27400198 | 27400742 | 3,38E-09 |
| 59 | ID166666 | chr7 | 149354316 | 149354562 | 6,06E-09 |
| 60 | ID167174 | chr7 | 152884159 | 152884405 | 6,96E-09 |
| 61 | ID34211 | chr11 | 113989177 | 113989682 | 9,11E-09 |
| 62 | ID152478 | chr6 | 42253517 | 42253868 | 9,63E-09 |
| 63 | ID24712 | chr10 | 130382122 | 130382412 | 9,63E-09 |
| 64 | ID49246 | chr14 | 28324500 | 28324758 | 1,30E-08 |
| 65 | ID34960 | chr11 | 123811259 | 123816128 | 1,34E-08 |
| 66 | ID112713 | chr20 | 22506327 | 22506681 | 1,59E-08 |
| 67 | ID54570 | chr15 | 24795835 | 24796140 | 2,70E-08 |
| 68 | ID89508 | chr19 | 9469673 | 9470021 | 2,98E-08 |
| 69 | ID 13622 | chr1 | 177614171 | 177614509 | 3,10E-08 |
| 70 | ID 1820 | chr1 | 3672455 | 3672910 | 3,10E-08 |
| 71 | ID29015 | chr11 | 45136542 | 45137024 | 3,10E-08 |
| 72 | ID91861 | chr19 | 18622132 | 18622478 | 3,46E-08 |
| 73 | ID77745 | chr17 | 55571595 | 55571965 | 4,18E-08 |
| 74 | ID98238 | chr19 | 61846590 | 61847055 | 4,44E-08 |
| 75 | ID76689 | chr17 | 44074514 | 44074967 | 4,50E-08 |
| 76 | ID76692 | chr17 | 44075076 | 44075400 | 6,20E-08 |
| 77 | ID59231 | chr15 | 87711410 | 87711904 | 7,47E-08 |
| 78 | ID124608 | chr3 | 6878205 | 6878499 | 8,97E-08 |
| 79 | ID10950 | chr1 | 116868496 | 116868706 | 9,58E-08 |
| 80 | ID159953 | chr7 | 24097508 | 24097911 | 9,58E-08 |
| 81 | ID115475 | chr20 | 58536847 | 58537548 | 1,23E-07 |
| 82 | ID126115 | chr3 | 38714269 | 38714730 | 1,92E-07 |
| 83 | ID71392 | chr17 | 6057091 | 6057605 | 2,51E-07 |
| 84 | ID105601 | chr2 | 121341432 | 121341916 | 2,61E-07 |
| 85 | ID168382 | chr8 | 1982797 | 1983256 | 2,61E-07 |
| 86 | ID147288 | chr5 | 158456751 | 158457100 | 2,69E-07 |
| 87 | ID137304 | chr4 | 81466911 | 81467150 | 3,30E-07 |
| 88 | ID179567 | chr9 | 101579069 | 101579476 | 3,92E-07 |
| 89 | ID3487 | chr1 | 16606704 | 16606778 | 4,25E-07 |
| 90 | ID92361 | chr19 | 34425570 | 34426104 | 4,25E-07 |
| 91 | ID177598 | chr9 | 66276397 | 66276499 | 4,45E-07 |
| 92 | ID3846 | chr1 | 18994906 | 18995319 | 5,42E-07 |
| 93 | ID35773 | chr12 | 125067 | 125386 | 5,88E-07 |
| 94 | ID117488 | chr21 | 33327565 | 33327930 | 7,29E-07 |
| 95 | ID89802 | chr19 | 10450948 | 10451249 | 8,72E-07 |
| 96 | ID64615 | chr16 | 29702807 | 29703873 | 8,92E-07 |
| 97 | ID168612 | chr8 | 7917174 | 7917432 | 9,20E-07 |
| 98 | ID16187 | chr1 | 225850241 | 225850586 | 9,73E-07 |
| 99 | ID73339 | chr17 | 21160807 | 21161232 | 1,13E-06 |
| 100 | ID 18029 | chr10 | 11462206 | 11463043 | 1,53E-06 |
Гены, которые образуют основу настоящего изобретения, предпочтительно используют для формирования «панели генов», т.е. коллекции, содержащей конкретные генетические последовательности по настоящему изобретению и/или соответствующие им информативные сайты метилирования. Формирование панелей генов дает возможность быстрого и специфического анализа специфических аспектов рака молочной железы. Панель(и) генов, описанная(ые) и используемая(ые) в этом изобретении, может(гут) быть с неожиданно высокой эффективностью использована(ы) для диагностики, лечения и мониторинга, а также анализа предрасположенности к клеточно-пролиферативным заболеваниям молочной железы, в частности, опять же для детекции опухоли молочной железы.
Кроме того, применение большого числа сайтов CpG из различного набора генов дает возможность относительно высокой степени чувствительности и специфичности в сравнении со способами диагностики и детекции по одному гену.
Изобретение относится к способу анализа онкологических заболеваний молочной железы, включающему определение в панели по меньшей мере из четырех последовательностей ДНК статуса геномного метилирования одного или нескольких динуклеотидов CpG в каждой последовательности, где последовательности выбирают из группы последовательностей согласно SEQ ID NO.1-SEQ ID NO.10 и SEQ ID NO.50-SEQ ID NO.60.
В одном из вариантов осуществления предпочтительно, чтобы определяли статус метилирования одной или нескольких последовательностей, соответствующих SEQ ID NO.1-100, где последовательность имеет величину р, определенную в настоящем описании, которая меньше, чем 1Е-4 (0,0001), как указано в таблице 1А или 1В.
В одном из вариантов осуществления способа по изобретению анализ представляет собой детекцию рака молочной железы у индивидуума и при этом осуществляют следующие стадии: (а) получение образца от анализируемого индивидуума, (b) определение в панели по меньшей мере из четырех последовательностей ДНК статуса метилирования одного или нескольких динуклеотидов CpG в каждой последовательности, где последовательности ДНК выбирают из группы последовательностей согласно SEQ ID NO.1-SEQ ID NO.10 и SEQ ID NO.50-SEQ ID NO.60.
Статус метилирования областей CpG указывает на рак молочной железы. Предпочтительно, тем не менее, статус метилирования определяют для каждого CpG и определяют дифференциальный паттерн метилирования, поскольку не все области CpG обязательно должны быть метилированы.
Необязательно, осуществляют следующие стадии: (а) один или несколько результатов теста на определение статуса метилирования вводят в классификатор, который получают исходя из диагностической поливариативной модели, (b) рассчитывают вероятность того, получен ли образец из нормальной ткани или ткани рака молочной железы, и/или (с) рассчитывают ассоциированную величину р для степени достоверности в прогнозе.
Например, авторы изобретения используют классификатор метода опорных векторов для «изучения» важных характеристик опухоли или нормального образца на основе предварительно определенного набора тканей, полученных от пациентов. В настоящее время алгоритм выводится классификатором (уравнение, в котором переменные представляют собой коэффициенты метилирования из набора используемых элементов). Коэффициенты метилирования образца нового пациента затем вносят в этот классификатор. Результат может быть 1 или 0. Для получения величины р используют расстояние от критического уровня.
Предпочтительно, чтобы дополнительно определяли статус геномного метилирования одной или нескольких последовательностей ДНК, выбранных из группы последовательностей, соответствующих SEQ ID NO.11-SEQ ID NO.49 и SEQ ID NO.61-SEQ ID NO.100.
В одном из вариантов осуществления статус метилирования определяют по меньшей мере для десяти последовательностей ДНК, по меньшей мере двадцати последовательностей, по меньшей мере тридцати последовательностей, по меньшей мере сорока последовательностей или более чем сорока последовательностей из последовательностей согласно SEQ ID NO.1-SEQ ID NO.100. Особенно предпочтительно, чтобы статус метилирования определяли для всех последовательностей, соответствующих SEQ ID NO.1-SEQ ID NO.100.
В одном из вариантов осуществления статус метилирования определяют для последовательностей ДНК, соответствующих SEQ ID NO.1-SEQ ID NO.10 и SEQ ID NO.50-SEQ ID NO.60. По существу изобретение также относится к определению статуса метилирования лишь одной из последовательностей, соответствующих SEQ ID NO.1-SEQ ID NO.100.
Существует большое число способов определения статуса метилирования молекулы ДНК. Предпочтительно, чтобы статус метилирования определяли с помощью одного или нескольких способов, выбранных из следующей группы: бисульфитное секвенирование, пиросеквенирование, одноцепочечный конформационный анализ, чувствительный к метилированию (MS-SSCA), анализ кривых плавления с высоким разрешением (HRM), однонуклеотидное удлинение праймеров, чувствительное к метилированию (MS-SnuPE), расщепление по специфическим парам оснований/MALDI-TOF, ПЦР, специфичная к метилированию (MSP), способы на основе микроматриц и расщепление рестриктазой MspI. Общий обзор дополнительных известных способов определения 5-метилцитозина может быть получен из следующей обзорной статьи: Rein, T., DePamphilis, M.L., Zorbas, H., Nucleic Acids Res. 1998, 26, 2255. Дополнительные способы описаны в заявке на патент США 2006/0292564А1.
В предпочтительном варианте осуществления статус метилирования определяют путем расщепления с помощью MspI, лигирования адапторов, расщепления ферментом McrBC, ПЦР-амплификации, мечения и последующей гибридизации.
Предпочтительно, чтобы анализируемый образец был получен из типа тканей, выбранного из группы тканей, например тканевой биопсии, полученной из анализируемой ткани, вагинальной ткани, языка, поджелудочной железы, печени, селезенки, яичника, мышцы, соединительной ткани, нервной ткани, ткани желудочно-кишечного тракта, опухолевой ткани, жидкостей организма, крови, сыворотки, слюны и мочи.
В предпочтительном варианте осуществления определяют первичный рак молочной железы.
В одном из вариантов осуществления способа по изобретению полученный паттерн метилирования используют для прогнозирования терапевтического ответа на лечение рака молочной железы.
Настоящее изобретение также относится к зондам, таким как олигонуклеотиды, которые находятся в области вблизи сайтов CpG. Олигомеры по настоящему изобретению обычно используются в так называемых «наборах», которые содержат по меньшей мере один олигонуклеотид для каждого из динуклеотидов CpG в последовательности от SEQ ID NO.1 вплоть до SEQ ID NO.100 или по меньшей мере для 10, предпочтительно 20, более предпочтительно 30, наиболее предпочтительно более чем 50 указанных последовательностей. Изобретение также относится к обратному комплементу олигонуклеотидов, которые расположены в области сайтов CpG.
Зонды, используемые для такого анализа, определяют исходя из одного или нескольких из следующих условий: (1) последовательность зонда встречается в геноме человека лишь один раз; (2) плотность нуклеотидов С/G в зонде составляет от 30% до 70%; (3) характеристики плавления гибридизации и другие критерии соответствуют описанным в статье Mei R et al. Proc. Natl. Acad. Sci. USA, 2003, Sept.30; 100(20).11237-42.
В очень предпочтительном варианте осуществления изобретение относится к набору олигонуклеотидов, которые специфичны для последовательностей, соответствующих SEQ ID NO.1-10 и/или SEQ ID NO:50-60, или SEQ ID NO.50-60. Олигонуклеотид по изобретению может быть специфичным для последовательности, которая встречается in vivo, или он может быть специфичен для последовательности, которую обработали бисульфитом. Такой зонд имеет длину от 10 до 80 нуклеотидов, более предпочтительно длину от 15 до 40 нуклеотидов.
В случае наборов олигонуклеотидов по настоящему изобретению предпочтительно, чтобы по меньшей мере один олигонуклеотид связывался с твердой фазой. Дополнительно предпочтительно, чтобы все олигонуклеотиды одного набора связывались с твердой фазой.
Настоящее изобретение дополнительно относится к набору по меньшей мере из 10 зондов (олигонуклеотидов и/или PNA-олигомеров), используемому для детекции состояния метилирования цитозина геномной ДНК путем анализа указанной последовательности или обработанных версий указанной последовательности (согласно SEQ ID NO.1 вплоть до SEQ ID NO.100 и последовательностей, комплементарных им).
Эти зонды дают возможность улучшить детекцию, диагностику, лечение и мониторинг клеточно-пролиферативных заболеваний молочной железы.
Набор олигонуклеотидов также может быть использован для определения однонуклеотидных полиморфизмов (SNP) путем анализа указанной последовательности или обработанных версий указанной последовательности, соответствующей одной из последовательностей SEQ ID NO.1-SEQ ID NO.100.
По настоящему изобретению предпочтительно, чтобы расположение различных олигонуклеотидов и/или PNA-олигомеров (так называемая «матрица»), доступных по настоящему изобретению, было подобрано таким образом, чтобы также связываться с твердой фазой.
Эта матрица из последовательностей различных олигонуклеотидов и/или PNA-олигомеров может отличаться тем, что она располагается на твердой фазе в виде прямоугольной или гексагональной решетки. Поверхность твердой фазы предпочтительно состоит из силикона, стекла, полистирола, алюминия, стали, железа, меди, никеля, серебра или золота. Тем не менее, подходящими альтернативами являются нитроцеллюлоза, а также пластмассы, такие как найлон, который может существовать в виде гранул, или также как смоляные матрицы.
Поэтому дополнительным объектом настоящего изобретения является способ получения матрицы, фиксированной на материале носителя, для улучшенной идентификации, диагностики, лечения и наблюдения клеточно-пролиферативных заболеваний молочной железы и/или определения предрасположенности к клеточно-пролиферативным заболеваниям молочной железы. В указанном способе по меньшей мере один олигонуклеотид по настоящему изобретению связывается с твердой фазой. Способы получения таких матриц известны, например, из патента США № 5744305, с помощью твердофазной химии и светочувствительных защитных групп. Дополнительный объект настоящего изобретения относится к ДНК-чипу для улучшенной идентификации, диагностики, лечения и мониторинга клеточно-пролиферативных заболеваний молочной железы. Более того, ДНК-чип позволяет определять предрасположенность к клеточно-пролиферативным заболеваниям молочной железы.
ДНК-чип содержит по меньшей мере одну нуклеиновую кислоту и/или олигонуклеотид по настоящему изобретению. ДНК-чипы известны, например, из патента США № 5837832.
Изобретение также относится к композиции или матрице, содержащей нуклеиновые кислоты с последовательностями, которые идентичны по меньшей мере 10 последовательностям, соответствующим с SEQ ID NO.1-SEQ ID NO.100, где композиция или матрица содержит не более 100 различных молекул нуклеиновых кислот.
Настоящее изобретение относится к композиции или матрице, содержащей по меньшей мере 5 последовательностей с суммарной величиной р менее 0,001, предпочтительно менее 0,0001.
Более того, объектом настоящего изобретения является набор, который может быть составлен, например, из реагента, содержащего бисульфит, набора праймерных олигонуклеотидов, содержащего по меньшей мере два олигонуклеотида, последовательности которых в каждом случае соответствуют или комплементарны сегменту длиной по меньшей мере 15 оснований нуклеотидных последовательностей, заданных в SEQ ID NO.1- SEQ ID NO.100. Предпочтительно, чтобы праймеры имелись для последовательностей с SEQ ID NO. 1 по SEQ ID NO. 10 и с SEQ ID NO. 50 по SEQ ID NO. 60.
ПРИМЕРЫ
ОБРАЗЦЫ
Образцы пациентов получали из Norwegian Radium Hospital, Oslo, Norway и National Cancer Institute's Cooperative Human Tissue Network (CHTN), и согласие пациентов получали согласно требованиям законодательства.
ОБЛАСТИ CPG
Аннотированные области CpG получали из программного средства для просмотра генома UCSC. Эти области предсказывали используя опубликованное определение Gardiner-Garden (Gardiner-Garden, M. and M. Frommer (1987). “CpG islands in vertebrate genomes.” J Mol Biol 196(2): 261-82), включающее следующие условия: длина>=200н.п., %GC>=50%, наблюдаемые/предполагаемые CpG>=0,6. В геноме существует ~26219 областей CpG в диапазоне от 200 н.п. до 2000 н.п. Эти области хорошо покрываются фрагментацией рестриктазой Msp I.
Матрицы выпускались фирмой Nimblegen Systems Inc, используя формат 390К для следующих технических данных. Для создания 50-мерной черепичной (tiling) матрицы использовали аннотацию областей CpG из генома человека build 33 (hg17). Для равномерного распределения области 50-меры переносили по обе стороны от координат последовательности области. Формат 390К обладает 367658 доступными элементами, которые не вместили бы всех областей при 50-мерном звене. Поэтому авторы изобретения остановились на областях, представленных на основе размера, анализируя лишь области CpG размера 200н.п.-2000н.п. Для представления фонового сигнала создавали контрольные зонды. Подготовка образца: описание было дано ранее (Lucito, R., J. Healy, et al. (2003). “Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation” Genome Res 13(10): 2299-305), со следующими изменениями. Используемая первичная эндонуклеаза рестрикции представляет собой MspI. После расщепления лигировали следующие линкеры (MspI24-мер и MSPI12-мер). 12-Мер не фосфорилируется и не лигирует. После лигирования материал очищают с помощью фенола-хлороформа, осаждают, центрифугируют и ресуспендируют. Материал делят пополам, половину расщепляют эндонуклеазой McrBC, а для другой половины симулируют расщепление. По меньшей мере четыре пробирки объемом 250 мкл использовали для каждой пары образцов для увеличения копийности каждого с проведением реакции в объеме 100 мкл. Условия проведения цикла: 95°C в течение 1 мин, 72°C в течение 3 мин на протяжении 15 циклов с последующим удлинением в течение 10 мин при 72°C. При завершении содержимое пробирок для каждой пары объединяли. Копии очищали путем экстракции смесью фенол:хлороформ, осаждали, ресуспендировали и определяли концентрацию. ДНК метили, как описано, с незначительными изменениями (Lucito, R., J. Healy, et al. (2003). “Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation” Genome Res 13(10): 2299-305). В кратком изложении 2 мкг ДНК-матрицы помещали (растворив в ТЕ-буфере при рН 8) в пробирки для проведения ПЦР объемом 0,2 мл. Добавляли 5 мкл случайных девятичленных полимеров (продукция фирмы Sigma Genosys), доводя с помощью dH2O до 25 мкл, и перемешивали. Пробирки помещали в Tetrad при 100°C в течение 5 мин, после чего на лед в течение 5 мин. К продукту добавляли 5 мкл буфера NEB, по 2,5 мкл каждого dNTP (0,6 нм dCTP, 1,2 нм dATP, dTTP, dGTP), 5 мкл метки (Cy3-dCTP или Cy5-dCTP), производства фирмы GE Healthcare, 2 мкл фрагмента Кленова NEB и 2 мкл dH2O. Способы гибридизации и отмывки соответствовали сообщенным ранее (Lucito, R., J. Healy, et al. (2003). “Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation” Genome Res 13(10): 2291-305) за исключением того, что температуру печи для гибридизации повышали до 50°C. Матрицы сканировали с помощью набора для сканера Axon GenePix 4000B при размере пикселя 5 мкм. Для количественного определения интенсивности свечения матриц использовали программное обеспечение GenePix Pro 4.0. Данные, полученные с помощью матриц, вводили в S-PLUS для дополнительного анализа.
АНАЛИЗ ДАННЫХ
Изображения, полученные с помощью микроматриц, сканировали на сканере GenePix 4000B и получали данные используя программное обеспечение Nimblescan (продукция фирмы Nimblegen Systems Inc). Для каждого зонда среднее геометрическое коэффициентов (GeoMeanRatio) McrBc и контрольных обработанных образцов рассчитывали для каждого эксперимента и ассоциированной с ним смены красителя. Коэффициенты GeoMeanRatio всех образцов в совокупности данных затем нормализовали, используя способ квантильной нормализации (Bolstad,B.M., R.A. Irizarry, et al. (2003). “A comparison of normalization methods for high density oligonucleotide array data based on variance and bias” Bioinformatics 19(2): 185-93). Коэффициенты нормализации для каждого эксперимента затем сжимали до получения одной величины для всех зондов в каждом фрагменте, полученном после расщепления рестриктазой MspI, используя модель медианного сглаживания. Сжатые данные затем использовали для дополнительного анализа.
Для идентификации самых существенных областей использовали дисперсионный анализ. Для определения самых постоянно встречающихся изменений в метилировании между опухолевыми и нормальными образцами авторы изобретения использовали подход t-теста. Используя предельную величину р 0,001 после поправки на множественное тестирование (False Discovery Rate, Benjamini and Hotchberg (Benjamini 1995)), авторы получили список из 916 фрагментов MspI, где наблюдается различное метилирование этих 916 фрагментов исходя из ассоциации с генами.
Управляемое обучение: для идентификации количества элементов, требуемого для установления отличия опухолевых образцов от нормальных, авторы использовали классификатор с управляемым обучением. Для получения точности классификации использовали общедоступную библиотеку опорных векторов (SVM) (LibSVM Версия 2.8), используя способ с исключением объектов по одному (Lin, C.J. and Chang C.C. (2001). LIBSVM: a library for support vector machines). Элементы метилирования для классификации сначала выбирали, используя t-тест только среди данных режима обучения. SVM затем обучали на первых 10, 50 и 100 элементах, используя основной компонент радиальной базисной функции (RBF).
Для N образцов для идентификации фрагментов с существенными различиями в коэффициентах метилирования t-тесты осуществляли для (N-1) образцов. Для базы данных по молочной железе эту процедуру осуществляли 52 раза для всех 52 образцов молочной железы, так что в процессе расчетов t-теста каждый образец удаляется один раз. Коэффициенты метилирования элементов первых 10 фрагментов из (N-1) образцов затем использовали для обучения SVM, и коэффициенты от одного образца, не использованного для обучения SVM, использовали для тестирования. Основываясь только на 10 элементах, авторы могут достичь точности классификации 94% (суммарно правильные прогнозы/все прогнозы, 49/52). Чувствительность идентификации опухоли составила 92,5% (37/40), специфичность идентификации опухоли составила 100%). Увеличение количества элементов до 50 дает степень классификации 96% (50/52 классифицировано верно). Интересно, что два образца опухоли, которые классифицировали как нормальные в этом анализе, оказались также приближены к нормальным как в анализе экспрессии генов, так и анализе ROMA.
ДЕТЕКЦИЯ МЕТИЛИРОВАННЫХ САЙТОВ
В предпочтительном варианте осуществления способ включает следующие стадии: на первой стадии способа образец геномной ДНК должен быть выделен из источников, таких как клеточные линии, образцы ткани или крови. Экстракцию ДНК можно осуществить средствами, которые являются стандартными для специалиста в данной области. К ним относятся применение детергентных лизатов, обработка ультразвуком и интенсивное перемешивание со стеклянными бусинами. После того как нуклеиновые кислоты были экстрагированы, геномную двухцепочечную ДНК использовали в анализе.
В предпочтительном варианте осуществления ДНК может быть расщеплена перед следующей стадией способа, причем это можно осуществить любыми средствами, принятыми на существующем уровне техники, в частности, но ими не ограничиваясь, с помощью эндонуклеаз рестрикции.
На второй стадии способа образец геномной ДНК обрабатывают таким образом, чтобы цитозиновые основания, которые неметилированы в 5'-положении, преобразовать в урацил, тимин или другое основание, которое отличается от цитозина с точки зрения реакции гибридизации. Далее в настоящем описании это необходимо понимать как «предварительную обработку».
Описанную выше обработку геномной ДНК предпочтительно осуществляют с помощью бисульфита (сульфита, дисульфита) и последующего щелочного гидролиза, который приводит к преобразованию неметилированных цитозиновых нуклеиновых оснований в урацил или другое основание, которое отличается от цитозина с точки зрения реакции основания вайрин (vairine). При использовании для проведения реакции бисульфитного раствора добавление происходит по неметилирован