Способ лечения рака, несущего мутации egfr
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для лечения рака, несущего мутации EGFR. Заявлено применение BIBW 2992 (1) для получения фармацевтической композиции для лечения пациентов с резистентным к гефитинибу и/или эрлотинибу раку. Использование изобретения эффективно для лечения пациентов с раковыми заболеваниями, у которых имеются мутации EGFR в опухоли. 3 з.п. ф-лы, 1 табл., 10 пр.
Реферат
Настоящее изобретение относится к способу лечения пациентов с раковым заболеванием, которые несут мутации гена рецептора эпидермального фактора роста (epidermal growth factor receptor - EGFR) в опухоли. Указанный способ включает введение эффективного количества необратимого ингибитора EGFR BIBW2992 (1) субъекту, нуждающемуся в таком введении, необязательно в комбинации с введением дополнительного химиотерапевтического агента (2), в комбинации с радиотерапией, радио-иммунотерапией и/или хирургическим удалением опухоли. К мутациям EGFR относятся, по меньшей мере, все амплификации или активирующие генные мутации, которые важны для повышенной экспрессии (например, пониженное число повторов СА (цитозин-аденозин) в первом интроне или другие специфические полиморфизмы), повышенная чувствительность к активированию или истинно активируемые мутации (например, L858R или G719S точечные мутации или специфические 19 делеций в экзоне). К ним также относятся мутации, связанные с устойчивостью (например, D761Y, инсерции D770_N771insNPG) или возникновением приобретенной устойчивости (например, Т790М) для лечения с применением обратимых ингибиторов EGFR и/или HER2, например, гефитиниба, эрлотиниба, вандетаниба (ZD-6474), АЕЕ-788, PKI-166, лапатиниба, цетуксимабом, нимотузумаба, матузумаба, панитумумаба, трастузумаба и пертузумаба или других необратимых ингибиторов, например, CI-1033, ЕКВ-569, HKI-272 или HKI-357.
Уровень техники
Соматические мутации в домене тирозинкиназы (ТК) гена рецептора эпидермального фактора роста (epidermal growth factor receptor - EGFR) при раковых заболеваниях легких вызывают огромный интерес, обеспечивая подход для прогнозирования чувствительности к ингибиторам ТК (ТК inhibitors - TKI). Хотя мутационный статус чрезвычайно важен при определении ответа на TKI, он не является единственным фактором, и накапливаются доказательства, что амплификация гена EGFR, других представителей семейства EGFR (HER2, HER3) и генов, расположенных ниже по сигнальному пути EGFR (KRAS, BRAF), могут быть вовлечены в патогенез рака и ответ ингибиторов TKI.
В WO 2006/084058 описан способ лечения форм рака, устойчивых к гефитинибу и/или эрлотинибу, включающий введение фармацевтической композиции, содержащей необратимый ингибитор рецептора эпидермального фактора роста (EGFR), субъекту, нуждающемуся в таком лечении, для которого характерно применение необратимых ингибиторов EGFR ЕКВ-569, HKI-272 и HKI-357.
Раковые заболевания эпителиальных клеток, например, рак простаты, рак груди, рак толстой кишки, рак легких, рак поджелудочной железы, рак яичника, рак селезенки, рак семенников, рак тимуса и др., являются заболеваниями, для которых свойственен повышенный рост эпителиальных клеток. Избыточный рост первоначально является причиной формирования опухоли. Со временем также образуются метастазы к разным частям органа. Хотя были достигнуты успехи в диагностике и лечении различных форм рака, эта болезнь по-прежнему приводит к высокой смертности.
Рак легких остается основной причиной смерти от рака легких в промышленно развитых странах. Рак, начинающий развиваться в легких, подразделяется на два основных типа - немелкоклеточный и мелкоклеточный рак легких, в зависимости от того, какие клетки наблюдают под микроскопом. Немелкоклеточный рак легких (плоскоклеточный рак, аденокарцинома и крупноклеточный рак) обычно распространяется на другие органы медленнее, чем мелкоклеточный рак легких. Примерно 75% случаев рака легких относят к немелкоклеточному раку легких (например, аденокарциномы), и оставшиеся 25% представляют мелкоклеточный рак легких. Немелкоклеточный рак легких (НМКРЛ) является основной причиной смерти от рака в США, Японии и Западной Европе. Для пациентов с запущенной формой заболевания химиотерапия обеспечивает наилучшее выживание, но оно достигается ценой существенной токсичности, что подчеркивает потребность в терапевтических агентах, специфически нацеленных на принципиально важные генетические повреждения, которые направляют рост опухоли (Schiller J.H. и др., N Engl J Med, 346, 2002, сс.92-98).
К двум или нескольким соединениям, разработанным и применяемым в медицинской практике, относятся гефитиниб (соединение ZD 1839, разработанное фирмой AstraZeneca UK Ltd. и распространяемое под торговой маркой IRESSA, называется ниже «IRESSA») и эрлотиниб (соединение OSI-774, разработанное фирмами Genentech, Inc. и OSI Pharmaceuticals, Inc., и распространяемое под торговой маркой TARCEVA, называется ниже «TARCEVA»); оба соединения показали обнадеживающие клинические результаты. Обычное лечение рака с помощью и IRESSA, и TARCEVA, представляет ежедневное пероральное введение не более 500 мг соответствующих соединений. В мае 2003 года IRESSA стал первым из тех продуктов, которые поступили на рынок в США и были одобрены для лечения пациентов с продвинутой формой немелкоклеточного рака легких. Продукт IRESSA является хиназолином перорального действия, который действует путем прямого ингибирования фосфорилирования тирозинкиназы на EGFR. Он конкурирует за сайт связывания аденозинтрифосфата (АТФ), приводя к подавлению HER-kinase axis. Точный механизм ответа на лечение агентом IRESSA полностью неясен, однако, исследования показывают, что наличие EGFR является необходимым условием для такого действия.
Существенное ограничение применения этих соединений заключается в том, что у реципиентов возможно формирование устойчивости к их терапевтическому воздействию после первоначального ответа на терапию, или у реципиентов вообще может не быть измеряемого ответа на ингибиторы EGFR-тирозинкиназы (TKI). Степень ответа на EGFR-TKI различна в разных этнических группах. При нижней границе респондеров на EGFR-TKI в некоторых популяциях только 10-15% пациентов с запущенной формой немелкоклеточного рака легких отвечает на ингибиторы EGFR-киназы. Таким образом, лучшее понимание молекулярных механизмов, лежащих в основе чувствительности к IRESSA и TARCEVA, может быть чрезвычайно важно для направленной терапии применительно к тем индивидуумам, для которых наиболее вероятно будет полезный результат от такой терапии.
Таким образом, в данной области существует потребность в разработке эффективных способов лечения рака, особенно эпителиальных форм рака, например, рака легких, яичника, мозга, толстой кишки и простаты, которые включают преимущества TKI-терапии и преодолевают отсутствие реакции на эту терапию у пациентов. Такое лечение может иметь большое значение для здоровья людей, особенно пожилых, среди которых особенно часто встречается рак.
Соединение BIBW2992 (1) имеет формулу 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((8)-тетрагидрофуран-3-илокси)-хиназолин,
.
Соединение BIBW 2992 (1) является мощным и избирательным ингибитором двойного действия рецептора erbbl (EGFR) и рецептора erbB2 (Her2/neu) рецепторных тирозинкиназ. Кроме того, соединение BIBW 2992 (1) было разработано для ковалентного связывания с рецепторами EGFR и HER2, тем самым необратимо инактивируя молекулы рецепторов, с которыми соединение связывается. Это соединение, его соли, включая соль дималеат, их получение и фармацевтические составы, включающие соединение BIBW2992 (1) или его соль, описаны в WO 02/50043 и WO 2005/037824. Эти документы включены в настоящее изобретение в виде ссылок на указанные вопросы.
Краткое описание изобретения
Неожиданно было установлено, что необратимый ингибитор BIBW2992 (1) двойного действия (EGFR/HER2) является преимущественно эффективным в лечении рака у пациентов, несущих мутацию EGFR в опухоли, например, активирующую мутацию EGFR, особенно если активирующая мутация ассоциирована с другой мутацией, ответственной за устойчивость или возникновение приобретенной устойчивости к лечению обратимыми ингибиторами EGFR, например, гефитинибом и/или эрлотинибом, или другими необратимыми ингибиторами, например, CI-1033, ЕКВ-569, HKI-272 или HKI-357. Следовательно, пациенты, которые показывают низкий ответ, или не показывают ответа, или перестают показывать ответ на лечение гефитинибом и/или эрлотинибом, могут получить эффективное лечение соединением BIBW 2992.
Таким образом, основной объект во всеохватывающих вариантах осуществления настоящего изобретения относится к способу лечения пациентов с раковым заболеванием, которые несут мутацию гена EGFR в опухоли, по сравнению с нативной последовательностью EGFR. Указанный способ включает введение эффективного количества необратимого ингибитора EGFR соединения BIBW2992 (1) субъекту, нуждающемуся в таком лечении, необязательно в комбинации с введением дополнительного химиотерапевтического агента (2), и/или необязательно в комбинации с радиотерапией, радио-иммунотерипией и/или хирургическим удалением опухоли.
Вторым объектом настоящего изобретения является применение соединения BIBW 2992 (1) для приготовления фармацевтической композиции для лечения пациента с раковым заболеванием, несущим мутацию гена рецептора EGFR в опухоли, сравниваемого с нативным рецептором, необязательно в комбинации с другим химиотерапевтическим агентом (2).
В первом предпочтительном варианте осуществления настоящего изобретения мутация гена EGFR является активирующей мутацией.
Во втором предпочтительном варианте осуществления настоящего изобретения мутация гена EGFR является активирующей мутацией, ассоциированной с устойчивостью, или мутацией приобретенной устойчивости к лечению обратимыми ингибиторами EGFR и HER2, например, гефитинибом, эрлотинибом, вандетанибом (ZD-6474), АЕЕ-788, PKI-166, лапатинибом, цетуксимабом, нимотузумабом, матузумабом, панитумумабом, трастузумабом и пертузумабом, или другими необратимыми ингибиторами, например, CI-1033, ЕКВ-569, HKI-272 или HKI-357.
Таким образом, в одном из вариантов осуществления настоящего изобретения предусмотрен способ лечения рака, устойчивого к лечению обратимыми ингибиторами EGFR, например, рака, устойчивого к гефитинибу и/или эрлотинибу. В таком варианте осуществления настоящего изобретения прогрессирование рака у субъекта подвергают мониторингу после начала лечения субъекта гефитинибом и/или эрлотинибом или лечения другим обратимым ингибитором EGFR. Прогрессирование рака является показателем того, что данная форма рака устойчива к лечению обратимым ингибитором EGFR.
Прогрессирование рака может подвергаться мониторингу способами, известными специалистам в данной области. Например, прогрессирование рака может подвергаться мониторингу путем визуального осмотра рака, например, с помощью рентгена, компьютерной томографии или магнитно-резонансной томографии (MRI). В другом варианте прогрессирование может подвергаться мониторингу путем анализа биомаркеров опухоли.
В другом варианте осуществления настоящего изобретения пациента подвергают мониторингу в разное время на протяжении лечения рака. Например, прогрессирование рака может подвергаться мониторингу путем анализа прогрессирования рака во второй временной точке и сравнения этого анализа с анализом в первой временной точке. Первая временная точка может быть до или после инициации лечения гефитинибом и/или эрлотинибом, а вторая временная точка наступает после первой. Повышенный рост рака свидетельствует о прогрессировании рака.
В одном из вариантов осуществления настоящего изобретения рак является эпителиально-клеточным раком. В другом варианте осуществления настоящего изобретения рак является желудочно-кишечным раком, раком простаты, раком яичника, раком груди, раком головы и шеи, раком пищевода, раком легких, немелкоклеточным раком легких, раком нервной системы, раком почки, раком сетчатки, раком кожи, раком печени, раком поджелудочной железы, раком мочеполовой системы и раком мочевого пузыря.
В одном из вариантов осуществления настоящего изобретения размер рака подвергают мониторингу на протяжении дополнительного времени, причем временные точки наступают после второй временной точки.
В одном из вариантов осуществления настоящего изобретения более поздняя временная точка наступает, по меньшей мере, через 2 месяца после предшествующей временной точки. В другом варианте осуществления настоящего изобретения более поздняя временная точка наступает, по меньшей мере, через 6 месяцев после предшествующей временной точки. В еще одном из вариантов осуществления настоящего изобретения более поздняя временная точка наступает, по меньшей мере, через 10 месяцев после предшествующей временной точки. В другом варианте осуществления настоящего изобретения более поздняя временная точка наступает, по меньшей мере, через 1 год после предшествующей временной точки.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения рака, включающий введение субъекту, имеющему мутацию в EGFR, а именно, замещение метионина на треонин по положению 790, называемую в данной области мутацией Т790М, фармацевтической композиции, включающей эффективное количество BIBW 2992 (1). Мутация Т790М придает устойчивость к лечению гефитинибом и/или эрлотинибом.
Подробное описание изобретения
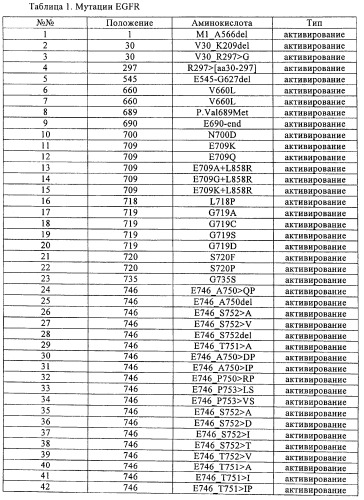
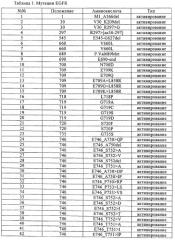
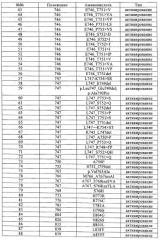
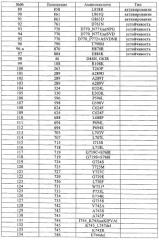
Всеохватывающие варианты осуществления настоящего изобретения не ограничиваются мутацией EGFR, которая представляет какое-либо отличие в последовательности гена EGFR по сравнению с нативной последовательностью, и которую следует учитывать в виде мутации в вариантах осуществления настоящего изобретения, описанных выше, например, мутации EGFR, выбранные из группы мутаций, перечисленных в табл.1. Все мутации EGFR, указанные в табл.1, известны в данной области.
В таблице выше мутации были описаны в виде отдельных событий. Следует отметить, что по частоте 90% чувствительных мутаций связано с 19 делециями в экзоне (например, положения 746 и 747, 61%) и 21 точечной мутацией в экзоне (L858R, 24%, L861Q, 4%). Также следует отметить, что часто наблюдают варианты сложных комбинаций мутаций (например, G719S+S768I). Приобретенная устойчивость, когда мутация, обусловливающая устойчивость (например, Т790М), возникает в активирующем окружении, вариант сложной комбинации является общим правилом.
В первом предпочтительном варианте осуществления настоящего изобретения мутация EGFR является активирующей мутацией, например, выбранной из группы, включающей мутации, описанные в табл.1 под номерами 1-91, или, что более предпочтительно, идентифицированные в табл.1 под номерами 1-29, 57-65, 73, 75, 76, 77, 79 и 80-91.
Во втором предпочтительном варианте осуществления настоящего изобретения мутация EGFR является активирующей мутацией, ассоциированной с устойчивостью или мутацией приобретенной устойчивости к лечению обратимыми ингибиторами EGFR и HER2, например, гефитинибом, эрлотинибом, вандетанибом (ZD-6474), АЕЕ-788, PKI-166, лапатинибом, цетуксимабом, нимотузумабом, матузумабом, панитумумабом, трастузумабом и пертузумабом или другими необратимыми ингибиторами, например, CI-1033, EKB-569, HKI-272 или HKI-357, например, выбранными из группы, состоящей из мутаций, идентифицированных в табл.1 под номерами 92-97, или, что более предпочтительно, идентифицированными в табл.1 под номерами 92, 93, 96, 96-a и 97.
Согласно третьей подгруппе предпочтительных вариантов осуществления настоящего изобретения мутация EGFR является показателем чувствительности к гефитинибу и/или эрлотинибу; такой мутацией может быть делеция остатков с 747 (лизина) по 749 (глутаминовая кислота), комбинированная с мутацией по положению 750 (аланин), делецией остатков в 747 (лизин) по 750 (аланин), замещением аргинина на лейцин по остатку 858, или замещением глутамина на лейцин по остатку 861.
В четвертом предпочтительном варианте осуществления настоящего изобретения мутация EGFR выбрана из группы, включающей Т790М, E746_A750del, E746_S752>V, L747_P753>S, L858R, L747_A750>P, S752_I759del.
К примерам карцином, проявляющих устойчивость или приобретенную устойчивость к лечению обратимыми ингибиторами EGFR и HER2, например, гефитинибом или эрлотинибом, или другими необратимыми ингибиторами, например, CI-1033, EKB-569, HKI-272 или HKI-357, в рамках охвата настоящего изобретения относятся, но ими не ограничиваются, аденокарцинома (АК), плоскоклеточный рак (ПКР) и смешанные или недифференцированные карциномы. К карциномам в рамках охвата настоящего изобретения относятся, но ими не ограничиваются, карциномы со следующими гистологическими признаками:
- Опухоли головы и шеи: ПКР, АК, формы переходно-клеточного рака, формы мукоэпидермоидного рака, недифференцированные карциномы;
- Опухоли центральной нервной системы: астроцитома, глиобластома, менингеома, невринома, шваннома, эпендимома, гипофизома, олигодендроглиома, медуллобластома;
- Бронхиальные и средостенные опухоли:
- Опухоли бронхов:
- Формы мелкоклеточного рака легких (Small cell lung cancers - SCLC): овсяно-клеточный рак легких, промежуточноклеточный рак, комбинированный овсяно-клеточный рак легких;
- Формы немелкоклеточного рака легких (НМКРЛ): ПКР, карцинома веретенообразных клеток, АК, бронхоальвеолярная карцинома, крупноклеточный НМКРЛ, светлоклеточный НМКРЛ;
- Мезотелиома;
- Тимома;
- Карциномы щитовидки: сосочковые, фолликулярные, анапластические, медуллярные;
- Опухоли желудочно-кишечного тракта:
- Формы рака пищевода: ПКР, АК, анапластическая карциноидная
саркома;
- Формы рака желудка: АК, аденочешуйчатый, анапластический;
- Формы колоректального рака: АК, в том числе наследственные формы АК, карциноид, саркома;
- Формы анального рака: ПКР, формы переходно-клеточного эпителиального рака, АК, базально-клеточный рак;
- Формы рака поджелудочной железы: АК, в том числе формы рака протоков и ацинозного рака, папиллярный, аденочешуйчатый, недифференцированный, опухоли эндокринной части поджелудочной железы;
- Печеночно-клеточная карцинома, холангиокарцинома, ангиосаркома, злокачественная опухоль из эмбриональных печеночных клеток;
- Билиарная карцинома: АС, ПКР, мелкоклеточная, недифференцированная;
- Формы желудочно-кишечного стромального рака;
- Гинекологические формы рака:
- Формы рака груди: АК, в том числе инвазивные формы рака протоков, долей и медулярная форма рака, тубулярная и коллоидная формы рака, карцинома Педжета, воспалительная карцинома, карцинома протоков и долей in situ;
- Формы рака яичника: опухоли эпителия, опухоли стромы, опухоли зародышевых клеток, недифференцированные опухоли;
- Формы рака шейки матки: ПКР, АК, смешанные и недифференцированные опухоли;
- Формы рака эндометрия: АК, ПКР, смешанные, недифференцированные опухоли;
- Формы рака внешних половых органов: ПКР, АК;
- Формы рака влагалища: ПКР, АК;
- Формы рака мочевых путей и семенников:
- Формы рака семенников: семинома;
- Несеминоматозные опухоли половых клеток: тератома, эмбриональная клеточная карцинома, хориокарцинома, опухоль желточного мешка, смешанная форма, опухоли клеток Сертоли-Лейдинга;
- Формы опухолей половых клеток вне половых желез;
- Формы рака простаты: АК, мелкоклеточный, ПКР;
- Формы почечно-клеточного рака: АК, включая светлоклеточную, папиллярную и хромофобную карциному, наследуемые формы (например, синдром Фон Гиппелялиндау), нефробластома;
- Формы рака мочевого пузыря: формы переходно-клеточного рака (уротелиального), ПКР, АК;
- Формы рака уретры: ПКР, формы переходно-клеточного рака, АК;
- Формы рака полового члена: ПКР;
- Опухоли эндокринной ткани:
- Формы рака щитовидной железы: папиллярная, фолликулярная, анапластическая, медуллярная формы карциномы, включая синдром мышечной скованности;
- Опухоли эндокринной части поджелудочной железы;
- Карциноиды;
- Феохромоцитома.
В большинстве случаев, признаки устойчивых форм рака относятся к формам рака из следующей группы:
- Формы рака головы и шеи: ПКР, АК, формы переходно-клеточного рака, мукоэпидермоидные формы рака, недифференцированные карциномы;
- Формы рака толстой и прямой кишки, метастатические или неметастатические: АК, включая наследуемые формы АК, карциноид, саркома;
- Формы рака поджелудочной железы: АК, включая рак протоков и ацинозный рак, папиллярный, аденочешуйчатый, недифференцированный, опухоли эндокринной части поджелудочной железы;
- Формы рака груди, метастатические или неметастатические: АК, включая инвазивные формы рака протоков, долей и медулярная форма рака, тубулярная, коллоидная формы рака, карцинома Педжета, воспалительная карцинома, карцинома протоков и долей in situ;
- Формы рака простаты: АК, мелкоклеточный рак, ПКР;
- Формы немелкоклеточного рака легких (НМКРЛ): ПКР, веретеноклеточная карцинома, АК, бронхоальвеолярная карцинома, крупноклеточный НМКРЛ, светлоклеточный НМКРЛ.
В рамках настоящего изобретения следующие классы химиотерапевтических агентов (2) представляют особый интерес, хотя ими перечень не ограничивается:
- Синтетические низкомолекулярные антагонисты рецептора VEGF,
- Низкомолекулярные антагонисты рецептора фактора роста (GF);
- Ингибиторы рецепторов EGF и/или HER2, и/или рецептора VEGF, и/или рецепторов интегрина, или каких-либо других рецепторов протеин тирозинкиназы, которые нельзя классифицировать в качестве синтетических низкомолекулярных соединений;
- Низкомолекулярные ингибиторы Polo-подобной киназы-1 (PLK-1)
- Низкомолекулярные ингибиторы метаболических путей Ras/Raf/мАРК или PI3K/AKT или каких-либо других серин/треониновые киназ.
- Ингибиторы метаболических путей Ras/Raf/мАРК или PI3K/AKT или каких-либо других серин/треониновые киназ, которые нельзя классифицировать в качестве синтетических низкомолекулярных соединений;
- Ингибиторы, направленные на рецептор EGF, и/или рецептор VEGF, и/или рецепторы интегрина, или какие-либо другие рецепторы протеин-тирозинкиназы, которые являются синтетически получаемыми антителами, фрагментами антител или гибридными белками,
- Ингибиторы, влияющие на оборот VEGF и являющиеся антителами, получаемыми синтетическим путем, фрагментами антител или гибридными белками,
- Ингибиторы, направленные на рецептор EGF и/или фактор роста IGF1 или IGF2, которые являются синтетически получаемыми объектами или антителами, фрагментами антител или гибридными белками,
- Соединения, которые взаимодействуют с нуклеиновыми кислотами, и которые классифицируют в качестве алкилирующих агентов или соединений платины,
- Соединения, которые взаимодействуют с нуклеиновыми кислотами, и которые классифицируют в качестве антрациклинов, интеркаляторов ДНК или агентов, перекрестно связывающих ДНК,
- Антиметаболиты,
- Природные, полусинтетические или синтетические антибиотики типа блеомицина (группы антибиотиков типа блеомицина),
- Ингибиторы ДНК-транскрибирующих ферментов, особенно ингибиторов топоизомеразы I или топоизомеразы II,
- Хроматин-модифицирующие агенты,
- Ингибиторы митоза, анти-митотические агенты или ингибиторы клеточного цикла,
- Соединения, взаимодействующие с тубулином или связывающие его,
- Соединения, ингибирующие митотические кинезины или другие двигательные белки, включая, но, не ограничиваясь ими, Eg5, CENP-E, MCAK, Kid, MKLP-1,
- ингибиторов протеосом,
- ингибиторов белков теплового шока,
- соединений, нацеливающих анти-апоптическую функцию Bcl-2, Bcl-x1 и других молекул,
- стероидов,
- цитокинов, гипоксия-избирательных цитокинов, ингибиторов цитокинов, лимфокинов, антител, направленных против цитокинов или стратегий пероральной и парентеральной индукции устойчивости,
- поддерживающих агентов,
- противовоспалительных соединений, например, ингибиторов СОХ-2, но не только из них,
- агентов, чувствительных к химическому действию облучения, или предохраняющих от него,
- ингибиторов белков теплового шока,
- соединений, нацеливающих анти-апоптическую функцию Bcl-2, Bcl-x1 и других подобных молекул,
- ферментов-гормонов, антагонистов гормонов, или ингибиторов гормонов, или ингибиторов биосинтеза стероидов,
- стероидов,
- цитокинов, гипоксия-избирательных цитокинов, ингибиторов цитокинов, лимфокинов, антител, направленных против цитокинов или стратегий пероральной и парентеральной индукции устойчивости,
- поддерживающих агентов,
- противовоспалительных соединений, например, ингибиторов СОХ-2, но не только из них,
- агентов, чувствительных к химическому действию облучения, или предохраняющих от него,
- фотохимически активированных лекарственных средств,
- синтетических поли- и олигонуклеотидов,
- других химиотерапевтических природных, полусинтетических или синтетических терапевтических агентов, например, цитотоксических антибиотиков, антител, нацеливающихся на молекулы на поверхности раковых клеток, антител, нацеливающих факторы роста или их рецепторы, ингибиторов металлопротеиназ, ингибиторов онкогенов, ингибиторов генной транскрипции, или трансляции РНК, или экспрессии белка, или комплексов редкоземельных элементов.
В другом предпочтительном варианте осуществления настоящего изобретения химиотерапевтический агент (2) выбран из группы, включающей низкомолекулярный антагонист рецептора VEGF, например, ватаналиб (РТК-787/ZK222584), SU-5416, SU-6668, SU-11248, SU-14813, AZD-6474, AZD-2171, СР-547632, CEP-7055, AG-013736, IM-842 или GW-786034, двойного действия антагонист EGFR/HER2, например, гефитиниб, эрлотиниб, HKI-272, CI-1033 или GW-2016, антагонист EGFR, например, пресса (ZD-1839), тарцева (OSI-774), PKI-166, ЕКВ-569 или герцептин, антагонист митоген-активированной протеин-киназы, например, BAY-43-9006 или BAY-57-9006, антагонист рецептора протеин-киназы, которые не могут быть классифицированы в качестве синтетических низкомолекулярных ингибиторов, например, атразентан, ритуксимаб, цетуксимаб, продукт Avastin™ (бевацизумаб), биватузумаб мертансин, IMC-1C11, эрбитукс (С-225), DC-101, EMD-72000, витаксин, имтиниб, ингибитор протеин-тирозинкиназы, который является гибридным белком, например, VEGFtrap, алкилирующий агент или соединение платины, например, мелфалан, циклофосфамид, оксазафосфорин, цисплатин, карбоплатин, оксалиплатин, санраплатин, тетраплатин, ипроплатин, митомицин, стрептозоцин, кармустин (BCNU), ломустин (CCNU), бусульфан, ифосфамид, стрептозоцин, тиотепа, хлорамбуцил, азотистый иприт, например, меклоретамин, соединение этиленимина, алкилсульфонат, даунорубицин, доксорубицин (адриамицин), липосомальный доксорубицин (доксил), эпирубицин, идарубицин, митоксантрон, амсакрин, дактиномицин, дистамицин или его производные, нетропсин, пибензимол, митомицин, СС-1065, дуокармицин, митрамицин, хромомицин, оливомицин, фталанилид, например, пропамидин или стилбамидин, антрамицин, азиридин, нитрозомочевина или ее производное, аналог пиримидина или пурина, или антагонист, или ингибитор нуклеозиддифосфатредуктазы, например, цитарабин, 5-фторурацил (5-ФУ), пеметрексед, тегафур/урацил, азотистоипритовое производное урацила, флударабин, гемцитабин, капецитабин, меркаптопурин, кладрибин, тиогуанин, метотрексат, пентостатин, гидроксимочевина, или фолиевая кислота, флеомицин, блеомицин или его производное или его соль, CHPP, BZPP, MTPP, BAPP, либломицин, акридин или его производное, рифамицин, актиномицин, адрамицин, камптотецин, например, иринотекан (камптосар) или топотекан, амсакрин или его аналог, трициклический карбоксамид, ингибитор гистондеацетилазы, например, SAHA, MD-275, трихостатин A, CBHA, LAQ824 или вальпроевая кислота, противораковые лекарственные средства растительного происхождения, например, паклитаксел (таксол), доцетаксел или таксотере, алкалоид винке, например, навелбин, винбластин, винкристин, виндезин или винорелбин, алкалоид траполона, например, колхицин или его производное, макролид, например, майтансин, ансамитоцин или ризоксин, антимитотический пептид, например, фомопсин или доластатин, эпиподофиллотоксин или производное подофиллотоксина, например, этопозид или тенипозид, стеганацин, производное антимитотического карбамата, например, комбретастатин или амфетинил, прокарбазин, ингибитор протеасом, например, бортезомиб, фермент, например, аспарагиназа, пэгилированная аспарагиназа (пэгаспаргаза) или ингибитор тимидинфосфорилазы, гестаген или эстроген, например, эстрамустин (Т-66) или мегестрол, анти-андроген, например, флутамид, казодекс, анандрон или кипротерон ацетат, ингибитор ароматазы, например, аминоглутетимид, анастрозол, форместан или лепрозол, аналог GNrH, например, лейпрорелин, бусерелин, госерелин или трипторелин, анти-эстроген, например, тамоксифен или его цитрат, дролоксифен, триоксифен, ралоксифен или зиндоксифен, производное 17β-эстрадиола, например, ICI 164,384 или ICI 182,780, аминоглутетимид, форместан, фадрозол, финастерид, кетоконазол, антагонист LH-RH, например, лейпролид, стероид, например, преднизон, преднизолон, метилпреднизолон, дексаметазон, буденозид, флуокортолон или триамцинолон, интерферон, например, интерферон β, интерлейкин, например, ИЛ-10 или ИЛ-12, анти-TNFα антитело, например, этанерцепт, TNF-α (тазонермин) иммуномодулирующее лекарственное средство, например, талидомид, его R- и S-энантиомеры и их производные, или ревимид (СС-5013), антагонист лейкотриена, митомицин C, азиридохинон, например, BMY-42355, AZQ или EO-9, 2-нитроимидазол, например, мизонидазол, NLP-1 или NLA-1, нитроакридин, нитрохинолин, нитропиразолоакридин, ароматические нитро-соединения «двойного действия», например, RSU-1069 или RB-6145, CB-1954, N-оксид азотистого иприта, например, нитромин, комплекс азотистого иприта с металлом, анти-CD3 или анти-CD25 антитело, агент индукции устойчивости, бифосфонат или его производное, например минодроновая кислота или ее производные (YM-529, Ono-5920, YH-529), моногидрат золедроновой кислоты, натрий ибандронат гидрат или клодронат динатриевая соль, нитроимидазол, например, метронидазол, мизонидазол, бензнидазол или ниморазол, нитроарильное соединение, например, RSU-1069, нитроксил или N-оксид, например, SR-4233, галогенированный аналог пиримидина, например, бромдезоксиуридин, иоддезоксиуридин, тиофосфат, например, WR-2721, фотохимически активируемое лекарственное средство, например, порфимер, фотофрин, производное бензопорфирина, производное феофорбида, мероцианин 540 (МС-540) или этиопорпурин олова, ant-матричная или антисмысловая РНК или ДНК, например, облимерсен, нестероидное противовоспалительное лекарственное средство, например, ацетилсалициловая кислота, месалазин, ибупрофен, напроксен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, миропрофен, тиоксапрофен, супрофен, алминопрофен, тиапрофеновая кислота, флупрофен, индометацин, сулиндак, толметин, зомепирак, набуметон, диклофенак, фенклофенак, алклофенак, бромфенак, ибуфенак, ацеклофенак, ацеметацин, фентиазак, клиданак, этодолак, окспинак, мефенаминовая кислота, меклофенамовая кислота, флуфенамовая кислота, нифлуминовая кислота, толфенамовая кислота, дифлунизол, флуфенизол, пироксикам, теноксикам, лорноксикам, нимезулид, мелоксикам, целекоксиб, рофекоксиб или фармацевтически приемлемая соль нестероидного противовоспалительного средства, цитотоксический антибиотик, антитело, нацеливающееся на молекулы на поверхности раковых клеток, например, аполизумаб или 1D09C3, ингибитор металлопротеиназ, например, TIMP-1 или TIMP-2, цинк, ингибитор онкогенов, например, Р53 и Rb, комплекс редкоземельных элементов, например, гетероциклические комплексы лантанидов, фотохимиотерапевтический агент, например, PUVA, ингибитор комплекса фактора транскрипции ESX/DRIP130/Sur-2, ингибитор экспрессии рецептора HER-2, например, модулятор белка теплового шока HSP90 гелданамицин и его производное 17-аллиламиногелданамицин или 17-AAG, или терапевтический агент, выбранный из IM-842, тетратиомолибдата, скваламин, комбрестатин А4, TNP-470, маримастат, неовастат, бикалутамид, абареликс, ореговомаб, митумомаб, TLK-286, алемтузумаб, ибритумомаб, темозоломид, денилейкин дифтитокс, алдеслейкин, дакарбазин, флоксуридин, пликамицин, митотан, пипоброман, пликамицин, тамоксифен и тестолактон.
Например, раковые заболевания первоначально могут быть диагностированы в качестве чувствительных к гефитинибу/эрлотинибу, или может быть дан прогноз о развитии чувствительности к гефитинибу/эрлотинибу с помощью методов, описанных Lynch и др., 350, 2004, сс.2129-2139. Чувствительность к гефитинибу/эрлотинибу может прогнозироваться по наличию в опухоли мутаций EGFR, включая, например, делецию остатков с положения 747 (лизин) по положение 749 (глутаминовая кислота), объединенную с мутацией по положению 750 (аланин), делецию остатков с положения 747 (лизин) по положение 750 (аланин), замещение аргинина на лейцин по положению остатка 858, замещение глутамина на лейцин по остатку 861.
Формы рака могут быть диагностированы в качестве устойчивых к лечению обратимыми ингибиторами рецепторов EGFR и HER2, например, гефитинибом или эрлотинибом, или к лечению другими необратимыми ингибиторами, например, CI-1033, ЕКВ-569, HKI-272 или HKI-357 после начала лечения соответствующим агентом. В другом варианте формы рака можно было диагностировать в качестве устойчивых к действующим агентам, указанным выше, до начала лечения этими соединениями. Например, устойчивость опухоли к гефитинибу и/или эрлотинибу может возникнуть, например, после лечения на протяжении 6 месяцев или больше гефитинибом и/или эрлотинибом. В другом варианте устойчивость опухоли к гефитинибу и/или эрлотинибу может быть установлена раньше 6 месяцев после начала лечения гефитинибом и/или эрлотинибом. Диагностика устойчивости к гефитинибу и/или эрлотинибу может быть установлена путем мониторинга прогрессирования опухоли во время лечения гефитинибом и/или эрлотинибом. Прогрессирование опухоли может быть установлено путем сравнения состояния опухоли между двумя временными точками после начала лечения, или путем сравнения состояния опухоли между временной точкой после начала лечения и временной точкой до начала лечения гефитинибом и/или эрлотинибом. Прогрессирование опухоли можно подвергать визуальному мониторингу во время лечения гефитинибом и/или эрлотинибом, например, радиографией, например, рентгеном, сканированием методом компьютерной томографии, или другими методами, известными специалистам, включая пальпацию рака или методы мониторинга по уровням биомаркеров опухоли. Прогрессирование рака во время лечения гефитинибом и/или эрлотинибом выявляет устойчивость к гефитинибу и/или эрлотинибу. Таким образом, повышение уровней боимаркеров опухоли во время лечения гефитинибом и/или эрлотинибом выявляет устойчивость к гефитинибу и/или эрлотинибу. Выявление новых опухолей или метастазов свидетельствует о прогрессировании опухоли. Прекращение уменьшения опухоли свидетельствует о прогрессировании опухоли. Развитие опухоли выявляется, например, по увеличению размера опухоли, метастазов или по выявлению новых опухолей и/или по повышению уровней биомаркеров опухоли. Сходным образом выявляют устойчивость к другим лекарственным средствам, указанным выше.
Развитие устойчивости к лекарственным средствам, указанным выше, может подвергаться мониторингу путем тестирования наличия мутации, связанной с устойчивостью к соответствующему агенту, в циркулирующих опухолевых клетках, выделенных из системы кровообращения, или из другой жидкости тела субъекта. Например, наличие мутаций, связанных с устойчивостью к гефитинибу и/или эрлотинибу, в опухолевых клетках субъекта является показателем опухоли, устойчивой к гефитинибу и/или эрлотинибу.
В одном из вариантов осуществления настоящего изобретения опухоль субъекта несет мутации, являющиеся показателем чувствительности к гефитинибу и/или эрлотинибу, хотя опухоль устойчива к лечению гефитинибом и/или эрлотинибом. В одном из вариантов осуществления настоящего изобретения опухоль субъекта несет мутации, являющиеся показателем чувствительности к гефитинибу и/или эрлотинибу, и несет мутации, являющиеся показателем устойчивости к гефитинибу и/или эрлотинибу, например, мутацию Т790М, которая при замещении остатка метионина на остаток нативного треонина, в EGFR, например, повышает интернализацию EGFR. В одном из вариантов осуществления настоящего изобретения опухоль субъекта не несет мутаций, указывающих на чувствительность к гефитинибу и/или эрлотинибу, и действительно несет мутации, являющиеся показателем устойчивости к гефитинибу и/или эрлотинибу, например, мутацию Т790М в EGFR, например, повышенная интернализация EGFR.
При введении лекарственного средства «эффек