Вододиспергируемые пероральные, парентеральные и местные композиции для плохо растворимых в воде лекарственных препаратов, включающие улучшающие их свойства полимерные наночастицы
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к полимерным наночастицам с гидрофобным ядром и гидрофильной оболочкой, полученным из N-изопропилакриламида (NIPAAM), водорастворимых винильных производных типа винилпирролидона (ВП) или винилацетата (ВА), или водонерастворимых винильных производных типа метилметакрилата (ММА) или стирола (СТ) для специфических способов доставки, таких как пероральный и парентеральный. Полимерные наночастицы позволяют доставлять различные лекарственные средства или биологические активные агенты в рамках перорального, парентерального или местного способов введения. Благодаря реализации изобретения становится возможным формулировать в водном растворе плохо растворимые в воде лекарственные средства или биологические активные агенты или иные средства с плохой пероральной доступностью, что позволяет осуществлять доставку в системный кровоток. 6 н. и 58 з.п. ф-лы, 12 ил., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям на основе наночастиц, предназначенных для солюбилизации и инкапсулирования лекарственных средств, включающих лекарственные средства, которые плохо растворимы в воде. Более конкретно, настоящее изобретение относится к композициям, обладающим «улучшенными» свойствами, такими как мукоадгезивность, пероральная биодоступность и полифункциональное действие, при системном введении.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
За последние два десятилетия было разработано множество различных систем доставки гидрофобных и плохо растворимых в воде лекарственных средств. При разработке указанных систем основное внимание уделяли преодолению плохой доступности лекарственного средства и связанной с этим неэффективности терапии, в случае использования молекул такого типа.
Для решения указанной выше проблемы, которая ассоциирована с солюбилизацией плохо растворимых в воде лекарственных средств, были разработаны способы, описанные в патентах США NoNo. No. 5645 856 и 6096338, направленные на изготовление носителей для гидрофобных лекарственных средств и созданных на их основе фармацевтических композиций, в которых носитель включает биодоступное масло и фармацевтически приемлемый поверхностно-активный компонент для диспергирования масла in vivo при введении носителя. Используемый при этом амфифильный поверхностно-активный компонент по существу не приводит к ингибированию in vivo липолиза масла. Композиции указанного типа могут использоваться в качестве системы носителей для множества гидрофобных лекарственных средств, что приводит иногда к повышению биодоступности, в сравнении с существующими композициями таких лекарственных средств. Однако, композиции такого типа нестабильны in vivo и имеется возможность вытекания лекарственного средства из эмульсии, что может приводить к развитию неблагоприятных эффектов в организме. Кроме того, используемые поверхностно-активные вещества могут разрушать биологические мембраны, вызывая цитотоксичность. Дополнительно, при использовании таких эмульсионных систем практически невозможно осуществить направленное воздействие лекарственного вещества.
Были использованы другие носители для лекарственных средств, такие как амфифильные блок-сополимеры, которые образуют полимерные мицеллы или надмолекулярные структуры, где их гидрофобная часть формирует ядро, а гидрофильная часть формирует оболочку. В патенте США No. 5510103 описываются блок-сополимеры, содержащие гидрофильные и гидрофобные сегменты, которые формируют мицеллы и захватывают гидрофобные лекарственные средства по физическим механизмам. Гидрофильный сегмент предпочтительно представляет собой поли(этиленоксид), а гидрофобный сегмент предпочтительно представлен поли(эпсилон-бензил-L-аспартатом), и в этом случае предпочтительным лекарственным средством является Адриамицин.
В последнее время, полимерные мицеллы широко использовались в качестве носителей для доставки лекарственных средств при парентеральном введении. Мицеллярные носители для доставки лекарственных средств обладают рядом преимуществ, включающих биосовместимость, солюбилизацию гидрофобных лекарственных средств в ядре, нанометрический диапазон размеров, что облегчает выделение лекарственного носителя в сайте воспаления, сайт-специфическую доставку и т.п. Так, например, в патенте США No. 5955 509 описывается использование сополимеров поли(винил-N-гетероцикл)-b-поли(алкиленоксида) в мицеллах, содержащих фармацевтические композиции. Указанные сополимеры реагируют на изменения pH окружающей среды и могут использоваться для доставки терапевтических соединений при пониженных значениях pH. Указанные полимерные мицеллы остаются интактными при физиологических значениях pH, тогда как высвобождают свое содержимое при воздействии на них сниженного pH в окружающей среде, например, в случае опухолевой ткани.
В литературе имеются сообщения о различных амфифильных сополимерах, содержащих неионные и/или заряженные гидрофобные и гидрофильные сегменты, которые формируют мицеллы. Например, в патенте США No. 6322817 описывается инъецируемая композиция поперечно сшитых полимерных мицелл, состоящих из акриловых мономеров N-изопропилакриламида, N-винилпирролидона и ПЭГилированных моноэфиров малеиновой кислоты. По сообщениям, указанные полимерные наночастицы содержат растворенный паклитаксел и доставляют лекарственное средство в опухолевую ткань при парентеральном введении. Однако, как отмечается, указанные частицы пригодны лишь для доставки внутривенным способом. Кроме того, описанное использование акрилцианоакрилата, как одного из компонентов сополимерных мицелл, может сделать такие композиции токсичными и, соответственно, непригодными для введения in vivo.
В одном из патентов, патенте США No. 6555139, описывается способ микрофлюидизации и влажной микронизации гидрофобных лекарственных средств в сочетании с декстринами, такими как β-циклодекстрин. В патенте указывается, что способ микрофлюидизации способствует снижению среднего размера частиц слабо растворимых, но обладающих высокой проникающей способностью лекарственных средств и позволяют создавать однородную латексо-подобную микросуспензию. Смесь разбухаемого полимера и нерастворимых гидрофильных эксципиентов, гранулированных с микросуспензией, создает матрицу, которая, после уплотнения, равномерно эродирует в течение 24-часового периода. Однако, при использовании таких систем микрофлюидизации, возникают проблемы, определяемые тем, что для каждой молекулы лекарственного средства требуется одна молекула β-циклодекстрина, что ведет к необходимости вводить в организм большие количества этого соединения вместе с лекарственным средством. Кроме того, вытекание лекарственного агента из β-циклодекстрина, а также плохая биодоступность комплекса β-циклодекстрин - лекарственное средство может вызвать побочные эффекты. И, наконец, размер частиц, до 500 нм в диаметре, может стать причиной их ограниченного использования с целью доставки лекарственных средств.
В другом патенте, патенте США No. 6579519, описываются композиции неПЭГилированных pH-чувствительных и температурочувствительных сшитых полимерных мицелл, состоящих из N-изопропилакриламида, акриловой кислоты и N-винилпирролидона. Указанные частицы обладают очень ограниченной сферой применения и могут использоваться лишь для специфических целей местного введения на поверхности глаза. Это связано с тем, что показатель LCST (нижняя критическая температура растворения (НКТР)) для данных частиц ниже температуры тела и частицы агрегируют in vivo с образованием гидрофобной массы. В этой связи, указанный частицы не пригодны для введения их в системный кровоток и для направленной доставки, в том числе пероральной доставки. Другие родственные патенты включают патенты США NoNo. 6746635 и 6824791.
В другом патенте США No. 7094 810 описывается композиция, которая состоит из гидрофильного сегмента, выполненного из поли(этиленоксида), и гидрофобного сегмента, состоящего из винильных мономеров, которые содержат по меньшей мере одну боковую карбоксильную группу. Более конкретно, винильные мономеры, включенные в состав полимера, представляют собой акриловую кислоту или метакриловую кислоту, содержащие боковые карбоксильные группы, и бутил(алкил)акрилат, где указанный бутильный сегмент может быть линейно-цепочечным или разветвленным. Таким образом, гидрофобный сегмент представляет собой смесь неионизируемого бутил(алкил)- акрилата и ионизируемой (алкил)акриловой кислоты, которые контролируют гидрофобность полимера. Сообщается, что ионизируемая карбоксильная группа полимера, выходящая на поверхность частицы, отвечает за pH-чувствительность.
Несмотря на то что большинство указанных полимеров может использоваться для инъекции или для местной доставки биологически активных агентов, в настоящее время отсутствуют полифункциональные амфифильные полимеры, подходящие для пероральной доставки, за счет размера их частиц в нанодиапазоне и соответствующей мукоадгезивности. Реактивные функциональные группы на поверхности таких «быстрых» наночастиц характеризуются способностью к необязательной модификации путем ПЭГилирования, за счет присоединения лиганда или введения флуорофора для целей системной направленной доставки, что будет представлять интерес в контексте применяемых в настоящее время методов биологической диагностики, соответствующих терапевтических средств и способов визуализации. В настоящем изобретении описывается такая биодоступная при пероральном приеме быстрая полимерная система на основе наночастиц.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к поперечно сшитым полимерным наночастицам, которые могут содержать один или несколько биологически активных агентов, таких как плохо растворимые в воде лекарственные средства, которые особенно хорошо подходят для пероральной доставки, но также применимы для других способов их использования, включая инъецируемые или местные композиции.
Другим объектом настоящего изобретения является разработка способа получения полимерных наночастиц, которые могут захватывать плохо растворимые в воде лекарственные средства, по отдельности или в сочетании с другими биологически активными агентами, до максимально достижимого уровня. Полимерные наночастицы предпочтительно захватывают одного или нескольких типов лекарственных средств. Предпочтительно, полимерные наночастицы имеют средний диаметр меньше или равный 50-100 нм и менее 5% из них имеют размер более 200 нм в диаметре.
Другим объектом настоящего изобретения является разработка способа получения наночастиц, содержащих полимерные цепи с межцепьевыми сшивками, так что может контролироваться высвобождение захваченных одного или нескольких лекарственных средств и инкапсулированных в указанной наночастице.
Еще одним объектом настоящего изобретения является разработка способа получения наночастиц, содержащих включенные в них один или сочетание лекарственных препаратов, но так что при этом сохраняется возможность химического конъюгирования полиэтиленгликолевых (ПЭГ) цепей с варьирующей длиной цепи (50-8000 Да) на наружной поверхности наночастиц с реактивными фрагментами на поверхности сформированных наночастиц. ПЭГ-цепи способствуют циркуляции указанных частиц в крови в течение относительно длительного времени, после их системного введения.
Кроме того, настоящее изобретение относится к доставке в принципе водорастворимых лекарственных средств, но в случае которых пероральная доставка по какой-либо причине в настоящее время не применима, путем химического конъюгирования лекарственного средства или сочетания лекарственных средств на поверхности наночастиц, которые затем действуют в качестве носителя для абсорбции по пероральному пути доставки, так что достигается нужная биодоступность лекарственного средства.
Другой целью настоящего изобретения является использование производных акриловых соединений, полученных на основе карбоновой кислоты, амина или альдегида, или аналогичных винильных производных, по отдельности или в сочетании, в качестве мономеров, в ходе полимеризации, с тем чтобы получить наночастицы с полифункциональными характеристиками, так называемые «быстрые» наночастицы.
Еще одним объектом настоящего изобретения является разработка способа получения полимерных наночастиц, включающих плохо растворимые лекарственные средства или сочетания лекарственных средств, диспергированных в водном растворе, которые свободны от нежелательных и токсичных материалов, таких как непрореагировавшие мономеры.
Другим объектом настоящего изобретения являются разработка способа получения полимерных наночастиц, включающих плохо растворимое/ые в воде лекарственное средство или сочетания лекарственных средств, которые могут использоваться в экспериментах in vivo для целей направленной доставки максимально возможных количеств лекарственных средств в пораженный сайт и лишь незначительных количеств в другие ткани, что позволит преодолеть недостатки, ассоциированные со способами, используемыми в настоящее время. Так, например, полимеризованные мицеллярные комплексы, согласно настоящему описанию, могут быть функционализированы с использованием направленного фрагмента, такого как флуорофор, краситель, контрастное вещество, антиген, антитело, аминокислота или сахар типа глюкозамина, или родственные углеводные производные, за счет химической конъюгации с ПЭГ-цепями, ассоциированными с полимерными мицеллами, так что указанные комплексы могут быть использованы, в дополнение к указанным пероральным композициям, в рамках терапевтических и диагностических процедур и методов визуализации, в случае которых требуется направленная доставка в конкретные типы клеток или тканей.
Еще одним объектом настоящего изобретение является маскирование нативного вкуса некоторых лекарственных средств, включенных в полимерные мицеллы, путем химического конъюгирования агентов, модифицирующих вкус, с поверхностью мицелл, так что получаемая при этом композиция имеет более приемлемый вкус при пероральном приеме.
Еще одним объектом настоящего изобретения является разработка способа использования полимерных наночастиц, включающих плохо растворимые в воде одно или сочетания лекарственных средств, полученных по способу настоящего изобретения, для лечения состояний, возникающих в случае нежелательных патогенных и анатомических состояний.
Согласно настоящему изобретению, получают медицинские композиции, которые включают полимерные наночастицы, предпочтительно обладающие средним размером менее 100 нм в диаметре, которые способны захватывать по меньшей мере одно плохо растворимое в воде гидрофобное лекарственное средство или его сочетание с одним или несколькими дополнительными лекарственными средствами. Указанные амфифильные наночастицы могут быть получены из поперечно сшитых полимеров, которые в основном состоят из трех следующих компонентов, добавляемых в качестве мономеров в специфических молярных соотношениях: (1) N-изопропилакриламид (NIPAAM); плюс (2) либо водорастворимое винильное соединение типа винилацетата (ВА), либо винилпирролидон (ВП), так что создается более гидрофильная оболочка у образуемых частиц, или добавляется водонерастворимое винильное производное, такое как стирол (ST) или метилметакрилат (MMA), так что получают более гидрофобное ядро у частиц, плюс (3) акриловая кислота (АК), которая обеспечивает наличие реактивных функциональных групп на поверхности частиц. Поверхность наночастиц может быть необязательно функционализирована с использованием реактивных функциональных групп, обеспечиваемых за счет АК, включая способы ПЭГилирования для достижения длительной циркуляции в крови, или за счет добавления других локализованных на поверхности реактивных групп, которые могут использоваться для направленной доставки в ткани in vivo терапевтических, диагностических и визуализирующих средств.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
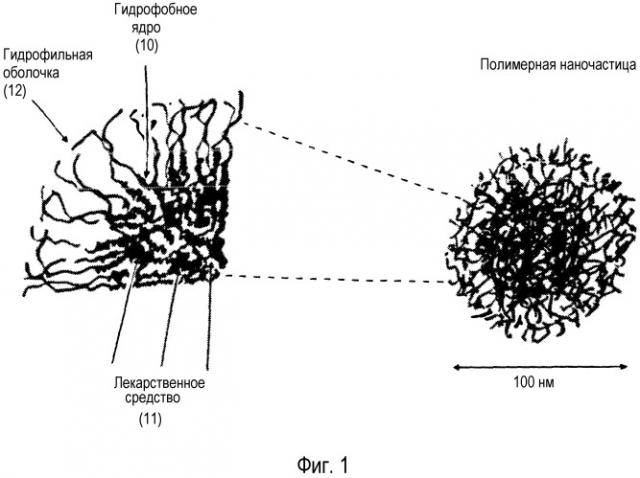
На фиг. 1 приведена иллюстрация наночастицы, содержащей гидрофобное ядро (10), состоящее из гидрофобных частей полимера с захваченным в него лекарственным средством (11), гидрофильных частей, образующих гидрофильную оболочку (12), которая направлена в сторону водной среды. Наночастицы имеют размер менее 10 нм и могут включать одну или несколько молекул лекарственных средств или других биологически активных агентов.
На фиг. 2 приведена иллюстрация трех примеров плохо растворимых в воде лекарственных средств, солюбилизация которых может быть достигнута при их включении в полимерные наночастицы согласно настоящему изобретению. Свободный паклитаксел (таксол) (А), свободный рапамицин (С) и свободный рифампицин (Е) практически не растворимы в воде, что следует из мутности раствора и видимых взвешенных частиц каждого из лекарственных средств. Тогда как эквивалентные количества инкапсулированного в наночастицы паклитаксела (B), инкапсулированного в наночастицы рапамицина (D) и инкапсулированного в наночастицы рифампицина (F) образуют прозрачные растворы в воде.
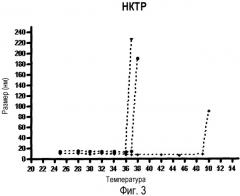
На фиг. 3 показано значение нижней критической температуры растворения (НКТР (LCST)) в виде функции процентного соотношения веса к компонентам и, в частности, молярная пропорция NIPAAM в наночастицах. В приведенном на иллюстрации примере показаны три разных композиции наночастиц, каждая из которых характеризуется определенной, отличной от других, молярной пропорцией NIPAAM (NP), винилпирролидона (ВП) и акриловой кислоты (АК), включенных в полимерные наночастицы. Средний размер наночастиц (нм) определяют с использованием метода динамического рассеяния света и ряда других методик. Композиции с молярной пропорцией NIPAAM 90% имеют показатель НКТР (LCST) ниже, чем температура тела, тогда как композиции с молярной пропорцией NIPAAM 60% имеют показатель НКТР (LCST) выше температуры тела.
На фиг. 4а показан снимок, полученный методом трансмиссионной электронной микроскопии (ТЭМ) NIPAAM/ВП/АК полимерных наночастиц (молярные соотношения 60:20:20), которые имеют средний диаметр 50 нм или меньше (в нижней правой части чертежа приведена иллюстрация по шкале 100 нм). На фиг. 4b приведен ТЭМ-снимок с NIPAAM/MMA/АК полимерными наночастицами (молярные соотношения 60:20:20), которые имеют средний диаметр 50 нм или меньше (в нижней правой части чертежа приведена иллюстрация по шкале 500 нм). Наблюдается минимальная полидисперсия.
На фиг. 5a-c проиллюстрирован факт отсутствия видимой токсичности in vivo при пероральном введении пустых (со свободным пространством) полимерных наночастиц. Используют два типа перорально доставляемых «пустых» наночастиц: NIPAAM/ВП/АК с молярными соотношениями 60:20:20 (обозначены как NVA622) и NIPAAM/MMA/АК с молярными соотношениями 60:20:20 (обозначены как NMA622). Мышам в группах, включающих по четыре животных CD1 дикого типа (два самца, две самки), вводят в дозе 500 мг/кг пустые NVA622 или пустые NMA622 наночастицы в 500 мкл воды, в течение пяти последовательных дней в неделю и в течение двух недель. В ходе всего процесса и в верхней точке введения пустых наночастиц у животных не отмечается снижения веса, бихевиоральных аномалий или других аномальных особенностей. Не наблюдалось также выраженных (макроскопических) проявлений токсичности у мышей, которым вводили либо пустые NVA622, либо пустые NMA622 наночастицы.
На фиг. 6 проиллюстрирована жизнеспособность in vitro клеток в тестах (с использованием бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия, или MTT), проведенных с полимерными наночастицами (паклитаксел) (нанопаклитаксел), в сравнении со свободным паклитакселом. В указанном проиллюстрированном примере для инкапсулирования паклитаксела были использованы NIPAAM/ВП/АК полимерные наночастицы с молярным соотношением 60:20:20. Три клеточных линии клеток рака поджелудочной железы человека (XPA-1, BxPC3 и PANC-1) инкубируют с возрастающими концентрациями (1, 10, 20, 50 и 100 нм) либо свободного паклитаксела (черные прямоугольники), либо с эквивалентным количеством нанопаклитаксела (серые прямоугольники) в течение 48 часов. В каждый из вариантов включают в качестве контроля свободные полимерные наночастицы, соответствующие тому количеству, которое требуется для инкапсулирования указанной дозы нанопаклитаксела (белые прямоугольники) и растворитель (диметилсульфоксид, ДМСО) (синие прямоугольники), соответствующий тому количеству, которое требуется для растворения указанной дозы свободного паклитаксела. Нанопаклитаксел (серые прямоугольники) демонстрирует сравнимую цитотоксичность во всех клеточных линиях in vitro, что и свободный паклитаксел (черные прямоугольники). Таким образом, наноинкапсулирование лекарственного средства не ассоциировано с потерей активности лекарственного средства. И при этом, как это ожидалось, введение одного свободного полимера не демонстрирует какой-либо значительной цитотоксичности в сравнении с базовым контрольным ростом клеток (точка 0 нм). Все тесты проводились в тройном повторе и на диаграмме показаны значения стандартного отклонения.
На фиг. 7 проиллюстрирована жизнеспособность клеток in vitro (MTT) в тестах, проводимых для демонстрации синергических эффектов полимерных наночастиц с инкапсулированным паклитакселом (нанопаклитаксел) и полимерных наночастиц с инкапсулированым куркумином (нанокуркумин). Три клеточных линии рака поджелудочной железы человека (XPA-1, BxPC3 и PANC-1) инкубируют с возрастающими концентрациями (1, 2, 4, 6, 8 и 10 нм) либо свободного паклитаксела (черные прямоугольники), либо с эквивалентным количеством нанопаклитаксела (белые прямоугольники) в течение 48 часов. Для тестирования наличия терапевтической синергии с куркумином, клетки также инкубируют либо со свободным куркумином (15 мкМ) плюс свободный паклитаксел (серые прямоугольники), либо с эквивалентным количеством нанокуркумина (15 мкм) плюс нанопаклитаксел (синие прямоугольники). Как показано на иллюстрации, сочетание нанопаклитаксела и нанокуркумина демонстрирует повышенную цитотоксичность, чем свободный паклитаксел или нанопаклитаксел, каждый из них, в любой данной дозе паклитаксела. Следует отметить, что, особенно при низких дозировках, используемых в случае двух клеточных линий (XPA-1 и Panc-1), сочетание нанопаклитаксела и нанокуркумина также обладает, по всей видимости, большей эффективностью, чем сочетание свободного паклитаксела и свободного куркумина, возможно в связи повышенным клеточным поступлением наноинкапсулированных соединений. При более высоких дозировках комбинированная терапия с использованием либо свободного, либо наноинкапсулированного лекарственного средства, демонстрирует, как это видно, сравнимые эффекты.
На фиг. 8 проиллюстрированы бактерицидные эффекты наночастиц с инкапсулированным рифампицином и свободным рифампицином против Mycobacterium tuberculosis (MTB). В этом эксперименте, MTB культивируют в течение двух недель без какой-либо обработки, а также с наноинкапсулированным рифампицином, свободным рифампицином и пустыми наночастицами. Отмечается стабильный рост в варианте без обработки и в случае введения пустых наночастиц, причем в последнем случае отмечается отсутствие токсичности от полимера per se. Тогда как рост MTB полностью ингибируется в случае введения наноинкапсулированного рифампицина и трубок со свободным рифампицином.
На фиг. 9 приведена иллюстрация жизнеспособности клеток in vitro (MTT тест), где указанный тест проводится с использованием водорастворимого лекарственного средства гемцитабина, конъюгированного с акриловой кислотой (АК) по ее реактивной функциональной группе на поверхности полимерной наночастицы. В отличие от плохо растворимых в воде лекарственных средств, которые инкапсулируют в составе наночастиц, водорастворимые лекарственные средства типа гемцитабина могут быть конъюгированы с поверхностью наночастицы, что придает такому соединения способность к пероральной доставке. Клеточную линию рака поджелудочной железы человека BxPC3 инкубируют с возрастающими дозировками либо свободного гемцитабина (черные прямоугольники), либо наногемцитамина (белые прямоугольники), либо свободного полимера (серые прямоугольники), либо растворителя ФБР (заштрихованный прямоугольник). Знак UT=нет обработки. После 96 часов, свободный гемцитабин и наногемцитабин демонстрируют сравнимую активность. Все тесты проводят в тройном повторе и на графике показаны средние значения и данные по стандартным отклонениям.
На фиг. 10 проиллюстрированы результаты определения уровня рапамицина в крови после пероральной доставки полимерных наночастиц. Рапамицин инкапсулируют в наночастицы, включающие повышенное процентное содержание акриловой кислоты (АК) в сополимерной композиции. Наночастицы вводят либо сами по себе, либо после проведения поверхностного ПЭГилирования. Приведены для сравнения: контроль А (рапамицин, суспендированный в воде); наночастицы с рапамицином, включающие NIPAAM:ВП:АК в соотношении 60:30:10 (обозначены как NVA631); наночастицы с рапамицином, состоящие из NIPAAM:ВП:АК в соотношении 60:20:20 (обозначены как NVA622); наночастицы с рапамицином, состоящие из NIPAAM:ВП:АК в соотношении 60:10:30 (обозначены как NVA613); и наночастицы с рапамицином, состоящие из NEPAAM:MMA:АК в соотношении 60:20:20 (обозначены как NMA622). Соответствующие ПЭГилированные наночастицы (PEG-NVA-631, PEG-NVA-622, PEG-NVA-613 и PEG-NMA-622) с инкапсулированным рапамицином показаны в виде зачерненных прямоугольников. Рапамицин вводят либо в виде свободного лекарственного средства, диспергированного в воде (15 мг/кг), либо в виде эквивалентной дозировки наноинкапсулированного рапамицина в соответствующей композиции полимерных наночастиц. В каждую группу данного исследования включают по шесть мышей дикого пита C57/B6. Уровни исследуемых лекарственных средств определяют в образцах, полученных через два часа после пероральной доставки, с использованием метода ВЭЖХ. Два типа наночастиц, каждый из которых содержит 20% молярную долю АК (NVA622 и NMA622), демонстрирует наивысшие уровни рапамицина в крови после пероральной доставки.
На фиг. 11 проиллюстрированы результаты фармакокинетического анализа (ФК) после проведения пероральной доставки наноинкапсулированного рапамицина мышам в течение 24-часового периода. Для данного исследования отбирают две полимерных наночастичных композиции, в которых были отмечены наивысшие уровни соединений в крови через 2 часа после пероральной доставки (фиг. 10): NVA622 и NMA622, которые содержат NIPAAM/ВП/АК и NEPAAM/MMA/АК в молярном соотношении 60:20:20, соответственно. В каждую группу данного исследования включают шесть мышей дикого типа C57/B6. Однократную дозу наноинкапсулированного рапамицина (эквивалентную 15 мг/кг лекарственного средства) вводят в момент времени 0 и кровь отбирают из лицевой вены путем венопунктуры через 30 минут, 2, 4, 8 и 24 часа после перорального введения. Уровни рапамицина определяют в плазме мышей методом ВЭЖХ. На графике для каждой временной точки исследования композиции наночастиц приведены средние значения полученных данных и стандартные отклонения (стрелки ошибок измерения). Наночастицы NMA622 характеризуются более высоким значением площади под кривой (AUC) в сравнении с наночастицами NVA622 (среднее значение AUC 26,949, в сравнении с 11,684, соответственно).
На фиг. 12 проиллюстрированы уровни рапамицина в центральном и периферическом венозном кровотоке через два часа после перорального введения наночастиц с инкапсулированным рапамицином. Частицы NVA622 с инкапсулированным рапамицином вводят в пероральном режиме трем мышам (доза 15 мг/кг) и уровни рапамицина измеряют в центральном венозном и периферическом венозном (лицевая вена) кровотоке через 2 часа. Уровни оказываются идентичными во всех трех независимых измерениях для двух сайтов, что соответствует равному системному распределению перорально введенного инкапсулированного в наночастицах рапамицина в системе кровообращения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании приводятся терапевтические композиции плохо растворимых в воде лекарственных средств, по отдельности или в сочетании с двумя или более лекарственными средствами, включенными в состав полимерных наночастиц. Описывается также терапевтическая композиция водорастворимых лекарственных средств, таких как гемцитабин, конъюгированных с поверхностью полимерных наночастиц. Наночастицы, после своего формирования, имеют почти сферическую форму и предпочтительно характеризуются размером по диаметру в диапазоне 50-100 нм или меньше. Наночастицы могут быть описаны как частицы мицеллярных агрегатов амфифильных и сшитых полимеров с размерами в нанодиапазоне.
Согласно настоящему изобретению, наночастицы полимерных мицелл получают в рамках методов, включающих:
(i) растворение NIPAAM и АК в воде с образованием мицелл;
(ii) добавление по меньшей мере одного соединения винильного производного, которое может быть либо водорастворимым, либо нерастворимым в воде, но где оба растворимым в указанных мицеллах и где указанное производное может быть полимеризовано в реакции свободнорадикальной полимеризации;
(iii) добавление соответствующего количества активатора и инициатора, которые представляют собой, например, тетраметилэтилендиамин (ТМЭД) и сульфат железа-аммония. В качестве активатора используют пердисульфат аммония;
(iv) добавление сшивающего агента к указанному мицеллярному раствору, который предпочтительно представляет собой N,N'-метилен-бис-акриламид;
(v) полимеризацию мономеров с образованием сополимера в атмосфере инертного газа, такого как азот, при температуре 30ºC-40ºC в течение 24 часов, практически до полного завершения реакции;
(vi) очистку наночастиц полученных сополимерных мицелл путем диализа в течение трех часов для удаления токсичных мономеров и других не прореагировавших материалов;
(vii) необязательную поверхностную модификацию наночастиц путем химического конъюгирования ПЭГ-амина варьирующей длины цепи (50-8000 Да) или других конъюгированных фрагментов с реактивными функциональными группами на поверхности наночастиц;
(viii) добавление одного или нескольких биологически активных агентов, которые следует встроить в сформированные полимерные наночастицы в водном растворе, или лиофилизацию пустых полимерных наночастиц до получения сухого порошка с целью будущего использования;
(ix) восстановление сухого порошка пустых полимерных наночастиц в водном растворе и добавление одного или нескольких биологически активных агентов с целью их включения в указанные полимерные наночастицы;
(x) лиофилизацию полимерных наночастиц с включенным в них лекарственным средством до получения сухого порошка; и
(xi) восстановление полимерных наночастиц с включенным в них лекарственным средством в водном растворе для дальнейшей пероральной, инъекционной или местной доставки.
Кроме NIPAAM и АК, винильные мономеры отбирают из водорастворимых винильных соединений, таких как винилацетат, 4-винилбензойная кислота, N-винилпирролидон (ВП) и N-винилпиперидон, а нерастворимые в воде амфифильные винильные соединения включают метилметакрилат (MMA), винилметакрилат, N-винилкапролактум, N-винилкарбазол и стирол.
В одном варианте осуществления настоящего изобретения, наночастицы формируют путем полимеризации мономеров в составе реакционной смеси. Композиции берут в следующих молярных соотношениях: NIPAAM, от примерно 50% до примерно 90%, и предпочтительно 60% для специфических способов доставки, таких как пероральный или парентеральный; винильный мономер типа водорастворимого ВП или водонерастворимого ММА: от примерно 10% до примерно 30%; и АК от примерно 10% до примерно 30%. Мономеры растворяют в воде и добавляют к ним пердисульфат аммония, TEMED и сульфат аммония-железа. К сшитому полимеру также добавляют N,N'-метилен-бис-акриламид. Смесь оставляют для полимеризации, предпочтительно в атмосфере инертного газа (например, азота, аргона и т.п.), при температуре, предпочтительно варьирующей от 20°C до 80°C, или более предпочтительно, от 30°C до 40°C, до завершения полимеризации. Завершение полимеризации может быть определено по снижению содержания мономеров в реакционной смеси, по результатам оценки в рамках ВЭЖХ-анализа или 1H-ЯМР винильных протонов. Раствор может быть очищен путем диализа, например, в течение 2-4 часов, с целью удаления токсичных мономеров или других не прореагировавших продуктов. В рамках Примера 1, используют NIPAAM, ВП и АК для целей получения сополимеров, характеризующихся молярными соотношениями 60:30:10, 60:20:20 и 60:10:30, с тем чтобы достичь возможной модуляции мукоадгезивности перорально вводимых наночастиц в ЖКТ, за счет варьирования доли АК в полимере. В рамках Примера 2, получают аналогичные сополимерные наночастицы, в которых ВП заменен на ММА, и в конкретном приведенном примере используемые компоненты берут в количествах, позволяющих достичь молярных пропорций в полученном продукте 60:20:20, применительно к NIPAAM, MMA и АК, соответственно. Как будет обсуждаться ниже, доля используемых мономеров также влияет на стабильность наночастиц при температуре тела.
Один вариант осуществления настоящего изобретения проиллюстрирован на фиг. 1, где показано, что наночастицы содержат гидрофобное ядро (помечено меткой 10), состоящее из гидрофобных частей полимеров с включенным в них лекарственным средством (помечено цифрой 11), тогда как гидрофильные части, формирующие гидрофильную оболочку (помечено цифрой 12), локализованы ближе к водной среде. На фиг. 1 показано также, что полимерные наночастицы предпочтительно имеют размер меньше, чем 100 нм, и могут включать одну или несколько молекул лекарственных средств или других биологически активных агентов.
В связи с наличием NIPAAM в композиции сополимера, оболочка наночастиц превращается из гидрофильной в гидрофобную структуру, при сниженных значениях критической температуры растворения (НКТР (LCST)), которая может подвергаться модуляции путем изменения доли NIPAAM в используемых мономерах, как показано на фиг. 3. Для того, чтобы указанные наночастицы были пригодны для системного введения в кровоток, наночастицы должны иметь показатель НКТР (LCST) выше температуры тела человека (примерно 37°C). С тем чтобы получить наночастицы с более высоким показателем НКТР (LCST), например, в диапазоне 45-50°C, что позволило бы осуществить системную доставку лекарственных средств и достичь стабильности наночастиц при температуре тела, требуется, чтобы компонент NIPAAM использовался в оптимальном для этого молярном соотношении 50-70%, тогда как два оставшихся мономера будут составлять оставшиеся 100%. Как отмечалось выше, в композицию могут быть также включены дополнительные мономеры или функциональные фрагменты, и это не будет влиять на показатель НКТР (LCST).
Наночастицы, приведенные в настоящем описании, могут использоваться в качестве системы для доставки лекарственных средств или, необязательно, поверхность наночастиц может быть модифицирована за счет использования соответствующих функциональных реакционных поверхностных групп (COO-) из АК для присоединения ПЭГ-аминных цепей варьирующей длины (50-8000 Да) или для химической конъюгации направляющих фрагментов типа лигандов, антител, радионуклидов, флуорофоров и контрастирующих веществ, или для добавления маскирующих вкус агентов типа аспартама. Добавление ПЭГ-аминных цепей не снижает пероральную биодоступность, характерную для лекарственного вещества, инкапсулированного в наночастицы, как видно на фиг. 10. На данном чертеже четыре независимых наночастичных композиции (NVA631, NVA622, NVA613 и NMA622) вводили мышам в пероральном режиме и уровни лекарственного средства в системном кровотоке через два часа после введения сравнивали с уровнями рапамицина, инкапсулированного в соответствующие ПЭГилированные наночастицы (ПЭГ-NVA631, ПЭГ-NVA622, ПЭГ-NVA613 и ПЭГ-NMA622). Как видно на приведенном чертеже, уровни рапамицина в крови после пероральной доставки не ПЭГилированных и ПЭГилированных наночастиц сравнимы. Для специалистов в данной области понятно, что ПЭГилирование придает наночастицам способность к длительной циркуляции в кровотоке, за счет того, что могут обходить ретикулоэндотелиальную систему (РЭС) и конструирование «РЭС-уклоняющихся» наночастиц, согласно настоящему изобретению, не ухудшает их пероральную биодоступность.
Полимерные наночастицы согласно настоящему изобретению предпочтительно содержат включенные в них лекарственные средства или другие биологически активные вещества в максимально возможном количестве. Указанные лекарственные вещества или биологически активные агенты могут представлять собой органические соединения, которые плохо растворяются в воде или вовсе не растворимы в воде, но которые легко растворяются в органических растворителях. Указанные лекарственные вещества или биологически активные агенты вносят в полимерный раствор либо в виде сухого порошка, либо в виде раствора в хлороформе, этаноле или эфире, в зависимости от растворимости лекарственного вещества в данном растворителе, с образованием оптически прозрачного раствора. Примеры таких лекарственных средств