Диспиро 1,2,4-триоксоланы как противомалярийные средства
Иллюстрации
Показать всеИзобретение относится к диспиро 1,2,4-триоксоланам формулы:
где значения R представлены в п.1 формулы изобретения. Соединения данного изобретения неожиданно обеспечивают лечение малярии однократной дозой, а также профилактическое действие против малярии и шистосомоза. 3 н. и 14 з.п. ф-лы, 6 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к композициям и способам лечения малярии. В частности данное изобретение относится к фармацевтическим композициям, содержащим диспиротриоксоланы и способам их применения и производства.
Уровень техники
Малярия представляет собой острую и часто хроническую инфекционную болезнь, происходящую в результате присутствия простейших паразитов в эритроцитах. Вызываемая одноклеточными паразитами рода Plasmodium, малярия передается от человека к человеку через укус самок комаров.
Хотя когда-то малярия была распространена в Северной Америке и умеренных областях мира, в наше время она встречается главным образом в тропических и субтропических странах. Каждый год от 400 миллионов до 600 миллионов человек заражается этой болезнью и от 1,5 миллионов до 2,7 миллионов умирает от этой болезни.
Как правило, ответственными за малярию являются четыре вида простейших паразитов Plasmodium, включая Plasmodium vivax, Plasmodium falciparum, Plasmodium malariae и Plasmodium ovale. Наиболее опасным из четырех видов и отвечающим за половину из всех клинических случаев малярии и 90% смертельных случаев от этой болезни является Plasmodium falciparum.
Передача малярии начинается, когда самка комара жалит человека, уже инфицированного малярийным паразитом. Когда инфицированный комар жалит другого человека, спорозоиты из слюны комаров переносятся в кровь, которые затем премещаются в печень. В печени спорозоиты быстро делятся, затем поступают в кровообращение, где они проникают в эритроциты. Внутри этих клеток крови мерозоиты быстро размножаются, до тех пор пока не вызывают разрыв эритроцитов, высвобождая в кровоток новую генерацию мерозоитов, которые затем заражают другие эритроциты.
Симптомы, ассоциированные с малярией, главным образом связаны с разрывом эритроцитов. Разрушение эритроцитов приводит к сбрасыванию продуктов жизнедедятельности, токсинов и других продуктов распада в кровь. Это в свою очередь вызывает сильную лихорадку, которая приводит инфицированного индивидуума к истощению и ослаблению. Более тяжелые симптомы, связанные с повторными инфекциями и/или инфекцией Plasmodium falciparum, включают анемию, тяжелые головные боли, судороги, бред и, в некоторых случаях, смерть.
Лечение малярии особенно трудно из-за способности малярийных паразитов развивать устойчивость к лекарственным препаратам. Хинин, противомалярийное средство, которое извлекают из коры южноамериканского хинного дерева, является одним из старейших и наиболее эффективных существующих фармацевтических препаратов. Недостатком хинина является то, что он действует кратковременно и не предотвращает рецидивы болезни. Более того, хинин связан с побочными явлениями в диапазоне от головокружения до глухоты.
Хлорохин является синтетическим химическим препаратом, подобным хинину. Его выбрали в качестве лекарственного средства для лечения малярии после его разработки в 1940-х годах вследствие его эффективности, легкости производства и, в общем, отсутствия побочных эффектов. Однако в течение последних десятилетий малярийные паразиты во многих областях мира стали устойчивыми к хлорохину.
Мефлохин является другим синтетическим аналогом хинина, который используют для лечения малярии. Однако малярийный паразит также выработал устойчивость к мефлохину. К тому же мефлохин связан с нежелательными побочными эффектами на центральную нервную систему у некоторых пациентов, включая галлюцинации и образные кошмарные сновидения.
Антифолатные лекарственные средства являются эффективными в отношении малярийных паразитов, действуя путем подавления их размножения. Несмотря на то, что паразиты также выработали устойчивость к антифолатным лекарственным препаратам, данные лекарственные средства еще можно эффективно использовать в комбинации с другими типами противомалярийных средств. Однако применение комбинированной терапии при лечении малярии имеет недостатки, так как является неудобным и дорогим.
Более поздние разработки для лечения малярии касаются использования пероксидной функциональной группы, как показано на примере лекарственного средства артемизинина, который содержит уникальный 1,2,4-триоксановый гетероциклический фармакофор. Полагают, что противомалярийное действие артемизинина является следствием его реакции с железом в свободных гемсодержащих молекулах малярийного паразита с образованием свободных радикалов, приводящих к разрушению клеток.
Открытие артемизинина (qinghaosy), природного эндопероксидного сесквитерпенового лактона (Meshnick et al., 1996; Vroman et al. 1999; Dhingra et al., 2000) вызвало существенную попытку объяснить его молекулярный механизм действия (Jefford, 1997; Cumming et al., 1997) и установить новые противомалярийные пероксиды (Dong и Vennerstrom, 2001). Получены многие синтетические 1,2,4-триоксаны, 1,2,4,5-тетраоксаны и другие эндопероксиды.
Хотя клинически пригодные полусинтетические производные артемизинина являются быстродействующими и сильными противомалярийными лекарственными средствами, они имеют несколько недостатков, включая рецидив, нейротоксичность, (Wesche et al., 1994) и метаболическую неустойчивость (White, 1994). Значительное число из этих соединений являются весьма активными in vitro, но большинство страдает от низкой пероральной активности (White, 1994; van Agtmael et al., 1999). Несмотря на то, что с тех пор получены многие синтетические противомалярийные 1,2,4-триоксаны (Cumming et al., 1996; Jefford, 1997), в данной области техники существует необходимость найти новые пероксидные противомалярийные средства, особенно те, которые легко синтезировать, которые не имеют нейротоксичности и обладают улучшенными фармакокинетическими свойствами, например, улучшенной стабильностью, оральной абсорбцией и т.д.
Раскрытие изобретения
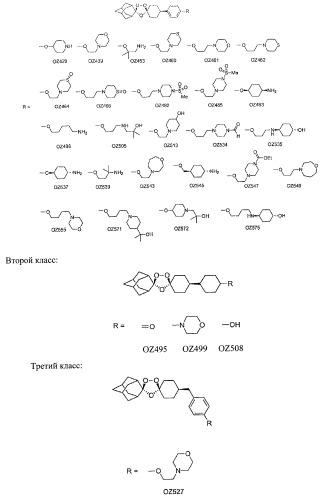
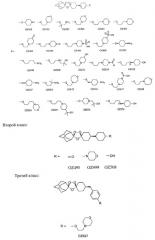
Данное изобретение описывает способ и композицию для лечения малярии с помощью диспиро 1,2,4-триоксоланов, их пролекарств и аналогов. За несколькими исключениями, предпочтительные триоксоланы данного изобретения содержат цис-8'-фенильный заместитель в циклогексильном кольце. Соединения изобретения относятся к следующим трем структурным классам:
Первый класс:
Данное изобретение включает аналоги, ахиральные, ахиральные диастереомеры, рацемические смеси, а также энантиомерные формы соединения.
Триоксоланы данного изобретения обладают отличной потенциальной активностью и эффективностью против паразитов Plasmodium. Кроме того, в противоположность ранее синтезированным триоксоланам, соединения данного изобретения демонстрируют профилактическую активность против малярии и во многих случаях обеспечивают эффективность одократной дозы. Более того, некоторые из триоксоланов пригодны для перорального применения. Кроме того, по сравнению с полусинтетическими производными артемизинина соединения данного изобретения являются структурно простыми, удобными и недорогими для синтеза и могут быть эффективно использованы отдельно или совместно с другими противомалярийными средствами.
Осуществление изобретения
Настоящее изобретение относится к разработке спиро и диспиро 1,2,4-триоксоланов для применения в профилактике и лечении малярии. Настоящее изобретение основано на неожиданном открытии, что Триоксоланы, имеющие особые заместители на одной стороне гетероцикла триоксолана, обеспечивают метаболическую и химическую стабильность кольцу триоксолана, при этом обеспечивая лучшую активность in vivo, особенно в отношении перорального применения. В отличие от ранее известных триоксоланов соединения данного изобретения обеспечивают неожиданно хорошие противомалярийные профилактические свойства, а также лечение болезни однократной дозой во многих случаях.
При использовании здесь термин "профилактически-эффективное количество" относится к концентрации соединения данного изобретения, которая является эффективной для ингибирования, уменьшения вероятности или предупреждения инфекции и последующей болезни под влиянием малярийных паразитов. Таким же образом, термин "лечебно-эффективное количество" относится к концентрации соединения, которая является эффективной для лечения малярии в плане предотвращения увеличения концентрации малярийных паразитов, снижения концентрации малярийных паразитов и/или "лечения" малярийной инфекции, т.е. на стандартной модели малярии у мышей это было бы равно выживаемости в течение 30 дней после инфекции.
В предшествующих заявках настоящие изобретатели раскрыли определенные новые четырехзамещенные Триоксоланы, имеющие следующую структурную формулу:
в которой R1, R2, R3 и R4 представляют комбинации кольцевых систем, ациклических систем и функциональных групп, которые обеспечивают достаточное стерическое затруднение около кольца триоксолана для предоставления химической и метаболической стабильности кольцу.
Соединения триоксолана настоящего изобретения неожиданно являются железо-стабильными и, как было обнаружено, дают неожиданно хорошую противомалярийную активность. Соединения данной структуры являются активными при пероральном приеме, и даже, как было обнаружено, определенные репрезентативные соединения являются лечебными при малярии в единственной дозе. Более того, предпочтительные соединения данного изобретения имеют улучшенный профиль безопасности по сравнению с ранее открытыми соединениями триоксаланов.
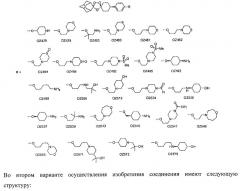
В одном варианте осуществления изобретения соединения имеют следующую общую структуру, причем R группы перечислены ниже главной структуры. "OZ" (что обозначает "озонид") является собственным обозначением этих соединений, которое будет использоваться на всем протяжении оставшейся части заявки для удобства.
Предпочтительные соединения настоящего изобретения, определенные до сих пор, включают:
- цис-Адамантан-2-спиро-3'-8'-[4'-[2'-(4'-морфолинил)этокси]фенил]-1',2',4'-триоксаспиро[4.5] декан мезилат (OZ439);
- цис;-Адамантан-2-спиро-3'-8'-[4'-[3'-(4'-морфолинил)пропокси]фенил]-1',2',4'-триоксаспиро [4.5]декан мезилат (OZ461);
- цис-Адамантан-2-спиро-3'-8'-[4'-[3'-(4'-тиоморфолинил)пропокси] фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ462);
- цис-Адамантан-2-спиро-3'-8'-[4'-[3'-(1'-оксидо-4'-морфолинил)пропокси]фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ466);
- цис-Адамантан-2-спиро-3'-8'-[4'-[3'-[4'-(метилсульфонил)-1'-пиперазинил]пропокси]фенил]-1',2',4'-триоксаспиро[4.5] декан p-тозилат (OZ482);
- цис-Адамантан-2-спиро-3'-8'-[4'-(цис-4'-аминоциклогексилокси)фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ493);
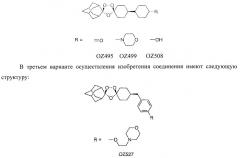
-цис-Адамантан-2-спиро-3'-8'-[4'-(4'-морфолинил)циклогексил]-1',2',4'-триоксаспиро[4,5]декан мезилат (OZ499);
- цис-Адамантан-2~спиро-3'-8'-(4'-гидроксициклогексил)-1',2',4'-триоксаспиро[4.5]декан (OZ508);
- цис-Адамантан-2-спиро-3'-8'-[[4'-[2'-(4'-морфолинил)этокси]фенил]метил]-1',2',4'-триоксаспиро [4.5] декан p-тозилат (OZ527);
- цис-Адамантан-2-спиро-3'-8'-[4'-(транс-4'-аминоциклогексилокси)фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ537);
- цис-Адамантан-2-спиро-3'-8'-[4'-(3'-амино-3'-метилбутокси)фенил]-1',2',4'-триоксаспиро [4.5] декан p-тозилат (OZ539);
- цис-Адамантан-2-спиро-3'-8'-[4'-[2'-(тетрагидро-1',4'-оксазепин-4'(5'H)-ил)этокси]фенил]-1',2',4'-триоксаспиро[4.5] декан p-тозилат(OZ543); и
- цис-Адамантан-2-спиро-3'-8'-[4'-[(транс-4'-аминоциклогексил)метокси]фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ545).
- цис-Адамантан-2-спиро-3'-8'-[4'-[4'-(4'-морфолинил)бутокси]фенил]-1',2',4'-триоксаспиро[4.5]декан мезилат (OZ555).
- цис-Адамантан-2-спиро-3'-8'-[4'-[4'-[4'-(1'-гидрокси-1'-метилэтил)-1'-пиперидинил]бутокси]фенил]-1',2',4'-триоксаспиро[4,5] декан p-тозилат(0 г571).
- цис-Адамантан-2-спиро-3'-8'-[4'-[1'-(2'-гидрокси-2'-метилпропил)-4'-пиперидинилокси] фенил]-1',2',4'триоксаспиро [4.5] декан р-тозилат (OZ5 72).
Наиболее предпочтительными из этих соединений являются OZ439, OZ466, OZ493, OZ527, OZ537, OZ539 и OZ555, так как, как было обнаружено, они являются лечебными в отношении малярии в некоторых случаях с помощью единственной дозы.
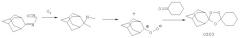
Примечательной особенностью этих спиро и диспиро 1,2,4-триоксоланов по сравнению с полусинтетическими производными артемизинина является их структурная простота и легкость синтеза. Например, диспиротриоксоланы могут быть легко синтезированы с помощью совместного озонолиза (coozonolysis) 0-метилоксимов циклоалканонов в присутствии соответствующих производных циклоалканонов согласно методу Griesbaum et al. (1997a; 1997b), как проиллюстрировано ниже для симметричного диспироциклогексилтриоксолана:
Если в этой реакции совместного озонолиза выходы низкие, их можно заметно улучшить, когда O-метилоксим и кетон являются "повернутыми". Этот новый способ предоставляет однозначно удобный метод синтеза спиро и диспиро триоксоланов. Преимущества пути эфиров оксимов по сравнению с подходом с помощью алкенов включают удобный синтез исходных веществ (эфиры оксимов против четырезамещенных алкенов), высокий выход и селективность образования желательных триоксоланов посредством правильного выбора парных субстратов реакции. Триоксоланы можно очистить с помощью кристаллизации или колоночной флэш-хроматографии. Их структуру и чистоту можно подтвердить с помощью аналитической ВЭЖХ, 1H и 13C ЯМР, ИК, температуры плавления и элементарного анализа.
Полагают, что образование триоксолана из эфира оксима и кетона является трехступенчатым процессом. Порядок выполнения начинается электрофильным присоединением озона к двойной связи оксима для образования первичного озонида. Во-вторых, очень нестабильный первичный аддукт распадается до химически активного карбонил оксида, направляемый отчасти сопутствующим вытеснением относительно стабильного метилнитрита. B-третьих, карбонил оксид подвергается [3+2] циклоприсоединению с кетоном с получением вторичного озонида или 1,2,4-триоксолана. Остается определить, является ли это
периодическим или согласованным рекомбинационным процессом.
Многие из новых диспиротриоксоланов содержит спироадамантан и могут быть синтезированы с помощью совместного озонолиза адамантанон O-метилоксима в присутствии необходимого производного циклоалканона. Предпочтительными реакционными растворителями для реакции совместного озонолиза являются углеводородные растворители, такие как пентан или циклогексан; более полярные растворители имеют склонность к уменьшению выхода реакции. Когда кетоны не являются легко растворимыми в пентане или циклогексане, можно использовать смешанный растворитель (пентан/метиленхлорид) или только метиленхлорид. Несколько факторов влияют на отношение эфира оксима к кетону. В некоторых реакциях, для того, чтобы избежать образования дипероксида (1,2,4,5-тетраоксан), предотвратить образование диозонида из дикетонов и способствовать реакции с легко растворимыми в петане кетонами, используется избыток кетона (2:1). Чаще всего в стадии получения при синтезе, и особенно в случаях, когда кетоны не являются легко растворимыми в пентане, дорогими или трудными для удаления в реакции обработки, можно использовать отношение кетона к эфиру оксима 1:1. В крупномасштабном синтезе триоксоланов может быть использован 1,5-кратный избыток эфира оксима для достижения более высоких концентраций кетонов в желательном продукте триоксоланов, не вызывая проблем очистки.
Композиции диспиро триоксолана настоящего изобретения в целом можно использовать для профилактики и лечения малярии. Композиции триоксолана настоящего изобретения вводят вместе с фармацевтически приемлемым носителем. Для этой цели в большинстве случаев можно использовать любой фармацевтически приемлемый носитель, при условии, что носитель не затрагивает значительно стабильность или биодоступность соединения триоксолана данного изобретения.
Триоксоланы данного изобретения можно применять в любой эффективной фармацевтически приемлемой форме для теплокровных животных, включая человека и других животных, например, в форме для местного использования, форме для промывания, оральной форме, в форме суппозитория, парентеральной или инфузионной лекарственных формах, как местную, щечную (буккальную), подъязычную или в форме назального спрея или любым другим способом, эффективным для доставки веществ. Путь введения предпочтительно разрабатывают с целью оптимизировать доставку и/или локализацию препаратов в целевых клетках.
В дополнение к активным соединениям, то есть триоксоланам, фармацевтические композиции данного изобретения могут содержать подходящие эксципиенты и вспомогательные вещества, которые содействуют переработке активного соединения в препараты, которые можно использовать фармацевтически. Лекарственные формы для орального применения включают таблетки, капсулы и гранулы. Препараты, которые могут быть введены ректально, включают суппозитории. Препараты, которые можно вводить ректально, включают суппозитории. Другие лекарственные формы включают подходящие растворы для парентерального или орального применения, и композиции, которые могут быть введены щечным или подъязычным способом.
Фармацевтические препараты настоящего изобретения изготавливают способом, который хорошо известен в данной области техники. Например, фармацевтические препараты могут быть сделаны с помощью обычного процесса смешивания, гранулирования, изготовления драже, растворения, лиофилизации. Процессы, которые используются, в конечном счете, зависят от физических свойств используемого активного ингредиента.
Подходящими эксципиентами являются в частности такие наполнители, как сахара, например, лактоза или сахароза, маннитол или сорбитол, препараты целлюлозы и/или фосфаты кальция, например, трикальцийфосфат или вторичный кислый фосфат кальция, а также связующие вещества, такие как крахмал, паста, с использованием, например, кукурузного крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала, желатина, трагакантовой камеди, метилцеллюлозы, гидроксипропилметилцеллюлозы, натрий карбоксиметилцеллюлозы и/или поливинил пирролидона. При желании можно добавить вещества для улучшения распадаемости таблеток, такие как вышеупомянутые крахмалы, а также карбоксиметил крахмал, поперечно связанный поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Вспомогательными средствами являются вещества, регулирующие текучесть, и смазочные вещества, например, такие как кремнезем, тальк, стеариновая кислота или их соли, такие как стеарат магния или стеарат кальция и/или полиэтиленгликоль. Лекарственные формы для перорального применения могут иметь подходящие покрытия, которые, если желательно, могут быть устойчивыми к желудочным сокам.
Для этой цели можно использовать концентрированные растворы сахаров, которые необязательно могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или титан диоксид, лакирующие растворы и подходящие органические растворители или смеси растворителей. Например, для получения покрытий, устойчивых к желудочным сокам, к покрытиям для таблеток можно добавить растворы подходящих препаратов целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы, а для распознавания или для того, чтобы отличить разные комбинации доз соединения - красители и пигменты.
Другие фармацевтические препараты, которые можно использовать перорально, включают вставные капсулы, сделанные из желатина, а также мягкие, герметичные капсулы, сделанные из желатина и пластифицирующей добавки, такой как глицерин или сорбитол. Вставные капсулы могут содержать активные соединения в форме гранул, которые могут быть смешаны с наполнителями, такими как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния и, необязательно, стабилизирующими веществами. В мягких капсулах активные соединения предпочтительно являются растворенными или суспендированными в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. В дополнение могут быть добавлены стабилизирующие вещества. Возможные фармацевтические препараты, которые можно использовать ректально, включают, например, суппозитории, которые состоят из комбинации активных соединений с основой суппозитория. Подходящими основами для суппозитория являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие спирты. Кроме того, также возможно испльзовать желатиновые ректальные капсулы, которые состоят из комбинации активного соединения с основой. Возможный материал для основы включает, например, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды.
Композиции, подходящие для парентерального введения, включают водные растворы активных соединений в водорастворимой форме или в форме, диспергируемой в воде. Кроме того, суспензии активных соединений можно использовать в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, например, кунжутное масло, или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, включая, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Такие композиции также могут включать вспомогательные средства, такие как консервирующие, увлажняющие, эмульгирующие и распыляющие вещества. Также композиции можно стерилизовать, например, с помощью фильтрования через фильтр, удерживающий бактерии, или посредством включения стерилизующих средств в композиции. Также композиции можно изготовить в форме стерильных твердых композиций, которые можно растворить или суспендировать в стерильной воде, физиологическом растворе или другой среде для инъекций перед применением.
В дополнение к введению с помощью обычных носителей активные ингредиенты можно вводить с помощью целого ряда специализированных способов доставки лекарственных препаратов, которые известны специалистам в данной области техники, таких, как портативные инфузионные дозаторы.
Композиции триоксолана настоящего изобретения вводят вместе с фармацевтически подходящим носителем в количестве, достаточном для предотвращения малярийной инфекции и/или лечения активной инфекции. Соединения триоксолана данного изобретения имеют очень низкую токсичность и низкую степень побочных эффектов даже в высоких дозах. Предел дозирования композиций триоксолана будет изменяться в зависимости от некоторого количества факторов, таких как, используют ли их для профилактики или лечения активной инфекции, способа введения, режима дозирования и т.д. В большинстве случаев терапевтическая доза триоксолана может находиться в пределах примерно 0,1-1000 мг/кг/день, доза примерно между 1-100 мг/кг/день является предпочтительной. Вышеупомянутые дозы могут быть введены как однократная доза или могут быть поделены на многократные дозы для введения. Для однократного дозирования возможный предел дозирования составляет около 0,5-5,0 мг/кг. Однако этот предел дозирования может продолжаться значительно выше.
Композиции триоксолана могут быть введены от одного до нескольких раз ежедневно. Для предотвращения малярии, обычный режим дозирования может быть, например (отличным от режима для лечения однократной дозой), 2,0-1000 мг/кг еженедельно, начиная за 1-2 недели до подвергания воздействию малярии до 1-2 недель после воздействия.
Спиро и диспиро триоксоланы данного изобретения могут быть введены в форме любой фармацевтически эффективной соли. Такие соли хорошо известны в данной области техники и включают, но не ограничиваются этим, такие соли, как ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, сульфонат камфары, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глютамат, бикарбонат, р-толуол-сульфонат и ундеканоат. Предпочтительными солями являются соли, которые увеличивают биодоступность соединений триоксолана. Это будет зависеть от некоторого количества факторов, включая химическую структуру триоксолана, носитель, с которым он объединен, способ введения и т.д.
Как правило, предпочтительным является введение соединений настоящего изобретения, так же как и других противомалярийных средств, как части комбинированной терапии для того, чтобы предотвратить резистентность. Преимущества такой комбинированной терапии при лечении малярии хорошо известны в данной области техники. Комбинированная терапия с противомалярийными средствами представляет собой одновременное применение двух или более кровяных шизонтоцидных лекарственных препаратов с независимыми механизмами действия и разными биохимическими мишенями у паразита. Концепция комбинированной терапии основывается на синергическом или дополнительном потенциале двух или более лекарственных препаратов, для того, чтобы улучшить терапевтическую эффективность и также избежать развития резистентности к отдельным компонентам комбинации. Примеры современных комбинаций противомалярийных лекарственных препаратов включают комбинации артемизинина с хлорохином и мефлохином и комбинации на основе хинина с тетрациклином и клиндамицином. Предполагается, что триоксоланы настоящего изобретения будут вводиться в комбинации со многими другими противомалярийными средствами включая, но, не ограничиваясь этим, артеметер, хлорохин, мефлохин, пипераквин и пиронаридин.
Обнаружено, что спиро и диспиро триоксоланы данного изобретения являются эффективными при лечении шистосомоза. Шистосомоз занимает второе место после малярии в социально-экономическом отношении и в аспекте здравоохранения в тропических и субтропических областях. Данное заболевание является эндемическим в 74 развивающихся странах и приводит к заражению более чем 200 миллионов человек в сельских земледельческих и пригородных районах. По оценкам 500-600 миллионов человек во всем мире находятся под угрозой заболевания.
Основные формы шистосомоза у человека вызывают пять видов передающихся через воду плоских червей, или кровяных сосальщиков, называемых шистосомами. Одним из этих видов является Schistosoma mansoni, который распространен в 53 странах в Африке, в зоне Восточного Средиземноморья, в зоне Карибского моря и в Южной Америке. Паразиты попадают в тело через контакт с инфицированной поверхностью воды, главным образом среди людей, занятых в сельском хозяйстве и рыболовстве. Паразиты обычно заражают хозяина на стадии церкарии или стадии личинки. Внутри хозяина церкарии развиваются во взрослых особей или шистосомы.
Современные виды лечения шистосомоза главным образом фокусируются на профилактике, т.е. предотвращении заражения хозяина церкарией. В настоящее время для лечения шистосомоза наиболее широко применяемым лекарственным препаратом является празиквантел. Несмотря на то, что артеметер продемонстрировал активность в профилактике шистосомоза, он не показал какой-либо активности против взрослых S. mansoni.
Теперь неожиданно было обнаружено, что спиро и диспиро триоксоланы данного изобретениея активны и против церкарии и против зрелых S. Mansoni и S. Japonicum при введении в дозировках и способом, изложенным выше в отношении лечения малярийных паразитов. Также предполагается, что триоксоланы данного изобретения будут активны против S. haematobium. Предпочтительные уровни дозирования диспиро триоксоланов данного изобретения составляют примерно около 100-200 мг/кг/день перорально.
Кроме триоксоланов в носитель также могут быть включены другие лекарственные препараты, которые совместимы с компонентами-носителями. Средние специалисты в данной области техники могут легко установить подобные лекарственные препараты, которые могут включать, например, антибиотики, другие противомалярийные препараты, противовоспалительные средства и т.д.
Понятно, что настоящее изобретение рассматривает применение не только самих вышеупомянутых соединений триоксолана, но их пролекарства, которые метаболизируют в соединения и аналоги и биологически активные формы их солей, а также оптические изомеры, которые обеспечивают сходные фармацевтические результаты.
Следующие примеры предложены для иллюстрации, а не ограничения изобретения. Таким образом, они предоставлены с пониманием, что могут быть сделаны различные модификации композиции, а также модификации способа доставки и, тем не менее, они находятся в рамках сущности изобретения.
Пример 1
Противомалярийная активность
Действие 1,2,4-триоксоланов против Р. falciparum in vitro. Провели проверку каждого триоксолана на штамме K1 Plasmodium falciparum, устойчивом к хлорохину, и штамме NF54, чувствительном к хлорохину, in vitro.
Действие 1,2,4-триоксоланов против Р. berghei in vivo. При проведении проверки однократной дозы in vivo мышей NMRI, инфицированных штаммом ANKA P. berghei (группы из пяти мышей), на следующий день после инфицирования обработали триоксоланами, растворенными или суспендированными в стандартном суспендирующем носителе (SSV). SSV состоит или из 0,5% вес./об. карбокиметил целлюлозы, 0,5% об./об. бензилового спирта, 0.4% об./об. Твина 80 и 0,9% вес./об. хлорида натрия в воде или из 0,5% гидроксипропилметилцеллюлозы 0,4% v/s Твин 80 и 0,5% об/об бензилового спирта в воде. Триоксоланы вводили в виде однократных ро доз 30 мг/кг. Противомалярийную активность измеряли с помощью процента уменьшения паразитемии на третий день после заражения и времени выживания по сравнению с необработанной контрольной группой. Выживаемость на 30 день после заражения считалась излечением на этой модели. Также включены сравнительные данные для противомалярийных контрольных лекарственных препаратов артесуната (AS), артеметера (AM), хлорохина (CQ) и мефлохина (MQ).
| Таблица 1 | ||||
| Противомалярийная активность триоксоланов в отношении P. falciparum in vitro и P. berghei in vivo. | ||||
| Соедине-ние | IC50 (нг/мл) K1/NF54 | Активность (%) 30 мг/кг SSVpo | Выживаемость (дни) 30 мг/кг SSVpo | Излечение 30 мг/кг SSVpo |
| Контроль | 0 | 6-7 | ||
| OZ429 | 0.52/1.3 | 99.97 | 27.8 | 4/5 |
| OZ439 | 1.5/2.0 | 98 | >30 | 5/5 |
| OZ453 | 0,66/1.1 | >99.9 | 24.0 | 3/5 |
| OZ460 | 3.5/3.3 | 99 | 25.0 | 3/5 |
| OZ461 | 2.8/2.8 | 99.8 | >30 | 5/5 |
| OZ462 | 3.2/3.1 | 99.7 | >30 | 5/5 |
| OZ464 | 3.5/3.3 | 99.8 | >30 | 5/5 |
| OZ466 | 3.2/2.5 | >99.9 | >30 | 5/5 |
| OZ482 | 4.2/4.3 | 99.9 | >30 | 5/5 |
| OZ485 | 6.1/5.6 | 99,9 | 24.8 | 2/5 |
| OZ493 | 1.1/2.1 | 99.7 | >30 | 5/5 |
| OZ495 | 1.9/3.8 | 99.3 | 26.8 | 3/5 |
| OZ498 | 1.6/2.5 | 99.0 | 24.8 | 2/5 |
| OZ499 | 1.0/1.5 | 99.8 | 25.2 | 1/5 |
| OZ505 | 2.1/1.9 | 99.7 | 27.4 | 4/5 |
| OZ508 | 1.2/1.4 | 99.8 | 24.4 | 3/5 |
| OZ513 | 1.1/0.82 | 99.9 | 21.0 | 1/5 |
| OZ527 | 3.6/2.9 | 99.7 | >30 | 5/5 |
| OZ534 | 2.1/1.7 | 99.8 | 22.8 | 1/5 |
| OZ535 | 1.8/1.6 | 99.7 | 26.4 | 3/5 |
| OZ537 | 2.1/2.4 | 99.9 | >30 | 5/5 |
| OZ539 | 1.5/1.4 | 99.7 | 25.2 | 3/5 |
| OZ543 | 1.3/2.2 | 99.6 | >30 | 5/5 |
| OZ545 | 3.3/3.9 | 99.5 | 27.6 | 4/5 |
| OZ547 | 3.9/7.9 | 99.7 | 24.8 | 3/5 |
| OZ549 | 1.3/3.1 | 99.8 | 22.4 | 2/5 |
| OZ555 | 1.7/1.5 | >99.9 | >30 | 5/5 |
| OZ571 | 1.7/1.9 | 99.9 | 24.0 | 3/5 |
| OZ572 | 1.2/1.4 | 99.9 | 30.0 | 4/5 |
| OZ575 | 1.2/1.6 | 99.7 | 22.2 | 1/5 |
| OZ277 | 1.0/0.91 | 99.7 | 8.0 | 0/5 |
| OZ401 | 1.9/1.7 | 98 | 23.7 | 3/5 |
| AS | 1.3/1.6 | 92 | 9.0 | 0/5 |
| AM | 0.74/1.2 | 99.7 | 9.0 | 0/5 |
| CO | 62/5.1 | 99.9 | 9.6 | 0/5 |
| MQ | 3.0/5.8 | 99.6 | 21.8 | 0/5 |
Данные в Таблице 1 демонстрируют неожиданные лечебные свойства однократной дозы этих новых триоксоланов на мышиной модели, инфицированной P. berghei. В этих экспериментах соединения вводили перорально в носителе SSV в однократных дозах 30 мг/кг через 24 часа после заражения. По сравнению с OZ277 (описанный в более раннем патенте изобретателей) и всеми контрольными противомалярийными лекарственными препаратами эти новые триоксоланы вылечивают от 1/5 до 5/5 инфицированных мышей. OZ439, OZ461, OZ462, OZ464, OZ466, OZ482, OZ493, OZ527, OZ537 успешно вылечили болезнь у всех из пяти реципиентов.
Пример 2
Противомалярийная активность
Действие 1,2,4-триоксоланов против P. falciparum in vitro. Провели проверку каждого триоксолана на штамме K1 Plasmodium falciparum, устойчивом к хлорохину, и штамме NF54, чувствительном к хлорохину, in vitro.
Действие 1,2,4-триоксоланов против P. berghei in vivo. При проведении проверки однократной дозы in vivo мышей NMRI, инфицированных штаммом ANKA Р. berghei (группы из пяти мышей), на следующий день после инфицирования обработали триоксоланами, растворенными или суспендированными в стандартном суспендирующем носителе (SSV). SSV состоит или из 0,5% вес/об карбокиметил целлюлозы, 0,5% об/об бензилового спирта, 0.4% об/об Твина 80 и 0,9% вес/об хлорида натрия в воде или из 0,5% гидроксипропилметилцеллюлозы 0,4% v/s Твин 80 и 0,5% об/об бензилового спирта в воде. Триоксоланы вводили в виде однократных ро доз 10 мг/кг. Противомалярийную активность измеряли посредством процента уменьшения паразитемии на третий день после заражения и времени выживания по сравнению с необработанной контрольной группой. Выживаемость на 30 день после заражения считалась излечением на этой модели.
Также включены сравнительные данные для противомалярийных контрольных лекарственных препаратов артесуната (AS), артеметера (AM), хлорохина (CQ) и мефлохина (MQ).
| Таблица 2 | ||||
| Противомалярийная активность различных форм солей OZ439 в отношении P. falciparum in vitro и P. berghei in vivo. | ||||
| Соединение | Форма соли | IC50 (нг/мл) K1/NF54 | Активность(%) 10 мг/кг SSV po | Выживаемость (дни) 10 мг/кг SSVpo |
| Контроль | - | - | 0 | 6-7 |
| OZ439 | Мезилат | 1.5/2.0 | 99.9 | 14.4 |
| OZ558 | Тозилат | 1.4/1.2 | 99.7 | 13.8 |
| OZ559 | Гидроген малеат | 1.5/1.4 | 99.9 | 14.6 |
| OZ560 | Гидрохлорид | 1.3/1.2 | 99.9 | 14.6 |
| OZ561 | Изотионат | 1.6/1.5 | 99.9 | 19.0 |
| OZ562 | Гидроген Фумарат | 1.7/1.6 | 99.8 | 24.0 |
| OZ563 | Дигидроген фосфат | 1.8/1.7 | 99.7 | 14.4 |
| OZ568 | Гидроген тартрат | 1.3/1.2 | 99.8 | 14.0 |
| AS | - | 1.3/1.6 | 67 | 7.4 |
| AM | - | 0.74/1.2 | 99.4 | 9.7 |
| CQ | - | 62/5.1 | 99.9 | 8.9 |
| MQ | - | 3.0/5.8 | 99.8 | 18.3 |
| Таблица 3 | ||||
| Противомалярийная активность различных форм солей OZ493 в отношении Р. falciparum in vitro и Р. Berghei in vivo. | ||||
| Соединение | Форма соли | IC50(нг/мл) K1/NF54 | Активность (%) 10 мг/кг SSVpo | Выживаемость (дни) 10 мг/кг SSVpo |
| Контроль | - | - | 0 | 6-7 |
| OZ493 | Мезилат | 1.1/2.1 | 99.8 | 12.6 |
| OZ556 | Гидрохлорид | 1.7/1.5 | 99.7 |