Способ стимулирования экспансии гематопоэтических стволовых клеток
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ стимулирования экспансии гематопоэтических стволовых клеток (HSC) in vitro или in vivo. Проводят инкубацию популяции клеток, содержащей HSC, в присутствии, по меньшей мере, одного модулятора HSC, при этом модулятор HSC выбран из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY 171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сульпростона, сериноламида PGE2, сложного метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-РGЕ2. Предложен способ усиления приживления HSC, а также способ усиления восстановления гематопоэтических стволовых клеток, которые включают инкубацию HSC в присутствии, по меньшей мере, одного модулятора HSC. Изобретение расширяет арсенал методов для стимулирования роста гематопоэтических стволовых клеток у субъекта. 6 н. и 23 з.п. ф-лы, 38 ил., 11 табл., 2 пр.
Реферат
ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Настоящее изобретение поддержано Национальными институтами здоровья - грант NIH № CA103846-02. Правительство Соединенных Штатов Америки имеет определенные права на изобретение.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США с регистрационными No. 60/785968, озаглавленной «Способ модулирования роста гематопоэтических стволовых клеток», поданной 24 марта 2006 Leonard I. Zon и Trista E. North, которая включена в данное описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В описанных вариантах осуществления изобретения предлагаются модуляторы, которые либо увеличивают, либо уменьшают популяции гематопоэтических стволовых клеток in vitro, in vivo и ex vivo.
УРОВЕНЬ ТЕХНИКИ
Исследование стволовых клеток создает исключительную возможность для разработки способов терапии, которые могут изменить будущее людей, страдающих от таких заболеваний, как лейкоз, диабет и анемия. Многие исследования сфокусированы на изучении биологии стволовых клеток в качестве ключа к лечению заболеваний. Благодаря выяснению роли стволовых клеток в нормальном развитии исследователи стремятся собрать и направить природные возможности стволовых клеток на лечение многих состояний. В настоящее время исследования одновременно проводятся в ряде областей: исследование генетических и молекулярных пусковых механизмов, которые побуждают эмбриональные стволовые клетки к развитию в различные ткани; изучение того, как подтолкнуть такие клетки к делению и образованию специализированных тканей; культивирование эмбриональных стволовых клеток и разработка новых линий для работы с ними; поиск путей отмены или контроля болезни «трансплантат против хозяина» посредством устранения необходимости в донорах; и создание линии универсальных трансплантируемых клеток.
Гематопоэтические стволовые клетки (HSC) образуются во время эмбриогенеза в определенных областях, в которых специфичные явления индукции превращают мезодерму в стволовые клетки крови и клетки-предшественники. Сохраняется необходимость в выяснении взаимосвязей между конкретными биомолекулами, химическими агентами и другими факторами в указанных явлениях индукции. Например, сохраняется необходимость в идентификации того, какие биологические молекулы или химические агенты являются перспективными при обработке популяции HSC для достижения требуемой цели, такой как увеличение популяции HCS для исследования или терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Композиции и способы согласно вариантам осуществления настоящего изобретения относятся к модуляторам HCS, которые представляют собой средства, которые либо увеличивают количества HSC, либо уменьшают количества HSC, в зависимости от того, что является необходимым в случае конкретного симптома. Например, обнаружено, что модуляторы HSC, которые увеличивают количества HSC, включают простагландин E2 (PGE2) и агенты, которые стимулируют путь PGE2. Наоборот, модуляторы HSC, которые предотвращают синтез PGE2, уменьшают количества HSC.
В одном варианте предлагается способ стимулирования роста гематопоэтических стволовых клеток у субъекта, включающий в себя введение, по меньшей мере, одного модулятора гематопоэтических стволовых клеток (HSC) и фармацевтически приемлемого носителя.
В другом варианте модулятор HSC увеличивает количество HSC путем модификации пути простагландина. Модулятором HSC, который увеличивает популяции HCS посредством модификации простагландинового пути, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из PGE2, dmPGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Cay 1039, агониста рецептора PGE2 и производного любого из указанных агентов. В более конкретном варианте модулятором HSC является производное PGE2, выбранное из группы, состоящей из 16,16-диметил-PGE2, 19(R)-гидрокси-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16,16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, бутапроста, сульпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-PGE2, 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
В другом варианте модулятор HSC увеличивает количество HSC посредством модификации пути Wht. Модулятором HSC, который увеличивает популяции HCS посредством модификации пути wnt, может быть, по меньшей мере, соединение, выбранное из группы, состоящей из PGE2, dmPGE2, BIO, LiCl и производных указанных соединений.
В еще одном варианте модулятор HSC увеличивает количество HSC посредством модификации вторичного мессенджера cAMP/P13K/AKT. Модулятором HSC, который увеличивает популяции HCS посредством модификации вторичного мессенджера cAMP/P13K/AKT, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из 8-бром-cAMP, форсколина и производных указанных агентов.
В еще одном варианте модулятор HSC увеличивает популяции HCS посредством модификации вторичного мессенджера Ca2+. Модулятором HCS, который увеличивает популяции HCS посредством модификации вторичного мессенджера Ca2+, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из бапта-AM, фендилина, никардипина и производных указанных соединений.
В другом варианте модулятор HSC увеличивает популяции HSC посредством модификации передачи сигнала NO/ангиотензин. Модулятором HCS, который увеличивает популяции HCS посредством модификации передачи сигнала NO/ангиотензин, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из L-Arg, нитропруссида натрия, ванадата натрия, брадикинина и их производных.
В еще одном варианте модулятором HSC, который увеличивает популяции HCS, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из мебеверина, флурандренолида, атенолола, пиндолола, габоксадола, кинуреновой кислоты, гидралазина, тиабендазола, бикукллина, везамикола, перувосида, имипрамина, хлорпропамида, 1,5-пентаметилентетразола, 4-аминопиридина, диазоксида, бенфотиамина, 12-метоксидодеценовой кислоты, N-формил-Met-Leu-Phe, галламина, IAA 94, хлортрианизена и производных указанных соединений.
В другом варианте предлагается способ стимулирования роста HSC посредством контактирования возникающей популяции стволовых клеток, по меньшей мере, с одним соединением, выбранным из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Cay1039, агониста рецептора PGE2, 16,16-диметил-PGE2, 19(R)-гидрокси-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16,16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, бутапроста, сульпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-PGE2, 15(S)-15-метил-PGE2, 15(R)-15-метил-PGE2, BIO, 8-бром-cAMP, форсколина, бапта-AM, фендилина, никардипина, нифедипина, пимозида, строфантидина, ланатозида, L-Arg, нитропруссида натрия, ванадата натрия, брадикинина, мебеверина, флурандренолида, атенолола, пиндолола, габоксадола, кинуреновой кислоты, гидралазина, тиабендазола, бикукллина, везамикола, перувосида, имипрамина, хлорпропамида, 1,5-пентаметилентетразола, 4-аминопиридина, диазоксида, бенфотиамина, 12-метоксидодеценовой кислоты, N-формил-Met-Leu-Phe, галламина, IAA 94, хлортрианизена и их производных. Новообразованная популяция стволовых клеток может быть собрана из периферической крови, пуповинной крови, ворсин хориона, амниотической жидкости, плацентарной крови или костного мозга.
В другом варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, включающий инкубацию HSC в присутствии, по меньшей мере, одного модулятора HSC. В другом варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, включающий сбор образца источника HSC (например, периферической крови, пуповинной крови, амниотической жидкости, плацентарной крови, костного мозга, ворсинок хориона) и хранении образца в присутствии, по меньшей мере, одного модулятора HSC, такого как PGE2. В конкретном варианте предлагается набор, содержащий емкость, подходящую для хранения образца HCS-источника, при этом в емкость предварительно вносят, по меньшей мере, один модулятор HSC, который увеличивает количество HCS. В дополнительном варианте предлагается набор, содержащий емкость, подходящую для хранения образца источника HCS, и флакон, содержащий подходящее количество, по меньшей мере, одного модулятора HSC, который увеличивает количество HSC. В следующем варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, в котором полученный источник HSC подвергают контакту с PGE2 или его производным при начальном сборе, во время обработки, при хранении, после оттаивания или во время трансфузии.
В другом варианте осуществления настоящего изобретения модулятор HSC ингибирует HSC посредством модификации простагландинового пути. Модулятором HSC, который ингибирует популяции HCS посредством модификации простагландинового пути, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из индометацина, фенбуфена, NS398, SC560, сулиндака, суксибузона, аспирина, напроксена, ибупрофена, целекоксиба, PGJ2, аристолохиевой кислоты, AH6809, AH23848 и их производных.
В другом варианте модулятор HSC ингибирует HSC посредством модификации пути Wnt. Модулятором HSC, который ингибирует популяции HCS посредством модификации пути Wnt, может быть, по меньшей мере, одно из средств, выбранное из группы, состоящей из ингибиторов простагландина, кенпауллона, вальпроевой кислоты или их производных.
В еще одном варианте осуществления настоящего изобретения модулятор HSC ингибирует HSC посредством модификации вторичного мессенджера cAMP/P13K/AKT. Модулятором HSC, который ингибирует популяции HCS посредством модификации вторичного мессенджера cAMP/P13K/AKT, может быть одно или несколько соединений, выбранных из группы, состоящей из PD98059, KT5720, H89, U0126, вортманнина и их производного.
В другом варианте модулятор HSC ингибирует HSC посредством модификации вторичного мессенджера Ca2+. Модулятором HSC, который ингибирует популяции HCS посредством модификации вторичного мессенджера Ca2+, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из BayK-8644, тиоридазина и производного таких средств.
В еще одном варианте модулятор HSC ингибирует HSC посредством модификации передачи сигнала NO/ангиотензина. Модулятором HSC, который ингибирует популяции HCS посредством модификации передачи сигнала NO/ангиотензина, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из L-NAME, эналаприла, каптоприла, AcSDKP, лозартана, AcSDKP, лозартана, телимазартана, гистамина, амброксола, хризина, циклогексимида, метиленового синего, эпинефрина, дексаметазона, проадифена, бензилизотиоцианата, эфедрина и их производных.
В дополнительном варианте осуществления изобретения модулятором HSC, который ингибирует популяции HCS, является, по меньшей мере, одно соединение, выбранное из группы, состоящей из парагилина, пропранолола, этанидазола, метимазола, циноксацина, пеницилламина, фуросемида, эбурнамининона, акларубицина, варфарина, гамма-аминомасляной кислоты, норэтиндрона, лупинидина, гидрохинидина, тодралазина, метоксамина, гидроксимочевины, дигидроэрготамина, антазолина, 3-нитропропионовой кислоты, N-фенилантраниловой кислоты, феназопиридина, дихлоркинуреновой кислоты, 3-эстрадиола, L-Leu, феноксибензамина, мефентермина, гувацина, гвайзулена, имидазола, бета-каротина, клофибрата и производных указанных соединений.
В еще одном варианте предлагается способ ингибирования роста HSC у субъекта, включающий введение, по меньшей мере, одного модулятора HSC и фармацевтически приемлемого носителя. В конкретном варианте модулятором HSC является одно или несколько из соединений, выбранных из группы, состоящей из индометацина, целекоксиба, фенбуфена, простагландина J2, суксибузона, сулиндака и их производных.
В другом варианте предлагается способ снижения роста HSC посредством осуществления контакта новообразованной популяции стволовых клеток, по меньшей мере, с одним соединением, выбранным из группы, состоящей из индометацина, фенбуфена, NS398, SC560, сулиндака, суксибузона, аспирина, напроксена, ибупрофена, целекоксиба, PGJ2, аристолохиевой кислоты, AH6809, AH23848, кенпауллона, вальпроевой кислоты, PD98059, KT5720, H89, U0126, вортманнина, BayK-8644, тиридазина, L-NAME, эналаприла, каптоприла, AcSDKP, лозартана, AcSDKP, лозартана, телимазартана, гистамина, амброксола, хризина, циклогексимида, метиленового синего, эпинефрина, дексаметазона, проадифена, бензилизотиоцианата, эфедрина, парагилина, пропранолола, этанидазола, метимазола, циноксацина, пеницилламина, фуросемида, эбурнамининона, акларубицина, варфарина, гамма-аминомасляной кислоты, норэтиндрона, лупинидина, гидрохинидина, тодралазина, метоксамина, гидроксимочевины, дигидроэрготамина, антазолина, 3-нитропропионовой кислоты, N-фенилантраниловой кислоты, феназопиридина, дихлоркинуреновой кислоты, 3-эстрадиола, L-Leu, феноксибензамина, мефентермина, гувацина, гвайзулена, имидазола, бета-каротина, клофибрата, антагониста рецептора PGE2 и производных указанных соединений.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
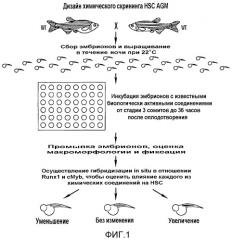
На фиг. 1 представлена схема скрининга химических веществ, которые влияют на стволовые клетки в AGM, с использованием эмбрионов рыб данио.
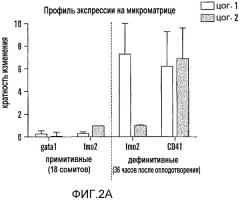
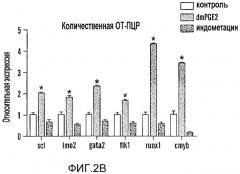
Фиг. 2A и 2B относятся к агонистам и антагонистам простагландина, которые изменяют экспрессию runx1/cmyb, не влияя при этом на развитие сосудов. На фиг. 2A показаны профили экспрессии на микроматрице отсортированных с помощью FACS популяций клеток, выделенных во время примитивного (gata1 и Imo2) и дефинитивного (Imo2 и cd41) гематопоэза. Показана относительная экспрессия ЦОГ-1 (светло серый) и ЦОГ-2 (темно-серый) в каждой отсортированной фракции GFP+ по сравнению с клетками GFP-. На фиг. 2B показаны профили кПЦР эндотелиальной и HSC-специфичной экспрессии генов после воздействия dmPGE2 длительного действия (10 мкм, второй столбик в каждой комбинации из трех столбиков, темно серый) или неспецифичного ингибитора ЦОГ индометацина (10 мкМ, третий из трех столбиков) по сравнению с контролем (первый из трех столбиков). Обе обработки приводили к статистически значимым отличиям от контролей в случае каждого исследуемого гена (ANOVA, p<0,05, n=8).
На фиг. 3 изображены данные, показывающие, что агонисты и антагонисты простагландина изменяют экспрессию runx1/cmyb, полученные при количественном анализе HSC в бигенных эмбрионах рыб данио, выявляемых конфокальной микроскопией: ДМСО 23,3±5,0 (среднее±SD), dmPGE2 (10 мкМ 38,0±2,2, индометацин (10 мкМ) (ANOVA, p<0,00001, n=10/обработку).
На фиг. 4A и 4B показано, что обработка dmPGE2 усиливает восстановление гематопоэтических клеток у сублетально облученных взрослых особей данио. Проводили эксперименты по восстановлению после облучения целого мозгового вещества данио. Звездочками (*) указаны статистически значимые различия: *=50 мкМ по сравнению с контролем, **=50 мкМ по сравнению с 10 мкМ, и 50 мкМ по сравнению с контролем, ***=все переменные значимы (ANOVA, p<0,05, n=15/переменную). На фиг. 4A показаны типичные профили FACS FSC/SSC гематопоэтических линий клеток в KM в 0, 4, 7, 10 и 14 день восстановления после облучения у обработанных ДМСО и обработанных dmPGE2 (50 мкМ) данио. На фиг. 4B показана кинетика восстановления в KM клеток-предшественников, лимфоидных и миелоидных клеток у контрольных рыб (треугольники) и рыб, обработанных dmPGE2 (квадраты, 10 мкМ; кружки, 50 мкМ).
На фиг. 5A и 5B изображено модулирование пути PG, которое изменяет экспрессию связанных с HSC генов и восстановление у сублетально облученных взрослых рыб данио. На фиг. 5A показано влияние обработки dmPGE2 на маркеры стволовых клеток и эндотелиальных клеток, которое измеряли с помощью кПЦР на целых KM, выделенных на третий день после облучения. Звездочками (*) указано статистически значимое различие (двухсторонний t-критерий, n=15, runx1: p=0,0001; Imo2: p=0,014; fli1: p=0,049). На фиг. 5B изображено влияние ингибирования ЦОГ-1 (SC560, 10 мкМ) и ЦОГ-2 (NS398, 10 мкМ) на восстановление после облучения (n=5/обработку). В случае рыб, обработанных SC560 или NS398, нельзя было провести анализ на четырнадцатый день вследствие повышенной гибели у указанных группах обработки.
На фиг. 6A и 6B показано, что dmPGE2 модулирует количество колоний и дифференцировку гематопоэтических клеток в ES клетках мышей. Осуществляли анализы образования колоний ES-клеток на M3434 и OP9; количества указаны на 100000 посеянных клеток. Столбиками указаны ES-клетки с контрольной обработкой и ES-клетки, обработанные возрастающими дозами dmPGE2 (10 мкМ, 20 мкМ, 100 мкМ) или обработанные индометацином (10 мкМ, 100 мкМ). Звездочкой (*) указано статистически значимое различие (двухсторонний t-критерий, n=5/переменную). Фиг. 6 A: Влияние возрастающих доз dmPGE2 и ингибирования активности циклооксигеназы индометацином на гематопоэтическую дифференцировку в метилцеллюлозе; показаны количества колоний дефинитивных эритроидных клеток (E), смешанных гранулоцитов/моноцитов (GM) и мультипотентных (GEMM) предшественников (10 мкМ dmPGE2: GM p=0,005, GEMM p=0,017; 20 мкМ dmPGE2: dE p=0,04, GM p=0,007, GEMM 0,016; 100 мкМ индометацина: GM p=0,024). Фиг. 6B: Влияние dmPGE2 и индометацина на количество гематопоэтических колоний на OP9 (20 мкМ: p=0,047).
На фиг. 7A и 7B изображено влияние PGE2 на количество колоний. Более конкретно фиг. 7A и 7B иллюстрируют dmPGE2-опосредованную (10 мкМ) защиту образования колоний от ингибирования индометацином (100 мкМ) в анализах в (A) метилцеллюлозе и (B) OP9.
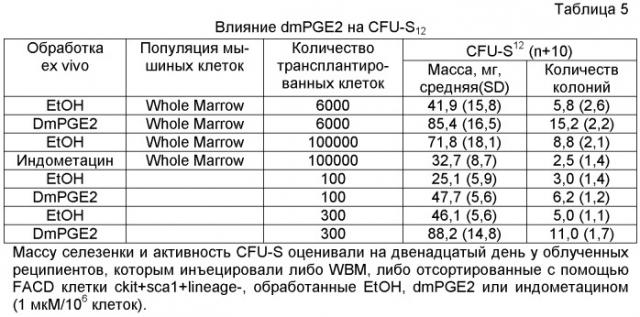
На фиг. 8A-8F показано, что воздействие на BM мышей dmPGE2 увеличивает количество CFU-S и репопулирующих HSC. Звездочками (*) указано статистически значимое различие. Фиг. 8A и 8B: Влияние обработки ex vivo WBM (2 часа на льду) контрольным EtOH или dmPGE2 (1 мкМ/106 клеток) на CFU-S8 и CFU-S12 (60000 клеток/реципиент; CFU-S12: двухсторонний t-критерий, n=10, p<0,0001). Фиг. 8С: Влияние на CFU-S12 после обработки ex vivo индометацином (1 мкМ/106 клеток) (100000 клеток/реципиент; двухсторонний t-критерий, n=10, p=0,0002). Фиг. 8D: Оценка CFU-S12 после обработки стволовых клеток ckit+sca1+lineage-dmPGE2 или контрольным EtOH (двухсторонний t-критерий, 100 клеток: n=10, p=0,013; 300 клеток: p=0,0003). Фиг. 8E и 8F: Анализ конкурентного репопулирования при лимитирующем разведении. Количество негативных реципиентов, которое определяли в FACS-анализе (e) относительно общего количества трансплантированных клеток в случае контрольных (квадраты) или dmPGE2-обработанных (кружки) образцов клеток показаны через 12 недель. Частота приживления трансплантата (панель F) через 6, 12 и 24 недели после трансплантации у реципиентов обработанных EtOH по сравнению с dmPGE2-обработанными WBM, рассчитанная с использованием статистики Пуассона (ANOVA, n=10/переменную, 6 недель: p=0,005; 12 недель: p=0,002; 24 недели: p=0,05); количество реципиентов, выживших к моменту анализа в каждой временной точке, показано в Таблице 6 - Таблице 8.
На фиг. 9A-9N изображены данные, показывающие, что при воздействии на BM мышей dmPGE2 увеличивается масса селезенки и приживление трансплантатов HSC. Фиг. 9A и 9B: Влияние обработки ex vivo WBM и изолированных HSC контрольным EtOH или dmPGE2 на массу селезенки на (a) восьмой день и (b) двенадцатый день (двухсторонний t-критерий, CFU-S8: n=5, p=0,339; CFU-S12: n=9, p<0,00001). Фиг. 9C: Масса селезенки после обработки индометацином (зеленые) по сравнению с контролем (двухсторонний t-критерий: n=10, p=0,00026). Фиг. 9D: количество колоний в селезенке после обработки dmPGE2 клеток KSL (двухсторонний t-критерий, 100 клеток: n=4, p=0,0013; 300 клеток: n=5, p=0,009). Фиг. 9E: Типичные графики FACS, иллюстрирующие уровни приживления трансплантатов CD45.1 (верхний левый квадрант) у реципиентов контрольных и обработанных dmPGE2 клеток BM. Фиг. 9F-9J: Средний химеризм (F, H, I) и рассчитанная частота приживления трансплантатов (фиг. 9G и 9J) у реципиентов dmPGE2-обработанного WBM (кружки) по сравнению с контролем (квадраты). Фиг. 9K и 9L: Влияние обработки ex vivo WBM ингибиторами ЦОГ-1 (SC560, 10 мкМ) и ЦОГ-2 (NS398, 10 мкМ) в анализе CFU-S12 на количество колоний (парный t-критерий, n=10, SC560 p=0,00016, NS398 p<0,00001) и массу селезенки (парный t-критерий, n=10, SC560 p=0,025, NS398 p=0,00075). Фиг. 9M и 9N: Количества лейкоцитов в периферической крови (14 день после обработки) и костном мозге (16 день после обработки) после повреждения костного мозга 5-FU; воздействие in vivo SC560 или NS398 значимо ингибировало восстановление лейкоцитов, тогда как dmPGE2 увеличивал количества лейкоцитов.
На фиг. 10 представлена диаграмма пути передачи сигнала Wnt.
На фиг. 11A и 11B изображены данные о том, что модулирование активности wnt влияет на гомеостаз во взрослом организме. На фиг. 11A показана схема анализа с использованием облучения; на фиг. 11B показан FACS-анализ цельного мозгового вещества почек на десятый день после облучения у взрослых животных wt, hs:wnt8, hs:dkk и hs:dnTCF.
На фиг. 12 показана основанная на кПЦР количественная оценка изменений активности wnt в развивающемся эмбрионе, вызванных передачей сигнала простагландина, в анализе Top:dGFP in vivo.
На фиг. 13 представлена модель, изображающая вероятные точки взаимодействия путей PG и wnt. (1) PGE2 не может спасать dkk, axin, dnTCF; индометацин не может блокировать wnt8. (2) PGE2 спасает dkk, но не axin и dnTCF; индометацин может блокировать wnt8; PGE2 спасает dkk и axin, но не dnTCF; индометацин может блокировать wnt8. (4) PGE2 спасает dkk, axin и dnTCF; индометацин может блокировать wnt8.
На фиг. 14 показан процент GFP-позитивных клеток в мозговом веществе почек взрослых животных Top:dGFP на третий день после облучения и обработки dmPGE2 или индометацином.
ПОДРОБНОЕ ОПИСАНИЕ
Если не оговорено особо, научные и технические термины, используемые в связи с настоящей заявкой будут иметь значения, которые обычно подразумеваются специалистами в данной области. Кроме того, если иное не указано в контексте, то формы единственного числа будут включать формы множественного числа, а формы множественного числа будут включать формы единственного числа.
Следует понимать, что настоящее изобретение не ограничено конкретной методикой, протоколами и реагентами и т.д., указанным в данном описании, и могут варьировать. Терминология использована в данном описании только в целях описания конкретных вариантов и не предназначена для ограничения объема настоящего изобретения, который определен только формулой изобретения.
Кроме случаев рабочих примеров или случаев, когда указанно иное, все числа, выражающие количества ингредиентов или условия реакции, используемые в данном описании, следует понимать во всех остальных случаях как определяемые термином «примерно». Термин «примерно» при использовании в связи с процентным содержанием может означать ± 1%.
Все патенты и другие указанные публикации специально включены в данное описание в виде ссылки в целях описания и раскрытия, например, методики, описанной в таких публикациях, которая может быть использована в настоящем изобретении. Такие публикации предлагаются только в отношении раскрытия уровня техники до даты подачи настоящей заявки. В этом отношении их не следует рассматривать как допущение того, что авторы изобретения не имеют права датировать более ранним числом такое раскрытие на основании предшествующего изобретения или по какой-либо другой причине. Все утверждения в отношении даты или изложение содержания таких документов основано на информации, доступной заявителям, и не являются признанием корректности дат или содержания таких документов.
Гомеостаз гематопоэтических стволовых клеток (HSC) строго контролируется факторами роста, передающими сигналы молекулами и факторами транскрипции. Дефинитивные HSC, получаемые во время эмбриогенеза в области аорто-гонадного мезонефроса (AGM), впоследствии колонизируют нишу в гематопоэтических органах плода и взрослого организма. Dzierzak, 12 Curr. Opin. Hematol. 197-202 (2004); Galloway and Zon, 53 Curr. Top. Devel. Biol. 139-58 (2003).
В настоящем изобретении предлагаются способы модулирования роста и обновления HSC in vitro, in vivo или ex vivo. Способ включает осуществление контакта новообразованной популяции стволовых клеток, по меньшей мере, с одним модулятором HSC. Такая популяция может находиться в периферической крови, пуповинной крови, костном мозге, амниотической жидкости, ворсинах хориона, плаценте или других гематопоэтических нишах стволовых клеток. В одном варианте осуществления изобретения предлагаются способы стимулирования роста гематопоэтических стволовых клеток и восстановления популяции клеток. В другом варианте осуществления изобретения предлагаются способы ингибирования роста гематопоэтических стволовых клеток и восстановления популяции клеток.
Настоящее изобретение частично основано на открытии того, что PGE2 и агенты, которые усиливают синтез PGE2, вызывают увеличение количества HSC. Наоборот, агенты, которые блокируют синтез PGE2, уменьшают количество HSC. В этой связи агенты, влияющие на синтез PGE2, можно считать модуляторами HSC. Например, циклооксигеназы (ЦОГ), ответственные за синтез PGE2, могут быть необходимы для образования HSC. Кроме того, сосудорасширяющие средства стимулируют размножение HSC, наоборот, сосудосуживающие средства уменьшают количество HSC. Например, гидралазин, противогипертоническое сосудорасширяющее средство, увеличивает количество HSC, тогда как фенбуфен, нестероидное противовоспалительное сосудосуживающее лекарственное средство уменьшает количество HSC. Соответственно, такие средства также считаются модуляторами HSC.
В используемом в данном описании смысле модуляторы HSC могут либо стимулировать, либо ингибировать рост и восстановление HSC. Модуляторы HSC влияют на количество HSC в популяции клеток. Модуляторы HSC влияют на размножение HSC в культуре (in vitro), во время кратковременной инкубации (ex vivo) или in vivo. Смотри Таблицу 1 ниже. Модуляторы HSC, которые увеличивают количество HSC, включают средства, которые осуществляют повышающую регуляцию синтеза PGE2. Увеличение количества HSC может составлять увеличение примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более по сравнению с количеством HSC, имеющимся у субъекта до обработки.
Модуляторы HSC, которые вызывают уменьшение количества HSC, осуществляют понижающую регуляцию синтеза PGE2 и/или стимулируют сужение кровеносных сосудов. Смотри, например, Таблицу 2 ниже. Уменьшение количества HSC может представлять собой уменьшение примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более по сравнению с количеством HSC, имеющимся у субъекта до обработки. Количества HSC можно оценить по уменьшению симптомов заболевания, например, повышенному количеству тромбоцитов, повышенному гематокриту, при этом количество тромбоцитов или гематокрит увеличиваются примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более. Влияние количества HSC можно оценить по ослаблению симптомов заболевания, например, повышенному количеству тромбоцитов, повышенному гематокриту, при этом количество тромбоцитов или гематокрит увеличиваются примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более.
В одном варианте PGE2 или dmPGE2 используют в качестве модуляторов HSC, чтобы увеличить популяцию HSC.
Модуляторы HSC согласно настоящему изобретению также включают производные модуляторов HSC. Производные в используемом в данном описании смысле включают химически модифицированное соединение, при этом предполагается, что модификация является стандартной для специалиста в области химии, такая как дополнительные химические остатки (например, сложный эфир или амид кислоты, защитные группы, такие как бензильная группа в случае спирта или тиола и трет-бутоксикарбонильная группа для амина). Производные также включают радиоактивно меченые модуляторы HSC, конъюгаты модуляторов HSC (например, с биотином или авидином, с ферментами, такими как пероксидаза хрена и тому подобные, с биолюминсцентными агентами, хемилюминесцентными агентами или флуоресцирующими агентами). Кроме того, к модулятору HCS или его части могут быть добавлены остатки для увеличения времени полужизни in vivo. Производные в используемом в данном описании смысле также охватывают аналоги, такие как соединение, которое содержит химически модифицированную форму конкретного соединения или класса, и которое сохраняет фармацевтические и/или фармакологические активности, характерные для указанного соединения или класса, такие производные также входят в объем настоящего изобретения. Производные в используемом в данном описании смысле также охватывают пролекарства модуляторов HCS, которые, как известно усиливают различные требуемые качества фармацевтических средств (например, растворимость, биодоступность, обработку и т.д.).
Прямое введение ex vivo модуляторов HSC может обеспечивать значительную экспансию in vivo гематопоэтических стволовых клеток, так что даже небольшие количества гематопоэтических стволовых клеток затем могут быть достаточны для трансплантации. Следовательно, в таком случае трансплантацию стволовых клеток пуповинной крови, например, можно применять не только для детей, но и для взрослых. Такие стволовые клетки могут быть собраны из источников, включая, например, периферическую кровь, пуповинную кровь, костный мозг, амниотическую жидкость или плацентарную кровь. Альтернативно образец HSC-содержащего источника можно собрать и затем хранить непосредственно в присутствии модулятора HSC, такого как PGE2, и сначала инкубировать (перед дифференцировкой) в присутствии модулятора HSC перед введением субъекту.
Кроме того, один или несколько модуляторов HSC можно использовать in vivo для увеличения количества стволовых клеток в костном мозге или других источниках (таких как пуповинная кровь). Благодаря увеличению количества стволовых клеток можно значительно увеличить общий сбор стволовых клеток из организма субъекта. Кроме того, благодаря увеличению количества стволовых клеток, собранных из организма субъекта, количество стволовых клеток, доступных для обратной трансплантации субъекту или трансплантации другому субъекту, также может быть значительно увеличено, тем самым возможно сокращение периода времени для приживления трансплантата и, следовательно, это приводит к сокращению периода времени, в течение которого субъект имеет недостаточное количество нейтрофилов и тромбоцитов, тем самым предотвращая инфекции, кровотечение или другие осложнения.
Кроме того, настоящее изобретение может уменьшать долю субъектов, у которых иным образом невозможна мобилизация достаточного количества клеток для сбора стволовых клеток, чтобы продолжить лечение их первичного заболевания, например, при химиотерапии и других разрушающих костный мозг обработках. Следовательно, доля пациентов с замедленным первичным приживлением трансплантата также может быть уменьшена. Кроме того, настоящее изобретение позволяет стимулировать восстановление после разрушающих костный мозг обработок посредством увеличения количества HSC.
Модуляторы HSC, такие как модуляторы, указанные в Таблице 1 и раскрытые в описании, можно применять in vivo для увеличения продукции HSC и ex vivo для увеличения количества HSC. Это осуществляют путем введения одного или нескольких соединений субъекту или к стволовым клеткам.
Модуляторы HSC также можно применять для получения аутологичных для субъекта HSC. Обычно для этого используют стадии введения модуляторов HSC субъекту, нуждающемуся в аутологичных HSC, чтобы увеличить экспансию популяции стволовых клеток в костном мозге и/или мобилизовать стволовые клетки в периферическое кровообращение; сбора одной или нескольких стволовых клеток костного мозга или одной или нескольких стволовых клеток из периферического кровообращения; и трансплантации одной или нескольких собранных стволовых клеток снова в организм субъекта.
Кроме того, стволовые клетки, полученные в результате сбора способом согласно настоящему изобретению, описанным выше, могут быть подвергнуты криоконсервации с использованием способов, известных в данной области для криоконсервации стволовых клеток. Соответственно, используя криоконсервацию, стволовые клетки можно хранить, так что как только определяют, что субъекту необходима трансплантация стволовых клеток, стволовые клетки можно разморозить и трансплантировать снова в организм субъекта. Как указано ранее, применение одного или нескольких модуляторов HSC, например PGE2, во время криоконсервации может увеличивать популяцию HSC.
Более конкретно другой вариант осуществления настоящего изобретения относится к увеличению количества HSC, собранных из пуповинной крови, или эквивалентного неонатального или фетального источника стволовых клеток, который можно криоконсервировать, для терапевтических применений таких стволовых клеток после размораживания. Такую кровь можно собрать несколькими способами, известными в данной области. Например, поскольку кровь пуповины является богатым источником HSC (смотри Nakahata and Ogawa, 70 J. Clin. Invest. 1324-28 (1982); Prindull et al., 67 Acta. Paediatr. Scand. 413-16 (1978); Tchernia et al., 97(3) J. Lab. Clin. Med. 322-31 (1981)), то прекрасным источником неонатальной крови являются пуповина и плацента. Неонатальная кровь может быть получена прямым сливанием из пуповины и/или отсасыванием через иглу из плаценты после родов у корня и из расширенных вен. Смотри, например, патенты США № 7160714, № 5114672, № 5004681; заявку на выдачу патента США с регистрационным № 10/076180, № публикации 20030032179.
Действительно, стволовые клетки пуповинной крови применяли для восстановления гематопоэза у детей со злокачественными и незлокачественными заболеваниями после обработки дозами химио- и лучевой терапии, разрушающими миелоидные клетки. Sirchia and Rebulla, 84 Haematologica 738-47 (1999). Также смотри Laughlin 27 Bone Marrow Transplant. 1-6 (2001); патент США № 6852534. Кроме того, сообщалось, что стволовые клетки и клетки-предшественники в пуповинной крови по-видимому обладают более высокой пролиферативной способностью в культуре, чем клетки в костном мозге взрослого организма. Salahuddin et al., 58 Blood 931-38 (1981); Cappellini et al., 57 Brit. J. Haematol. 61-70 (1984).
Альтернативно кровь плода можно собрать из кровообращения плода у корня плаценты с использованием иглы, управляемой ультразвуком (Daffos et al., 153 Am. J. Obstet. Gynecol. 655-60 (1985); Daffos et al., 146 Am. J. Obstet. Gynecol. 985-87 (1983), пункцией плаценты (Valenti, 115Am. J. Obstet. Gynecol. 851-53 (1973); Cao et al., 19 J. Med. Genet. 81-87 (1982)), фетоскопией (Rodeck, in PRENATAL DIAGNOSIS, (Rodeck and Nicolaides, eds., Royal College of Obstetricians and Gynaecologists, London, 1984)). Действительно, ворсинки хориона и амниотическая жидкость в дополнение к пуповиной крови и плаценте являются источниками плюрипотентных фетальных стволовых клеток (смотри WO 2003 042405), которые могут быть обработаны модуляторами HCS согласно настоящему изобретению.
Известны различные наборы и устройства для сбора, обработки и хранения пуповинной крови. Смотри, например, патенты США № 7147626, № 7131958. Сбор следует осуществлять в стерильных условиях, и кровь может быть обработана антикоагулянтом. К таким антикоагулянтам относятся растворы цитрат-фосфат-декстроза, кислый цитрат-декстроза, раствор Олсвера (Alsever and Ainslie, 41 N. Y. St. J. Med. 126-35 (1941), раствор ДеГовина (DeGowin et al., 114 J.A.M.A. 850-55 (1940)), эдглугат-Mg (Smith et al., 38 J. Thorac. Cardiovasc. Surg. 573-85 (1959)), раствор Рауса-Тюрнера (Rous and Turner 23 J. Exp. Med. 219-37 (1916)), другие смеси с глюкозой, гепарин или этилбискумацетат. Смотри Hum Storage of Blood 26-160 (Acad. Press, NY, 1968).
Различные способы известны в данной области и могут быть использованы для обогащения собранной пуповинной крови клетками HCS. Такие способы включают без ограничения равновесное центрифугирование в градиенте плотности, гравитационное осаждение при скоростном центрифугировании, иммунное розеткообразование и иммунную адгезию, сепарация при проточном центрифугировании, истощение по T-лимфоцитам и сортировку клеток с активированной флуоресценцией, отдельно или в комбинации. Смотри, например, патент США № 5004681.
Обычно собранную кровь готовят для криогенного хранения добавлением криопротекторных средств, таких как ДМСО (Lovelock and Bishop, 183 Nature 1394-95 (1959); Ashwood-Smith 190 Nature 1204-05 (1961)), глицерин, поливинилпирролидин (Rinfret 85 Ann. N. Y. Acad. Sci. 576-94 (I960)), полиэтиленгликоль (Sloviter and Ravdin 196 Nature 899-900 (1962)), альбумин, декстран, сахароза, этиленгликоль, i-эритрит, D-рибит, D-маннит (Rowe,