Смягчающая композиция
Иллюстрации
Показать всеИзобретение относится к косметической промышленности и представляет собой дерматологическую композиция, которая в качестве активного ингредиента содержит комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле, где вазелин имеет температуру каплепадения от 51°С до 57°С, консистенцию от 175 1/10 мм до 195 1/10 мм (конусная пенетрация при 25°С) и вязкость от 4 сСт до 5 сСт при 100°С. Изобретение обеспечивает улучшение стабильности при хранении и лечение небольших поверхностных ожогов и обострений экзематозного процесса. 6 н. и 17 з.п. ф-лы, 3 пр., 1 табл., 1 ил.
Реферат
Изобретение относится к области лечения патологий и состояний, ассоциированных с защитной функцией пораженной кожи.
Эпидермис представляет собой постоянно обновляющийся слоистый эпителий эктодермального происхождения.
Он защищает организм от обезвоживания, механических стрессов и атак определенных патогенных микроорганизмов.
Он состоит из нескольких слоев клеток: более чем на 90% из кератиноцитов, но также из клеток Лангерганса, клеток Меркеля и меланоцитов.
В направлении от внутренней стороны к внешней стороне можно различить отдельные слои различной морфологической природы и клеточного состава: базальный слой, представляющий собой клеточный слой, кератиноциты которого обладают способностью к очень сильной пролиферации, обеспечивающей самовосстановление эпидермиса, далее надбазальные слои (зернистый слой, шиповатый слой) и в конце роговой слой (SC).
Одной из фундаментальных функций кожи является обеспечение барьера между организмом и внешней средой, препятствующего в одном направлении проникновению в эпидермис грибков, бактерий и аллергенов из окружающей среды и в другом направлении потере воды.
Качество защитной функции оценивают in vivo у человека путем измерения неощущаемой потери воды и скорости гидратирования, а у мыши на основании эмбриональной смертности в результате обезвоживания, на основании проницаемости кожи для красителей или по уменьшению массы тела.
Целостность внеклеточного цемента липидной природы, а также всех клеточных элементов рогового слоя, и равновесие между пролиферацией и дифференцировкой кератиноцитов являются существенными для поддержания функциональной защитной функции эпидермиса.
Градиент рН регулирует активности различных ферментов и таким образом вносит вклад в равновесие данного барьера.
Посредством регуляции секреции слоистых телец в зернистый слой концентрация ионов кальция влияет на состав внеклеточного цемента рогового слоя и таким образом на равновесие эпидермального барьера (Lee et al., Calcium and potassium are important regulators of barrier homeostasis in murine epidermis, J. Clin. Invest., 89, 530-538, 1992).
Существование водного градиента, который изменяется в диапазоне от 70% в видимых слоях эпидермиса до 30% в более низких слоях SC и до 15% в самых внешних клеточных слоях эпидермиса (Warner et al., Electron probe analysis of human skin: determination of the water concentration profile, J. Invest. Dermatol., 90, 218-224, 1988) говорит о том, что некоторая часть воды удерживается в месте контакта между зернистым слоем и роговым слоем.
Одна из функций воды в роговом слое заключается в обеспечении возможности реакций ферментативного гидролиза, необходимых для эластичности кожи и нормального отслоения (рогового слоя эпидермиса). Если количество воды, присутствующей в SC, уменьшается ниже критического порога, ферментативные реакции нарушаются, что приводит к адгезии корнеоцитов и аккумуляции клеток на поверхности кожи. Это проявляется в заметной сухости и кожном зуде, отслаиваниях кожи и шелушениях.
Гидратирование кожи основывается на двух явлениях: снабжении водой за счет трансэпидермального потока из кровотока и удерживании воды в эпидермисе, которая приводит в действие защитную функцию кожи. Однако барьер в плане потери воды не является абсолютным. Нормальное движение обмениваемой воды между внешней средой и внутренней средой через роговой слой называется TEWL (трансэпидермальная потеря воды) и составляет часть неощущаемой потери воды.
Защитная функция кожи нарушается при большинстве кожных патологий, наиболее широко распространенных среди населения, и часто сопровождается воспалительным компонентом (псориазом, атопическим дерматитом, ихтиозом, сухостью кожи и т.д.). Она также нарушается со временем при большом числе физиологических состояний (старение кожи) или под действием окружающей среды (УФ лучи, уровень влажности, загрязнение, ожоги).
Нарушение защитной функции, хроническое или острое, делает организм более чувствительным к внешним атакам и обезвоживанию. Это может быть связано с нарушением отслоения и с гиперпролиферацией (Jackson et al., Pathobiology of the stratum corneum, West J. Med., 158, 279-285, 1993).
Заявка на патент FR 2847467 относится к применению по меньшей мере одного модулятора активности оксистерол-7а-гидроксилазы для изготовления косметической композиции для предупреждения и/или лечения расстройств кожи и/или слизистой, нарушающих надлежащее функционирование кожного барьера.
Заявка на патент FR 2831443 относится к применению по меньшей мере одного экстракта гингко билоба (Gingko biloba) или маслины европейской (Olea europaea) для приготовления композиции для улучшения защитной функции кожи.
Заявка на патент FR 2905857 относится к применению композиции, содержащей экстракт мякоти плода рожкового дерева для гидратирования кожи и/или защиты кожи от высыхания.
Существует необходимость в лечении патологий и состояний, ассоциированных с защитной функцией пораженной кожи.
Авторами изобретения было замечено, что удивительным и неожиданным образом комбинация глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле может лечить сухие состояния кожи.
Авторы изобретения продемонстрировали, что эта комбинация восстанавливает защитное и функциональное состояние кожного барьера. Авторы изобретения оценивали увлажняющую активность этой комбинации и последующее улучшение защитной функции кожи, используя модель индуцированного обезвоживания кожи ex vivo. Кроме того, они следили за экспрессией молекулярных эпидермальных маркеров, потенциально вовлеченных в гомеостаз эпидермальной защитной функции, используя количественную ПЦР и иммуногистохимический анализ.
Кроме этого авторы изобретения отслеживали активность сериновых протеаз, использую зимографию in situ, и функциональность кожного барьера, используя флуоресцентные зонды. Результаты показывают, что комбинация глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле восстанавливает активность сериновых протеаз и подавляет стресс-индуцированное воспаление.
Авторы изобретения также продемонстрировали, что конкретно выбор вазелина в этой комбинации является особенно эффективным для достижения представленных выше результатов. Вазелин в качестве вызывающего окклюзию средства и смягчающего средства особенно важен в композиции. Действительно, формируя защитную пленку на коже, он помогает компенсировать недостаток нарушенной защитной функции. Качество образованной на коже пленки очень сильно зависит от реологических свойств вазелина, используемого в изготовлении.
Таким образом, задачей настоящего изобретения является композиция для местного применения, которая в качестве активного ингредиента содержит комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле.
В контексте настоящего изобретения "активная комбинация" означает комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле.
Предпочтительно, глицерин, вазелин и вазелиновое масло удовлетворяют критериям, описанным и установленным в соответствии с "Европейской фармакопеей" 6-го издания.
Предпочтительно, вазелин активной комбинации имеет температуру каплепадения от 35°С до 70°С, предпочтительно от 51°С до 57°С, и особенно предпочтительно приблизительно 54°С. Температуру каплепадения измеряют в соответствии с методом 2.2.17, описанным в "Европейской фармакопее" 6-го издания.
Предпочтительно, вазелин активной комбинации имеет консистенцию от 175 1/10 мм до 195 1/10 мм, предпочтительно приблизительно 185 1/10 мм (конусная пенетрация при 25°С).
Предпочтительно, вазелин активной комбинации имеет вязкость от 4 сСт до 5 сСт при 100°С, предпочтительно приблизительно 4,8 сСт при 100°С.
Предпочтительно, вазелин активной комбинации характеризуется спектром спектроскопии ЯМР (ядерного магнитного резонанса) углерода-13 (13С) (500 МГц), содержащим пик при 24,55 млн-1, площадь которого относительно контроля 1%-го тетраметилсилана (TMS) составляет 4-8.
В композициях по изобретению доля активной комбинации составляет от 10% до 50% и предпочтительно от 20% до 30% по массе по сравнению с общей массой композиции; концентрация глицерина составляет от 5% до 30%, предпочтительно от 10% до 20% и более предпочтительно составляет приблизительно 15% по массе по сравнению с общей массой композиции; концентрация вазелина составляет от 3% до 20%, предпочтительно от 5% до 10% и особенно предпочтительно составляет приблизительно 8% по массе по сравнению с общей массой композиции, а концентрация вазелинового масла составляет от 0,5% до 5%, предпочтительно от 1% до 3% и особенно предпочтительно приблизительно 2% по массе по сравнению с общей массой композиции.
В водной фазе вода составляет от 30% до 80% по массе по сравнению с общей массой композиции.
Предпочтительно, композиция по изобретению состоит из приблизительно из 15% глицерина, приблизительно 8% вазелина и приблизительно 2% вазелинового масла по массе по сравнению с общей массой композиции.
Дерматологическая композиция по изобретению дополнительно содержит стандартные дерматологически совместимые эксципиенты.
Дерматологическая композиция по настоящему изобретению может быть приготовлена в виде эмульсии типа масло-в-воде (W/O) или вода-в-масле (O/W), в виде множественной эмульсии, такой как, например, эмульсия типа вода/масло/вода (W/O/W) или эмульсия типа масло/вода/масло (O/W/O), или также в форме гидродисперсии или липодисперсии, геля или аэрозоля.
Дерматологически совместимыми эксципиентами может быть любой эксципиент среди эксципиентов, известных специалисту в данной области техники для приготовления композиции для местного применения в форме крема, лосьона, геля, мази, эмульсии, микроэмульсии, спрея и т.д.
В частности, композиция по изобретению может содержать добавки и вспомогательные вещества к композициям, такие как эмульгаторы, загустители, гелеобразующие агенты, влагоудерживающие агенты, усиливающие растекание агенты, стабилизаторы, красители, отдушки и консерванты.
Подходящие эмульгаторы включают стеариновую кислоту, троламин и ПЭГ-40-стеарат.
Предпочтительно, в композиции по изобретению имеется приблизительно 5% эмульгатора по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 1% до 5% стеариновой кислоты, предпочтительно приблизительно 3% по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 0% до 2% троламина, предпочтительно приблизительно 0,5% по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 0% до 2% ПЭГ-40-стеарата, предпочтительно приблизительно 0,5% по массе по сравнению с общей массой композиции.
Подходящие загустители включают глицерина моностеарат и ПЭГ 600.
Предпочтительно, в композиции по изобретению имеется приблизительно 5% загустителей по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 2% до 10% глицерина моностеарата, предпочтительно приблизительно 5% по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 2% до 10% ПЭГ 600, предпочтительно приблизительно 5% по массе по сравнению с общей массой композиции.
Подходящие консерванты включают пропил-парагидроксибензоат и хлоркрезол.
Предпочтительно, в композиции по изобретению имеется приблизительно 0,1% консервантов по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 0,05% до 1% пропил-парагидроксибензоата, предпочтительно приблизительно 0,1% по массе по сравнению с общей массой композиции.
Подходящие усиливающие растекание агенты включают диметикон и полидиметилциклосилоксан.
Предпочтительно, в композиции по изобретению имеется приблизительно 2% усиливающих растекание агентов по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 0,2% до 2% диметикона, предпочтительно приблизительно 0,5% по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 1% до 3% полидиметилциклосилоксана, предпочтительно приблизительно 2,5% по массе по сравнению с общей массой композиции.
Подходящие влагоудерживающие агенты включают полиэтиленгликоль, предпочтительно полиэтиленгликоль 600.
Предпочтительно, в композиции по изобретению имеется приблизительно 8% влагоудерживающих агентов по массе по сравнению с общей массой композиции.
Предпочтительно, в композиции по изобретению имеется от 2% до 10% полиэтиленгликоля, предпочтительно приблизительно 5% по массе по сравнению с общей массой композиции.
Водой, используемой для водной фазы эмульсии может быть дистиллированная или термальная вода, обладающая дермато-косметическими свойствами.
Предпочтительно, композиция по изобретению состоит из:
- приблизительно 15% глицерина,
- приблизительно 8% вазелина,
- приблизительно 2% вазелинового масла, и в качестве эксципиентов:
- приблизительно от 1% до 5% стеариновой кислоты,
- приблизительно от 2% до 10% глицерина моностеарата,
- приблизительно от 1% до 3% полидиметилциклосилоксана,
- приблизительно от 0,2% до 2% диметикона,
- приблизительно от 2% до 10% полиэтиленгликоля 600,
- приблизительно от 0% до 2% троламина,
- приблизительно от 0,05% до 1% пропил-парагидроксибензоата,
- до 100% воды.
Кроме того задачей настоящего изобретения является применение композиции по изобретению для изготовления лекарственного средства для лечения состояний сухой кожи, ассоциированных с определенными видами дерматоза, такими как атопический дерматит, ихтиозные состояния и псориаз.
Задачей настоящего изобретения также является применение композиции по изобретению для изготовления лекарственного средства для лечения небольших поверхностных ожогов.
Кроме того, задачей настоящего изобретения является применение композиции по изобретению для изготовления лекарственного средства для предупреждения и/или лечения и/или снижения частоты возникновения и интенсивности обострений экзематозного процесса, наблюдаемых среди пациентов, страдающих от атопического дерматита.
Настоящее изобретение проиллюстрировано следующими далее примерами.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
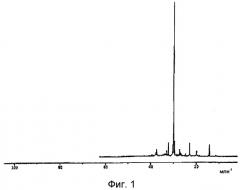
Фиг.1: спектр ЯМР углерода-13 (500 МГц) для 5 г образца вазелина Syntadex A (Syntheal) и композиции А.
ПРИМЕРЫ
Пример 1. Композиции
Композиция А
- 15 г глицерина,
- 8 г вазелина,
- 2 г вазелинового масла,
- 0,5 г троламина,
- и в качестве эксципиентов: стеариновая кислота, глицерина моностеарат, полидиметилциклосилоксан, диметикон, полиэтиленгликоль (ПЭГ) 600, пропил-парагидроксибензоат,
- вода до 100 г.
Композиция А'
- 15 г глицерина,
- 8 г вазелина,
- 2 г вазелинового масла,
- 1,5 г стеариновой кислоты,
- 5 г глицерина моностеарата,
- 1,5 г полидиметилциклосилоксана,
- 0,5 г диметикона,
- 5 г полиэтиленгликоля 600,
- 0,15 г троламина,
- 0,1 г пропил-парагидроксибензоата,
- вода до 100 г.
Композиция В
- 15 г глицерина,
- 8 г вазелина,
- 2 г вазелинового масла,
- 0,5 г ПЭГ-40-стеарата,
- и в качестве эксципиентов: стеариновая кислота, глицерина моностеарат, полидиметилциклосилоксан, диметикон, полиэтиленгликоль 600, хлоркрезол,
- вода до 100 г.
Композиция В'
- 15 г глицерина,
- 8 г вазелина,
- 2 г вазелинового масла,
- 3 г стеариновой кислоты,
- 5 г глицерина моностеарата,
- 2 г полидиметилциклосилоксана,
- 0,5 г диметикона,
- 0,1 г троламина,
- 3 г полиэтиленгликоля 600,
- 0,5 г ПЭГ-40-стеарата,
- 0,075 г хлоркрезола,
- вода до 100 г.
Пример 2: анализ регуляции индуцированного обезвоживания кожи
Здесь авторы изобретения оценивают увлажняющую активность композиции А и последующее улучшение защитной функции кожи, используя модель индуцированного обезвоживания кожи ex vivo.
Авторы изобретения наблюдают за экспрессией различных молекулярных эпидермальных маркеров с помощью количественной ПЦР (полимеразной цепной реакции) и иммуногистохимического анализа.
Кроме этого авторы изобретения отслеживают активность ферментов - сериновых протеаз, используя зимографию in situ, и деградацию десмосомальных белков роговой оболочки, используя вестерн-блоттинг.
Функциональность кожного барьера анализируют, используя флуоресцентные зонды.
Материалы и методы
I. Модели ткани
1. Подготовка эксплантатов кожи
Лаборатория получает образцы кожи из отходов после операций пластической хирургии (по уменьшению молочной железы). Использование этих образцов подпадает под "Декларацию о деятельности по консервации и препарированию элементов человеческого тела для нужд научной программы группы Пьера Фабра" ("the declaration of an activity for preserving and preparing elements of the human body for the needs of a research program of the Pierre Fabre group"), утвержденной министерством высшего образования и научных исследований Франции.
Эти образцы промывают в 10 промывках PBS и затем с помощью штамповального пресса вырезают диски диаметром 2 см. Эксплантанты кожи расстилают на сетке в чашке Петри и, чтобы ограничить площадь обработки, на кожу укладывают кольцо диаметром 1 см.
2. Кинетики моделей
Для индуцирования модели обезвоживания кожу высушивают в течение 2 часов в вытяжном шкафу для клеточных культур в чашке без крышки и затем помещают в инкубатор на 2 часа для местной обработки в присутствии или в отсутствие активной комбинации. Отрицательный контроль обезвоживающего стресса подвергается той же самой кинетике в закрытой чашке Петри.
3. Образцы для анализа
После обработки отбирают 2 образца биоптата диаметром 6 мм для анализа экспрессии РНК, а биоптат диаметром 4 мм помещают в полимерный блок Tissue Tek® (Sakura Finetek) для гистологического исследования. Для анализа белков кожу подвергают воздействию теплового шока в водяной бане при 60°С в течение 5 минут и затем в бане при 4°С в течение 2 минут, чтобы отделить эпидермис от дермы.
Биоптаты и образцы эпидермиса замораживают в жидком азоте и хранят при -80°С до проведения анализа.
II. Анализ транскриптома посредством количественной ПЦР
Кожные биоптаты измельчают в ступке, заранее охлажденной жидким азотом, и РНК экстрагируют, используя набор RNeasy® (QIAGEN) в соответствии с рекомендациями поставщика. Затем РНК анализируют с использованием Bioanalyzer 2100® (Agilent Technologies) на РНК-чипах 6000 Nano LabChip®. кДНК получают из 1 мкг РНК посредством ферментативной реакции ретротранскрипции, проводимой с использованием набора Access RT-PCR Core Reagents® (Promega) с олиго-dT-праймерами. Уровни экспрессии генов анализируют посредством количественной ПЦР в флуоресцентном термоциклере iCycler iQ® (Biorad), используя наборы для ПЦР iQ™ с красителем супермикс зеленым SYBR® (Biorad) в в соответствии с протоколом из 40 циклов, включающих в себя денатурацию при 95°С (15 с) и элонгацию при 60°С (1 мин). Накопление продукта ПЦР, пропорциональное эмиссии флуоресценции (интеркалирующий краситель SYBR®Green), наблюдают цикл за циклом, используя программное обеспечение iCycler.
Аналитическое программное обеспечение iCycler, версия 3.1, выдает приближенные величины Ст (порогового цикла), цикла, с которого начинается регистрация амплификации кДНК. Параллельно выполняют анализ экспрессии нескольких генов сравнения, используя программу Genorm, версию 3.4, что позволяет отобрать наиболее стабильный ген сравнения для каждого образца. Затем этот ген используют в качестве сравнения для нормирования результатов, рассчитывая ΔСT=СT представляющего интерес гена - СT гена сравнения.
Затем рассчитывают фактор индукции (IF) для каждой обработки по отношению к соответствующему контрольному состоянию. IF=2-ΔΔCT, где ΔΔСT=ΔСT после обработки - ΔСT контроля. Экспрессию мРНК оценивают в двух повторах для пяти экспериментов для 5 различных индивидуумов. Если фактор индукции относительно контроля составляет больше 2, считается, что экспрессия гена индуцирована, а если меньше 0,5, считается, что экспрессия репрессирована. Влияние активного начала на ответ на стресс, вызываемый в модели, оценивают как процент ингибирования, рассчитанный по следующей формуле:
(% ингибирования ответа на стресс)=100×(((IF после стресса) - (IF контроля в отсутствие стресса)) - ((IF после обработки) - (IF контроля в отсутствие стресса)))/((IF после стресса) - (IF контроля в отсутствие стресса)).
В рамках исследуемой модели состояние "контроль в отсутствие стресса" соответствует контролю в отсутствие сушки; состояние "после стресса" соответствует кожному биоптату, который сушили в течение 2 часов и который затем находился 2 дополнительных часа в условиях контроля (то есть без местной обработки); и наконец состояние "после обработки" относится к коже, которую в течение 2 часов подвергали сушке, затем в течение 2 часов местной обработке смягчающим средством.
III. Анализ белковой экспрессии вестерн-блоттингом
Подвергнутые обработке образцы эпидермиса измельчают в ступке, охлажденной жидким азотом, и белки экстрагируют в лизирующем буфере RIPA (50 мМ Трис HCl, рН 8; 150 мМ NaCl; 1% Тритона X 100; 1% дезоксихолата Na+; 0,1% SDS (додецилсульфата натрия); 5 мМ EDTA (этилендиаминтетрауксусная кислота); 100 мМ DTT (дитиотриит); коктейль ингибиторов протеаз (Р8340, SIGMA).
Затем белки анализируют, используя метод анализа белков в присутствии восстанавливающих агентов и детергентов (RC-DC Protein Assay) (Biorad), и анализируют вестерн-блоттингом. Для каждого состояния на гели (7,5%-ый полиакриламид, трис-глицин) наносят по 25 мкг - 40 мкг общего белка. Смесь белков разделяют электрофорезом, используя систему Mini Protean II (Biorad), и белки переносят на мембрану PVDF (поливинилиденфторид) (Hybond-P, Amersham). Представляющий интерес белок выявляют, используя специфичное к нему антитело и набор ECL+(Amersham). Количество белков и долю деградированной формы рассчитывают, используя программное обеспечение Image Master TotaILab, версию 1.11 (Amersham) после нормирования на (3-актин (белок сравнения).
IV. Гистологические методики
Кожные биоптаты разрезают, используя криотом (Leica CM 3050s), на срезы толщиной 5 мкм и помещают на предметные стекла для изучения (Starfrost®).
1. Иммуногистохимический анализ
Криосрезы фиксируют в течение 10 минут в ацетоне при 20°С и затем регидрируют PBS перед проведением анализа посредством иммуногистохимического мечения. После фиксации и регидрирования проводят насыщение кожных срезов 3%-ым раствором BSA (бычьего сывороточного альбумина) и инкубируют в течение 1 часа с первичным антителом к представляющему интерес белку. Далее их инкубируют в течение 1 часа со вторичным антителом, конъюгированным с флуорохромом Alexa-488 или Alexa-555, и окончательно укрепляют в мовиоле (Mowiol), содержащем DAPI (4',6-диамидино-2-фенилиндол) для мечения ядер.
2. Зимография in situ
После фиксации в течение 10 минут в ацетоне при -20°С срезы промывают в промывающем растворе (1%-ом Твине 20 в воде) и инкубируют в течение 2 часов при 37°С с раствором, содержащим специфический субстрат представляющих интерес ферментов, конъюгированный с флуорофором (вторичный). Когда фермент активен, флуорофор отщепляется, испуская сигнал флуоресценции, который можно наблюдать под микроскопом. Затем меченые предметные стекла разглядывают под микроскопом с эпифлуоресценцией (Nikon Eclipse 50i) или под инвертированным конфокальным микроскопом Zeiss Axiovert 100.
3. Флуоресцентный зонд
После обезвоживающей обработки эксплантаты кожи дополнительно инкубируют в течение одного часа в инкубаторе при 37°С с флуоресцентным зондом дилитиевой солью карбокси-гидрозида люциферового желтого красителя (Invitrogen) в концентрации 1 мМ в буфере HBSS (сбалансированный солевой раствор Хенка). После этого кожу промывают в ванночке с HBSS в течение 1 минуты и затем отбирают образцы биоптатов диаметром 4 мм и помещают в полимеризующуюся массу Tissue TekR® (Sakura Finetek) (Matsuki et al., 1998). Затем кожу разрезают на секции, ядра окрашивают с помощью DAPI и предметные стекла разглядывают под флуоресцентным микроскопом с длиной волны 450 нм, как описано выше.
Результаты
I. Модель нарушения защитной функции индуцированным высушиванием
1. Измерение проницаемости кожи с использованием флуоресцентного зонда
Первый анализ заключался в изучении фундаментального функционального параметра защитной функции кожи: проницаемости верхних слоев эпидермиса. Инкубация кожи с флуоресцентным зондом (люциферовым желтым) после эксперимента с высушиванием позволила охарактеризовать изменение проницаемости кожи. Для контрольного состояния включение метки является очень слабым и поверхностным; зонд слабо проникает через роговой слой и удаляется во время промывки. После двух часов высушивания включение метки наблюдается в более глубоких пластах рогового слоя. Высушивание делает кожу более проницаемой; ее защитная функция ухудшается. Местная обработка композицией А после двух часов высушивания восстанавливает непроницаемость SC для зонда; включение метки опять слабое и поверхностное, такое же, как для контрольного состояния. Ввиду этого можно сделать заключение, что увлажняющая обработка оказывает восстанавливающий эффект на высушенную кожу и на защитную функцию кожи, наблюдаемую в данной модели ткани.
2. Влияние на регуляцию транскриптома и протеома
Экспрессию различных генов, потенциально вовлеченных в гомеостаз эпидермальной защитной функции, измеряли с использованием количественной ПЦР в различных стрессовых состояниях или при различной обработке в модели сушки. Иммуногистохимический анализ показал наличие перестройки экспрессии некоторых белков в плане локализации, например, белков межклеточных контактов. Анализ деградации десмосомальных белков роговой оболочки проводили, используя вестерн-блоттинг.
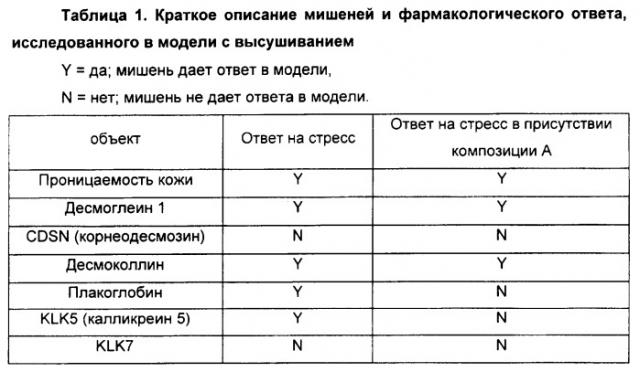
Мишени, исследованные с использованием этих разных подходов, объединяли в группы в соответствии с их физиологической ролью (см. Таблицу 1). Цель этого исследования заключается в обнаружении наблюдаемого ответа на стресс и коррекции данного эффекта стресса посредством местного применения композиции А.
В выполненной работе также продемонстрированы различные уровни регуляции определенных мишеней. Таким образом, отмечается, что ферменты, обуславливающие отслаивание, не регулируются на уровне транскрипции, а более конкретно, регулируются на уровне их активности (сравн. Результаты 3).
3. Измерение ферментативной активности, имеющей отношение к отслаиванию
Активность сериновых протеаз оценивали с использованием зимографии in situ на модели обезвоживания и наблюдали с использованием конфокального микроскопа в контрольном состоянии после двух часов высушивания и после двух часов высушивания с последующей инкубацией с композицией А в течение двух часов. Включение метки наиболее интенсивно в контрольном состоянии; оно соответствует нормальной сильной активности. Это включение метки уменьшается и становится неравномерным вдоль по роговому слою после двух часов высушивания, в то время как его интенсивность усиливается и локализация активности преобразуется после двух часов инкубации с композицией А. Высушивание оказывает влияние на уменьшение и нарушение ферментативной активности. Эти результаты согласуются с уменьшением деградации десмосомальных белков роговой оболочки, наблюдаемой при высушивании, и подтверждают влияние высушивания на уменьшение отслаивания, наблюдаемое в разработанной модели. Композиция А способна восстанавливать ферментативную активность обезвоженной кожи, что подтверждает влияние этой композиции на восстановление гомеостаза отслаивания.
Эти результаты показывают, что применение композиции А восстанавливает уровень экспрессии молекулярных мишеней, экспрессия которых повышается под действием стресс-индуцированного обезвоживания кожи. С помощью композиции А также возможно восстановление активности сериновой протеазы. Кроме того, местное применение композиции А позволяет устранить стресс-индуцированное воспаление.
В целом эти результаты позволяют предположить, что композиция А при местном применении восстанавливает защитную функцию кожи
Пример 3. Характеристика вазелина Syntadex А посредством ЯМР
5 г образца солюбилизируют в дейтерированном хлороформе для измерения посредством ЯМР углерода-13 (500 МГц).
Вазелин Syntadex A (Syntheal) демонстрирует характерный спектр ЯМР углерода-13 (500 МГц), в частности, содержащий пик при 24,55 млн-1, площадь которого относительно контроля 1%-го тетраметилсилана (TMS) составляет 4-8.
Такой же аналогичный пик обнаружен в композиции А.
1. Дерматологическая композиция, которая в качестве активного ингредиента содержит комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле, где вазелин имеет температуру каплепадения от 51°С до 57°С, консистенцию от 175 1/10 мм до 195 1/10 мм (конусная пенетрация при 25°С) и вязкость от 4 сСт до 5 сСт при 100°С.
2. Дерматологическая композиция по п.1, где вазелин характеризуется спектром ЯМР-спектроскопии углерода-13 (500 МГц), содержащим пик при 24,55 млн-1, площадь которого относительно контроля 1%-ного тетраметилсилана (TMS) составляет от 4 до 8.
3. Дерматологическая композиция по п.1, где вазелин имеет температуру каплепадения 54°С.
4. Дерматологическая композиция по п.1, где вазелин имеет консистенцию приблизительно 185 1/10 мм (конусная пенетрация при 25°С).
5. Дерматологическая композиция по п.1, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
6. Дерматологическая композиция по п.4, где вазелин имеет температуру каплепадения 54°С.
7. Дерматологическая композиция по п.3, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
8. Дерматологическая композиция по п.4, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
9. Дерматологическая композиция по п.6, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
10. Дерматологическая композиция по п.2, где вазелин имеет температуру каплепадения 54°С.
11. Дерматологическая композиция по п.2, где вазелин имеет консистенцию приблизительно 185 1/10 мм (конусная пенетрация при 25°С).
12. Дерматологическая композиция по п.2, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
13. Дерматологическая композиция по п.11, где вазелин имеет температуру каплепадения 54°С.
14. Дерматологическая композиция по п.10, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
15. Дерматологическая композиция по п.11, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
16. Дерматологическая композиция по п.13, где вазелин имеет вязкость приблизительно 4,8 сСт при 100°С.
17. Дерматологическая композиция по п.1, содержащая приблизительно 15% глицерина, приблизительно 8% вазелина и приблизительно 2% вазелинового масла.
18. Дерматологическая композиция по п.1, содержащая один или более эксципиентов, выбранных из группы, состоящей из стеариновой кислоты, глицерина моностеарата, полидиметилциклосилоксана, диметикона, полиэтиленгликоля 600, троламина, пропил-парагидроксибензоата, хлоркрезола, ПЭГ-40-стеарата, дистиллированной воды.
19. Применение дерматологической композиции по любому из пп.1-18 для изготовления лекарства для лечения состояний сухой кожи при определенных видах дерматоза, таких как атопический дерматит, ихтиозные состояния и псориаз.
20. Применение дерматологической композиции по любому из пп.1-18 для изготовления лекарства для лечения небольших поверхностных ожогов.
21. Применение дерматологической композиции по любому из пп.1-18 для изготовления лекарства для предупреждения, и/или лечения, и/или снижения частоты возникновения и интенсивности обострений экзематозного процесса, наблюдаемых среди пациентов, страдающих от атопического дерматита.
22. Применение вазелина с температурой каплепадения от 51°С до 57°С для изготовления композиции для местного применения, которая в качестве активного ингредиента содержит комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле.
23. Применение вазелина, характеризующегося спектром ЯМР-спектроскопии углерода-13 (500 МГц), содержащим пик при 24,55 млн-1, площадь которого относительно контроля 1%-ного тетраметилсилана (TMS) составляет от 4 до 8, для изготовления композиции для местного применения, которая в качестве активного ингредиента содержит комбинацию глицерина, вазелина и вазелинового масла в форме эмульсии типа масло-в-воде или вода-в-масле.