Способ получения биологически активной наножидкости на основе наночастиц оксида железа (ii, iii) и производного 3-гидроксипиридина
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ приготовления биологически активной дисперсной системы, представляющей собой наножидкость на основе наночастиц оксида железа (II, III). Способ отличается тем, что готовят 3-6% раствор поливинилпирролидона низкомолекулярного 8000±2000, в котором растворитель представляет собой жидкость, содержащую 2,75-5,5 г натрия хлорида, 0,21-0,42 г калия хлорида, 0,25-0,5 г кальция хлорида, 0,00025-0,005 г магния хлорида, 0,115-0,23 г натрия бикарбоната и дистиллированную воду до 1 л, доставляют полученный раствор к смеси порошка наночастиц оксида железа (II, III), класса USPIO, с размерами 5-8 нм, осажденных на кристаллы натрия хлорида, взятого из расчета 1-10 мг на мл дисперсной системы, и субстанции производного 3-гидроксипиридина, взятой из расчета 1-200 мг на мл дисперсной системы, тщательно перемешивают и выдерживают при +60°С на протяжении 2 часов, полученную жидкость постепенно охлаждают до комнатной температуры (+20°С) с последующим отделением осадка. Изобретение обеспечивает получение наножидкости за одну стадию и без токсичных реагентов, а стабильность наножидкости, размеры композитных наночастиц в ней и биологическая активность ингредиентов обеспечивают перспективность ее биомедицинского применения. 2 з.п. формулы, 4 ил., 7 табл. 3 пр.
Реферат
Изобретение принадлежит к области нанотехнологий, а именно к получению наножидкости, которая может быть использована в медицине.
Свойства наночастиц оксида железа (II, III) (магнетита) определяют перспективы их применения для контрастирования во время магнитно-резонансной томографии, а также для лечения злокачественных новообразований и фармакологической коррекции анемических состояний [Petri-Fink A. Superparamagnetic iron oxide nanoparticles (SPIONs): from synthesis to in vivo studies - a summary of the synthesis, characterization, in vitro, and in vivo investigations of SPIONs with particular focus on surface and colloidal properties / A. Petri-Fink, H. Hofmann // IEEE Trans. Nanobioscience. - 2007. - Vol.6(4). - P. 289-297]. Применение супермагнитных наночастиц возможно только при условии придания им необходимой лекарственной формы. В этом плане особый интерес представляют композитные наночастицы, которые характеризуются сочетанием различных свойств в одной частице (так называемые core-shell nanoparticles) [Behrens S. Preparation of functional magnetic nanocomposites and hybrid materials: recent progress and future directions / S. Behrens // Nanoscale. - 2011. - Vol.3. - P. 877-892]. На их основе разрабатывают жидкие дисперсные системы, которые содержат инкапсулированные наночастицы и пригодны для парентерального введения [Highly water-dispersible biocompatible magnetite particles with low cytotoxicity stabilized by citrate groups / J. Liu, Z. Sun, Y. Deng [et al.] // Angew Chem. Int. Ed. Engl. - 2009. - Vol.48(32). - P.5875-5879]. Важными аспектами биомедицинского применения таких систем являются их поглощение макрофагами и токсичность, которые обусловливаются полимерными агентами, образующими «ракушку» (shell) [Differential proteomics analysis of the surface heterogeneity of dextran iron oxide nanoparticles and the implications for their in vivo clearance / D. Simberg, J.H.Park, P.P.Karmali [et al.] / Biomaterials. - 2009. - Vol.23-24. - P. 3926-3933].
Описано получение наножидкости для обеззараживания объектов окружающей среды от возбудителей инвазивных заболеваний, которая содержит электрически заряженные наночастицы металлов (серебра, меди, магния, цинка), полученные с помощью электроимпульсной абляции, и воду [Пат. 39407 UA, МПК A61L 2/16. Нанородiина для знешкодження об'єктiв довкiлля вiд збудникiв iнвазiшних хвороб / Волошина Н.О. (UA); Каплуненко В.Г. (UA); Кочнов М.В. (UA); Салова М.В. (UA); заявник та власник патенту Волошина И.О. (UA); Каплуненко В.Г. (UA); Косшов М.В. (UA); Салова М.В. (UA). - №u200811521; заявл. 25.09.2008; опубл. 25.02.2009, бюл. №4, 2009]. Однако эта жидкость содержит гальванизированные наночастицы, которые могут терять заряд под влиянием внешних факторов, что будет сопровождаться изменениями дисперсности. Кроме того, такая жидкость не содержит железа и предназначенная лишь для обработки предметов окружающей среды.
Известен способ получения поверхностно-модифицированных наночастиц для иммобилизации биологически активных веществ, который заключается в том, что производят модификацию содержащих сложноэфирные группы наночастиц магнетита (Fe3O4), обрабатывают полученные частицы амино-пропил-3-этилетоксисиланом, инкубируют с конденсирующим агентом и используют их для иммобилизации фермента [Пат. 2425879 C1 RU, МПК C12N 11/14; С07В 43/04. Способ получения поверхностно-модифицированных наночастиц для иммобилизации биологических веществ / Просеков А.Ю. (RU), Солдатова Л.С.(RU), Бабич О.О. (RU); заявитель и патентообладатель Гос. образ, учреждение высшего проф. образования «Кемеровский технол. ин-т пищевой промышленности» (RU). - №2010105590/10; заявл. 16.02.2010; опубл. 10.08.2011]. Недостатком данного способа является то, что он узко направлен на получение иммобилизованных ферментов, является сложным и многостадийным, причем одна из стадий осуществляется в газовой среде, а также нуждается, кроме наночастиц магнетита и фермента, в дополнительных токсичных ингредиентах, которые необходимо специально отмывать.
Для диагностики состояния островковых клеток поджелудочной железы созданы супермагнитные частицы оксида железа, инкапсулированные N-[2-гидрокси-3-метил-аммоний]-пропил]-хитозана хлоридом, который растворим в широком диапазоне рН, имеет катионные свойства, поверхностную активность, противомикробное и противогрибковое действие [Pat. 201114438 (A) TW, IPC A61K 35/39; A61K 49/12. Methods of using HTCC-coated superparamagnetic iron oxide nanoparticles to label islet cells and applying the same to islet cell transplantation / Zhuang Jun-Huang (TW); Cai Rui-Can (TW); Shen Jia-Rui (TW); Wang Jun-Jie (TW); Yan Zi-Chen (TW); applicant Chang Gung Medical Foundation (TW). - №TW 20100140986; applic. 26.11.2010; public. 01.05.2011]. Такие покрытые наночастицы хорошо поглощаются трансплантированными клетками островков и уменьшают их повреждение меткой во время ядерного магнитного резонанса, но они не предназначены для действия на другие клетки с лечебной целью.
Предложен способ получения силикато-инкапсулированных магнитных наночастиц [Pat. 2011274832 (Al) US, IPC B05D 5/12. Method for silica encapsulation of magnetic particles / Dai Qiu (US); Nelson Alshakim (US); applicant International Business Machines Corporation (US). № US 20100775439; applic. 06.05.2010; public. 10.11.2011]. Он заключается в том, что супермагнитные наночастицы CoFe2O4 модифицируют поликислотами и обрабатывают тетра-алкил-орто-силикатами или триалкил-окси-алкилсиланами с целью образования «ракушки», регулируя толщину которой можно управлять магнитным взаимодействием наночастиц и поддерживать стабильность дисперсной системы. Описанный способ позволяет получить стабильную наножидкость, но использованные полимеры и силикаты не имеют лечебных свойств, являются ксенобиотиками и потенциально могут вызвать напряжение и (или) нарушение детоксикационных процессов в организме.
Известен способ получения диспергированных ультрамалых супермагнитных наночастиц, покрытых поли-(этиленгликоль)-фумаратом [Pat. 2011223112 (A1) US, IPC A61K 49/18; А61Р 35/00. Unsaturated polyester coated magnetic ultra-fine particles for biological applications / Morteza Mahmoudi (IR); Imani Mohammad (IR); Simchi Abdolreza (IR); applicant Iran Polymer And Petrochemical Institute (IR). - №US 20100723646; applic. 14.03.2010; public. 15.09.2011]. Такой наноматериал с модифицированной поверхностью имеет перспективы применения как контрастный агент и носитель для доставки и прицельного высвобождения лекарственных веществ, но его компоненты, образующие «ракушку», не имеют лечебных свойств.
Существует способ приготовления композитных магнитных наночастиц, покрытых глицерилмоноолеатом, с хорошей растворимостью в воде, низкой токсичностью и функциолизованными группами на их поверхности [Pat. 2009346580 (A1) AU, IPC A61K 31/231; A61K 33/26; A61K 9/51. Water dispersible glyceryl monooleate magnetic nanoparticle formulation / Kumar Sahoo Sanjeeb (AU); Fahima Dilnawaz (AU); Singh Singh Abhalami (AU); applicant Institute Of Life Sciences (AU). - № AU 20090346580; applic. 12.11.2009; public. 27.10.2011]. Недостатками этого способа является сложная технология получения наножидкости и необходимость нагрузки наночастиц терапевтическим агентом.
Описан способ получения и применения полимерных наночастиц, покрытых магнитным оксидом металла [Pat. 2399610 (А2) ЕР, IPC A61K 41/00; A61K 47/48; A61K 49/18; B82Y 5/00. Polymer nanoparticles coated by magnetic metal oxide and uses thereof / Margel Shlomo (IL); Perlstein Benny (IL); Brodie Chaya (US); Mikkelsen Tom (US); applicant Bar-Ilan University (IL); Henry Ford Hospital (US). - № EP 20110164795; US 20070960270P; applic. 24.09.2008; public. 28.12.2011]. Он раскрывает получение дисперсной среды, содержащей композитные наночастицы, в состав которых входит желатин как полимер, образующий хелатные связи с оксидом железа. Последний может быть представлен магнетитом, магемитом или их смесью. Активный агент (контрастное вещество, краситель, пептид, пептидомиметик или малая молекула) ковалентно связывается с хелатообразующим полимером или присоединяется к магнитному оксиду железа. Для стабилизации наночастиц и связывания внешних функциональных групп используют полимер (полисахарид, протеин или полиэтиленгликоль), в частности, декстран. Дисперсные системы на основе таких наночастиц могут служить основой для фармацевтических композиций и проявляют биологическую активность в культуре клеток и в экспериментах на животных. Недостатком данного способа является то, что сами наночастицы, в сущности, выполняют только функцию доставки активного агента, присоединенного к ним, а их получение происходит в несколько стадий.
Наиболее близким к заявляемому способу (прототипом) является одностадийный способ получения магнетит-декстрановых наночастиц, которые содержат карбоксильные группы и синтезируются без применения органических растворителей и сурфактантов [The one-pot synthesis of dextran-based nanoparticles and their application in in-situ fabrication of dextran-magnetite nanocomposites / H. Dou, B. Xu, K. Tao [et al.] // J. Mater. Sci. Mater. Med. - 2008. - Vol.19(7). - P. 2575-2580]. Этот способ заключается в том, что наночастицы на основе декстрана применяют для роста и организации наночастиц магнетита в водной среде со щелочной реакцией. Приведенный способ достаточно простой, но биологическая активность таких композитных наночастиц ограничена лишь свойствами самого нанооксида железа.
Таким образом, недостатками известных способов является то, что вещества, которые применяются для инкапсулирования наночастиц оксида железа (или других металлов) и образования мицелл не имеют лечебных свойств, а в некоторых случаях являются токсичными, что требует их отмывания во время приготовления дисперсной системы.
Задачей изобретения является расширение арсенала способов получения наножидкостей (дисперсных систем), которые содержат наночастицы оксида железа (II, III), класса USPIO (ультрамалые суперпарамагнитные наночастицы оксида железа, ultrasmall superparamagnetic iron oxide nanoparticles) за счет применения новых веществ, которые обеспечивают модификацию и диспергирование супермагнитных наночастиц и имеют собственные лечебные свойства.
Поставленная задача решается путем совместного применения наночастиц оксида железа (II, III), производного 3-гидроксипиридина и низкомолекулярного поливинилпирролидона в ходе приготовления наножидкости, которое отличается тем, что осуществляется в одну стадию с использованием биологически активных веществ, а именно производного 3-гидроксипиридина для модификации наночастиц и поливинилпирролидона низкомолекулярного для их стабилизации.
Способ воспроизводится следующим образом.
Наночастицы оксида железа (II, III), класса USPIO 5-20 нм, осажденные направленным паровым потоком на поверхность исходных кристаллов натрия хлорида, получают электронно-лучевой технологией в вакууме и используют в виде порошковой субстанции. Полученные известным образом частицы имеют содержание железа в диапазоне 0,1-30% от массы субстанции [Мовчан Б.А. Твердо- и жидкофазные медицинские субстанции с наноразмерной структурой, осаждаемые из паровой фазы в вакууме (электронно-лучевая технология) / Б.А.Мовчан. - Нанотехнологiï у фармацiï та медицинi: Матерiали мiжнародноï науково-практичноï конференцiï у, м. Харкiв, Украïна, 13-14 жовтня 2011 р. - Харкiв, 2011. - С.130-132]. В данном изобретении использовали порошковую субстанцию с наночастицами оксида железа (II, III) USPIO размером 5-8 нм, осажденными на кристаллы натрия хлорида. Предпочтительное содержание железа 20-30%. В наиболее предпочтительном варианте субстанция с наноразмерной структурой имеет состав в масс.%: железо - 26,9%; натрий - 22,5%; хлор - 34,4%; кислород - 16,2%.
В настоящее время в мире разрешен к применению лишь один противоанемический препарат на основе наночастиц окида железа (II, III) - ферумокситол, или «Feraheme®» (AMAG Pharmaceuticals, Inc., USA) [Rosner M.H.Ferumoxytol for the treatment of iron deficiency / M.H.Rosner, M.Auerbach // Expert. Rev. Hematol. - 2011. - Vol.4(4). - P.399-406]. Доза этого препарата в клинических испытаниях составляла 1-4 мг Fe/кг [Landry R. Pharmacokinetic study of ferumoxytol: a new iron replacement therapy in normal subjects and hemodialysis patients / R.Landry, P.M.Jacobs, R.Davis [et al.] // Am. J.Nephrol. - 2005. - Vol.25(4). - P.400-410].
Для получения наножидкости согласно изобрению используют также субстанцию производного 3-гидроксипиридина. Указанные производные относятся к известному классу соединений, который включает широкий ряд веществ, проявляющих биологические свойства [Дюмаев К.М. Строение и реакционная способность производных 3-оксипиридина при электрофильном замещении / К.М. Дюмаев, Л.Д. Смирнов // Успехи химии. - 1975. - Т.44, №10. - С.1788-1804]. Класс соединений проявляет антиоксидантные свойства и широко используется в медицине [Фармакология антиоксидантов на основе 3-оксипиридина / В.Е. Новиков, Л.А. Ковалева, С.О. Лосенкова [и др.] // Режим доступа к статье: http://www.mexifln.ru/nauka_st_9.php].
Согласно изобретению магнитную жидкость могут образовывать любые соединения группы 3-гидроксипиридинов, но наиболее эффективны 2,6-диалкил-3-гидроксипиридины, предпочтительно 2-третбутил-6-метил- и 2-этил-6-метил-3-гидроксипиридины, такие как 2-этил-6-метил-3-гидроксипиридина сукцинат («Мексидол») и 2-этил-6-метил-3-гидроксипиридина гидрохлорид («Эмоксипин»).
Самое широкое распространение в настоящее время из данной группы получила субстанция этилметилгидроксипиридина сукцината, который представляет собой белое кристаллическое вещество с эмпирической формулой C12H17NO5 и молярной массой 255,26 г/моль, хорошо растворимое в воде и этиловом спирте, малорастворимое в эфире и нерастворимое в хлороформе, имеющее максимум поглощения при длине волны 297±2 нм при идентификации методом ультрафиолетовой спектроскопии [Этилметилгидроксипиридина сукцинат. Субстанция-порошок. Производитель: ООО «Бион». Per. номер: ЛСР-001704/07-260707].
2-этил-6-метил-3-гидроксипиридина сукцинат применяется в медицине (лекарственный препарат «Мексидол» и др.) и проявляет антиоксидантное, антигипоксантное, анксиолитическое, ноотропное действие, улучшает функции миокарда и печени, способствует восстановлению кроветворения на фоне его угнетения [Воронина Т.А. Антиоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия / Т.А. Воронина // Психофармакология и биологическая наркология. - 2001. - №1. - С.2-12; Мексидол и сочетанная сосудистая патология мозга и сердца / Р.С. Мирзоян, Т.С. Ганыыина, М.А. Лебедева [и др.] // Эксперим. и клин, фармакология. - 2011. - Т.74, №6. - С.20-23; Влияние мексидола на пострадиационное восстановление системы гемопоэза / В.В. Мороз, Ю.Б. Дешевой, Г.В. Сукоян [и др.] // Радиац. биол. радиоэколог.- 2009. - Т. 49, №1. - С.91-96].
Летальная доза 2-этил-6-метил-3-гидроксипиридина сукцината, которая вызывает гибель 50% животных (ЛД50), равняется для крыс 820 мг/кг и для мышей 475 мг/кг, а при пероральном введении - более 3000 мг/кг у крыс и 2010 мг/кг у мышей. Сопоставление эффективных терапевтических доз (ЭД) мексидола (10-300 мг/кг) с токсичными и летальными дозами показывает значительную терапевтическую широту и безопасность средства: терапевтический индекс, вычисленный как соотношение ЛД50/ЭД50 составляет 16,4 [Воронина Т.А. МЕКСИДОЛ® основные эффекты, механизм действия, применение [Электронный ресурс] / Т.А. Воронина. - Режим доступа: http://medi.ru/doc/a070196.htm].
Третий компонент, который использован для создания наножидкости по изобретению представляет собой поливинилпирролидон низкомолекулярный (повидон), который имеет молекулярную массу 8000±2000 Дальтон. Данный комонент известен как субстанция для производства препарата Гемодез-Н. Это порошок белого или желтоватого цвета со слабым специфическим запахом, легко растворяется в воде, спирте, хлороформе, не растворимый в эфире. По степени влияния на организм принадлежит к 4 классу опасности - мало опасные вещества [Поливинилпирролидон низко-молекулярный медицинский 8000±2000. Фармакопейная статья ФСП 42-0345-4367-03: PN002600/01-2003. - [Действующий от 2008-06-17]. - [Электронный ресурс]. - Режим доступа: http://www.sintvita.ru/docs/povidone8000.pdf].
Для выполнения способа порошок наночастиц оксида железа (II, III), класса USPIO, размерами 5-8 нм, осажденных на кристаллы натрия хлорида, взвешивают с точностью до четвертого знака и вносят в сухую стеклянную или пластиковую пробирку (или колбу) в количестве из расчета 1-10 мг на мл дисперсной системы, которое в будущий дисперсной системе достаточно для создания концентрации, эквивалентной эффективной дозе наножелеза как противоанемического агента.
Субстанцию производного 3-гидроксипиридина взвешивают с точностью до четвертого знака и в сухом виде прибавляют к порошку наночастиц в количестве из расчета 1-200 мг на мл дисперсной системы, которое достаточное для создания концентрации, эквивалентной эффективной дозе этого препарата.
Делают точную навеску поливинилпирролидона низкомолекулярного медицинского, достаточную для приготовления необходимого объема 3-6% раствора этого вещества, используя как растворитель жидкость, содержащую 2,75-5,5 г натрия хлорида, 0,21-0,42 г калия хлорида, 0,25-0,5 г кальция хлорида, 0,00025-0,005 г магния хлорида, 0,115- 0,23 г натрия бикарбоната и дистиллированную воду до 1 л.
Прибавляют полученный 3-6% раствор поливинилпирролидона низкомолекулярного к смеси порошков наночастиц оксида железа и производного 3-гидроксипиридина, тщательно перемешивают встряхиванием до максимально возможного уменьшения осадка и выдерживают при +60°С на протяжении 2 часов. Полученную жидкость постепенно охлаждают до комнатной температуры (+20°С), отделяют от осадка и хранят закрытой при этих условиях. рН полученной жидкости составляет 4,0-8,0, что позволяет использовать ее в том числе для парентерального введения.
В качестве критерия для оценки физико-химических свойств наножидкости выбирают лазерную корреляционную спектроскопию и атомно-эмиссионную спектрометрию, которые позволяют определить размеры наночастиц, их распределение по размеру, массовую долю отдельных фракций и концентрацию железа в образцах наножидкости.
Изобретение иллюстрируется следующими примерами.
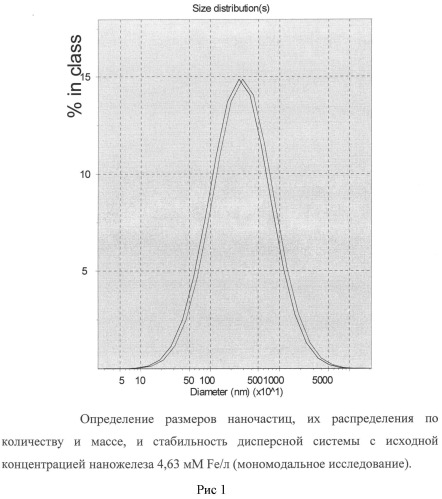
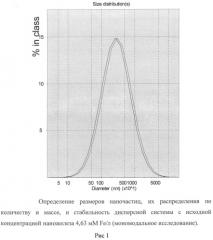
Пример 1. Наножидкость готовили следующим образом. Порошок наночастиц оксида железа (II, III), класса USPIO, размерами 5-8 нм, осажденных на кристаллы натрия хлорида, взвешивали с точностью до четвертого знака и вносили в сухую пластиковую пробирку в количестве 1 мг порошка на 1 мл дисперсной системы, что достаточно для создания концентрации 0,263 мг Fe/мл (4,69 мМ Fe/л) при условии полного диспергирования навески.
Субстанцию 2-этил-6-метил-3-гидроксипиридина сукцината взвешивали с точностью до четвертого знака и в сухом виде прибавляли к порошку наночастиц оксида железа в количестве 20 мг на 1 мл дисперсной системы, создавая концентрацию 2% или 78,4 мМ/л.
Делали точную навеску поливинилпирролидона низкомолекулярного медицинского и готовили 3% раствор этого вещества, используя как растворитель жидкость, содержащую 2,75 г натрия хлорида, 0,21 г калия хлорида, 0,25 г кальция хлорида, 0,003 г магния хлорида, 0,115 г натрия бикарбоната и дистиллированную воду до 1 л.
Прибавляли 3% раствор поливинилпирролидона низкомолекулярного к смеси порошков наночастиц оксида железа и 2-этил-6-метил-3-гидроксипиридина сукцината, тщательно перемешивали встряхиванием до максимально возможного уменьшения осадка, после чего жидкость выдерживали при +60°С на протяжении 2 часов. Полученную жидкость охлаждали до комнатной температуры, отделяли от осадка отстаиванием и подвергали анализу, используя лазерную корреляционную спектроскопию и атомно-эмиссионную спектрометрию.
Полученная жидкость прозрачная, гомогенная, имеет желтоватый цвет.
По данным лазерной корреляционной спектроскопии жидкость содержит два типа частиц. Малые - наночастицы размерами около 30-40 нм; их общая масса составляет 5% от массы всех частиц, а количество преобладающее - 99,9%. Крупные частицы имеют средний диаметр 4,5 мкм; их общая масса составляет 95% от массы всех частиц, а количество - менее 0,1%. Образец стабилен во времени. Результаты исследования приведены на рисунках 1 и 2.
По данным атомно-эмиссионной спектрометрии концентрация железа в приготовленной жидкости составляет 11,6±0,04 мг/л (в среднем 0,21 мМ Fe/л).
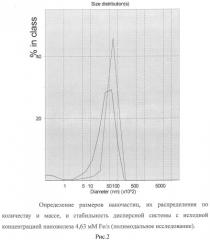
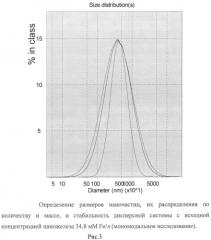
Пример 2. Содержание железа в наножидкости увеличивали за счет изменений соотношения ингредиентов.
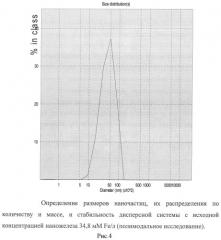
Для этого наножидкость готовили, как описано в примере 1, но порошок наночастиц оксида железа (II, III), класса USPIO, размерами 5-8 нм, осажденных на кристаллы натрия хлорида, брали в количестве 7,5 мг порошка на 1 мл дисперсной системы, что достаточно для создания концентрации 1,95 мг Fe/мл (34,8 мМ Fe/л) при условиях полного диспергирования навески.
В качестве субстанции 3-гидроксипиридина использовали 2-этил-6-метил-3-гидроксипиридина гидрохлорид (эмоксипин) в количестве 150 мг на 1 мл дисперсной системы, что создает концентрацию 15%, или 588 мМ/л.
Поливинилпирролидон низкомолекулярный медицинский использовали в виде 6% раствора, который дополнительно содержит в 1 л 5,5 г натрия хлорида, 0,42 г калия хлорида, 0,5 г кальция хлорида, 0,005 г магния хлорида, 0,23 г натрия бикарбоната.
Полученную жидкость, как и в примере 1, после охлаждения до комнатной температуры, отделяли от осадка и подвергали анализу методом лазерной корреляционной спектроскопии и атомно-эмиссионной спектрометрии.
Полученная жидкость прозрачная, гомогенная, бурого цвета.
По данным лазерной корреляционной спектроскопии жидкость содержит наночастицы размерами от 10 до 100 нм. Средний размер этих частиц - 39,4 нм. Их массовая часть равна 0,3%, а количество - 99%». В образце также присутствуют крупные частицы со средним диаметром 4,7 мкм. Их общая масса составляет 99,7%» от массы всех частиц, а количество - менее 1%. Образец стабилен по распределению частиц и во времени.
Результаты исследования приведены на рисунках 3 и 4.
По данным атомно-эмиссионной спектрометрии концентрация железа в приготовленной жидкости составляет 392,7±15,0 мг/л (в среднем 7,02 мМ Fe/л).
Пример 3. Изучение биологической активности наножидкости при острой кровопотере
Материалы и методы. В эксперименте использованы белые крысы-самцы линии Вистар массой 180-200 г (Биомодельсервис, Киев). Проведено 2 серии опытов по изучеию действия наножидкости и ее компонентов через 3 часа и через 72 часа после кровопотери. Группировка опытов в каждой серии имеет следующий вид при 5-6 животных в каждой группе: 1. Интактные; 2. Кровопотеря+вода для инъекций; 3. Кровопотеря+наночастицы оксида железа (ПДП) (НЧЖ); 4. Кровопотеря+2-этил-6-метил-3-гидроксипиридина сукцинат; 5. Кровопотеря+поливилпирролидон низкомолекулярный (ПВП); 6. Кровопотеря+2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП; 7. Кровопотеря+2-этил-6-метил-3-гидроксипиридина сукцинат+НЧЖ 8.Кровопотеря+ПВП+НЧЖ; 9. Кровопотеря+2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ; 10. Кровопотеря+препарат сравнения (феррум-лек).
Острую кровопотерю (острую постгеморрагическую анемию) моделировали путем забора из сердца 25% циркулирующенй крови под эфирным наркозом [Доктлiчнi дослiдження лiкарсысих засобiв: метод, рекомендацiï / [наук. ред. О.В. Стефанов]. - К.: Авiцена, 2001. - 527 с].
Жидкость, содержащую наночастицы оксида железа (ИДИ), осажденные на натрия хлорид, в дозе 1 мг/мл, 2-этил-6-метил-3-гидроксипиридина сукцинат (20 мг/мл) и ПВП низкомолекулярный (ЗОмг/мл) вводили животным по 1 мл внутрибрюшинно непосредственно после забора крови. В качестве групп сравнения использовали введение НЧЖ, 2-этил-6-метил-3-гидроксипиридина сукцинат, ПВП или их комбинаций «НЧЖ+2-этил-6-метил-3-гидроксипиридина сукцинат», «НЧЖ+ПВП», «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП» в тех же дозах.
НЧЖ диспергировали в воде для инъекций в соотношении 1 мг нанопорошка/1 мл воды и вводили животным после кровопотери. В пересчете на железо доза составляла 1,35 мг Fe/кг.
Раствор 2-этил-6-метил-3-гидроксипиридина сукцината готовили ех tempore на воде для инъекций и вводили животным интраперитонеально в дозе 20 мг/мл на 1 животное (100 мг/кг) непосредственно после кровотери.
3% раствор ПВП вводили интраперитонеально в дозе 1 мл/животное (5 мл/кг, что равно 150 мг ПВП/кг).
Для изучения комбинированного действия веществ НЧ диспергировали в вышеуказанных растворах 2-этил-6-метил-3-гидроксипиридина сукцината или ПВП, а субстанцию 2-этил-6-метил-3-гидроксипиридина сукцината растворяли в 3% растворе ПВП. Животным контрольной группы водили 1 мл воды для инъекций.
В качестве препарата сравнения использовали феррум-лек (ЛЕК, Словения) для внутримышечного введения в дозе 0,075 мл/кг, что в пересчете на железо составляет 3,75 мг Fe/кг и равно половине расчетной дозы для полной компенсации воспроизведенной кровопотери [Машковский М.Д. Лекарственные средства- М: Новая Волна, 2006. - 1206 с]. Феррум-лек разводили непосредственно перед использованием и вводили животным внутрибрюшинно после забора крови.
Через 3 и 72 часа крыс выводили из опыта под эфирным наркозом. Кров забирали из сердца и подвергали исследованию. Производили гематологический анализ [Погорелов В.М. Лабораторно-клиническая диагностика анемий / В.М. Погорелов, Г.И. Козинец, Л.Г. Ковалева. - М.: МИА, 2004. - 173 с], в ходе которого оценивали общее количество эритроцитов (RBC), общий гемоглобин (Hb) и гематокрит (Hct). Определяли число ретикулоцитов в крови [Руководство к практическим занятиям по клинической лабораторной диагностике / [М.А.Базарнова, В.Т.Морозова, И.Н.Заика и др.]; под. ред. М.А.Базарновой, В.Т.Морозовой. - К.: Выш. шк., 1988. - 318 с]. Также определяли содержание продуктов, которые реагируют с тиобарбитуровой кислотой (ТБКАП) [Гаврилов В.Б.Анализ методов определения продуктов перекисного окисления липидов в сыворотке крови по тесту с тиобарбитуровой кислотой / В.Б.Гаврилов, А.Р.Гаврилова, Л.М.Мажуль // Вопросы медицинской химии. - 1987. - Т.33, №1. - С.118-122] и активность ключевого фермента антиоксидантной защиты супероксиддисмутазы (СОД) в эритроцитах [Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы / Т.В. Сирота // Вопросы медицинской химии. - 1999. - №3. - С.263-272].
Полученные результаты статистически обрабатывали с помощью стандартных компьютерных программ Microsoft Excel. Для сравнения эффективности наножидкости «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» и препарата феррум-лек расчитывали, какую часть (%) от условной нормы (параметров интактных животных) составляют показатели после применения указанных средств.
Результаты исследования
A. Эффекты наножидкости, содержащей наночастицы оксида железа, 2-этил-6-метил-3-гидроксипиридина сукцинат (мексидол) и ПВП, в раннем сроке после острой кровопотери
Через 3 часа после кровопотери RBC снижается на 32%, (р<0,001), общий гемоглобин падает на 38% (р<0,001) и уменьшается гематокрит на 25% (р<0,001) по сравнению с интактными животными (табл.1).
| Таблица 1 | |||
| Влияние наножидкости и ее компонентов на гематологические показатели в раннем сроке (3 часа) после острой кровопотери (М±т) | |||
| Группы животных | RBC, 1012/л | Hct, единицы | Hb, г/л |
| 1. Интактные | 7,51±0,23 | 0,4±0,01 | 140,7±3,3 |
| 2. Кровопотеря, 3 часа | 5,1±0,15* | 0,3±0,01* | 87,8±2,8* |
| 3. Кровопотеря+НЧЖ | 5,82±0,28 | 0,33±0,02 | 104,2±4,9** |
| 4. Кровопотеря+мексидол | 5,72±0,27 | 0,33±0,02 | 103,0±5,8 |
| 5, Кровопотеря+ПВП | 6,23±0,43 | 0,36±0,02** | 112,8±9,3** |
| 6. Кровопотеря+мексидол+ПВП | 5,64±0,23 | 0,32±0,02 | 95,0±5,0 |
| 7. Кровопотеря+мексидол+НЧЖ | 5,85±0,15** | 0,33±0,01 | 103,0±2,8** |
| 8. Кровопотеря+ПВП+НЧЖ | 5,54±0,1** | 0,32±0,01 | 106,3±1,7** |
| 9. Кровопотеря+мексидол+ПВП+НЧЖ | 6,41±0,51** | 0,34±0,02 | 106,2±7,4** |
| Примечания: 1. * -р<0,05 по сравнению с интактными животными;2. ** -р<0,05 по сравнению с кровопотерей. |
НЧЖ вызывают тенденцию к увеличению RBC на 14% (р<0,1), повышают гемоглобин на 18% (р<0,05) и практически не влияют на гематокрит по сравнению с кровопотерей без фармакокоррекции (см. табл.1). 2-этил-6-метил-3-гидроксипиридина сукцинат действует аналогично по степени изменения параметров, но это имеет характер тенденции (р<0,1). ПВП увеличивает число эритроцитов на 22% (р<0,1), достоверно улучшает гематокрит на 20% и гемоглобин на 28% (р<0,05). Сочетание 2-этил-6-метил-3-гидроксипиридина сукцината с ПВП не вызывает достоверных изменений гематологических параметров по сравнению с кровопотерей. Композиция «2-этил-6-метил-3-гидроксипиридина сукцинат+НЧЖ» достоверно увеличивает RBC на 15% (р<0,01) и гемоглобин на 17% (р<0,01). Композиция «ПВП+НЧЖ» достоверно увеличивает RBC на 9% (р<0,05) и Hb на20%(р<0,005).
Наножидость «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» повышает число эритроцитов на 26% (р<0,05) и Hb на 21% (р<0,05), а также вызывает тенденцию к увеличению гематокрита (р<0,25).
Таким образом, наножидость состава «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» по выраженности эффекта в отношении восстановления числа эритроцитов через 3 часа после кровопотери опережает другие исследованные вещества и их композиции, а по действию на гематокрит и гемоглобин приближается к эффекту ПВП, который в данной ситуации продемонстрировал наибольшее влияние на показатели «красной крови».
О регенераторной реакции костного мозга судили по числу ретикулоцитов в крови. Через 3 часа после кровопотери содержание ретикулоцитов в крови такое же, как у интактных животных (табл.2).
Введение НЧЖ увеличивает содержание ретикулоцитов на 31% (р<0,1) по сравнению с кровопотерей без фармакокоррекции. 2-этил-6-метил-3-гидроксипиридина сукцинат повышает этот показатель в той же мере, что, однако, не достоверно. ПВП не влияет на содержание ретикулоцитов при острой кровопотере. Совместное введение 2-этил-6-метил-3-гидроксипиридина сукцината и ПВП вызывает повышение числа ретикулоцитов на 56% (р<0,01) по сравнению с патологическим фоном. Комбинированное введение 2-этил-6-метил-3-гидроксипиридина сукцината и НЧЖ увеличивает этот показатель на 62% (р<0,05). В то же время ПВП+НЧЖ и наножидкость состава «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» не вызывают существенных изменений числа ретикулоцитов через 3 часа после кровопотери.
Таким образом, по степени активации регенераторной реакции костного мозга через 3 часа после острой кровопотери наножидкость состава «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» уступает ее составляющим и, по-видимому, в эту фазу компенсации кровопотери реализует свой протективный эффект за счет других механизмов.
| Таблица 2 | |
| Влияние наножидкости и ее компонентов на содержание ретикулоцитов в | |
| крови в раннем сроке (3 часа) после острой кровопотери (М±т) | |
| Группы животных | Ретикулоциты, %о |
| 1. Интактные | 60,0±9,7 |
| 2. Кровопотеря, 3 часа | 62,3±4,3 |
| 3. Кровопотеря+НЧЖ | 81,4±7,5 |
| 4. Кровопотеря+мексидол | 82,8±16,3 |
| 5, Кровопотеря+ПВП | 69,0±7,5 |
| 6. Кровопотеря+мексидол+ПВП | 97,0±8,1** |
| 7. Кровопотеря+мексидол+НЧЖ | 101,2±13,8** |
| 8. Кровопотеря+ПВП+НЧЖ | 57,0±2,1 |
| 9. Кровопотеря+мексидол+ПВП+НЧЖ | 64,5±4,1 |
| Примечания: 1. * - р<0,05 по сравнению с интактными животными; | |
| 2. **- р<0,05 по сравнению с кровопотерей. |
Потеря крови характеризуется резким возрастанием содержания промежуточных продуктов перекисного окисления липидов (ПОЛ) в эритроцитах на 272% (р<0,001) по сравнению с интактными животными (табл.3).
НЧЖ вызывают тенденцию к уменьшению содержания этих веществ на 36% (р<0,1). 2-этил-6-метил-3-гидроксипиридина сукцинат, ПВП и «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП» снижают содержание продутов ПОЛ в эритроцитах на 75-87% (р<0,001). Композиция «2-этил-6-метил-3-гидроксипиридина сукцинат+НЧЖ» уменьшает этот показатель на 60% (р<0,002), «ПВП+НЧЖ» - на 88% (р<0,001).
Наножидкость «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» снижает уровень ТБКАП в эритроцитах на 54%» (р<0,05) по сравнению с кровопотерей без фармакокоррекции. Это свидетельствует, что в использованных соотношениях НЧЖ не отменяют антиоксидантное действие 2-этил-6-метил-3-гидроксипиридина сукцината, хотя и вызывают его ослабление.
| Таблица 3 | ||
| Влияние наножидкости и ее компонентов на показатели перекисного оксиления липидов в раннем сроке (3 часа) после острой кровопотери (М±т) | ||
| Группы ЖИВОТНЫХ | ТБКАП, ед.экстинкции/мл | СОД, % торможения |
| 1. Интактные | 3,01±0,49 | 54,3±3,8 |
| 2. Кровопотеря | 11,21±1,97* | 52,6±5,0 |
| 3. Кровопотеря+НЧЖ | 7,15±1,35 | 56,4±6,2 |
| 4. Кровопотеря+мексидол | 2,13±0,73** | 62,0±4,5 |
| 5, Кровопотеря+ПВП | 1,48±0,41** | 73,6±6,9** |
| 6. Кровопотеря+мексидол+ПВП | 2,84±1,33** | 60,2±1,9 |
| 7. Кровопотеря+мексидол+НЧЖ | 4,50±0,82** | 49,1±4,4 |
| 8. Кровопотеря+ПВП+НЧЖ | 1,36±0,61** | 60,0±1,2 |
| 9. Кровопотеря+мексидол+ПВП+НЧЖ | 5,12±1,45** | 68,4±3,8** |
| Примечания: 1. * - р<0,05 по сравнению с итактными животными; | ||
| 2. ** - р<0,05 по сравнению с кровопотерей. |
Через 3 часа после потери крови активность СОД в эритроцитах сохраняет нормальное значение (см. табл. 3). Она не изменяется после введения животным НЧЖ. В то же время введение самого 2-этил-6-метил-3-гидроксипиридина сукцината характеризуется тенденцией к повышению активности этого антиоксидантного фермента на 18% (р<0,25). Под действием ПВП активность СОД в эритроцитах увеличивается на 40% (р<0,05) по сравнению с патологическим фоном. Введение животным жидкостей состава «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП» и «ПВП+НЧЖ» сопровождается тенденцией к увеличению активности СОД на 14% (р<0,25). Состав «2-этил-6-метил-3-гидроксипиридина сукцинат+НЧЖ» также не вызывает существенных изменений активности фермента.
Наножидкость, содержащая 2-этил-6-метил-3-гидроксипиридина сукцината+ПВП+НЧЖ достоверно повышает активность СОД в эритроцитах на 30% (р<0,05), что в данной ситуации более выражено, чем эффект других изученных веществ и композиций за исключением ПВП.
По данным проведенного исследования можно утверждать, что композиция «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ», перспективна для коррекции ранних компенсаторных реакций при острой кровопотери, т.к. одновременно улучшает показатели «красной крови» и уменьшает ПОЛ в эритроцитах, что проявляются уже через 3 часа после потери крови и по ряду показателей превосходят эффеты отдельных компонентов этой жидкости.
Б. Эффекты наножидкости, содержащей наночастицы оксида железа, 2-этил-6-метил-3-гидроксипиридина сукцинат (мексидол) и ПВП, в позднем сроке после острой кровопотери
Через 72 часа после кровопотери RBC снижено на 18%, (р<0,001) по сравнению с интактными животными (табл.4). В этот период Hct меньше нормы на 17% (р<0,001), а Hb - на 15% (р<0,1).
| Таблица 4 | |||
| Влияние наножидкости и ее компонентов на гематологические показатели в позднем сроке (72 часа) после острой кровопотери (М±m) | |||
| Группы животных | RBC, 1012/л | Hct, единицы | Hb, г/л |
| 1. Интактные | 7,25±0,13 | 0,41±0,010 | 139,3±3,7 |
| 2. Кровопотеря 72 часа | 5,97±0,18* | 0,34±0,010* | 119±12,9 |
| 3. Кровопотеря+НЧЖ | 6,26±0,04 | 0,37±0,005** | 150,0±4,0** |
| 4. Кровопотеря+ | 5,38±0,17** | 0,35±0,010 | 134,0±2,5 |
| мексидол | |||
| 5. Кровопотеря+ПВП | 5,77±0,09 | 0,34±0,004 | 136,3±1,2 |
| 6. Кровопотеря+мексидол+ПВП | 6,24±0,20 | 0,37±0,010 | 141,0±3,4 |
| 7. Кровопотеря+мексидол+НЧЖ | 6,32±0,10 | 0,38±0,006** | 146,3±2,5 |
| 8. Кровопотеря+ПВП+НЧЖ | 6,46±0,14 | 0,37±0,010 | 144,2±3,1 |
| 9. Кровопотеря+мексидол+ПВП+НЧЖ | 6,27±0,06 | 0,38±0,003** | 144,0±3,0 |
| Примечания: 1. * - р<0,05 по сравнению с интактными животными;2. **-р<0,05 по сравнению с кровопотерей. |
В сроке 72 часа после кровопотери НЧЖ вызывают тенденцию к увеличению RBC на 5% (р<0,25), достоверно повышают Hb на 26% (р<0,05) и Hct на 9% (р<0,05) по сравнению с кровопотерей без фармакокоррекции (см. табл.4). 2-этил-6-метил-3-гидроксипиридина сукцинат не улучшает основные показатели «красной крови» в позднем сроке после потери крови и даже снижает число эритроцитов по сравнению с патологическим фоном (р<0,05). ПВП существенно не влияет на гематологические параметры. Сочетанное применение 2-этил-6-метил-3-гидроксипиридина сукцината с ПВП в отдаленном сроке после потери крови не вызывает достоверных изменений RBC, но сопровождается тенденцией к увеличению Hct на 9% (р<0,1) и Hb на 18%о (р<0,25). При использовании жидкости, содержащей 2-этил-6-метил-3-гидроксипиридина сукцинат+НЧЖ, изменения гематологических параметров подобны тем, которые вызывает предыдущее сочетание веществ, но увеличение Hct носит достоверный характер (р<0,01). Введение жидкости, содержащей ПВП+НЧЖ, вызывает аналогичную тенденцию к улучшению содержения эритроцитов в крови, гематокрита и гемоглобина (р<0,1).
Эффект наножидкости «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» через 72 часа проявляется тенденцией к увеличению RBC на 5% (р<0,25) и Hb на 21% (р<0,1) на фоне достоверного повышния Hct на 12% (р<0,005) по сравнению с кровопотерей без фармакологической коррекции.
Таким образом, наножидость состава «2-этил-6-метил-3-гидроксипиридина сукцинат+ПВП+НЧЖ» по степени восстановления основных показателей «красной крови» через 72 часа после кровопотери опережает 2-этил-6-метил-3-гидроксипиридина сукцинат и ПВП и действует примерно так, как их композиции с НЧЖ или сами НЧЖ.
Срок 72 часа после потери крови соответствут переходу гипергидремической фазы компенсации кровопотери в костномозговую [Покровський В.М. Физиология человека: учебник [для