Способ очистки вируса гриппа
Иллюстрации
Показать всеИзобретение относится к биотехнологии и описывает способ получения очищенного концентрата вируса гриппа, способ включает микрофильтрацию вирусосодержащей аллантоисной жидкости на фильтрующих элементах 0,1-0,2 мкм с дальнейшей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, концентрирование вируса гриппа на мембранах с порогом отсечения 300-500 кДа с последующей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, 0,02-0,002% анионного детергента и ультрацентрифугирование в градиенте плотности сахарозы, приготовленной на фосфатном буферном растворе, содержащем 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия и 0,02-0,002% анионного детергента. Технический результат изобретения заключается в получении высокоочищенного концентрата вируса гриппа с выходом более 80%, оптимизации технологического процесса. 3 пр., 2 табл.
Реферат
Изобретение относится к биотехнологии и может быть использовано в производстве противогриппозных субъединичных и спплит-вакцин, применяемых для профилактики гриппа и острых респираторных вирусных заболеваний.
Несмотря на достижения медицины, грипп остается одной из самых насущных медико-социальных проблем современного общества. Эпидемии гриппа, вспыхивающие с определенной периодичностью по всему земному шару, каждый раз приносят человеческие и экономические потери, подталкивая ученых к поиску новых методов получения высокоэффективных, безопасных лекарственных средств для профилактики, лечения и предотвращения серьезных последствий этого заболевания.
На сегодняшний день разработано множество вакцин против гриппа, различных по типу, составу, форме выпуска и технологии производства. В основе любой из них лежит цельный или расщепленный вирус, выращенный на куриных эмбрионах или клеточных культурах тканей. В связи с этим одной из актуальных задач является поиск наиболее технологичных решений в области очистки гриппозной вакцины от остатков примесных белков аллантоисной жидкости или культуральной среды, негативно влияющих на организм человека и обладающих высокой реактогенностью.
Получение очищенного вирусного концентрата - один из основных этапов производства вакцины. Существуют различные методы концентрирования вирусов, наиболее распространенными среди которых являются осаждение в изоэлектрической точке, сорбционный метод и ультрацентрифугирование [1]. Наряду с перечисленными способами очистки и концентрирования вирусов, широкое распространение получил метод, основанный на микро- и ультрафильтрации. В целом ряде случаев метод микро- и ультрафильтрации имеет преимущества перед методами осаждения, сорбции и ультрацентрифугирования, обеспечивая менее трудоемкий и более мягкий способ очистки. Данный способ отличается экономичностью и позволяет в короткие сроки сконцентрировать большие объемы вируссодержащих сред.
Известны различные способы получения концентратов вируса гриппа с применением микро- и ультрафильтрации [2, 3, 4, 5, 6].
Согласно технологии приведенной в статье [3], вирус гриппа очищают низкоскоростным центрифугированием, затем концентрируют ультрафильтрацией на кассетных модулях 300 кДа, с последующей анионообменной хроматографией. Однако общий выход по всем стадиям данного метода составляет всего 25%.
Метод [4], основанный на очистке вируса гриппа глубинной микрофильтрацией в тупиковом режиме через каскад фильтров 5 мкм и 1 мкм с последующим концентрированием ультрафильтрацией на листовой мембране 100 кДа также имеет относительно низкий выход по гемагглютинину (порядка 37%).
Наиболее близкие к представленному способу технологии концентрирования и очистки вируса гриппа раскрыты в ссылках [5, 6].
Способ [5] включает очистку вируссодержащей среды микрофильтрацией на элементе 0,65 мкм с последующим концентрированием и ультрадиафильтрацией на полых волокнах с отсечением по молекулярному весу 500 кДа (буферный раствор, используемый при диафильтрации, содержит 20 мМ Трис, 0,5 М натрия хлорида рН 7,5). Средний выход по всем стадиям процесса 59%.
Микрофильтрация на элементе с отсечением 0,65 мкм не гарантирует полного удаления клеток живых и мертвых микроорганизмов, которые в дальнейшем могут концентрироваться и разрушаться на стадии ультрафильтрации с выделением бактериального эндотоксина под действием буферного раствора с большой ионной силой.
Применение в качестве дезагрегирующего раствора 0,5 М натрия хлорида в сочетании с 20 мМ Трис не всегда обеспечивает полное отщепление животного альбумина и его удаление из концентрата вируса. Кроме того, при осуществлении экспериментальной ультрафильтрации вируссодержащей аллантоисной жидкости (штамм вируса гриппа A/California/07/2009 (H1N1)) на кассетном элементе с мембраной 500 кДа в указанных условиях была отмечена потеря вируса за счет частичного прохождения через мембрану в фильтрат [таблица 2].
Согласно технологии описанной в патенте US №4327182 [6] (прототип) в неочищенную вируссодержащую аллантоисную жидкость добавляют детергент Triton Х-100 до концентрации 0.05%, после чего концентрируют в два раза микрофильтрацией в тангенциальном потоке на фильтрующем элементе с мембраной 0,1 мкм. Затем диафильтрацией фосфатным буферным раствором (рН 7.1-7.2), содержащим 0,87% натрия хлорида и 0,05% Triton Х-100, удаляют из концентрата низкомолекулярные балластные компоненты. По окончании диафильтрации концентрируют вируссодержащую аллантоисную жидкость еще в 5 раз (всего в 10 раз по сравнению с исходным объемом) (стадия I). Полученный концентрат вируса гриппа фильтруют в присутствии той же концентрации детергента через микрофильтрационный элемент с мембраной 0,45 мкм (стадия II). Вируссодержащий фильтрат снова концентрируют и подвергают диафильтрации на микрофильтрационном элементе 0,1 мкм (повторно проводят стадию I) (стадия III).
Однако, приведенная последовательность технологических стадий не является оптимальной, так как предварительно неочищенная аллантоисная жидкость очень тяжело фильтруется через мембрану с таким низким рейтингом, кроме того, даже в присутствии детергента при концентрировании аллантоисной жидкости в 10 раз происходит частичное агрегирование вируса и увеличение концентрации высокомолекулярных примесей, что значительно затрудняет дальнейшую микрофильтрацию на фильтрующем элементе 0,45 мкм (стадия II).
Из литературных данных известно [7], что размер вируса гриппа лежит в пределах 80-120 нм (0,08-0,12 мкм). Номинальный предел отсечения мембраны 0,1 мкм очень близок к размеру свободного вируса, поэтому при концентрировании вируса гриппа в присутствии неионного детергента на модулях с мембраной 0,1 мкм происходит частичная потеря вируса за счет проскока через мембрану. Поэтому для полного извлечения вирусных частиц в процессе концентрирования методом микро(ультра)фильтрации целесообразно использовать мембраны с номинальным отсечением по размеру (или молекулярному весу) в 3-4 раза меньше размера (молекулярного веса) отделяемых частиц. В отличие от данного метода, заявляемый метод предусматривает не концентрирование (вирус не проходит через мембрану), а очистку вируса микрофильтрацией на кассетах 0,1-0,2 мкм (при этом вирус проходит через мембрану под действием дезагрегирующего раствора [таблица 1]).
Также недостатком данного способа является дублирование стадии концентрирования и диафильтрации на микрофильтрационном элементе 0,1 мкм (стадия III). Повторное концентрирование и диафильтрация увеличивают потери и продолжительность технологического процесса.
Задачей, на решение которой направлено данное изобретение, является разработка способа получения высокоочищенного концентрата вируса гриппа для производства противогриппозной вакцины.
Технический результат изобретения заключается в получении высокоочищенного концентрата вируса гриппа с выходом более 80%, оптимизации технологического процесса.
Поставленная задача решается следующим образом. Способ предусматривает центрифугирование вируссодержащей аллантоисной жидкости (ВАЖ) с последующей фильтрацией через полипропиленовое волокно, микрофильтрацию ВАЖ на фильтрующих элементах 0,1-0,2 мкм с дальнейшей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, концентрирование вируса гриппа на мембранах с порогом отсечения 300-500 кДа с последующей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, 0,02-0,002% анионного детергента и ультрацентрифугирование в градиенте плотности сахарозы, приготовленной на фосфатном буферном растворе, содержащем 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия и 0,02-0,002% анионного детергента.
Путем усовершенствования существующих методов концентрирования и очистки разработан новый способ получения высокоочищенного концентрата вируса гриппа для производства противогриппозных вакцин. Преимущество представленного способа заключается в простоте, экономичности, высокой конверсии и степени очистки целевого продукта. Изобретение позволяет получать высокоочищенные концентраты вируса гриппа с выходом более 80%, а также повысить технологичность и экологические условия процесса производства. Применение для очистки вируса мембран с пределом отсечения 0,1-0,2 мкм обеспечивает более глубокую степень очистки вируса гриппа по сравнению с существующими методами. Используемый при микрофильтрации фосфатный буферный раствор на основе 0,25-0,5 М натрия хлорида, ЭДТА или цитрата натрия (дезагрегирующий раствор), рН 7,4-7,8 позволяет практически полностью устранить агрегацию вируса гриппа и обеспечивает его прохождение через мембрану с пределом отсечения по размеру частиц 0,1-0,2 мкм. В отличие от существующих методов, концентрирование вируса гриппа проводят ультрафильтрацией на кассетных фильтрующих элементах 300-500 кДа в сочетании с детергентсодержащим дезагрегирующим раствором, позволяющим без разрушения вируса в мягких условиях отщепить и удалить диафильтрацией неспецифические белки (овальбумин), связанные с вирионом. Так при концентрировании вируссодержащей аллантоисной жидкости на кассетных фильтрующих элементах 300 и 500 кДа с последующей диафильтрацией фосфатным буферным раствором получают концентрат вируса гриппа с выходом 80-100% [таблица 2]. При этом содержание овальбумина в концентрате, полученном с применением детергентсодержащего дезагрегирующего раствора, в пять раз ниже, чем при использовании фосфатного буферного раствора, не содержащего детергент (527 мкг/мл и 103 мкг/мл соответственно). Кроме того, данный способ обеспечивает полное удаление клеток микроорганизмов из вируссодержащей среды, предотвращая их концентрирование и расщепление на последующих стадиях технологического процесса с выделением эндотоксина. Содержание эндотоксина в пробах фильтрата при очистке на кассетных элементах с различными рейтингами приведено в таблице 1.
Предложенный способ осуществляется следующим образом:
1. Осветление вируссодержащей среды на проточной центрифуге при 3000-5000 об/мин (1000-1500 g) с последующей фильтрацией через патронный элемент на основе полипропиленового волокна со средним отсечением по размеру частиц 1 мкм.
2. Очистка осветленной вируссодержащей среды микрофильтрацией в тангенциальном потоке на кассетных фильтрующих элементах с мембраной 0,1-0,2 мкм с последующей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, рН 7,4-7,8.
3. Концентрирование очищенной вируссодержащей среды ультрафильтрацией в тангенциальном потоке на кассетных ультрафильтрационных элементах с мембраной 300-500 кДа с последующей 5-кратной диафильтрацией фосфатным буферным раствором, содержащим 0,02-0,002% анионного детергента, 0.25-0.5 М натрия хлорида, ЭДТА или цитрат натрия, рН 7,4-7,8.
4. Ультрацентрифугирование в градиенте плотности 60% сахарозы, приготовленной на фосфатном буферном растворе, содержащем 0,02-0,002% анионного детергента, 0.25-0.5 М натрия хлорида, ЭДТА или цитрат натрия, рН 7,4-7,8 при 28 тыс. об/мин.
Пример 1.
100 л вируссодержащей аллантоисной жидкости (штамм вируса гриппа A/California/07/2009 (H1N1)), собранной через 48 ч после заражения куриных эмбрионов и охлажденной до температуры 2-4°С осветляют на проточной центрифуге при 3000-5000 об/мин (1000-1500 g), после чего дополнительно фильтруют через глубинный фильтрующий элемент на основе полипропиленового волокна 1 мкм (титр РГА 1:240, содержание овальбумина 1 015 мкг/мл). Микрофильтрацию осветленной аллантоисной жидкости проводят на кассетных фильтрующих элементах 0,2 мкм, при этом вирус проходит через мембрану в фильтрат. Для более полного извлечения вируса по окончании микрофильтрации проводят диафильтрацию непрофильтрованного остатка 20 л фосфатного буферного раствора, содержащего 0,25 М натрия хлорида и 10 мМ ЭДТА, рН 7,6. Фильтрат с кассет 0,2 мкм концентрируют в 10 раз ультрафильтрацией в тангенциальном потоке на фильтрующих элементах 300 кДа. По окончании концентрирования проводят 5-кратную диафильтрацию концентрата фосфатным буферным раствором, содержащим 0,002% лаурилсаркозината натрия, 0,5 М натрия хлорида и 10 мМ ЭДТА, рН 7,6. Титр РГА концентрата 1:2560, что составляет порядка 100% от теоретического выхода, содержание овальбумина 6 мкг/мл. Проводят ультрацентрифугирование концентрата в градиенте 60% сахарозы, приготовленной на буфере содержащим 0,002% лаурилсаркозината натрия, 0.5 М натрия хлорида и 10 мМ ЭДТА, рН 7,6 при 28 тыс. об/мин. Содержание эндотоксина 0,15 IU/мкг.
Пример 2.
100 л вируссодержащей аллантоисной жидкости (штамм вируса гриппа A/California/07/2009 (H1N1)), собранной через 48 ч после заражения куриных эмбрионов и охлажденной до температуры 2-4°С осветляют на проточной центрифуге при 3000-5000 об/мин (1000-1500 g), после чего дополнительно фильтруют через глубинный фильтрующий элемент на основе полипропиленового волокна 1 мкм (титр РГА 1:320, содержание овальбумина 1 102 мкг/мл). Микрофильтрацию осветленной аллантоисной жидкости проводят на кассетных фильтрующих элементах 0,2 мкм, при этом вирус проходит через мембрану в фильтрат. Для более полного извлечения вируса по окончании микрофильтрации проводят диафильтрацию непрофильтрованного остатка 20 л фосфатного буферного раствора, содержащего 0,5 М натрия хлорида и 0,1 М цитрата натрия, рН 7,8. Фильтрат с кассет 0,2 мкм концентрируют в 10 раз ультрафильтрацией в тангенциальном потоке на фильтрующих элементах 500 кДа. По окончании концентрирования проводят 5-кратную диафильтрацию концентрата фосфатным буферным раствором, содержащим 0,002% тауродезоксихолат натрия, 0,5 М натрия хлорида и 0,1 М цитрата натрия, рН 7,8. Титр РГА концентрата 1:2560, что составляет 80% от теоретического выхода, содержание овальбумина 10 мкг/мл. Проводят ультрацентрифугирование концентрата в градиенте плотности 60% сахарозы, приготовленной на буфере содержащим 0,002% тауродезоксихолат натрия, 0.5 М натрия хлорида и 0,1 М цитрата натрия, рН 7,8 при 28 тыс. об/мин. Содержание эндотоксина 0,15 IU/мкг.
Пример 3.
10 л вируссодержащей аллантоисной жидкости (штамм вируса гриппа A/California/07/2009 (H1N1)), собранной через 48 ч после заражения куриных эмбрионов и охлажденной до температуры 2-4°С осветляют на проточной центрифуге при 3000-5000 об/мин (1000-1500 g), после чего дополнительно фильтруют через глубинный фильтрующий элемент на основе полипропиленового волокна 1 мкм (титр РГА 1:160, общий белок 3,1 мг/мл). Проводят микрофильтрацию осветленной аллантоисной жидкости на кассетных фильтрующих элементах 0,1 мкм, при этом вирус проходит через мембрану в фильтрат (титр РГА 1:80, общий белок 2,9 мг/мл, объем 9 л; непрофильтрованный остаток - 1 л, титр РГА 1:1280, общий белок 5,3 мг/мл). По окончании микрофильтрации проводят диафильтрацию непрофильтрованного остатка 6 л фосфатного буферного раствора, содержащего 0,5 М натрия хлорида и 10 мМ ЭДТА, рН 7,4. После диафильтрации титр РГА непрофильтрованного остатка составил 1:80 (объем 0,55 л, общий белок 0,09 мг/мл). Исходя из данного значения, 97% вируса прошло через мембрану. Фильтрат с кассет 0,1 мкм концентрируют в 10 раз ультрафильтрацией в тангенциальном потоке на фильтрующих элементах 300 кДа. По окончании концентрирования проводят 5-кратную диафильтрацию концентрата фосфатным буферным раствором, содержащим 0,02% гликохолат натрия, 0,5 М натрия хлорида и 10 мМ ЭДТА, рН 7,4. Титр РГА концентрата 1:1280, что составляет 80% от теоретического выхода. Проводят ультрацентрифугирование концентрата в градиенте плотности 60% сахарозы, приготовленной на буфере содержащим 0,02% гликохолат натрия, 0.5 М натрия хлорида и 10 мМ ЭДТА, рН 7,4 при 28 тыс. об/мин. Содержание эндотоксина 0,025 IU/мкг.
Источники информации
1. Brok Т., Membrane filtration // Science Tech, Inc. Madison, - 1987. P.335-347.
2. Патент ЕР №1878791 публ. 2008.01.16., C12N 7/00.
3. Elisabeth Maurer, Matjaz Peterka, Manuela Gassner, Helena Seper, Franz Gelhart, Marko Banjac, Marko Jarc, Barbara Lah, Petra Kramberger, Ales Strancar and Thomas Muster. Influenza virus purification platform // Avir Green Hills Biotechnology.
4. Deba Prasad Nayak, Sylvia Lehmann, Udo Reichl. Downstream processing of MDCK cell-derived equine influenza virus // Journal of Chromatography B, 823 (2005) P.75-81.
5. Bernd Kalbfuss, Yvonne Genzel, Michael Wolff, Anke Zimmermann, Robert Moren-weiser, Udo Reich. Harvesting and concentration of human influenza a virus produced in serum-free mammalian cell culture for the production of vaccines // Biotechnology and Bioengi-neering, Vol.97, No.1, May 1, 2007.
6. Патент US №4327182 публ. 1982.04.27., C12N 7/06 A61K 39/145.
7. Под. ред. Воробьева А.А. Медицинская микробиология, вирусология и иммунология // М:. OOO «Медицинское информационное агентство», 2008. - с.560.
8. Influenza vaccine split virion, inactivated. European Pharmacopoeia 7.0. Monograph №0158, p.788-789.
9. Influenza vaccine surface antigen, inactivated. European Pharmacopoeia 7.0. Monograph №0869, p.789-791.
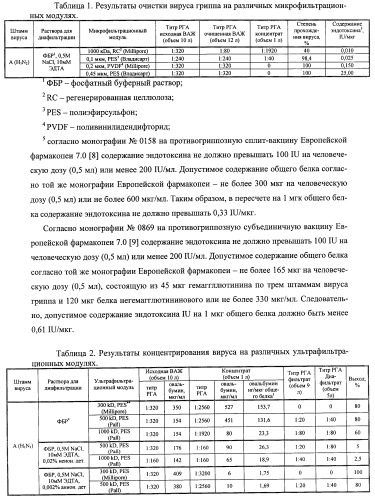
| Таблица 1. | |||||||
| Результаты очистки вируса гриппа на различных микрофильтрационных модулях. | |||||||
| Штамм вируса | Раствора для диафильтрации | Микрофильтрационный модуль | Титр РГА исходная ВАЖ (объем 10 л) | Титр РГА очищенная ВАЖ (объем 12 л) | Титр РГА концентрат (объем 1 л) | Степень прохождения вируса, % | Содержание эндотоксина5, IU/мкг |
| ФБР1, 0,5М | 1000 кДа, RC2 (Millipore) | 1:320 | 1:80 | 1:1920 | 40 | 0,010 | |
| A(H3N2) | NaCl, 10 мМ ЭДТА | 0,1 мкм, PES3 (Владисарт) | 1:240 | 1:240 | 1:40 | 98,4 | 0,025 |
| 0,2 мкм, PVDF4 (Millipore) | 1:320 | 1:320 | 0 | 100 | 0,150 | ||
| 0,45 мкм, PES (Владисарт) | 1:320 | 1:320 | 0 | 100 | 25,00 | ||
| 1 ФБР - фосфатный буферный раствор; | |||||||
| 2 RC - регенерированная целлюлоза; | |||||||
| 3 PES - полиэфирсульфон; | |||||||
| 4 PVDF - поливинилидендифторид; | |||||||
| 5 согласно монографии №0158 на противогриппозную сплит-вакцину Европейской фармакопеи 7.0 [8] содержание эндотоксина не должно превышать 100 IU на человеческую дозу (0,5 мл) или менее 200 IU/мл. Допустимое содержание общего белка согласно той же монографии Европейской фармакопеи - не более 300 мкг на человеческую дозу (0,5 мл) или не более 600 мкг/мл. Таким образом, в пересчете на 1 мгк общего белка содержание эндотоксина не должно превышать 0,33 IU/мкг. |
Согласно монографии №0869 на противогриппозную субъединичную вакцину Европейской фармакопеи 7.0 [9] содержание эндотоксина не должно превышать 100 IU на человеческую дозу (0,5 мл) или менее 200 IU/мл. Допустимое содержание общего белка согласно той же монографии Европейской фармакопеи - не более 165 мкг на человеческую дозу (0,5 мл), состоящую из 45 мкг гемаггллютинина по трем штаммам вируса гриппа и 120 мкг белка негемагглютининового или не более 330 мкг/мл. Следовательно, допустимое содержание эндотоксина IU на 1 мкг общего белка должно быть менее 0,61 IU/мкг.
Способ получения очищенного концентрата вируса гриппа, включающий микро- и ультрафильтрацию в тангенциальном потоке, отличающийся тем, что микрофильтрацию проводят на фильтрующих элементах 0,1-0,2 мкм с последующей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия, концентрирование вируса осуществляют на мембранах с пределом отсечения по молекулярному весу 300-500 кДа с последующей диафильтрацией фосфатным буферным раствором, содержащим 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия и 0,02-0,002% анионного детергента, ультрацентрифугирование проводят в градиенте плотности сахарозы, приготовленной на фосфатном буферном растворе, содержащем 0,25-0,5 М натрия хлорида, ЭДТА или цитрат натрия и 0,02-0,002% анионного детергента.