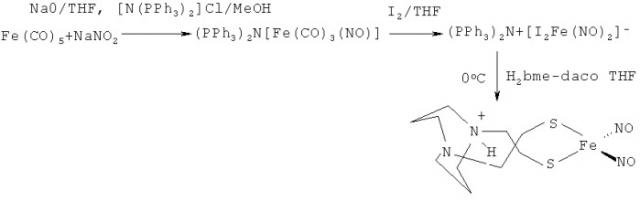Моноядерные динитрозильные комплексы железа, способ получения моноядерных динитрозильных комплексов железа, донор монооксида азота, применение моноядерного динитрозильного комплекса железа в качестве противоопухолевого лекарственного средства
Иллюстрации
Показать всеНастоящее изобретение относится к моноядерному динитрозильному комплексу железа с общей формулы (N2H5)+[Fe(SR)2(NO)2]-, где R представляет собой 5-нитропиридинил, а также 2-нитро-, 3-нитро- и 4-нитрофенилы и пиридинил. Также предложены способ получения моноядерного нитрозильного комплекса железа, донор монооксида азота и применение моноядерного нитрозильного комплекса железа. Изобретение позволяет получить новые динитрозильные комплексы железа, которые могут применяться в качестве противоопухолевых лекарственных средств. 4 н. и 3 з.п. ф-лы, 2 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к способу получения кристаллических моноядерных динитрозильных комплексов железа общей формулы (N2H5)+[Fe(SR)2(NO)2]- c R 5-нитропиридинилом реакцией взаимодействия Na2[Fe2(S2O3)2(NO)4]·H2O с продуктом восстановления 2,2'-дитиобис-(5-нитропиридина) гидразингидратом в водно-спиртовом растворе, к донору монооксида азота на их основе, к их применению в качестве противоопухолевых лекарственных средства.
Создание новых лекарственных препаратов для монотерапии злокачественных образований является актуальной проблемой последних десятилетий: в России рак ежегодно уносит жизни более 300000 пациентов. Ежегодно выявляется около 450000 новых онкологических больных. Сейчас на учете с различными онкологическими заболеваниями стоят около 2,5 млн. россиян. Эффективность борьбы с раковыми заболеваниями во многом зависит от лекарственной терапии. Наряду с хирургическим и лучевым методами, химиотерапия злокачественных опухолей получила широкое распространение, тем более что при ряде локализаций опухолевого процесса она является определяющей. На долю лекарственных средств, применяемых для лечения злокачественных новообразований, в общей структуре фармацевтического рынка России приходится 6,7% в денежном выражении. На сегодняшний день сегмент противоопухолевых препаратов оценивается в 19 млрд. руб.Российский рынок противоопухолевых препаратов - это рынок генерических лекарственных средств: алкалоидов растительного происхождения (Таксотер, Абитаксел, Абитаксел, Паклитаксел-ЛЭНС), антиметаболитов (Кселода, Флудара, Гемзар), алкилирующих препаратов (Темодал, Холоксан, Лейкеран), противоопухолевых антибиотиков (Доксорубицин, Доксорубицин-ЛЭНС, Митомицин-С) и других противоопухолевых препаратов (Велкейд, Гливек, Мабтера) на долю которых приходится 60% продаж. Доля оригинальных (инновационных) препаратов составляет около 14%, при этом в стоимостном выражении их продажи составляют почти 90%, что объясняется высокой стоимостью данных препаратов, на разработку и клинические испытания которых уходят миллионы долларов. По статистике, пятилетняя выживаемость онкологических больных составляет во Франции 57,9%, в США - 62% среди мужчин и 63,5% среди женщин. В России она не достигает и 43%. Это самый низкий показатель в Европе, что, в частности, связано с запоздалой диагностикой, лечением устаревшими препаратами. Аппаратов лучевой терапии в России насчитывается всего 70, а в США - около 3000. Между тем, снижение на треть смертности от онкозаболеваний в США и Европе за последние 20 лет было достигнуто именно благодаря применению инновационных препаратов, использование которых в России пока весьма ограничено. В стоимостном выражении преобладающая доля продаж (более 90%) принадлежит препаратам из стран Западной Европы. Россия занимает лишь 2% от всего объема продаж. И эта доля продолжает снижаться, уступая место инновационным зарубежным препаратам.
Одним из подходов в поиске инновационных противоопухолевых лекарств принципиально иного механизма действия является синтез и исследование соединений - доноров монооксида азота (NO). Действие NO на опухолевые клетки существенно различается в зависимости от его локальной концентрации: при нано/пикомолярных концентрациях NO в опухолях возрастают мутации ДНК, инвазивность, ангиогенез, цитозащита и иммунная толерантность, а апоптоз (программируемая смерть клетки) уменьшается, что приводит к развитию и прогрессии опухоли. Обратная картина наблюдается при микромолярных концентрациях NO: увеличивается количество повреждений ДНК опухолевых клеток, стимулируется оксидативный/нитрозативный стресс, апоптоз, митохондриальные повреждения, цитотоксичность, что ведет к гибели опухолевых клеток и торможению прогрессии опухоли (S.Mocellin, V. Bronte, D.Nitti, Nitric Oxide, a double edged sword in cancer biology: searching for therapeutic opportunities, Medicinal Reserch Reviews (2007) 27, 3, 317-352).
В современных медицинских исследованиях существуют две основные стратегии поиска препаратов при NO-терапии рака. Первая стратегия основана на уменьшении клеточного уровня NO и его канцерогенных интермедиатов. В течение процесса опухолевого развития/прогрессии клетки сами могут служить противовесом прооксидантным агентам (например, RNS и ROS), запуская антиоксидантные механизмы с привлечением таких энзимов, как супероксид-дисмутаза, глютатион-пероксидаза, каталаза, тиоредоксин или ловушек свободных радикалов - токоферола, аскорбата, альбумина, мочевой кислоты, глютатиона. Однако, при определенных обстоятельствах (например, при хроническом воспалении), ускоренное и поддерживаемое производство ROS или RNS может насыщать (и переполнить) антиоксидантную вместимость клетки, ингибировать функцию ДНК-репарации и клеточного апоптоза и, в конечным итоге, благоприятствовать канцерогенезу. Центральная роль, которую играет NO в этих процессах, предсказывает развитие следующих терапевтических подходов:
(1) использование ловушек NO/RNS; (2) ингибирование iNOS активности; (3) подавление NOS экспрессии лекарствами, нечувствительными к олиго-ДНК или РНК-вмешательству (Hobbs A.J., Higgs a., Moncada S. Inhibition of nitric oxide synthase as a potential therapeutic target. Annu.Rev.Pharmacol.oxicol. 1999; 39: 191-220; Wu J., Akaike Т., Maeda H. Modulation of enhanced vascular permeability in tumors by a bradykinin antagonist, a cyclooxygenase inhibitor, and a nitric oxide scavenger. Cancer.Res. 1998; 58(1): 159-165). Среди NO ловушек, PTIO уменьшает повышенную канцерогенную сосудистую проницаемость (Zhang H.J., Zhao W., Venkataraman S-, Robbins M.E., Buettner G.R., Kregel K.C., Oberley L.W. Activation of matrix metalloproteinase-2 by overexpression of manganese superoxide dismutase in human breast cancer MCF-7 cells involves reactive oxygen species. J.Biol.Chem. 2002; 277(23): 20919-20926), Ebselen ингибирует производство матричной металло-протеиназы опухолевыми клетками (Duvoix A., Blasius R., Delhalle S., Schnekenburger M., Moceau F., Henry E., Dicato M., Diederich M. chemopreventive and therapeutic effects ofcarcumin. Cancer. Lett. 2005; 223(2): 181-190). Curcumim фитохимический полифенол с мощными противовоспалительными свойствами (Rao C.V., Kawamori Т., Hamid R., Reddy B.S. Chemoprevention of colonic aberrant crypt foci by an inducible nitric oxide synthase-selective inhibitor. Carcinogenesis. 1999; 20(4): 641-644), является как NO-ловушкой, так и ингибитором iNOS экспрессии, подобно ингибированию NF(B активации (Kawamori Т., Lubet R., Steele V.E., KelloffG.J., Kaskey R.B., Rao C.V., Reddy B.S. Chemopreventive effect of curcumin, a naturally occurring anti-inflammatory agent, during the promotion/progression stages of colon cancer. Cancer.Res. 1999; 59(3): 597-601) и в предклинических in vivo моделях ингибирует развитие рака кишечника (Lu W., Schroit A.J., Vascularization of melanoma by mobilization and remodeling of preexisting latent vessels to patency. Cancer.Res. 2005; 65(3): 913-918. Отдельные аналоги L-аргинина являются эффективными не специфическими ингибиторами NOS изоэнзимов. Различными исследованиями в литературепредполагается про-ангиогенная активность NO и использование NOS-ингибиторов как опухоль-чувствительных антиангиогенных агентов (Jadeski L.C., Hum К.О., Chakraborty С., Lala P.К. Nitric oxide promotes murine mammary tumour growth and metastasis by stimulating tumour cell migration, invasiveness and angiogenesis. Int.J. Cancer. 2000;86(1):30-39). Например, анализируя антиметастатические эффекты L-NAME в модели опухоли молочной железы мыши, исследователи использовали подкожные импланты опухолевых клеток (Jadeski L.C., Lala Р.К. Nitric oxide synthase inhibition by N(G)-nitro-L-arginine methyl ester inhibits tumor-induced angiogenesis in mammary tumors. Am.J.Pathol. 1999; 155(4): 1381-1390; Uneda S., Hata H., Matsuno F., Nagasaki A., Harada N., Mitsuya Y., Matsuzaki H., Mitsuya H. A nitric oxide synthase inhibitor, N(G)-nitro-l-arginine-methyl-ester, exerts potent antiangiogenic effects on plasma-cytoma in a newly established multiple myeloma servere combined immunodeficient mouse model. Br.J.Haematol.2003; 120(3):396-404) в то время как опухоль и эндотелиальные клетки экспрессируют eNOS, iNOS локализована в эндотелиальных клетках и опухоль-впитывающих макрофагах; общая масса жизнеспособной ткани (строма или опухолевых клеток) и нео-васкуляризация значительно уменьшаются в L-NAME-обработанных мышах по сравнению с таковыми при обработке энантиомерной D-NAME. Предполагается, что NO является ключевым посредником опухоль-индуцированного ангиогенеза, и что противоопухолевая активность L-NAME проявляется, по крайней мере, в частности, из-за его способности вмешиваться в ангиогенетический путь.
Другие исследователи тестировали ангиогенное действие L-NAME в SCID мышиного порта с высоко васкуляризованной линии клеток плазмацитомы KHL-4, произведенных от пациентов с хемотерапевтически-резистентной множественной миеломой (Thomsen L.L., Miles D.W. Role of nitric oxide in tumour progression: Lessons from human tumoers. Cancer. Metastasis. Rev. 1998; 17(1): 107-118) значительное уменьшение размера опухоли наблюдалось в L-NAME-обработанных мышах, которое сопровождается существенным снижением ангиогенеза в гистологической оценке и коррелирует с уменьшением уровней VEGF в опухолевых тканях.
Селективные ингибиторы NOS-изоформ разрабатываются для терапевтических целей потому, что аргинин-связывающие домены для этих трех изоформ различны. HOOW-iNOS селективный ингибитор ингибирует сверхпроизводство ангиогенного фактора простагландина - Е2 (Mollace V., Muscoli С., Masini E., Cuzzocrea S., Salvemini D. Modulation of prostaglandin biosynthesis by nitric oxide and nitric oxide donors. Pharmacol. Rev. 2005; 57(2): 217-252) и рост солидных опухолей мышей, экспрессирующих iNOS (Chen Т., Nines R.G., Perchke S.M., Kresty L.A., Stoner G.D. chemopreventive effects of a selective nitric oxide synthase inhibitor on carcinogen-induced rat esophageal tumorigenesis. Cancer. Res. 2004; 64(10): 3714-3717). В экспериментальных моделях хемозащиты, другие iNOS-специфические ингибиторы (PBIT) успешно использовались для ингибирования химически-индуцированного рака пищевода (D.A. Wink, G. Sharon, S. Christofer, R. Lisa, A.Stefan, Passways associate Nitric Oxide Synthase and Cycloxygenase-2 that lead to poor prognosis in brest cancer. Nitric oxide: biology & chemistry, 2010, 22, s.l7). В моделях кишечного канцерогенеза как L-NAME, так и iNOS-специфичные ингибиторы (AMG, PBIT, SC-51) значительно уменьшают скорость развития предраковых очагов карциномы кишки (E.Okada, A role of nitric oxide in conversion of human colonic adenoma cell line accelerated by chronic inflammation. Nitric oxide: biology & chemistry, 2010, 22, s.l9; Ahn В., Ohshima H. Suppression of intestinal polyposis in Apc(Min/+) mice by inhibiting nitric oxide production. Cancer.Res.2001;61(23):8357-8360; GrattonJ.P., Lin M.I., Yu J., Weiss E.D., Jiang Z.L., Fairchild T.A., Iwakiri Y., Groszmann R., Claffey K.P., Cheng Y.C., Sessa W.C. Selective inhibition of yumor microvascular permeability by cavtratin blocks tumor progression in mice. Cancer. Cell. 2003; 4(1): 31-39).
Cavtratin, клеточно-водопроницаемый пептид, произведенный из кавеолина-1, уменьшает микроваскулярную гиперпроницаемость и задерживает прогрессию экспериментальных опухолей мышей (Tang C.H., Grimm E.A. Depletion of endogenous nitric oxide enhances cisplatin-induced apoptosis in a p53-dependent manner in melanoma cell lines. J.Biol.Chem. 2004; 279(1): 288-298). Эта противоопухолевая активность появляется в отсутствии прямого цитостатического или антиангиогенного эффектов и связана с eNOS ингибированием.
Повышение чувствительности к общепринятым антинеопластическим агентам и фотодинамическая и радиотерапия являются одним из развивающихся направлений терапии рака. Истощение эндогенного NO может способствовать апоптозу опухолевых клеток и также сенсибилизировать их для цитотоксической активности общепринятыми антинеопластическими лекарствами. В модели кишечной карциномы, SC-51 не только уменьшает сферу влияния очагов абберантных кишечных крипт в дозово-зависимой форме, но также увеличивает хемопротекторные свойства препарата Celecoxib, селективного СОХ-2 ингибитора.
Использование PTIO ведет к изменениям в регуляции клеточного цикла и уменьшает цисплатин-индуцированный апоптоз клеток меланомы in vitro (Muerkoster s., Wegehenkel К., Arti A., Witt M., Sipos В., Kruse M.L., Sebens Т., Kloppel G., Kalthoff H., Folsch U.R., Schafer H. Tumor stroma interactions induce chemoresistance in pancreatic ductal carcinoma cells involving increased secretion and paracrine effects of nitric oxide and interleukin-1 beta. Cancer.Res. 2004; 64(4): 1331-1337), это означает, что эндогенный NO может регулировать чувствительность клеток меланомы к цисплатину и что анти-NO агенты могут максимально увеличить эффективность химиотерапии in vivo.
Чтобы разъяснить молекулярные механизмы, лежащие в основе выдающейся устойчивости к химическим воздействиям карциномы поджелудочной, были исследованы взаимодействия "опухоль-строма" (Moccelin S., Rossi C.R., Pilati P., Nitti D. Tumor necrosis factor, cancer and anticancer therapy. Cytokine Gtowth Factor Rev. 2005; 16(1): 35-53). Если культивировать в фибробластной среде или хранить в со-культуре с фибробластами, оухолевые клеточные линии менее чувствительны к Etoposide цитотоксичности и увеличивают синтез IL-1, который является хорошо известным активатором как iNOS так и NF(B) путей. В то время как опухолевые клетки показывают не определяемую iNOS экспрессию, фибробласты демонстрируют iNOS синтез и NO выделение, что далее индуцируется опухолевыми клетками. Инкубация опухолевых клеток с NO донором - SNAP (S-нитрозо-N-ацетил-пеницилламином) подавляет Etoposide-индуцированный апоптоз и наоборот, резистентность-индуцированнный эффект фибробластов уничтожается, когда iNOS-селективный ингибитор AMG добавляется в течении со-культивирования. NO может модулировать цитотоксичность некоторый членов семейства TNF, таких как TNF и TRAIL. Введение NO перед или вместе с TNF-цитотокином также употребляют в клиническом комплекте как антинеопластические агенты (Korbelik M., Parkins C.S., Shibuya H., Cecic I., Stratford M.R., chaplin D.J. Nitric oxide production by tumour tissue: Impact on the response to photodynamic therapy. Br.J.Cancer. 2000; 82(11): 1835-1843), ингибирующие апоптоз как в нормальных, так и в опухолевых клетках (Thmas W.J., Thomas D.L., Knezetic J.A., Adrian Т.Е. The role of oxygen-derived free radicals and nitric oxide in cytokine-induced antiproferation of pancreatic cancer cells. Pancreas. 2002; 24(2): 161-168). Более того, ингибирование эндогенной NOS активности увеличивает индукцию апоптоза, вызванного цитотокинами (Bullota S., Barsacchi R., Rotiroti D., Borgese N., Clementi E. Activation of the endothelial nitric-oxide synthase by tumor necrosis factor-alpha. A novel feedback mechanism regulating cell death. J.Biol.Chem. 2001; 276(9): 6529-6536; de Wilt J.H., Manusama E.R., van Etten В., van Tiel S.T., Jorna A.S., Seynhaeve A.L., ten Hagen T.L., Eggermont A.M. Nitric oxide synthase inhibition results in synergistic anti-tumour activity with melphalan and tumour necrosis factor alpha-based isolated limb perfusions. Br. J. Cancer. 2000; 83(9): 1176-1182). В соответствии с этими данными, со-введение TNF и L-NAME несущим саркому животным значительно увеличивает скорость опухолевой регрессии по сравнению с введением только TNF (Zareba M., Nizioiek M., Korytowski W., Girroti A.W. Merocyanine 540-sensitized photokilling of leukemia cells: Role of post-irradiation chain peroxidation of plasma membrane lipids as revealed by nitric oxide protection. Biochim. Biophys. Acta. 2005; 1722(1): 51-59). NO, как известно, защищает опухолевые клетки также от действия фотодинамической терапии (Sonveaux P., Brouet A., Havaux X., Gregoire V., Dessy С., Balligand J.L., Feron 0. Irradiation-induced angiogenesis through the up-regulation of the nitric oxide pathway: Implications for tumor radiotherapy. Cancer. Res. 2003; 63(5): 1012-1019):
введение L-NNA и L-NAME (как NOS ингибиторов) животным сразу же после фотодинамической обработки подкожных опухолей уменьшает кровяной поток и уменьшает скорость лечения высоко (но не низко) NOS-экспрессирующих раков. Интересно, что возрастаемое производство NO, индуцируемое облучением ведет к глубоким морфологическим изменениям в эндотелиальных клетках in vitro, и это, в конечном счете, может способствовать раковому ангиогенезу in vivo (Wachsberger P.R., Burd R., Marrero N., Daskalakis C., Ryan A., McCue P., Dicker A.P. Effect of the tumor vascular-damaging agent, ZD6126, on the radioresponse of U87 glioblastoma. Clin. cancer. Res. 2005; 11(2 Pt 1): 835-842). Так как ингибирование NO производства подавляет эти про-ангиогенетические эффекты облучения in vitro и уменьшает противоопухолевую активность ZD6126 (как антиангиогенного агента) в комбинации с радиацией в модели человеческой трансплантированной глиобластомы (Xie К., Huang S. Contribution of nitric oxide-mediated apoptosis to cancer metastasis inefficiency. Free Radic. Biol. Med. 2003; 34(8): 969-986), открываются новые возможности для координированного использования антиангиогенных стратегий и радиотерапии для клинической практики.
Вторая стратегия поиска новых противоопухолевых препаратов основана на дополнительном введении NO и базируется на применении NO-генерирующих соединений как антинеопластических агентов (Таблица 3) (Garban H.J., Bonavida И. Nitric oxide disrupts H202-dependent activation of nuclear factor kappa. Role in sensitization of human tumor cells to tumor necrosis factor-alpha-induced cyotoxicity. J.Biol.Chem. 2001; 276(12): 8918-8923; Millet a., Bettaied A., Renaud F., Prevolat L., Hammann A., Solary E., Mignotte В., Jeannin J.F. Influence of the nitric oxide donor glyceryl trinitrate on apoptotic pathways in human colon cancer cells. Gastroenterology. 2002; 123(1): 235-246). В предклинических моделях введение экзогенных NO доноров, таких как GTN, DETA/NO и PABA/NO ведет к каспаз-зависимому апоптозу человеческих клеток кишечной карциномы in vitro, ингибированию канцерогенеза кожи в модели JB6 мыши, и регрессии роста метастазов B16F10 меланомы и человеческой карциномы яичника в SCID мышах (Dhar A., Brindley J.M., Stark С., Citro M.L., Keefer L.K., colburn ТюРю Nitric oxide does not mediate but inhibits transformation and tumor phenotype. Mol. Cancer. Ther. 2003; 2(12): 1285-1293; Postovit L.M., Adams M.A., Lash G.E., Heaton J.P., Graham C.P. Nitric oxide-mediated regulation of hypoxia-induced B16F10 melanoma metastasis. Int.J.Cancer. 2004; 108(1): 47-53; Findlay V.J., Townsend D.M., Saavedra J.E., Buzard G.S-, Citro M.L., Keefer L.K., Ji X., Tew K.D. Tumor cell responses to a novel glutathione S-transferase-activated nitric oxide-releasing prodrug. Mol.Pharmacol.2004;65(5): 1070-1079; Perrota С., Falcone S., Capobianco A., Camporeale A., Sciorati C., De Palma C., Pisconti A., Rovere-Querini P., Bellone M., Manfredi A.A., Clementi E. Nitric oxide confers therapeutic activity to dendritic cells in a mouse model of melanoma. Cancer. Res. 2004; 64(11): 3767-3771). Другие исследователи использовали способность NO к ингибированию запрограммированной клеточной смерти дендрических клеток в модели животных иммуно-стимулированного опухолевого отторжения, полагая, что опухоль-индуцированный апоптоз дендрических клеток уменьшает эффективность противоопухолевой иммунотерапии, доставка внутрь экспоненциально растущих дендрических клеток меаномы, обработанных ex vivo (вне клетки) DETA-NO, значительно уменьшает опухолевый рост. В этой модели DETA-NO предотвращает апоптоз дендрических клеток, ингибируя изменения экспрессии Вс-2, Вах и Bcl-xl и активацию каспазы-9; более того, DETA-NO увеличивает цитотоксичность дендрической клетки против опухолевых клеток и их способность запускать Т-лимфоцитную пролиферацию, все эффекты, которые стимулирутся генерацией cGMP. Наконец, YC-1 - NO-миметик с мощными sGC активирующими свойствами - показывает значительные антиангиогенные и проапоптотические эффекты в предклинических in vitro и in vivo опухолевых моделях (Yeo E.J., Chun Y.S., Cho Y.S., Kirn J, Lee J.C., Kirn M.S., Park J.W. YC-1: A potential anticancer drug targeting hypoxia-inducible factor 1. J. Natl. Cancer. Inst. 2003; 95(7): 516-525; Liu L., Li H., Underwood Т., Lloyd M., David M., Speri G., Pamukcu R., Thompson W.J. Cyclic GMP-dependent protein kinase activation and induction by exisuling and CP461 in colon tumor cells. J.Pharmacol. Exp. Ther. 2001; 299(2): 583-592; Rigas В., Kashfi K. Nitric-oxide-donating NSAIDs as agents for cancer prevention. Trends. Mol. Med. 2004; 10(7): 324-330). В настоящее время накоплено много экспериментальных доказательств по противораковым эффектам NO-NSAID - NO-донорных агентов, состоящих из традиционных NSAID, к которым NO-донирующий фрагмент ковалентно связан со спейсоровой молекулой (Steinbach G., Lynch P.M., Phillips R.K., Wallace M.H., Hawk E., Gordon G.B., Wakabayashi N.. Saunders В., Shen Y., Fujimura Т., Su L.K., Levin Ию The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N.Engl.J.Med. 2000; 342(26): 1946-1952). Лучшей охарактеризованной активностью NSAID является ингибирование СОХ энзиматической функции. ASA значительно уменьшает развитие кишечных полипов у пациентов с карциномой кишки (Ricchi P., Zarrilli R., Di Palma A., Acguaviva A.M. Nonsteroidal anti-inflammatory drugs in colorectal cancer: From prevention to therapy. Br J Cancer 2003; 88(6): 803-807). Селективные СОХ-2 ингибиторы предотвращают кишечный канцерогенез в предклинических моделях, и одна такая молекула (Celecoxib) достигает предотвращения кишечной карциномы у пациентов.
В этой связи разработка новых эффективных экзогенных доноров NO вызывает в последние годы огромный интерес специалистов в области практической медицины. Основные требования к соединениям- донорам NO сформировались благодаря накопившемуся опыту в их исследовании и, в определенной степени, являются обоснованием целесообразности поиска новых биологически активных веществ в этом ряду соединений: 1) целевые продукты синтеза NO доноров должны быть выделены в чистом виде и твердом состоянии; 2) NO-доноры должны быстро разлагаться в водных растворах при физиологическом значении рН с высвобождением NO без дополнительной активации; 3) при разложении NO доноров должен образовываться оксид азота с количественным выходом.
Таким образом, большинство существующих соединений и фармацевтических препаратов, способных регулировать уровень NO in vivo, являются органическими веществами и применяются, как правило, только для усиления (в различной мере, в зависимости от химической природы) действия существующих химиотерапевтических средств или радиотерапии (Wink D., Vodovoz J., Cook J., Biochemistry, 1998, 63, 7, pp.948-957; N.P. Konovalova, S.A. Goncharova, L.M. Volkova, T.A. Raevskaya, L.T. Eremenko, A.M. Korolev, Nitric Oxide: Biology and Chemistry, 2003, 8, pp.59-64; Yang, W., Rogers P.A., Ding H., J. Biol. Chem., 2002, 277, pp.12868-12873; 0. Siri, A. Tabard, P. Pullumbi, R. Guilard, Inorg. Chim. Acta 2003, 350, p.633; J.L. Burgaud, E. Jngini, Del Soldato P. Ann, N.Y. Acad. Sci. 2002, 962, p.360; Т.I. Karu, L.V. Pyatibrat, G.S. Kalendo, Toxicology Letters, 2001, 121, p.5 7). Но с тех пор, как было выявлено участие нитрозильных комплексов металлов (главным образом, железа) в биохимии NO, появилось новое направление, основанное на применении комплексов переходных металлов в регуляции уровня NO в живых системах. В работе A. Janczyk, et.all. Nitric Oxide, 2004, 10, 1, pp.42-50 изучено непосредственное цитотоксическое действие нитрозильного комплекса железа Na[Fe4S3(NO)7] на клетки меланомы человека и мыши. Однако этот нитрозильный комплекс железа генерирует NO при фотоактивации (даже в темноте), а также не может быть использован в качестве противоопухолевого лекарственного средства из-за высокой токсичности в отношении нормальных клеток.
В качестве таких доноров NO могут применяться нитрозильные комплексы железа, которые являются синтетическими аналогами природных доноров NO -нитрозильных [Fe-2S] протеинов и содержат в своем составе одновременно два лекарственных фармакофора: серосодержащие тиолилы - антиметаболиты пуриновых оснований ДНК, ингибиторы роста злокачественных опухолей различного генеза и NO группы, ключевые молекулы, регулирующие процесс опухолевых новообразований.
Особый интерес представляют солевые формы динитрозильных моноядерных комплексов железа (ДНКЖ) состава Q+[Fe(SR)2(NO)2]- с функциональными ароматическими тиолилами NO, поскольку вещества являются водорастворимыми и, соответственно, биодоступными.
Как правило, ДНКЖ получают в виде малостабильных водных растворов, которые получают пропусканием газообразного NO через смесь сульфата железа (II) и соответствующего водорастворимого тиола, взятых в мольном соотношении 1:2, соответственно (L. Li. Some Coordination Chemistry of Non-heme Iron Nitrosyi Complexes. Comments on Inorganic Chemistry. 2002. Volume 23, issue 5, pp.335-353; I.I. Lobysheva, V.A. Serezhenkov, R.A. Stucan, M.K. Bowman and A.F. Vanin. Redox Reactions and Stability of Dinitrosyi Iron Complexes with Thiolate Ligands as Potential Donors and Carriers of Nitric Oxide. Biochemistry, 1997, v. 62, N7, p.801; M.V. Stupakova, I.I. Lobysheva, V.D. Mikojan, A.F. Vanin and S.V. VasiPeva. A Role of Iron Ions in the SOS DNA Repair Response Induced by Nitric Oxide in Escherichia coli. Biochemistry, 2000, v. 65, N6, p.690; A. Mulsch, P.I. Mordvincev, A. F. Vanin and R. Buss. The potent vasodilating and guanylyl cyclase activating dinitrosyl-iron(II) complex is stored in a protein-bound form in vascular tissue and is released by thiols. FEBS Lett., 1991, v. 294, iss. 3, pp.252-256; I.Y. Malyshev, A.V. Malugin, L.Y. Golubeva, T.A. Zenina, E. B. Manukhina, V.D. Mikoyan and A.F. Vanin. Nitric oxide donor induces HSP70 accumulation in the heart and in cultured cells. FEBS Lett., 1996, v. 391, iss. 1-2, pp.21-23; A.L. Kleschyov, S. Strand, S. Schmitt, D. Gottfried, M. Skatchkov, N. Sjakste, A. Daiber, V. Umansky, T. Munzel. Dinitrosyl-iron triggers apoptosis in Jurkat cells despite overexpression of Bcl-2. / Free Radical Biology & Medicine 40 (2006) 1340-1348), или в форме лиофильно высушенных композитов этих растворов с водорастворимыми полимерами (Ванин А.Ф., Лозинский В.И. Капелько В.И., Полимерная композиция для получения стабилизированной формы динитрозильного комплекса железа и способ получения указанной формы комплекса. Патент RU 2291880 С1). Эти способы ограничивают широкое использование ДНКЖ в прикладных целях, связанное с неконтролируемостью исходного состава.
Первый синтетический аналог ДНКЖ с серосодержащим лигандом был синтезирован реакцией (FeL)2, где L-дианион N,N-диметил-N,N-бис(2-меркаптоэтил)-1,3-пропандиамина с NOPF6 в дихлорметане (К.М. Bultusis, K.D. Karlin, H.N. Rabinowitz, J.C. Dewan and S. J. Lippard. Synthesis and structure of Fe(L'H)(NO)2, a tetracoordinate complex having a twelve-membered chelate ring, and its conversion to pentacoordinate FeL'(NO) through formal loss of "HNO" (L'=SCH2CH2NMeCH2CH2CH2NMeCH2CH2S-). Inorg. Chem., 1980, v. 19, iss. 9, pp.2627-2632) и имел состав:
Анионный ДНКЖ состава [NEt4][Fe(NO)2(SPh)2] (Strasdeit, В. Krebs and G. Henkel. Synthese und Struktur von [Fe(SPh)2(NO)2]-, dem "Monomeren" des Roussinschen Phenylesters. Z. Naturforsch., 1986, 41B, pp.1357-1362) был получен реакцией "черной соли Руссина" с дифенилдисульфидом по схеме:
Катионные ДНКЖ состава [Fe(NO)2(SC(NH2)2)]X и [Fe2(S(CH)2NH3)2(NO)4]X (Х=Cl, I) синтезированы многостадийной реакцией из [Fe(NO)2(CO)2] или [Fe(NO)2I]2 в тетрагидрофуране и исследованы методом РСА (Traci R.Bryar and Donald R.Eaton. Electronic configuration and structure of paramagnetic iron dinitrosyl complexes. / Can. J. Chem. 1992. Vol.70. No.7: pp.1917-1926. [N(PPh3)2][Fe(NO)2I2]-). Для ряда анионных комплексов: [Fe(NO)2(h-SC3H7)2]-, [Fe(NO)2(4-NO2-C3H3N2)2)]-, [Fe(NO)2(NCS)2]-, Na[Fe(NO)2L2] с L=MeO-, EtO-, (NH2)2CO и F в этой же работе приведены данные ЭПР растворов в этаноле и CH2Cl2. Растворы ДНКЖ приготавливались добавлением избытка анионного лиганда к 10-2 М FeCl2 с последующим пропусканием газообразного NO в течении 5 минут.
Неустойчивость ДНКЖ вызывает большие трудности по их кристаллизации и изучению их строения и физико-химических свойств в твердой фазе. Активные исследования последних лет привели к успешному выделению и характеристике монокристаллов некоторых новых серосодержащих ДНКЖ, например, при использовании N,N'-бис(2-меркаптоэтил-1,5-диазоциклооктана (H2bme-daco) по методу (Sandra А. Т. Dillinger, Helmut W. Schmalle, Thomas Fox and Heinz Berke. Developing iron nitrosyi complexes as NO donor prodrugs. / Dalton Trans., 2007. Issue 32, pp.3562-3571; Ch.-Yi Chiang, M.L. Miller, J.H. Reibenspies and M.Y. Darenbourg. Bismercaptoethanediazacyclooctane as a N2S2 Chelating Agent and Cys-X-Cys Mimic for Fe(NO) and Fe(NO)2. J.Am.Chem.Sos., 2004, v. 126, iss. 35, pp.70867-10874) выделили комплекс стабильный при температуре Т=-35°С (см. схему 1). Хранение моноядерного комплекса железа на воздухе или повышение температуры (>-35°), а также присутствие влаги приводят к его разложению:
Анионный димерный ДНИК [(NO)2Fe(µ-StBu)2Fe(NO)2]2 - с катионом [К+-18-краун-6-эфир] был синтезирован недавно (Chih-Chin Tsou, Tsai-Te Lu, and Wen-Feng Liaw. EPR, UV-Vis, IR, and X-ray Demonstration of the Anionic Dimeric Dinitrosyl Iron Complex [(NO)2Fe(µ-StBu)2Fe(NO)2]2 -: Relevance to the Products of Nitrosylation of Cytosolic and Mitochondrial Aconitases, and High-Potential Iron Proteins. / J. Am. Chem. Soc. 2007, 129, pp.12626-12627) по схеме:
Синтез анионного комплекса состава [PPN][(PhS)2(Fe(NO)2], где PPN=бис(трифенилфосфоранилиден)аммоний (Tsai-Te Lu, Show-Jen Chiou, Chun-Yu Chen, and Wen-Feng Liaw. Mononitrosyl Tris(Thiolate) Iron Complex [Fe(NO)(SPh)3]- and Dinitrosyl Iron Complex [(EtS)2Fe(NO)2]-: Formation Pathway of Dinitrosyl Iron Complexes (DNICs) from Nitrosylation of Biomimetic Rubredoxin [Fe(SR)4]2-/1- (R=Ph, Et). / Inorg. Chem., 2006, vol.45 No.21, pp.8799-8806), осуществляли пропусканием газообразного NO через ТГФ раствор [PPN][Fe(SPh)3NO] и дальнейшим высаживанием гексаном. [PPN][(EtS)2(Fe(NO)2] синтезирован и исследован методом PCA: комплекс [PPN][(PhS)2(Fe(NO)2] и [PPN][EtS] растворяли в CH3CN в атмосфере N2, обрабатывали диэтиловым эфиром, фильтрованием удаляли нерастворившийся [PPN][PhS] и избыток [PPN][EtS], к фильтрату добавляли гексан для высаживания красно-коричневого порошка [PPN][(EtS)2(Fe(NO)2].
Динтрозильный комплекс железа с анионом [(-SC7H4SN)2Fe(NO)2]- например, был приготовлен реакцией [S5Fe(NO)2]- с бис(2-бензотиолил)дисульфидом (Fu-Te Tsai, Show-Jen Chiou, Ming-Che Tsai, Ming-Li Tsai, Hsiao-Wen Huang, Ming-Hsi Chiang, and Wen-Feng Liaw. Dinitrosyl Iron Complexes (DNICs) [L2Fe(NO)2]- (L=Thiolate): Interconversion among {Fe(NO)2}9 DNICs, {Fe(NO)2}10 DNICs, and [2Fe-2S] Clusters, and the Critical Role of the Thiolate Ligands in Regulating NO Release of DNICs. / Inorg. Chem., 2005, vol.44, No.16, pp.5872-5881). В синтезах аналогичных динитрозильных соединений сильные электрон-донирующие тиолаты {RS}-(R=C6H4-O-NHCOCH3, C4H3S, C6H4NH2, Ph) по сравнению с [SC7H4SN]-, инициируют тиолат-лигандное замещение давая [(-SC6H4-o-NHCOCH3)2Fe(NO)2]-, [(-SC4H3S)2Fe(NO)2]-, и [(SPh)2Fe(NO)2]-, соответственно.
По данным L. Li. (Some Coordination Chemistry of Non-heme Iron Nitrosyi Complexes. Comments on Inorganic Chemistry. 2002. Volume 23, issue 5, pp.335-353) растворы анионных ДНИК можно также получать при замещении СО лигандов в [Fe2(CO)2(NO)2] на азотсодержащие лиганды: l-MeIm, 4-MeIm, Im, Benzim, MeBenzIm, L-Histidine (FeNцNцNN). Идентификация комплексов осуществлялась методами ЭПР и ИК спектроскопии, для ДНИК с фосфиновыми и TCNE (РСА) лигандами выполнены квантово-химические расчеты фрагмента NNFe(NO)2 в комплексах.
Таким образом, существует потребность в разработке способов получения новых новых ДНКЖ - эффективных биосовместимых доноров NO, обладающих пониженной токсичностью.
Задачей настоящего изобретения является разработка новых динитрозильных анионных комплексов железа, расширение арсенала противоопухолевых средств и создание противоопухолевых лекарственных средств с улучшенным спектром активности и уменьшенными побочными эффектами, в частности лекарственного средства на основе анионных динитрозильных моноядерных комплексов железа с лигандами антиметаболитами пуриновых оснований ДНК; их NO донорная и цитотоксическая активность. Кроме того задачей изобретения является разработка способа получения моноядерных динитрозильных комплексов железа.
В одном аспекте изобретение относится новому противоопухолевому агенту -моноядерному динитрозильному комплексу железа формулы (N2H5)+[Fe(SR)2(NO)2]- (далее - I), где R представляет собой 5-нитропиридинил, 2-нитро-, 3-нитро- и 4-нитрофенилы и пиридинил.
В другом аспекте изобретение относится к способу получения моноядерного динитрозильного комплекса железа формулы (N2H5)+[Fe(SR)2(NO)2]-, где R представляет собой 5-нитропиридинил, 2-нитро-, 3-нитро- и 4-нитрофенилы и пиридинил, восстановлением соотвествующего дисульфида в водно-спиртовом растворе с последующими замещением тиосульфатных лигандов в биядерном тетранитрозильном тиосульфатном комплексе железа на ароматический тиол, предпочтительно предпочтительно 5-нитропиридинил, 2-нитро-, 3-нитро- и 4-нитрофенилы и пиридинил. Этот способ позволяет впервые получить заявляемые комплексы в кристаллической форме.
Кроме того настоящее изобретение относится к донору моноокисида азота, представляющему собой моноядерный динитрозильный комплекс железа с лигандами, охарактеризованными выше.
В следующем аспекте настоящее изобретение касается применения моноядерных динитрозильных комплексов железа формулы (N2H5)+[Fe(SR)2(NO)2]-, где R представляет собой 5-нитропиридинил, 2-нитро-, 3-нитро- и 4-нитрофенилы и пиридинил, в качестве противоопухолевых лекарственных средств.
Описание фигур
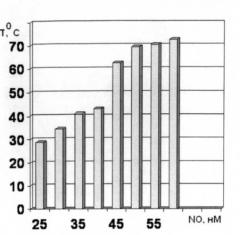
На фиг.1 показана зависимость количества МО(нМ), генерируемого комплексом I (4·10-6M) в воде, от температуры в анаэробных условиях при рН=7,0.
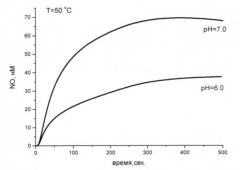
На фиг.2 показаны зависимости количества NO от времени при разложении комплекса I (4·10-6M) в воде в анаэробных условиях при рН=6,0 и 7,0 и температуре 50°С.
Сущность изобретения заключается в следующем. Разработанный способ отличается от метода, применяемого ранее для синтеза соединений этого класса (Structure of the neutral mononuclear dinitrosyi iron complex with l,2,4-triazole-3-thione [Fe(SC2H3N3)(SC2H2N3)(NO)2]·0.5 H2O / N.A. Sanina, O.A. Rakova, S.M. Aldoshin, G.V.Shilov, Yu.M. Shulga, A.V. Kulikov, N.S. Ovanesyan// Mend. Comm. - 2004. - №1. - P.9-10; Биядерные нитрозильные комплексы железа с бензазагетероциклическими производными, способ их получения, донор монооксида азота, фармацевтическая композиция, содержащая их и их применение в качестве противоопухолевых лекарственных средств / Н.А. Санина, О.С. Жукова, З.С. Смирнова, Т.Н. Руднева, Г.В. Шилов, С.М. Алдошин // - № PCT/RU 2007/000286 от 30.05.2007; Применение тетранитрозильного комплекса железа с тиофенолом в качестве противоопухолевого лекарственного средства и фармацевтические композиции и наборы, содержащий этот комплекс / Н.А. Санина, О.С. Жукова, С.М. Алдошин, Н.С. Емельянова, Г.К. Герасимова // Патент на изобретение N 2429242, Бюл. N 262011 от 20.09.2011; Водорастворимые биядерные катионные нитрозильные комплексы железа с природными алифатическими тиолилами, обладающие цитотоксической, апоптотической и NO-донорной активностью / Н.А. Санина, Т.Н. Руднева, К.А. Лысенко, О.С. Жукова, Н.С. Емельянова, С.М. Алдошин // - № PCT/RU 2008/000338 от 02.06.2008). Здесь восстановительное замещение тиосульфатных лигандов в Na2[Fe2(S2O3)2(NO)4]·4H2O на ароматический тиол осуществляется с использованием соли гидразония, которая может быть легко получена и выделена в кристаллической форме из соответствующего функционального дисульфида. Метод позволяет не применять концентрированные растворы щелочей для перевода тиолов в солевые формы, использование которых, как правило, приводит к образованию Fe(ОН)3 в качестве побочного продукта реакции и снижает выходы целевых продуктов.
Все операции проводились в инертной атмосфере по нижеприведенной схеме.
Ниже приведена схема реакции:
На первой стадии процесса проводят восстановление 2,2'-дитиобис-(5-нитропиридина) гидразингидратом в водно-спиртовом растворе.
На второй стадии - восстановительное замещение тиосульфатных лигандов в биядерном тетранитрозильном тиосульфатном комплексе железа на ароматический тиол.
Комплекс (N2H5)+[Fe(SR)2(NO)2]- устойчив в течение 7 месяцев хранения при комнатной температуре; растворим в ацетоне, ацетонитриле, диоксане, диметилсульфоксиде, тетрагидрофуране и этаноле. Не растворим в гептане, толуоле, хлористом метилене, серном и петролейном эфирах. Устойчивость растворов комплекса в растворителях зависит от природы растворителя - в этаноле-8 дней, в ДМСО-2 недели (показано с помощью спектрофотометрического метода).
В предлагаемом изобретении исследована NO- донорная активность моноядерных динитрозильных комплексов железа.
Методика эксперимента.
Концентрацию NO, генерируемого комплексом I в водных растворах, измеряли с помощью сенсорного электрода amino-700 системы «inNO Nitric Oxide Measuring System» (США). Навеску комплекса I (0.4·10-5 М) растворяли в 10 мл воды в течение 3 минут при 25 С, далее 1 мл раствора анаэробно вносили в термостатируемую электрохимическую ячейку, заполненную 49,0 мл фосфатного буферного раствора. Концентрацию NO фиксировали автоматически в течение первых 500 секунд с момента начала реакции гидролиза (с шагом 0.2 сек). Для калибровки сенсора amiNO-700 использовали стандартный водный раствор NaNO2 (100 мкМ, поставляется с электродом), который добавляли в смесь, состоящую из 20 мг KI (фирма «Aldrich»), 2 мл 1 М раствора H2SO4 (марка «хч») и 20 мл воды.
Согласно данным электро-химического анализа, комплекс I генерирует NO в результате гидролиза, однако количество выделившегося NO зависит от температуры растворителя: с ростом температуры раствора наблюдается увеличение (почти вдвое) количества генерированного NO с 34,4 нМ при Т=25°С до 72,5 нМ при Т=60 С (рис.1). При температурах выше 60°С количество генерированного NO уменьшается (при Т=70°С эта величина равна 64,1 нМ), что по-видимому, обусловлено участием генерированного NO во вторичных реакциях. Результаты прямых анаэробных измерений электрохимическим методом количества NO, выделившегося при гидролизе I показаны на рис.2 и представляют собой экспериментальные зависимости количества NO от времени в водных растворах при рН 6,0 и 7,0 и Т=50°С. Выделение NO, как видно из рис.2, наблюдается уже в первые секунды после растворения. Максимальное количество NO (37,4 (рН 6,0) и 72,5 (рН 7,0) нМоль на моль комплекса, соответственно) наблюдается через -300 секунд после растворения в водном растворе.
Эксперименты проведены в сравнении с NO-аддуктом диэтилентриамина -органическим донором NO, представителем семейства NONO-атов - эффективных доноров NO, использующихся в клинике. Установлено, что комплекс I является более эффективным донором NO, чем NO-ат: спустя 20 секунд после растворения комплекса I концентрация NO в растворе составляет ~15 нМ и значительно (в 60 раз) превышает NO-донорную активность NO-аддукта диэтилентриамина.
Было также изучено влияние моноядерного динитрозильного комплекса железа на выживаемость опухолевых клеток человека различного генеза (цитотоксическая активность 7). Перед началом эксперимента соединение растворяли в воде или 100 мкл ДМСО в соответствии с паспортными данными о растворимости, а затем доводили до нужной концентрации питательной средой RPMI1640. Конечная концентрация ДМСО в пробах не превышала 0,1% и не влияла на рост клеток.
Линии опухолевых клеток человека: LS174T рак толстой кишки, MCF7 карцинома молочной железы и А549 немелкоклеточный рак легкого выращивали в монослое в среде RPMI1640, содержащей 10% эмбриональной сыворотки теленка, при 37° и 5% содержании СО2. Для экспериментов клетки рассевали в 96-луночные планшеты и выращивали в тех же условиях.
Цитотоксическую активность соединения определяли по выживаемости клеток в пробах. Тестирование выживаемости проводили с помощью МТТ-теста, основанного на способности дегидрогеназ живых клеток восстанавливать неокрашенной МТТ-реагент в голубые кристаллы формазана, растворимые в диметилсульфоксиде (ДМСО).
Все соединения вносили в лунки в объеме 20 мкл в конечных концентрациях (мкМ) 100, 50, 25. Общий объем инкубации составлял 200 мкл. Клетки с препаратами инкубировали в указанных выше условиях в течение 72 часов. По окончании инкубации к клеткам доб