Гены, кодирующие главный капсидный белок l1 вируса папилломы человека, и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и вирусологии. В настоящем изобретении раскрывается кодон-оптимизированный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, который способен, после трансдукции в клетку дрожжей, к эффективной экспрессии главного капсидного белка L1 вируса папилломы человека. Описана также иммуногенная макромолекула, которая преимущественно образуется при экспрессии указанного кодон-оптимизированного гена, кодирующего главный капсидный белок L1 вируса папилломы человека в клетке дрожжей. Также раскрывается применение указанной иммуногенной макромолекулы и композиции, включающей указанную иммуногенную макромолекулу. Предложенная группа изобретений может быть использована в медицине для вакцинации против вируса папилломы человека. 8 н. и 7 з.п. ф-лы, 21 ил., 11 табл., 22 пр.
Реферат
Область изобретения
Настоящее изобретение относится к области биотехнологии, а именно к основному капсидному белку вируса папилломы человека, гену, кодирующему этот белок, а также к способу его получения и использованию.
Предпосылки создания изобретения
Вирус папилломы человека (ВПЧ) - малый вирус без оболочки с кольцевой двухспиральной ДНК, относящийся к подсемейству вирусов полиомы семейства паповавирусов. ВПЧ передается от человека к человеку при интимном контакте, приводя к таким поражениям у инфицированного пациента как бородавки на коже и кондиломы в перианальной области и в области половых органов, которые классифицируются как заболевания, передающиеся половым путем. Согласно результатам исследований, опубликованным Международным агентством по изучению рака в 1995, ВПЧ имеет прямое отношение к появлению рака шейки матки. Таким образом ясно, что ВПЧ является патогеном, вредным для здоровья человека, В связи с этим разработка высокоэффективных и недорогих вакцин против ВПЧ для предотвращения рака шейки матки у женщин, а также заболеваний, передающихся половым путем, вызванных инфицированием ВПЧ, является актуальной задачей.
В настоящее время идентифицировано более 100 подтипов ВПЧ. При использовании чувствительных методов исследования практически у 100% больных раком шейки матки в пораженных тканях обнаруживается ДНК, принадлежащая подтипам ВПЧ высокой степени риска. В зависимости от способности подтипов ВПЧ вызывать злокачественные новообразования в половых путях женщин, ВПЧ подразделяются на подтипы высокой степени риска и низкой степени риска. ВПЧ 6, 11, 34, 40, 42 и аналогичные относятся к подтипам низкой степени риска, которые обнаруживаются обычно при доброкачественных заболеваниях шейки матки, таких как кондиломы и умеренная атипическая гиперплазия цервикального эпителия, в то время как подтипы высокой степени риска - ВПЧ 16, 18, 31, 33, 35, 39, 45, как правило обнаруживаются при тяжелой атипической гиперплазии цервикального эпителия, а также при раке шейки матки. В ряде исследований различных групп населения показано, что инфицирование половых путей вирусами ВПЧ 16 и 18 в большей степени связано с появлением рака шейки матки, чем другие факторы риска. Около 50-60% случаев рака шейки матки вызвано инфицированием ВПЧ 16, около 14% - ВПЧ 18, около 8% - ВПЧ 45 и около 5% - ВПЧ 31. Оставшиеся 23% случаев вызвано другими подтипами ВПЧ.
ВПЧ является глобулярным вирусом без оболочки диаметром около 45-55 нм, имеет капсид, состоящий из 72 модулей (капсомеров) икосаэдрической симметрии. Капсид вириона состоит из главного капсидного белка (L1) и малого капсидного белка (L2). После экспрессии в клетках главные капсидные белки L1 способны к самосборке с образованием капсидных частиц, называемых вирусоподобными частицами (ВЧ).
Для обычной женщины вероятность заражения цервикальных путей хотя бы одним подтипом ВПЧ в течение всей жизни составляет 40%. Таким образом, разработка эффективных вакцин против рака шейки матки, имеющих приемлемую цену, и, прежде всего, вакцин против ВПЧ 16 и ВПЧ 18 имеет большое значение для снижения заболеваемости и смертности женщин от рака шейки матки.
Из уровня техники известны некоторые вакцины, разработанные против ВПЧ. Как правило, они характеризуются низкой эффективностью экспрессии белков ВПЧ, низкой активностью экспрессированного белка, неспособностью белка образовывать вирусоподобные частицы либо нежелательным иммунологическим действием образованных частиц. Следовательно, в данной области существует потребность в вакцинах против ВПЧ с улучшенными свойствами.
Краткое описание изобретения
Объектами данного изобретения является ген, кодирующий главный капсидный белок L1 вируса папилломы человека, а также способ его получения и использование.
Согласно первому аспекту настоящего изобретения, предлагается выделенный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, причем указанный ген содержит кодоны, предпочтительные для дрожжей Pichia.
В другом предпочтительном осуществлении настоящего изобретения указанный ген кодирует главный капсидный белок L1 вируса папилломы человека, включающий цепочку аминокислот, представленную в SEQ ID NO:10 либо в положениях 62-568 SEQ ID NO:10 (т.е., главный капсидный белок L1 вируса папилломы человека подтипа 18). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3; либо содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
В другом предпочтительном осуществлении настоящего изобретения указанный ген кодирует главный капсидный белок L1 вируса папилломы человека, включающий цепочку аминокислот, представленную в SEQ ID NO:11 (т.е., главный капсидный белок L1 вируса папилломы человека подтипа 16). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:7, SEQ ID NO:8 и SEQ ID NO:9.
Согласно второму аспекту настоящего изобретения, предлагается вектор экспрессии, содержащий последовательность указанного гена.
Согласно еще одному предпочтительному осуществлению настоящего изобретения, указанный вектор экспрессии представляет собой вектор для экспрессии в клетках дрожжей Pichia.
Согласно третьему аспекту настоящего изобретения, предлагается клетка-хозяин, полученная методом генной инженерии, причем указанная клетка содержит упомянутый экспрессирующий вектор или имеет указанный ген, включенный в ее геном.
Согласно другому предпочтительному осуществлению настоящего изобретения, указанная клетка представляет собой клетку дрожжей Pichia. Более предпочтительно, дрожжи Pichia выбираются из штаммов дрожжей Pichia Х-33, GS115, КМ71 и SMD1168. Наиболее предпочтительно, указанные дрожжи Pichia относятся к штамму дрожжей Pichia Х-33.
Согласно четвертому аспекту настоящего изобретения, предлагается иммуногенная макромолекула (т.е., вирусоподобная частица). Указанная макромолекула диаметром 50-80 нм получается путем самосборки из главного капсидного белка L1 вируса папилломы человека, который был экспрессирован в дрожжах Pichia.
В другом предпочтительном осуществлении настоящего изобретения указанную иммуногенную макромолекулу получают способом, включающим:
(1) культивирование указанной клетки-хозяина, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самосборку в указанную иммуногенную макромолекулу в указанной клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
Согласно пятому аспекту настоящего изобретения, предлагается способ получения указанной иммуногенной макромолекулы, причем данный способ включает:
(1) культивирование указанной клетки-хозяина, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самбосорку в указанную иммуногенную макромолекулу в указанной клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
Еще в одном предпочтительном осуществлении настоящего изобретения стадия (2), описанная выше, включает:
(a) разрушение клеток-хозяев, полученных на стадии (1) с образованием супернатанта, содержащего указанную иммуногенную макромолекулу; и
(b) последовательную очистку супернатанта, полученного на стадии (а), методом колоночной хроматографии на колонке с POROS 50 HS и методом колоночной хроматографии на колонке СНТ с образованием указанной иммуногенной макромолекулы.
Еще в одном предпочтительном осуществлении на стадии (b), описанной выше, очистку методом колоночной хроматографии на колонке с POROS 50 HS осуществляют следующим образом: Супернатант, полученный на стадии (а), наносят на предварительно очищенную и приведенную в равновесие колонку с POROS 50 HS, при этом указанная иммуногенная макромолекула связывается с колонкой. После промывки и приведения в равновесие, проводят элюирование линейным градиентом от 100% буфера А до 100% буфера В и собирают фракции, соответствующие хроматографическим пикам с электропроводностью 70-100 мСм/см, при этом указанный буфер А содержит 50±20 мМ MOPS (4-морфолинпропансульфоновая кислота), 0,75±0,3 М NaCl и 0,05±0,02% Твин-80 (pH 6.5±1), а указанный буфер В содержит 50±20 мМ MOPS, 1,5 М NaCl и 0,05±0,02% Твин-80 (pH 6.5±1); или
очистку методом колоночной хроматографии на СНТ осуществляют следующим образом: продукт, очищенный на колонке POROS 50 HS, наносят на предварительно очищенную и приведенную в равновесие колонку с СНТ. После промывки и приведения в равновесие, проводят элюирование линейным градиентом от буфера С до 100% буфера D, и собирают фракции, соответствующие хроматографическим пикам 50-70 мСм/см, причем указанный буфер С содержит 50±20 мМ MOPS, 0,5±0,2 М NaCl, 0,04±0,02 М фосфатный буфер (РВ) и 0,05±0,02% Твин-80 (pH 6.5±1), а указанный буфер D содержит 0,5±0,2М NaCl, 200 мМ РВ и 0,05±0,02% Твин-80 (pH 6.5±1).
Согласно шестому аспекту настоящего изобретения, предлагается иммуногенная композиция, причем упомянутая композиция содержит:
(i) эффективное количество указанной иммуногенной макромолекулы; и
(ii) фармацевтически приемлемый носитель.
В другом предпочтительном осуществлении настоящего изобретения, указанный фармацевтически приемлемый носитель включает по крайней мере один иммуностимулятор или адъювант.
Еще в одном предпочтительном осуществлении настоящего изобретения указанный адъювант является соединением алюминия.
Согласно другому предпочтительному осуществлению настоящего изобретения, указанная композиция представляет собой вакцину.
Согласно седьмому аспекту настоящего изобретения, предлагается применение указанной иммуногенной макромолекулы для профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека.
Согласно восьмому аспекту настоящего изобретения, предлагается способ профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека, причем указанный способ включает введение пациента, нуждающемуся в профилактике или лечении, эффективного количества указанной иммуногенной макромолекулы либо указанной иммуногенной композиции.
В другом предпочтительном осуществлении настоящего изобретения заболевания, связанные с инфицированием вирусом папилломы человека, выбраны из группы злокачественных новообразований (таких как рак шейки матки, рак влагалища, рак ануса или перианальный рак, ротоглоточный рак, рак гайморовой пазухи, рак легких) и интраэпителиальной цервикальной неоплазии.
Прочие аспекты настоящего изобретения будут очевидны для специалиста в данной области в рамках настоящего описания.
Краткое описание рисунков
На фиг.1 схематически показана конструкция вектора pPICZ-18L1.
На фиг.2 приведена диаграмма ПЦР-амплификации гена L1 ВПЧ 18.
На фиг.3 приведена схема идентификации вектора pPICZ-18L1, при этом дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI, а дорожка 2 - pPICZ-18L1, гидролизованный действием BstBI и KpnI.
На фиг.4 приведена схема анализа экспрессии L1 ВПЧ 18 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - отрицательный контроль экспрессии, 3 - штамм, экспрессирующий Bn418L1. Стрелкой отмечен экспрессированный L1 ВПЧ 18.
На фиг.5 приведена схема ПЦР-амплификации гена усеченного L1 ВПЧ 18.
На фиг.6 приведена схема идентификации вектора pPICZ-18L1', дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI; а дорожка 2 - pPICZ-18L1', гидролизованный действием BstBI и KpnI.
На фиг.7 приведена схема анализа экспрессии усеченного L1 ВПЧ 18 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - штамм, экспрессирующий усеченный Bn418L1; и 3 - отрицательный контроль экспрессии. Стрелкой отмечен экспрессированный усеченный L1 ВПЧ 18.
На фиг.8 приведены результаты электрофореза на ДДС-Na-ПААГ в восстанавливающих условиях хроматографически очищенного образца L1 ВПЧ 18, причем 1 - фракция пика 1, собранная на колонке POROS 50 HS; 2 - фракция пика 2, собранная на колонке POROS 50 HS; 3 - фракция пика 3, собранная на колонке POROS 50 HS; 4 - фракция пика 1, собранная на колонке СНТ; 5 - концентрат образца пика 1 с колонки СНТ; и 6 - положительный контроль.
На фиг.9 приведены результаты иммуноблоттинга очищенного продукта L1 ВПЧ 18, при этом первичным антителом является антитело против L1 ВПЧ 18 от компании Fitzgerald Corp. при разбавлении 1:5000; вторичным антителом является антитело козы против мышиного антигена при разбавлении 1:250; 1 - положительный контроль; 2 и 3 - очищенный белок L1 ВПЧ 18.
На фиг.10 приведена микрофотография, полученная методом просвечивающей электронной микроскопии (×105000), очищенного образца ВЧ L1 ВПЧ 18.
На фиг.11А приведена схема инфицирования клетки 293 FT псевдотипом вируса ВПЧ 18.
На фиг.11В приведена схема нейтрализации псевдотипа вируса ВПЧ 18 мышиной сывороткой.
На фиг.12 приведена схема конструкции вектора pPICZ-16 L1.
На фиг.13 приведена схема ПЦР-амплификации гена белка L1 ВПЧ 16.
На фиг.14 приведена схема идентификации вектора pPICZ-16 L1, при этом дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI; а дорожка 2 - pPICZ-16L1, гидролизованный действием BstBI и KpnI.
На фиг.15 приведена схема анализа экспрессии L1 ВПЧ 16 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - штамм, экспрессирующий L1 ВПЧ 16, 3 - отрицательный контроль экспрессии. Стрелкой отмечен экспрессированный L1 ВПЧ 16.
На фиг.16 приведены результаты электрофореза на ДДС-Na-ПААГ в восстанавливающих условиях хроматографически очищенного образца L1 ВПЧ 16, причем 1 - фракция пика, собранная на колонке POROS 50 HS; 2 - фракция 1, прошедшая через колонку СНТ; 3 - фракция 2, прошедшая через колонку СНТ; 4 - положительный контроль L1 ВПЧ 16; 5 - пик 1, элюированный с колонки СНТ; 6 - пик 2, элюированный с колонки; 7 - пик 4, элюированный с колонки СНТ; 8 - пик 8, элюированный с колонки СНТ; и 9 - пик 12, элюированный с колонки СНТ.
На фиг.17 приведены результаты определения чистоты L1 ВПЧ 16 по данным капиллярного электрофореза.
На фиг.18 приведена микрофотография, полученная методом просвечивающей электронной микроскопии (×105000), очищенного образца ВЧ L1 ВПЧ 16.
На фиг.19А приведена схема инфицирования клетки 293FT псевдотипом вируса ВПЧ 16.
На фиг.19В приведена схема нейтрализации псевдотипа вируса L1 ВПЧ 18 мышиной сывороткой.
Подробное описание изобретения
В результате интенсивных исследований авторы настоящего изобретения впервые раскрыли кодон-оптимизированный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, который при введении в клетку дрожжей способен эффективно экспрессировать главный капсидный белок L1 вируса папилломы человека, способный к самосборке в вирусоподобные частицы, причем величина экспрессии соответствует требованиям технологического производства. Настоящее изобретение также впервые представляет иммуногенную макромолекулу, образующуюся при экспрессии указанного кодон-оптимизированного гена, кодирующего главный капсидный белок L1 вируса папилломы человека, в клетке дрожжей.
В данном документе упомянутый главный капсидный белок L1 вируса папилломы человека обозначается для краткости белок L1 ВПЧ; упомянутый главный капсидный белок L1 вируса папилломы человека подтипа 18 для краткости обозначается белок L1 ВПЧ 18; а упомянутый главный капсидный белок L1 вируса папилломы человека подтипа 16 для краткости обозначается белок L1 ВПЧ 16. Белок L1 ВПЧ включает в себя белок L1 ВПЧ 18 и белок L1 ВПЧ 16, в также их усеченную форму.
В данном документе термин «иммуногенная макромолекула» относится к полимерной макромолекуле, включающей несколько мономерных главных капсидных белков L1 вируса папилломы человека, которая предпочтительно получена при полимеризации или сборке нескольких главных капсидных белков L1 вируса папилломы человека; указанные главные капсидные белки L1 вируса папилломы человека кодируются кодон-оптимизированным геном, кодирующим главный капсидный белок L1 вируса папилломы человека и экспрессируются в клетках дрожжей (предпочтительно в клетках дрожжей Pichia). Указанная иммуногенная макромолекула имеет гранулярную форму.
В данном документе термины «функционально связаны друг с другом» или «функционально связан с» относятся к ситуации, когда некоторая часть линейной последовательности ДНК может влиять на активность других частей той же самой линейной последовательности ДНК. Например, если промотор управляет транскрипцией кодирующей последовательности, то он функционально связан с кодирующей последовательностью.
В данном документе выражения «содержащий», «имеющий» или «включающий» (или их грамматические варианты) подразумевают «содержащий», «в основном состоящий из…», «преимущественно состоящий из…» и «состоящий из…». Понятия «в основном состоящий из…», «преимущественно состоящий из…» и «состоящий из…» - подчиненные понятия по отношению к «содержащий», «имеющий» или «включающий».
Ген, кодирующий главный капсидный белок L1 вируса папилломы человека
С учетом задачи экспрессии белка L1 ВПЧ с помощью клетки дрожжей авторы настоящего изобретения обнаружили в результате тщательных исследований оптимизированный ген, кодирующий белок L1 ВПЧ, который может эффективно экпрессироваться в клетке дрожжей, в частности, в клетке дрожжей Pichia. Указанный оптимизированный ген кодирует полноразмерный или усеченный белок L1 ВПЧ 18. Либо указанный оптимизированный ген кодирует полноразмерный белок L1 ВПЧ 16.
Специалистам в данной области хорошо известно, что, хотя существует 64 генетических кодона, в большинстве организмов встречается лишь часть этих кодонов. Например, гены клеток дрожжей проявляют иное предпочтение к кодонам, чем человеческие гены. Вследствие вырождения генетических кодонов, каждая аминокислота может кодироваться более чем одним кодоном, причем кодоны для той же самой аминокислоты характеризуются различной распространенностью в генах дикого типа. Существующее предпочтение клеток дрожжей к определенным кодонам может привести к низкой эффективности и низкому уровню экспрессии рекомбинантных белков.
Оптимизация кодонов в соответствии с настоящим изобретением в основном осуществлялась следующим образом. Во-первых, в результате многократных экспериментов в существующий в природе ген, кодирующий L1 ВПЧ, вносили модификации, оптимизируя кодоны для всех аминокислот гена, и многократно проводили опыты по экспрессии гена с оптимизированными последовательностями, с целью выявления нового набора последовательностей ДНК ВПЧ, пригодных для экспрессии в клетке дрожжей. Ген, кодирующий полноразмерный L1 ВПЧ 18, представлен в Genbank, № вхождения ААР20601; ген, кодирующий усеченный L1 ВПЧ 18, представлен в Genbank, № вхождения AAQ92369; и ген, кодирующий полноразмерный L1 ВПЧ 16 представлен в Genbank, № вхождения ААС09292.
Далее, во избежание наличия высокого соотношения GC в транскрибированных мРНК, влияния вторичной структуры мРНК на эффективность трансляции и присутствия общих сайтов рестрикции, авторы настоящего изобретения внесли изменения в некоторые из предпочтительных кодонов, например, кодон аспарагина (Asn) изменяли с ААС на ААТ; кодон лизина (Lys) - с AAG на ААА; кодон аспарагиновой кислоты (Asp) - с GAT на GAC, кодон фенилаланина (Phe) - с ТТТ на ТТС; кодон тирозина (Tyr) - с ТАС на ТАТ и кодон глицина (Gly) - с GGT на GGA, получая таким образом новые последовательности ДНК ВПЧ.
Согласно предпочтительному осуществлению настоящего изобретения, указанный ген кодирует главные капсидные белки L1 вируса папилломы человека, имеющие цепочку аминокислот, представленную в SEQ ID NO:10 либо в положениях 62-568 SEQ ID NO:10 (т.е., L1 ВПЧ 18). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:I, SEQ ID NO:2 и SEQ ID NO:3; или содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6. Еще более предпочтительно, указанный ген содержит последовательность нуклеотидов, представленную в SEQ ID NO:1 или SEQ ID NO:4. Наиболее предпочтительно, указанный ген имеет последовательность нуклеотидов, представленную в SEQ ID NO:1, являющуюся геном усеченного L1 ВПЧ 18, что соответствует усеченному белку L1 ВПЧ 18 с 61 аминокислотной делецией на N-конце. Такой усеченный ген более благоприятен для экспрессии в рекомбинантном векторе без изменения активности белка.
Еще в одном предпочтительном осуществлении настоящего изобретения указанный ген кодирует главные капсидные белки L1 вируса папилломы человека, имеющие цепочку аминокислот, представленную в SEQ ID NO:11 (т.е., L1 ВПЧ16). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:7, SEQ ID NO:8 и SEQ ID NO:9. Наиболее предпочтительно, указанный ген содержит последовательность нуклеотидов, представленную в SEQ ID NO:7.
Кодон-оптимизированный ген, предлагаемый в настоящем изобретении, имеет следующие преимущества: 1) данный оптимизированный ген в большей степени пригоден для эффективной экспрессии целевого белка в дрожжевой клетке-хозяине и удовлетворяет требованиям промышленного производства; 2) при использовании системы экспрессии на основе дрожжей Pichia он обеспечивает низкую стоимость, высокий выход, а также более равномерное и стабильное качество продукта.
В настоящем изобретении также предлагается вектор, включающий упомянутый ген, кодирующий L1 ВПЧ. Упомянутый вектор может содержать помимо этого регуляторные последовательности экспрессии, функционально связанные с последовательностью упомянутого кодирующего гена, которые содействуют экспрессии указанного белка L1 ВПЧ. Можно использовать любой подходящий вектор, прежде всего, из обычно применяемых для клонирования и экспрессии в клетке дрожжей. Более предпочтительно, указанный вектор экспрессии выбирают из наиболее распространенных в настоящее время векторов экспрессии в клетках дрожжей, например, pPICZs pPIC6, pGAPZ и рА0815. Такие векторы экспрессии имеются в открытой продаже.
Далее, к настоящему изобретению относится и рекомбинантная клетка, содержащая указанный ген, который кодирует L1 ВПЧ. Указанная рекомбинантная клетка представляет собой клетку дрожжей, в частности клетку дрожжей Pichia. Более предпочтительно, упомянутая клетка дрожжей Pichia выбирается из штаммов дрожжей Pichia X-33, GS115, KM71 и SMD1168. Указанные штаммы дрожжевых клеток имеются в открытой продаже. Способы введения внешнего гена в клетку дрожжей известны в данной области, например, электротрансформация или трансформация протопластов.
В настоящее изобретение входит также способ получения L1 ВПЧ. Указанный способ предполагает культивирование указанной рекомбинантной клетки, которая включает указанный кодирующий ген. Способ может включать экспрессию кодированного белка L1 ВПЧ в клетках, а также может включать отделение и(или) очистку экспрессированного белка. Белок L1 ВПЧ, полученный как указано выше, может быть очищен до преимущественно однородного состояния, например, дающего одну линию при электрофорезе на ДДС-Na-ПААГ.
Белок L1 ВПЧ, экспрессированный в клетке дрожжей в соответствии с настоящим изобретением, можно использовать для получения иммуногенной макромолекулы, которая может вызвать иммунный ответ in vivo, конкретно, гуморальный иммунный ответ.
В качестве осуществлении настоящего изобретения, авторы изобретения разработали в результате оптимизации несколько последовательностей генов, пригодных для экспрессии белка L1 ВПЧ в клетках дрожжей Pichia, которые затем использовали для полного синтеза полноразмерного гена L1 ВПЧ или его усеченной формы. Ген либо его усеченную форму клонировали в существующий вектор экспрессии на основе дрожжей, который затем служил для конструирования рекомбинантного штамма дрожжей Pichia для экспрессии с помощью гомологичной рекомбинации и тестирования по отношению к высоким концентрациям антибиотиков. Рекомбинантные клетки дрожжей Pichia культивировали в условиях ферментации, а затем обрабатывали метанолом для повышения внутриклеточной экспрессии белка L1 ВПЧ, способного к внутриклеточной конкурентной самосборке с образованием вирусоподобных частиц (ВЧ). Вирусоподобные частицы, очищенные методом колоночной хроматографии супернатанта, полученного из разрушенных клеток, имели чистоту более 90% и проявляли значительное иммуногенное действие при адсорбции на адъюванте - соединении алюминия, что позволяет применять их в качестве вакцины против рака шейки матки у женщин.
Экспрессия и очистка белка
Белок L1 ВПЧ эффективно экспрессируется при культивировании указанной рекомбинантной клетки, содержащей упомянутый ген, кодирующий L1 ВПЧ, причем экспрессированные белки способны к самосборке в конкурентных условиях с образованием иммуногенных макромолекул. Способ экспрессии и очистки включает: (1) культивирование указанной рекомбинантной клетки, обеспечивающее экспрессию упомянутого главного капсидного белка L1 вируса папилломы человека и конкурентную самосборку с образованием иммуногенных молекул в рекомбинантных клетках; (2) разрушение клеток, полученных на стадии (1) с образованием супернатанта, содержащего иммуногенные молекулы; и (3) последовательную очистку супернатанта, полученного на стадии (2) методом колоночной хроматографии на POROS 50 HS и колоночной хроматографии на СНТ с образованием указанных иммуногенных макромолекул.
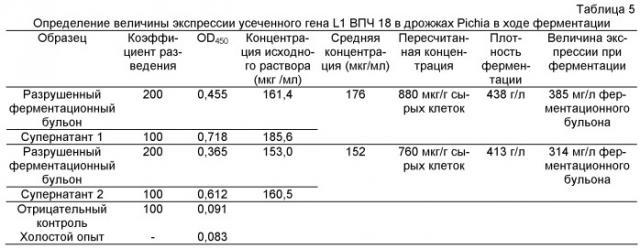
Предпочтительно, культивирование клеток и экспрессию белка проводят следующим образом. Полученные методом генной инженерии клетки дрожжей согласно настоящему изобретению инокулируют в активирующую среду (YPD, или LB, или SOC) и культивируют при 25-37°C, оставляя на ночь. Затем активированную жидкость инокулируют в питательную среду для культивирования (YPD или LB или SOC) и культивируют при 25-37°C, оставляя на ночь. Ферментацию проводят в солевой основной питательной среде (BSM1 или BSM2 или BSM3), которые добавляют со следовыми количествами солей (РТМ1, РТМ2, РТМ3) при температуре 20-37°C и при начальной величине pH 3-8. После первоначальной стадии пролиферации, занимающей 15-30 часов, концентрацию растворенного кислорода поддерживают на уровне 20-80% за счет регулирования скорости перемешивания, тока воздуха и давления в ферментере. После полного расходования источника углерода, масса сырых дрожжей составляет от 50 до 150 г/л. В этот момент начинают подачу раствора глицерина или глюкозы, поддерживая концентрацию растворенного кислорода на уровне 20-80%. Через некоторое время масса сырых дрожжей достигает от 50 до 500 г/л, после чего подачу прекращают и добавляют метанол для индуцирования, при этом pH поддерживают в интервале от 3 до 8. Концентрация растворенного кислорода находится в интервале от более 20% до 80%, температура - от 20 до 37°C, а pH составляет 3-8. В интервале 2-10 часов отбирают пробы и анализируют методом вестерн-блоттинга. Ферментацию останавливают через 5-90 часов после индуцирования, и ферментационный бульон выгружают из аппарата. Бульон центрифугируют на охлаждаемой центрифуге, после чего клетки отделяют и хранят при минус 20°C. Белок L1 ВПЧ, полученный при индуцированной экспрессии, способен к самосборке в вирусоподобные частицы (ВЧ L1 ВПЧ) внутри клетки дрожжей Pichia.
После экспрессии указанного белка L1 ВПЧ в клетке дрожжей Pichia более чистый белок может быть получен в результате разрушения клеток и очистки, после чего он подвергается самосборке с образованием вирусоподобных частиц. Очистка в целом осуществляется следующим образом. Клетки промывают для удаления захваченных компонентов среды (соли, пигменты и т.д.) с целью снижения их влияния на дальнейшую очистку. Промытые клетки помещают в соответствующий буфер для разрушения клеток, содержащий соли и поверхностно-активные вещества в определенных концентрациях. В качестве солей пригодны, например, NaCl и KCl в концентрациях от прибл. 0,4 до 0,8 моль/л. В качестве поверхностно-активных веществ можно применять, например, Твин-80, Твин-20 и Тритон-Х 100 в концентрации от прибл. 0,005 до 0,05% (масса/объем). К подходящим буферным системам относятся, например, фосфатный буфер, буфер Трис, буфер MOPS и буфер HEPES в концентрации от прибл. 0,02 до 0,2 моль/л. Смешанные клетки можно разрушить, например, в гомогенизаторе высокого давления с рабочим давлением от прибл. 800 до 2000 бар, что обеспечивает степень разрушения выше 90% за 2-4 цикла, либо в шаровом гомогенизаторе с использованием шаров диаметром от 0,2 до 0,4 мм, которые загружаются в количестве прибл. от 70 до 90%, что обеспечивает степень разрушения выше 80% за 1-2 цикла. Для отделения осадка от супернатанта раствор, содержащий разрушенные клетки, центрифугируют на высокоскоростной центрифуге на 6000-10000 об/мин (SORVALL, HITACHI и т.д.) в течение 20-60 мин или разделяют методом проточной микрофильтрации вдоль потока с мембранным модулем от 0,45 до 0,65 мкм (Millipore, PALL и т.д.). Прежде чем проводить дальнейшую очистку, полученный супернатант направляют на анионообменную хроматографию на Q Sepharose Flast Flow (GE) или DEAE SephroseFast Flow (GE) для удаления из супернатанта некоторых примесей, таких как ДНК, РНК и примесных белков. В качестве альтернативы полученный супернатант сразу направляют на дальнейшую очистку. Для дальнейшей очистки образцы супернатанта наносят на хроматографическую фазу, связывающую ВЧ L1 ВПЧ, такую как SP Sepharose FF, Heparin SepharoseCL-6В (GE), Poros 50 HS (Merck) и Fractogel@EMD TMAE-650 (Merck), в результате чего ВЧ белка L1 ВПЧ эффективно с ней связывается. Затем фазу промывают градиентом концентрации соли (например, буферным раствором 0,5-1,0 М NaCl или KCl) для отделения примесей от ВЧ белка L1 ВПЧ. Затем связанные ВЧ L1 ВПЧ элюируют концентрированным раствором солевого буфера (например, буферным раствором, 1,0-2,0 М NaCl или KCl), собирая фракцию предварительно очищенных ВЧ L1 ВПЧ. Полученные таким образом предварительно очищенные ВЧ L1 ВПЧ наносят на хроматографическую фазу для глубокой очистки, например, СНТ (BIO-RAD Тип II), с которой ВЧ белка L1 ВПЧ могут эффективно связываться в определенном интервале концентраций соли (например, в буферном растворе, содержащем 0,3-1,5 М NaCl или KCl). Элюируют градиентом концентрации фосфата (например, при изменении концентрации фосфата от 20 до 400 мМ) для отделения от ВЧ L1 ВПЧ примесей. В качестве альтернативы для более глубокой очистки предварительно очищенных ВЧ L1 ВПЧ можно применять хроматографические фазы такие как Sephacryl S-1000 (GE) и HW-75 (TSK), при этом отделение примесей от ВЧ L1 ВПЧ достигается методом гель-хроматографии. После глубокой очистки элюированные ВЧ L1 ВПЧ собирают в качестве конечной очищенной фракции.
Способ очистки в соответствии с настоящим изобретением позволяет удалить большую часть примесных биомолекул (в том числе ДНК, липиды и белки). Методом электрофореза на ДДС-Na-ПААГ восстанавливающих условиях или капиллярного электрофореза (Beckman Coulter) показано, что образец полученный в результате хроматографической очистки на POROS 50 HS, имеет чистоту от 75% до 80%, а конечный образец ВЧ L1 ВПЧ, очищенный на гидроксиапатитной фазе, имеет чистоту от 90% до 95%. Обнаружение методом вестерн-блоттинга (Bio-RAD) позволило выявить специфическую реакцию окрашивания между полосой целевого белка и моноклональным или поликлональным антителом к ВЧ L1 ВПЧ. Методом динамического светорассеяния (Malvern Instruments Zetasizer Nano ZS) установлено, что размер частиц в очищенном образце варьирует прибл. в интервале 50-80 нм, а исследование методом просвечивающей электронной микроскопии (Philips) показало наличие в образце вирусоподобных частиц (ВЧ) размером прибл. 50-80 нм. Наиболее предпочтительная гидроксиалатитовая фаза в настоящем эксперименте - это керамический гидроксиапатитовый наполнитель с размером частиц в интервале прибл. 20-50 нм и размером пор около 800 Å. Буферные растворы, которые применяются в хроматографии, имеют pH в интервале от 6 до 9, предпочтительным буфером является 50 мМ MOPS.
По сравнению с уровнем техники настоящее изобретение предлагает оптимальное конструирование гена для L1 ВПЧ 18 (полноразмерный ген, или предпочтительно усеченный ген, соответствующий белку L1 ВПЧ 18 с делецией 61 аминокислоты на N-конце) и его клонирование в дрожжи Pichia, что позволяет достичь значительного повышения экспрессии белка L1 ВПЧ 18 по сравнению с другими системами экспрессии (такими как клетки млекопитающих, бакуловирусы, Saccharomyces cerevisiae). После экспрессии полученные в результате очистки вирусоподобные частицы изучали с помощью электронного микроскопа, и было показано, что их размер - 50-80 нм, что близко к размеру частиц ВПЧ дикого типа. Вирусоподобные частицы, образованные из рекомбинантного белка L1 ВПЧ 18, адсорбировали на адъюванте - соединении алюминия - и использовали для иммунизации мышей, что приводило к высоким титрам антител к L1 ВПЧ 18. Опыты по нейтрализации с псевдотипом вируса показали высокую нейтрализующую активность антител (т.е. способность ингибировать попадание псевдотипа вируса в клетки). Кроме того, оптимальным образом сконструированный ген L1 ВПЧ 16 в соответствии с настоящим изобретением после клонирования в дрожжи Pichia позволяет достичь очень высоких уровней экспрессии белка L1 ВПЧ 16.
Иммуногенная макромолекула
В настоящем изобретении также предлагается иммуногенная макромолекула диаметром от 50 до 80 нм, представляющая собой полимолекулярный полимер, в основном полученный в результате самосборки главных капсидных белков L1 вируса папилломы человека, причем указанные главные капсидные белки L1 вируса папилломы человека экспрессированы в дрожжах Pichia.
Иммуногенную макромолекулу согласно настоящему изобретению предпочтительно получают следующим способом: (1) культивирование упомянутой рекомбинантной клетки, позволяющее экспрессию упомянутого главного капсидного белка L1 вируса папилломы человека и его конкурентную самосборку с образованием иммуногенной молекулы в рекомбинантных клетках; (2) разрушение клеток, полученных на стадии (1), с образованием супернатанта, содержащего иммуногенные молекулы; и (3) последовательная очистка супернатанта, полученного на стадии (2), методом колоночной хроматографии на POROS 50 HS и колоночной хроматографии на СНТ с образованием указанных иммуногенных макромолекул.
В настоящем изобретении также предлагается применение указанной иммуногенной макромолекулы для производства композиции для профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека (ВПЧ). Упомянутые заболевания выбираются, без ограничения, из группы злокачественных новообразований (таких как рак шейки матки, рак влагалища, рак ануса или перианальный рак, ротоглоточный рак, рак гайморовой пазухи, рак легких) и интраэпителиальной цервикальной неоплазии.
Композиция
В настоящем изобретении предлагается также иммуногенная композиция (такая как профилактическая или терапевтическая вакцина), содержащая эффективное количество указанных иммуногенных макромолекул в соответствии с настоящим изобретением и фармацевтически приемлемый носитель.
В настоящем изобретении предлагается также способ получения вакцины против вируса папилломы человека, включающий приготовление вирусоподобных частиц рекомбинантного белка L1 вируса папилломы человека описанным выше способом и добавление фармацевтически приемлемого адъюванта для вакцины. Указанный адъювант для вакцины может быть адъювантом - соединением алюминия или другим адъювантом. Вирусоподобные частицы, образованные из очищенного белка вируса папилломы человека (L1 ВПЧ), после адсорбции на адъюванте могут служить в качестве вакцины.
В настоящем документе термин «фармацевтически приемлемый» компонент относится к веществу, пригодному для употребления человеком и(или) млекопитающими без появления неприемлемого вредного побочного действия (например, токсичности), обеспечивающему разумное соотношение пользы и риска. Термин «фармацевтически приемлемый носитель» относится к носителям для введения терапевтических препаратов, включая различные наполнители и разбавители. Данный термин относится к таким носителям для терапевтических препаратов, которые сами по себе не являются основными активными компонентами и не обладают неприемлемой токсичностью после введения. Соответствующие требованиям носители хорошо известны рядовым специалистам в данной области. Полное описание фармацевтически приемлемых носителей можно найти в справочнике Reminton's Pharmaceutical Sciences (Mack Pub. Co., N.J