Способ определения таллия в водных растворах и технологических сливах методом инверсионной вольтамперометрии
Иллюстрации
Показать всеИзобретение относится к аналитической химии и может быть использовано в различных геологических изысканиях в случае анализа вод различного происхождения (родники, геотермальные источники, смывы хвостов обогащения), а также технологических сливов концентраций ионов таллия методом инверсионной вольтамперометрии (ИВ). Способ определения таллия в водных растворах или технологических сливах методом инверсионной вольтамперометрии заключается в том, что таллий (III) переводят в таллий (I) в растворе и проводят вольтамперометрическое определение. Согласно изобретению проводят накопление ионов таллия на графитовом электроде в перемешиваемом растворе в присутствии ионов платины (IV) в течение 60-120 секунд с последующей регистрацией анодных пиков селективного электроокисления таллия из интерметаллического соединения PtxTly при скорости развертки потенциала 50-100 мВ/с при потенциалах электролиза минус 1,0 В, а затем при минус 0,6 В на фоновом электролите 1 М HCl, концентрацию ионов таллия определяют по высоте анодного пика таллия на вольтамперной кривой в диапазоне потенциалов от 0,6 до 0,9 В относительно насыщенного хлоридсеребряного электрода методом добавок аттестованных смесей. Изобретение обеспечивает возможность снизить предел определяемых содержаний таллия (I) по пику электроокисления таллия из интерметаллического соединения PtxTly, полученного после электроконцентрирования бинарного осадка платина-таллий на графитовом электроде методом ИВ. 2 пр., 2 ил., 2 табл.
Реферат
Изобретение относится к аналитической химии, а именно к способам определения ионов металлов, и может быть использовано в различных геологических изысканиях в случае анализа вод различного происхождения (родники, геотермальные источники, смывы хвостов обогащения), а также технологические сливы концентраций ионов таллия методом инверсионной вольтамперометрии (ИВА).
Известен способ постоянно-токовой вольтамперометрии для определения таллия в водных средах. В методе используют сульфат марганца в присутствии персульфата калия, происходит образование осадка гидрооксида марганца (IV), который обрабатывают раствором сернокислого гидразина. Достигнутое нижнее значение концентрации таллия (I) составило 0,01 мкг/дм3 из объема 100 см3. [Патент 77482, Украiна, МПК7, G01N 27/26, 27/42, 27/40. Iнверсiйний вольтамперометричний cnociб визначення талiю у водному середовищi // Козiна С.О. - Надр. 15.12.2006, Бюл. №12]. Недостатком данного метода является использование токсичных сернокислого гидразина и ртути в виде ртутного пленочного электрода.
Известен метод определения таллия на капающей ртути. Используется многосоставной фон: 5,8 М NaOH + 0,22 М манит + 0,2% желатина. Чувствительность определения равна 0,09 мг/л. Раствор должен быть выдержан сутки. [Герцева Н.С. Полярографическое определение таллия в присутствии меди без их предварительного разделения. // Сб. статей «Теория и практика полярографического анализа», Кишинев, 1962, С.222-229]. Недостатком метода является использование больших количеств токсичной ртути, сложность приготовления многосоставного фона и суточное выдерживание раствора для повышения чувствительности определения.
Известен метод, основанный на использовании графитового дискового электрода модифицированного ртутью, в котором электродом сравнения служил нас. каломельный электрод. Время электролиза составляет пять минут, чем достигается чувствительность 7·10-4%. [Брайнина Х.З., Кива Н.К. «Концентрирование веществ в полярографическом анализе» // Журнал аналитической химии - 1965, - Т.20, - Вып.12, - С.1306-1311]. Основным недостатком метода является низкая чувствительность, а также использование ртути являющейся токсичным элементом.
Известна методика вольтамперометрического определения таллия в природных водах с применением ртутно-графитового электрода. Нижняя граница определения таллия из 100 мл пробы составила 1·10-2 нг/мл. [Шевченко Л.В., Портретный В.П., Чуйко В.Т. «Определение таллия в природных водах методом инверсионной вольтамперометрии с предварительным концентрированием соосождением» // Журнал аналитической химии - 1977, - Т.32, - Вып.7, - С.1448-1450]. Недостатком методики является необходимость концентрирования таллия и дополнительные операции с осадком, которые могут привести к потерям, и применение токсичного ртутного электрода.
Известен метод циклической вольтамперометрии определения таллия с использование прусско-синего электрода. Предел обнаружения таллия составляет 2·10-8 моль/л. [Heike Kahlert, Sebojka Komorsky-Lovria, Michael Hermes, Fritz Scholz. «A Prussian blue-based reactive electrode (reactrode) for the determination of thallium ions» // Fresenius J. Anal. Chem. - 1996, - V.356, - P.204-208]. Недостатком данного метода является адсорбция металлического таллия при взаимодействии графита и прусско-синего на поверхности электрода при строгом соблюдении потенциала электролиза.
Известна методика квадратно-волновой анодной вольтамперометрии для определения таллия, в которой в качестве рабочего электрода используют сплав серебра и золота. Предел обнаружения таллия составил 40 нМ. [Y. Bonfil, M. Brand, E. Kirowa-Eisner. «Characteristics of Subtractive Anodic Stripping Voltammetry of Lead, Cadmium and Thallium at Silver-Gold Alloy Electrodes» // Electroanalysis - 2003, - V.15, - No.17, - P.1369-1376]. Недостатком методики является перекрывание пиков таллия с пиками свинца и кадмия, а также сложность изготовления рабочего электрода.
Известна методика вольтамперометрического определения таллия (I) на ртутно-пленочном электроде в интервале концентраций 1·10-9-5·10-7 M. Применяется многосоставной фон: 0,17 М ЭДТА + 0,002 M HCl + 0,03 М аскорбиновой кислоты +5·10-5 M Hg(II), Предел обнаружения таллия составляет 5·10-10 М. [Козина С.А. «Инверсионная вольтамперометрия таллия на ртутном пленочном электроде» // Журнал аналитической химии - 2003, - Т.58, - №10, - С.1067-1071]. Недостаток метода - в использовании раствора, содержащего соль токсичной ртути большой концентрации, большое число компонентов, входящих в состав фона, и длительность времени электролиза.
Известен метод дифференциальной импульсной полярографии определения таллия. Предел обнаружения таллия составляет 0,025 мкг/мл. [Не Wei, Fan Zhongxiao, Huo Caihong. «Determination of trace amounts of thallium by differential pulse polarography» // Dianzi keji daxue xuebao = J. Univ. Electron and Technol. China. - 2004, - V.33, - №3, - P.309-311]. Недостатком данного метода является использование токсичной ртути.
Известен способ вольтамперометрического определения таллия на висмут-пленочном электроде. Минимально определяемая концентрация таллия на Bi-пленочном электроде составляет 0,001 мг/л. Значительный избыток Sn(II), Cd(II) и Pb(II) не мешает определению таллия. [Тарасова В.А. «Вольтамперометрическое определение таллия на механически обновляемом Bi-графитовом электроде» // Журнал аналитической химии - 2007, - Т.62, - Вып.2, - С.175-178]. Недостатком данного способа является трудоемкая операция подготовки электрода к работе и низкая чувствительность определения таллия.
Известна методика вольтамперометрического определения таллия в природных водах на ртутном пленочном электроде. Нижнее значение определения концентрации таллия (I) составила 0,01 мкг/дм3 из объема 100 см3. [Козина, С.А. «Концентрирование микроколичеств таллия соосаждением на коллекторе с последующим инверсионным вольтамперометрическим определением» // Химия и технология воды - 2005, - Т.27, - №4, - С.357-363]. Недостатком данной методики является использование токсичной ртути.
Известен метод инверсионно-вольтамперометрического определения таллия в индивидуальных растворах и его модельных бинарных, тройных и более сложных смесях. В качестве рабочего применялся угольно-пастовый электрод. Предел обнаружения таллия по данному методу составляет 0,2 мкг/15 см3. [Геворгян A.M., Марифова З.А., Минченко А.Н., Калядин В.Г. «К вопросу использования угольно-пастового электрода для инверсионно-вольтамперометрического определения таллия» // Экологические системы и приборы. - 2009, - №9, - С.14-18.]. Недостатком данного метода сложность подготовки угольно-пастового электрода к работе, что требует дополнительных затрат времени и сил.
Известен способ вольтамперометрического определения таллия на ртутно-углеродном электроде. Минимально определяемы содержания таллия составляют 10-10 М [Мунтяну Г.Г., Мунтяну С.Г. «Изучение электроаналитических особенностей тонкопленочного ртутно-углеродного электрода субнанометрической толщины в инверсионной анодной вольтамперометрии с линейной высокоскоростной разверткой потенциала. Определение T1(I)» // Журнал аналитической химии - 2006, - Т.61, - №3, - С.285-291.]. Недостатком данной методики является использование токсичной ртути.
Известен способ определения таллия на поликристаллическом золотом электроде в 0,1 М КОН. Минимально определяемые содержания таллия составляют 1·10-5 М [D. Poskus, G. Agafonovas. «Radiotracer study of thallium underpotential deposition on a polycrystalline gold electrode in alkaline solutions» // Journal of Electroanalytical Chemistry-2000, - V.493, - P.50-56]. Основным недостатком данной методики является низкая чувствительность.
Для определения таллия в рудном материале известен метод анодной инверсионной вольтамперометрии на 1 М ацетатном буфере +0,2 М ЭДТА на стеклографитовом электроде, покрытым пленкой висмута. [Mieczyslaw Korolczuk, Weronika Surmacz, Katarzyna Tyszczuk. «Determination of Thallium in a Flow System by Anodic Stripping Voltammetry at a Bismuth Film Electrode» // Electroanalysis - 2007, - №21, - P.2217-2221] (прототип). Определение таллия проводят по следующей методике. В качестве фонового электролита используют 1 М ацетатный буфер + 0,2 М ЭДТА. Пленку висмута на поверхность стеклографитового электрода наносили из раствора концентрацией 5·10-2 М. Электроосаждение проводилось при потенциале электроконцентрирования -1,1 В, время накопления 300 сек. Определение таллия методом анодной вольтамперометрии возможно по пику электроокисления таллия. Недостатком метода является низкая чувствительность (ПДК-T1 - 6,0001 мг/дм3) 2·10-9-3·10-8 М и использование соли висмута, являющейся токсичным элементом.
В работе была поставлена задача снизить предел определяемых содержаний таллия (I) по пику электроокисления таллия из интерметаллического соединения PtxTly, полученном после электроконцентрирования бинарного осадка платина-таллий на графитовом электроде методом ИВ.
Поставленная задача достигается тем, проводят накопление ионов таллия на графитовом электроде в перемешиваемом растворе в присутствии ионов платины (IV) в течение 60-120 секунд с последующей регистрацией анодных пиков селективного электроокисления таллия из интерметаллического соединения PtxTly при скорости развертки потенциала 50-100 мВ/с при потенциалах электролиза минус 1,0 В, а затем при минус 0,6 В на фоновом электролите 1 М HCl, концентрацию ионов таллия определяют по высоте анодного пика таллия на вольтамперной кривой в диапазоне потенциалов от 0,6 до 0,9 В относительно насыщенного хлоридсеребряного электрода методом добавок аттестованных смесей. Новым в способе является то, что для получения полезного сигнала, зависящего от концентрации таллия (I), используется процесс электроокисления таллия из ИМС PtxTly. Интервал определяемых содержаний, в котором сохраняется прямолинейность графика, составила 5·1010-5·10-8 М.
В предлагаемом способе впервые установлена способность осадка платины с таллием окисляться с поверхности графитового электрода. В качестве индикаторного применяли ГЭ модифицированный платиной, (в прототипе применяли стекло-графитовый электрод покрытый пленкой висмута). Использование такого электрода обусловлено высокой химической и электрохимической устойчивостью графита, широкой областью рабочих потенциалов, а также простотой механического обновления поверхности и требованиям техники безопасности. В анализе не используется висмут, т.к. висмут токсичен. Нижняя граница определяемых содержаний по данному методу составила 1·10-4 мг/дм3 (в прототипе 4·10-4 мг/дм3).
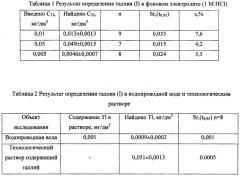
Результаты определения таллия из ИМС на ГЭ модифицированным платиной приведены в таблице 1 и таблице 2. Как видно из таблицы 1, максимальная погрешность измерений составляет порядка 10%, в технологическом растворе она составила ~5%. Расчет определяемых концентраций таллия проводится по методу «Введено-найдено».
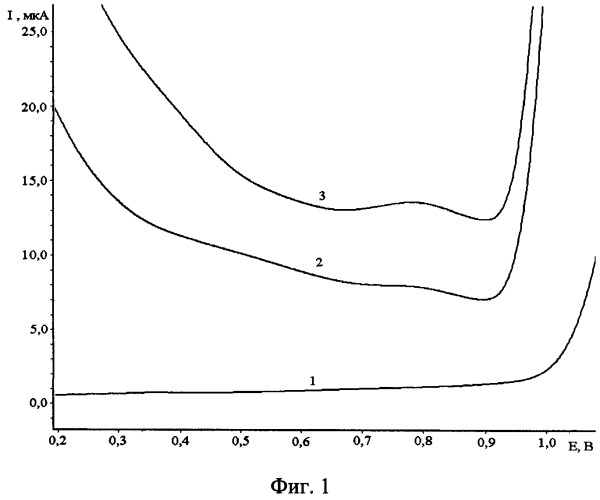
Проводят накопление ионов таллия (I) на поверхность графитового электрода в перемешиваемом растворе в присутствии ионов платины (IV) в течение 120 с при потенциале электролиза минус 0,6 В. При потенциале минус 0,6 В анодный пик таллия приближается к своему предельному значению и хорошо выражен. Дальнейшее увеличение потенциала электролиза вызывает разряд таллия и уменьшает максимум пика ИМС таллия с платиной, поэтому выбирался потенциал электролиза минус 0,6 В. Измерения проводились на фоне 1 М HCl, с последующей регистрацией анодных пиков в накопительном режиме и съемки вольтамперограмм при скорости развертки 50-100 мВ/с. Концентрацию ионов таллия (I) определяют по высоте анодного пика таллия в диапазоне потенциалов от 0,6 до плюс 0,9 В относительно насыщенного хлоридсеребряного электрода (нас.х.с.). На фиг.1 представлены вольтамперные кривые электроокисления осадка PtxTly с поверхности графитового электрода модифицированного платиной. Кривая 1- фон 1М HCl, содержащий CPt(IV)=0,05 г/дм3, кривая 2 - CT1(I)=0,002 мг/дм3, кривая 3 - CT1(I)=0,004 мг/дм3.
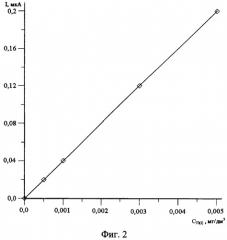
Таким образом, установленные условия впервые позволили количественно определять содержание ионов таллия (I) на основе реакции селективного электроокисления таллия из интерметаллического соединения (ИМС) PtxTly, полученного на стадии предварительного электроконцентрирования (фиг 2).
Предлагаемый вольтамперометрический способ позволил существенно улучшить метрологические характеристики анализа таллия (I); повысить чувствительность определения (1·10-4 мг/дм3), это на полпорядка ниже по сравнению с прототипом, что позволило приблизиться к ПДК по таллию.
Примеры конкретного выполнения:
Пример 1. Измерения были проведены на искусственных смесях. 10 мл фонового электролита (1М HCl) помещают в кварцевый стаканчик. Не прекращая перемешивания, проводят электролиз раствора, при Еэ=-1,0 В и при τэ=100 сек, снимают вольтамперную кривую электроокисления при скорости развертки 50 мВ/с. Затем добавляли аттестованный раствор Pt (IV) 1,0 мл из 0,05 г/дм3 и проводят электрохимическое концентрирование осадка при аналогичных условиях. Отсутствие пиков на вольтамперной кривой в интервале от плюс 0,6 до плюс 0,9 В свидетельствует о чистоте фона. Добавляли аликвотную часть 1-2 мл исследуемого раствора в фон, проводили электроконцентрирование и электроокисление таллия при потенциале накопления - 0,6 В. Вносили добавку стандартного образца таллия 0,02 мл из 0,1 мг/дм3 и снова регистрировали аналитический сигнал таллия при потенциале накопления - 0,6 В. По разнице токов пиков таллия вычисляли концентрацию таллия в растворе (при расчете брали токи пиков, кривые которых были накоплены при потенциале - 0,6 В). Пик тока таллия регистрировали в диапазоне потенциалов от 0,6 до 0,9 В (отн. нас.х.с.э.).
Пример 2. Измерения таллия были проведены после его выделения из раствора. 100 мл раствора помещают в коническую колбу и выпаривают до минимального объема. Количественно переносят раствор в кварцевый стакан объемом 20 мл и выпаривают до сухого остатка. Остаток обрабатывают смесью кислот 37% HCl и 68% HNO3 (3:1), для переведения в раствор, упаривают до минимального объема и дважды обрабатывают 37% HCl для переведения в хлориды. Вносят раствор сернокислого гидразина для переведения таллия (III) в таллий (I).
Проводят электролиз раствора при постоянном перемешивании при τэ=100 с. В фоновый электролит добавляют аттестованный раствор Pt (IV) 1,0 мл из 0,05 г/дм3 и снимают вольтамперную кривую при скорости развертки потенциала 50 мВ/с. Отсутствие дополнительных пиков свидетельствует о чистоте фона. Добавляют аликвотную часть 1-2 мл полученного раствора и снимают вольтамперную кривую электроокисления таллия при потенциале накопления - 0,6 В. Вносили добавку стандартного образца таллия 0,02 мл из 0,1 мг/дм3 и снова регистрировали аналитический сигнал таллия при потенциале накопления - 0,6 В. По разнице токов пиков таллия вычисляли концентрацию таллия в растворе (при расчете брали токи пиков, кривые которых были накоплены при потенциале - 0,6 В). Пик тока таллия регистрировали в диапазоне потенциалов от 0,6 до 0,9 В (отн. нас.х.с.э.).
Таким образом, впервые установлена способность количественного анализа таллия по пикам селективного электроокисления таллия из интерметаллического соединения PtxTly.
Предложенный способ прост, не используется висмут из-за его токсического действия. Способ может быть применен в любой химической лаборатории, имеющей компьютеризированные анализаторы типа СТА, ТА или полярограф.
Предложенный способ может быть использован для определения таллия в водных растворах или технологических сливах.
Способ определения таллия в водных растворах или технологических сливах методом инверсионной вольтамперометрии, заключающийся в том, что таллий (III) переводят в таллий (I) в растворе и проводят вольтамперометрическое определение, отличающийся тем, что проводят накопление ионов таллия на графитовом электроде в перемешиваемом растворе в присутствии ионов платины (IV) в течение 60-120 с с последующей регистрацией анодных пиков селективного электроокисления таллия из интерметаллического соединения PtxTly при скорости развертки потенциала 50-100 мВ/с при потенциалах электролиза минус 1,0 В, а затем при минус 0,6 В на фоновом электролите 1 М HCl, концентрацию ионов таллия определяют по высоте анодного пика таллия на вольт-амперной кривой в диапазоне потенциалов от 0,6 до 0,9 В относительно насыщенного хлоридсеребряного электрода методом добавок аттестованных смесей.