Составы, содержащие клонидин в разлагаемом полимере
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой имплантируемое депо лекарственного средства для уменьшения, предотвращения или лечения боли у нуждающегося в этом пациента, содержащее клонидин в количестве от 1 масс.% до 15 масс.% депо лекарственного средства и, по меньшей мере, один биоразлагаемый полимер, причем указанное депо лекарственного средства обладает поверхностью, обеспечивающей высвобождение пиковой дозы клонидина в количестве от 5 масс.% до 20 масс.% от общего количества клонидина в указанном депо в течение 24 часов и высвобождение эффективного количества клонидина в течение периода продолжительностью, по меньшей мере, три дня, указанный полимер обладает характеристической вязкостью от 0,45 дл/г до 0,55 дл/г и содержит поли(D,L-лактид), а указанный клонидин содержит гидрохлорид клонидина. Изобретение обеспечивает расширение арсенала средств для облегчения боли. 3 н. и 6 з.п. ф-лы, 2 пр., 5 табл., 34 ил.
Реферат
Данная заявка испрашивает приоритет по дате подачи заявки на патент США №12/420197 от 8 апреля 2009 г.под названием «Clonidine Formulations in a Biodegradable Polymer Carrier» («Составы, содержащие клонидин в биоразлагаемом полимере») и предварительной заявки на патент США №61/046201 от 21 апреля 2008 г.под названием «Clonidine Formulations in a Biodegradable Polymer Carrier» («Составы, содержащие клонидин в биоразлагаемом полимере»). Описания указанных заявок полностью в данное описание посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Боль обычно возникает при механическом, термическом, химическом и других вредных воздействиях на свободные нервные окончания болевых рецепторов. Болевые рецепторы передают сигналы по афферентным нейронам в центральную нервную систему и далее в головной мозг. Ощущение боли может сопровождаться любым числом проблем, которые включают, но не ограничиваются перечисленными: снижение функций, снижение подвижности, нарушение сна и снижение качества жизни.
Причинами возникновения боли могут быть воспаление, травма, инфекция, напряжение мышц, невропатическое событие или синдром, повреждения, которые могут быть результатом хирургического вмешательства или нежелательного физического, химического или термического воздействия, а также заражения биологическим агентом. При повреждении ткани начинают выделять множество эндогенных веществ, вызывающих боль, например брадикинин или гистамин. Вещества, вызывающие болевые ощущения, могут связываться с рецепторами чувствительных нервных окончаний, что вызывает индукцию афферентных болевых сигналов. После активации первичных афферентных сенсорных нейронов может происходить активация проецирующих нейронов. Эти нейроны передают сигнал боли по спинно-таламическому пути к высшим отделам центральной нервной системы.
Одним из известных классов лекарственных средств для лечения боли являются опиоиды. Данный класс веществ широко признан как наиболее эффективный тип лекарственных средств для контроля, к примеру, послеоперационных болей. К сожалению, поскольку опиоиды требуют системного введения, значительную обеспокоенность вызывают сопровождающие их применение побочные эффекты, такие как слабость, угнетение дыхательной системы, запоры и такие психотропные эффекты, как седативный эффект и эйфория, препятствующие выздоровлению и восстановлению подвижности. Поэтому врачи обычно ограничивают период введения опиоидов первыми двадцатью четырьмя часами после хирургического вмешательства. Таким образом, было бы предпочтительным использовать ненаркотические лекарственные препараты, которые обеспечивают непосредственный и локализованный контроль болевых ощущений в участке хирургического вмешательства.
Клонидин представляет собой лекарственное средство, широко известное в медицине как антигипертензивное средство, являющееся агонистом альфа-2-адреноцепторов и агонистом рецепторов нервной системы. В целом, клонидин, также называемый 2,6-дихлор-N-2-имидазолидинилденбензамином (C9H9Cl2N3), может быть представлен следующей химической структурой:
Однако до настоящего времени данное соединение не имело широкого применения в качестве эффективного болеутоляющего средства. Таким образом, существует необходимость в разработке его эффективных составов для применения по указанному назначению.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предложены составы и способы с использованием клонидина или фармацевтически приемлемых солей клонидина, которые применяют для лечения боли или воспаления. Данные соединения и способы могут быть использованы, к примеру, для лечения болей, вызванных межпозвоночными грыжами (т.н. ишиалгия), спондилезом, стенозом, остеоартритом, запястно-предплюсневым туннельным синдромом, тендинитом, заболеванием височно-нижнечелюстного сустава и болями в спине, связанными со смещением дисков, болями в суставах и болей, сопровождающих хирургическое вмешательство или возникающих после него.
Согласно одному из вариантов осуществления предложен лекарственный состав, содержащий: клонидин, причем массовая доля клонидина составляет от приблизительно 0,1% до приблизительно 30% общей массы состава, и по меньшей мере один биоразлагаемый полимер. Фармацевтическая композиция, например, может быть частью депо лекарственного средства. Депо лекарственного средства может (i) состоять из одного клонидина (или одной или более фармацевтически приемлемых солей клонидина) и биоразлагаемого полимера (полимеров); или (ii) состоять по существу из клонидина (или одной или более фармацевтически приемлемых солей клонидина) и биоразлагаемого полимера (полимеров); или (hi) содержать клонидин (или одну или более фармацевтически приемлемых солей клонидина), биоразлагаемого полимера (полимеров) и один или более активных компонентов, поверхностно-активных веществ, наполнителей или других компонентов или их комбинаций. В случае, когда в составе присутствуют другие активные ингредиенты, поверхностно-активные вещества, наполнители или другие компоненты или их комбинации, в некоторых вариантах вопложения указанные другие соединения или комбинации составляют менее 50% масс., менее 40% масс., менее 30% масс., менее 20% масс., менее 19% масс., менее 18% масс., менее 17% масс., менее 16% масс., менее 15% масс., менее 14% масс., менее 13% масс., менее 12% масс., менее 11% масс., менее 10% масс., менее 9% масс., менее 8% масс., менее 7% масс., менее 6% масс., менее 5% масс., менее 4% масс., менее 3% масс., менее 2% масс., менее 1% масс. или менее 0,5% масс..
Согласно другому варианту осуществления, предложен лекарственный состав, содержащий клонидин, причем клонидин присутствует в виде гидрохлорида, составляет от приблизительно 0,1% до приблизительно 30% масс. состава, и по меньшей мере один биоразлагаемый полимер, причем по меньшей мере один биоразлагаемый полимер представляет собой поли(лактид-со-гликолид) сополимер молочной и гликолевой кислот или поли(ортоэфир) или их комбинации, причем указанный по меньшей мере один биоразлагаемый полимер составляет по меньшей мере 70% масс. данного состава.
Согласно другому варианту осуществления, предложено имплантируемое депо лекарственного средства для уменьшения, предотвращения или лечения боли у нуждающегося в этом пациента, причем имплантируемое депо лекарственного средства содержит клонидин в количестве от приблизительно 0,1% до приблизительно 30% масс. состава и по меньшей мере один биоразлагаемый полимер.
Согласно другому варианту осуществления настоящее изобретение включает имплантируемое депо лекарственного средства для уменьшения, предотвращения или лечения боли у нуждающегося в этом пациента, причем указанное имплантируемое депо лекарственного средства содержит гидрохлорид клонидина в количестве от приблизительно 1% до приблизительно 20% масс. депо лекарственного средства и по меньшей мере один биоразлагаемый полимер, и при этом указанный по меньшей мере один биоразлагаемый полимер представляет собой поли(лактид-со-гликолид) или сополимер молочной и гликолевой вислот или поли(ортоэфир) или их комбинации, и этот по меньшей мере один биоразлагаемый полимер составляет по меньшей мере 80% от массы данного состава.
Согласно другому варианту осуществления изобретение включает депо лекарственного средства для уменьшения, предотвращения или лечения боли у нуждающегося в этом пациента, причем имплантируемое депо лекарственного средства содержит гидрохлорид клонидина в количестве от приблизительно 1% до приблизительно 20%масс.депо лекарственного средства и по меньшей мере один биоразлагаемый полимер, при этом указанный по меньшей мере один биоразлагаемый полимер представляет собой поли(лактид-со-гликолид) (или сополимер молочной и гликолевой кислот) или поли(ортоэфир), D-лактид, D,L-лактид, L-лактид, D,L-лактид-капролактон и D,L-лактид-со-гликолид-со-капролактон.
Согласно другому варианту осуществления настоящее изобретение включает способ лечения острой боли, который включает в себя имплантацию в организм депо лекарственного средства для уменьшения, предотвращения или лечения боли, причем указанное депо лекарственного средства содержит клонидин в количестве от приблизительно 0,1% до приблизительно 30% масс. депо лекарственного средства и по меньшей мере один биоразлагаемый полимер.
Согласно другому варианту осуществления настоящее изобретение включает способ лечения острой боли, который включает введение фармацевтической композиции, содержащей клонидин и по меньшей мере один биоразлагаемый полимер, причем клонидина составляет от приблизительно 0,1% до приблизительно 30% масс. депо лекарственного средства.
Согласно другому варианту осуществления настоящее изобретение включает имплантируемое депо лекарственного средства для уменьшения, предотвращения или лечения глаукомы у нуждающихся в этом пациентов, причем указанное депо лекарственного средства содержит клонидин в количестве от приблизительно 0,1% до приблизительно 30% масс. депо лекарственного средства и по меньшей мере один биоразлагаемый полимер, причем данное депо лекарственного средства обеспечивает высвобождение клонидина в течение периода времени от по меньшей мере трех дней до одного и более месяцев.
Дополнительные признаки и преимущества различных вариантов будут раскрыты частично в описании, приведенном ниже, и частично будут очевидны из этого описания, а также могут быть выявлены при практическом осуществлении указанных вариантов. Задачи и другие преимущества различных вариантов могут быть реализованы и достигнуты с использованием элементов и сочетаний, указанных особо в описании и формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВВ
Частично, другие аспекты, признаки, преимущества и полезные свойства вариантов осуществления, станут очевидны после ознакомления со следующем описанием, прилагаемой формулой изобретения и сопутствующими графическими материалами, где:
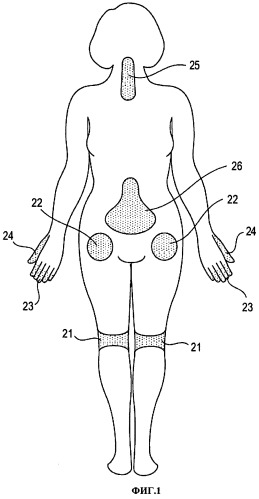
Фигура 1 иллюстрирует варианты обычного расположения источников боли у пациента и мест, куда можно локально вводить депо лекарственного средства, содержащее клонидин.
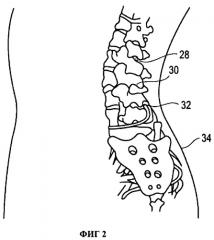
На Фигуре 2 схематично изображен вид позвоночника сзади с указанием мест локального введения депо лекарственного средства.
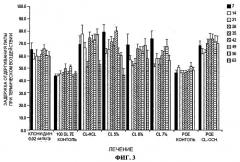
Фигура 3 представляет собой график изменения задержки отдергивания лапы при термическом воздействии, выраженной в процентах от фонового уровня для следующих вариантов введенич: клонидин 0,02 мг/кг/день подкожно, 100 DL 7E контроль, 5% CL-HCL, CL 5%, CL 8%, 1 CL 7%, РОЕ контроль и РОЕ CL-основание, на 7-ой день, на 14-ый день, на 21-ый день, на 28-ой день, 35-ый день, 42-ой день, 49-ый день, 56-ой день, и 63-ий день, где CL-HCL-гидрохлорид клонидина, РОЕ-поли(ортоэфир), CL-основание - клонидин в форме основания.
Фигура 4 представляет собой график изменения механических порогов в виде процентной доли от фонового уровня для следующих вариантов введения: клонидин 0,02 мг/кг в день подкожно, 100 DL 7E контроль, 5% CL-HCL, CL 5%, CL 8%, CL 7%, РОЕ контроль и РОЕ CL-основание, на 8-ой день, на 15-ый день, на 21-ый день, на 22-ой день, 29-ый день, 36-ой день, 43-ий день, 50-ый день, 57-ой и 64-й день.
Фигура 5 представляет собой график высвобождения клонидина in vitro из гранул с тремя дозами в виде процентной доли высвобождения.
Фигура 6 представляет собой график расчетного ежедневного высвобождения клонидина in vitro из гранул с тремя дозами в микрограммах.
Фигура 7 представляет собой график высвобождения гидрохлорида клонидина для различных вариантов составов относительно суммарного высвобождения клонидина в процентах.
Фигура 8 представляет собой графическое изображение профиля суммарного высвобождения in vitro для некоторых составов клонидина.
Фигура 9 представляет собой графическое изображение профиля суммарного высвобождения для некоторых составов облученного гидрохлорида клонидина.
Фигура 10 представляет собой графическое изображение некоторых расчетных количеств клонидина, высвобождающихся ежедневно из гранул с дозами 2/3/4.
Фигура 11 представляет собой графическое представление некоторых расчетных количеств клонидина, высвобождающихся ежедневно из гранул с некоторыми тремя дозами.
Фигура 12 представляет собой графическое представление профиля суммарного высвобождения клонидина in vitro из некоторых коаксиальных составов.
Фигура 13 представляет собой графическое представление профиля суммарного высвобождения из некоторых составов облученного клонидина.
Фигура 14 представляет собой графическое представление расчетного высвобождения клонидина в день из некоторых составов в виде гранул в трех дозах.
Фигура 15 представляет собой графическое представление суммарного процента высвобождения клонидина из некоторых составов.
Фигура 16 представляет собой графическое представление количества высвободившегося клонидина в микрограммах из некоторых составов с дозами 3/4/5 в форме гранул.
Фигура 17 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 18 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 19 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 20 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из одного состава.
Фигура 21 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 22 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 23 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из некоторых составов.
Фигура 24 представляет собой графическое представление процентной доли суммарного вымывания клонидина из некоторых составов.
Фигура 25 представляет собой графическое представление процентной доли суммарного вымывания клонидина из некоторых составов.
Фигура 26 представляет собой графическое представление процентной доли суммарного вымывания клонидина из некоторых составов.
Фигура 27 представляет собой графическое представление процентной доли суммарного вымывания клонидина из одного состава.
Фигура 28 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из одного состава.
Фигура 29 представляет собой графическое представление процентной доли суммарного элюирования клонидина для некоторых составов.
Фигура 30 представляет собой графическое представление процентной доли суммарного элюирования клонидина для некоторых составов.
Фигура 31 представляет собой графическое представление процентной доли суммарного элюирования клонидина для одного состава.
Фигура 32 представляет собой графическое представление процентной доли суммарного высвобождения клонидина для некоторых составов.
Фигура 33 представляет собой графическое представление процентной доли суммарного высвобождения клонидина для одного состава.
Фигура 34 представляет собой графическое представление процентной доли суммарного высвобождения клонидина из одного состава.
Следует понимать, что все рисунки представлены не в масштабе. Кроме того, соотношения между объектами на рисунке могут не соответствовать масштабу, а в действительности, могут иметь обратное отношение к размеру. Рисунки представлены для обеспечения понимания и ясности структуры каждого показанного объекта, и поэтому некоторые элементы могут быть непропорционально увеличены, чтобы проиллюстрировать специфичные особенности структуры.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В рамках данного описания и формулы изобретения все числа, выражающие количество компонентов, процентные доли или соотношения материалов, условия реакции, или другие численные значения, используемые в описании или формуле изобретения, следует понимать во всех случаях, когда не указано иное, как включающие термин «приблизительно». Соответственно, если не указано иное, численные значения параметров, указанные в данном описании и приложенной формуле изобретения, являются приблизительными и могут изменяться в зависимости от необходимых свойств, которые рассчитывают получить в соответствии с настоящим изобретением. По крайней мере, и не в качестве ограничения применения доктрины эквивалентов к объему защиты, каждый численный параметр, следует понимать по меньшей мере в свете указанных дл него значащих разрядов с применением обычных методик округления.
Несмотря на то, что численные значения параметров и их диапазоны, определяющие объем защиты настоящего изобретения, являются приблизительными; численные значения, указанные в конкретных примерах, приведены со всей возможной точностью. Любое численное значение, однако, по своей природе обязательно содержит некоторые ошибки в пределах стандартного отклонения результатов измерений. Кроме того, следует понимать, что все рассматриваемые в настоящем описании диапазоны следует понимать как включающие все значения и все подмножества значений, входящие в них. Например, диапазон "от 1 до 10" включает в себя все подмножества значений от минимального значения 1 (включительно) до максимального значения 10 (включительно), то есть любые подмножества, имеющие минимальное значение большее или равное 1, а максимальное значение меньшее или равное 10, например, от 5,5 до 10.
Определения
Следует подчеркнуть, что термины, используемые в данном описании или формуле изобретения в единственном числе, также включают и формы данных понятий во множественном числе, если однозначно не указано об ограничении одним обозначаемым предметом. Таким образом, например, понятие «депо лекарственного средства» включает один, два, три или более деполекарственного средства.
«Депо лекарственного средства» представляет собой композицию, в составе которой клонидин вводят в организм. Таким образом, депо лекарственного средства может включать физическую структуру, обеспечивающую имплантацию и удерживание в нужном месте (например, в межпозвоночном пространстве, в позвоночном канале, в ткани пациента, в частности, в месте локализации хронической боли или вблизи него и т.д.). Депо лекарственного средства может также включать само лекарственное средство. Используемый в настоящем описании термин «лекарственное средство», главным образом, относится к любому веществу, изменяющему физиологию пациента. Термин «лекарственное средство» может использоваться в качестве разнозначного термина с терминами «терапевтический агент», «терапевтически эффективное количество», «активный фармацевтический ингредиент», или АФИ (API). Очевидно, что если не указано другое, «состав лекарственного средства» может содержать один или большее количество терапевтических агентов, причем примеры таких комбинаций терапевтических агентов включают комбинацию из двух или более лекарственных средств. Лекарственное средство обеспечивает градиент концентрации терапевтического агента для доставки к необходимой области. В различных вариантах осуществления изобретения, депо лекарственного средства обеспечивает оптимальный градиент концентраций лекарственного средства или терапевтического агента на расстоянии от приблизительно 0,01 см до приблизительно 5 см от участка введения и содержит клонидин. Депо лекарственного средства может также включать насос или гранулы.
Понятие «терапевтически эффективное количество» или «эффективное количество» означает такое количество лекарственного средства, при введении которого достигают изменения биологической активности, такого как, например, ингибирование воспаления, уменьшение или облегчение (снижение выраженности) боли или спазма, улучшение состояние за счет расслабления мышц и т.д. Вводимая пациенту доза может быть однократной или многократной, в зависимости от множества факторов, включающих фармакокинетические свойства вводимого лекарства, пути введения, состояния пациента и его характеристик (пол, возраст, масса тела, состояние здоровья, размер и т.д.), степень выраженности симптомов, сопутствующее лечение, частоту применения и желаемый эффект. В некоторых вариантах состав предназначен для немедленного высвобождения, в других вариантах - для замедленного высвобождения. В некоторых других вариантах препарат включает один или несколько слоев для немедленного высвобождения и один или несколько слоев - для замедленного.
Термин «депо» включает капсулы, микросферы, микрочастицы, микрокапсулы, частицы из микроволокон, наносферы, наночастицы, покрытия, матрицы, таблетки, гранулы, эмульсии, липосомы, мицеллы, гели или другие фармацевтические композиции для доставки или их комбинации, но не ограничен перечисленными. Подходящими материалами для депо являются идеально фармацевтически приемлемые биоразлагаемые и/или биоабсорбируемые материалы, предпочтительно, разрешенные FDA (Агентство по контролю за продуктами питания и лекарственными средствами США) или материалы GRAS (признанные полностью безопасными). Данные материалы могут быть полимерными или неполимерными, а также иметь синтетическое или природное происхождение, также могут быть использованы материалы с комбинациями данных признаков.
Термин «биоразлагаемый» означает, что все депо лекарственного средства или его части разлагаются со временем под действием ферментов, в результате гидролиза и/или других аналогичных механизмов в организме человека. В различных вариантах осуществления изобретения, термин «биоразлагаемый» означает, что депо (например, микрочастица, микросфера и т.п.) может разрушаться или разлагаться в организме с образованием нетоксичных компонентов после или в процессе высвобождения терапевтического агента. Термин «подвергающийся биоэрозии» подразумевает, что депо будет размываться или разлагаться со временем по меньшей мере частично за счет контакта с веществами, находящимися в окружающей ткани, жидкости или за счет действия клеток. Термин «биоабсорбируемый» подразумевает, что депо разрушается или абсорбируется (всасывается) в организме человека, например в клетке или ткани. Понятие «биосовместимый» означает, что депо не вызывает существенного раздражения или некроза тканей в месте локализации в ткани-мишени.
В некоторых вариантах осуществления изобретения депо лекарственного средства имеет поры, что обеспечивает высвобождение лекарственного средства из депо. Депо лекарственного средства обеспечивает проникновение жидкости в депо, где она замещает лекарственное средство. Однако инфильтрация клеток в депо ограничена размером пор депо. Таким образом, в некоторых вариантах осуществления, депо не функционирует в качестве каркаса, удерживающего ткань, что обеспечивает рост тканей. Скорее, депо лекарственного средства будет использоваться исключительно для доставки лекарственного средства. В некоторых вариантах размер пор депо лекарственного средства составляет менее 250-500 микрон. Такой размер пор препятствует инфильтрации клеток в депо лекарственного средства прикреплению опорных клеток. Таким образом, в данном варианте осуществления, будет происходить вымывание лекарственного препарата из депо при попадании в депо жидкости, но в то же время оно будет предотвращать попадание клеток внутрь. В некоторых вариантах осуществления, подразумевающих присутствие небольшого количества пор или их отсутствие, препарат выходит из депо под действием ферментов, в результате гидролиза и/или других аналогичных механизмов в организме человека.
Фразы «замедленное высвобождение» или «медленное высвобождение» (также это относится к пролонгированному освобождению или контролируемому высвобождению) используется в настоящем описании по отношению к одному терапевтическому агенту или большему количеству терапевтических агентов, вводимых в организм человека или других млекопитающих, которые непрерывно или постоянно высвобождают поток одного или более терапевтических агентов на протяжении определенного периода времени при терапевтическом уровне, необходимом для достижения требуемого терапевтического эффекта на протяжении определенного периода времени. Указание на непрерывный или постоянный поток высвобождения охватывает высвобождение, происходящее в результате биоразложения депо лекарственного средства in vivo или матрицы или компонента, или за счет метаболической трансформации или растворения терапевтического(их) агента(ов) или конъюгатов терапевтического(их) агента(ов).
Словосочетание «немедленное высвобождение» используется в настоящем описании по отношению к одному или большему количеству терапевтических агентов, вводимых в организм и которым позволяют раствориться или всосаться в участке, куда его/их вводят, без задержки или пролонгирования растворения или всасывания лекарственного средства.
Данные два типа составов (замедленного и немедленного высвобождения) можно комбинировать. Составы с замедленным и немедленным высвобождением могут находиться в одном или большем количестве одинаковых депо. В различных вариантах осуществления изобретения, составы с замедленным высвобождением и немедленным высвобождением могут быть частями разных депо. Например, препараты клонидина с болюсным или немедленным высвобождением могут быть помещены в целевой участок или около него и составы с замедленным высвобождением могут также помещены в тот же участок или около него. Таким образом, даже после того, как болюс стал полностью доступен, состав с замедленным высвобождением будет продолжать выделять активный ингредиент в нужную ткань.
В различных вариантах осуществления изобретения депо лекарственного средства может быть предназначено для того, чтобы обеспечить первичную ударную дозу терапевтического агента в течение первых двадцати четырех - семидесяти двух часов после имплантации. «Начальная ударная доза», или «ударное действие», или «болюсная доза» относится к высвобождению терапевтических агентов из депо в течение первых двадцать четырех - семидесяти двух часов от того момента, когда депо приходит в контакт с водной жидкостью (например, в синовиальной жидкостью, церебральной спинномозговой жидкостью и т.д.). Считают, что «ударное действие» обусловлено усиленным высвобождением терапевтического агента из депо. В альтернативных вариантах осуществления настоящего изобретения депо (например, гель) предназначено для предотвращения или уменьшения этого первоначального ударного действия (например, за счет нанесения внешнего полимерного покрытия на депо).
Термин «лечение» заболевания или состояния относится к исполнению протокола, который может включать введение одного или более лекарственных средств пациенту (человеку или другому млекопитающему) для снижения выраженности снятия признаков или симптомов заболевания или состояния. Облегчение может осуществлять до возникновения признаков или симптомов заболевания или состояния или после возникновения признаков или симптомов. Таким образом, лечение включает профилактику или предотвращение заболевания или нежелательного состояния. Кроме того, понятие «лечение» не подразумевает обязательного полного устранения признаков или симптомов или полного выздоровления и отдельно включает протоколы, которые оказывают на пациента лишь незначительное действие. «Уменьшение боли и/или воспаления» включает снижение боли и/или воспаления и не подразумевает полного устранения боли и/или признаков или симптомов воспаления и не требует полного выздоровления. В различных вариантах осуществления изобретения уменьшение боли и/или воспаления включает даже незначительное уменьшение боли и/или воспаления. В качестве примера, применение клонидина в эффективной дозировке может быть использовано для предотвращения, лечения или смягчения симптомов боли и/или воспаления при различных заболеваниях или состояниях. Такие заболевания/состояния могут включать заболевания челюстно-лицевого отдела, бурсит, тендинит, хронические воспалительные заболевания, в том числе, но не ограничиваясь перечисленными, аутоиммунные заболевания, такие как рассеянный склероз, ревматоидный артрит, остеоартроз, инсулинозависимый сахарный диабет (диабет I типа), системная красная волчанка и псориаз, иммунные патологии инфекционной природы, например, вызванные гельминтами (например, лейшманиоз) и некоторыми вирусными инфекциями, включая ВИЧ, и бактериальными инфекциями, в том числе болезнь Лайма, туберкулез и лепроматозная проказа, отторжение трансплантата ткани, реакция трансплантат против хозяина и атопические состояния, такие как астма и аллергия, в том числе аллергический ринит, желудочно-кишечные аллергии, в том числе пищевые аллергии, эозинофилия, конъюнктивит или клубочковый нефрит.
Одним из хронических состояний является ишиалгия. В целом, ишиалгия является примером болей, которые могут переходить из острой формы к невропатической боли. Ишиалгия относится к боли, связанной с воспалением седалищного нерва, который идет от нижней части спинного мозга (поясничная область), вниз по задней поверхности голени и стопы. Ишиалгия обычно начинается с грыж межпозвоночных дисков. Грыжа межпозвоночного диска приводит к локальной активации иммунной системы. Грыжа межпозвоночного диска может также привести к повреждению нервных корешков за счет сдавливания или компрессии, что приводит к дополнительной активации иммунной системы в этой области. В различных вариантах осуществления изобретения клонидин может быть использован для уменьшения, лечения или предотвращения ишиалгической боли и/или воспаления за счет локального введения в один или несколько целевых участков тканей (например, нервные корешки, ганглий заднего корешка, очаги боли, в позвоночника или вблизи него и т.д.).
В некоторых вариантах осуществления изобретения депо лекарственного средства можно использовать для лечения одного или нескольких участков тканей, которые связаны с состояниями/заболеваниями, такими как, например, ревматоидный артрит, остеоартроз, ишиалгия, кистевой туннельный синдром, боли в пояснице, боль нижних конечностей, боль верхних конечностей, рак, боль в ткани и боль, связанная с травмой или восстановлением шейных, грудных и/или поясничных позвонков или межпозвонковых дисков, мышц плечевого пояса, синовиального соединения суставов, височно-нижнечелюстного сустава, сухожилий, связок, мышц, хирургически поврежденной области или области разреза и т.п.
В некоторых вариантах осуществления изобретения депо клонидина могут быть использованы для лечения глаукомы. Глаукома представляет собой состояние глаза, при котором внутриглазное давление (ВГД) увеличивается до аномального уровня. Увеличение ВГД обычно происходит в результате повышения давления жидкости в стекловидном теле глаза. Повышение внутриглазного давления вызывает развитие оптической нейропатии, а именно, вызывает гибель некоторых клеток сетчатки глаза, что приводит к сокращению поля зрения и возможной слепоте при отсутствии лечения.
В некоторых вариантах осуществления изобретения депо лекарственного средства может быть имплантировано внутрь или около глаза или глазной ткани таким образом, что депо обеспечивает контакт с жидкостью стекловидного тела или вожной влаги глаза и высвобождение лекарственного средства (например, клонидина) из депо на протяжении лечения глаукомы. Примеры ткани глаза для имплантации депо лекарственного средства включают, в частности, передняя камера глаза, склера, стенка склеры, роговица, шлеммов канал, трабекулярная сеть или другие ткани внутри глаза. В некоторых вариантах депо лекарственного средства может быть также имплантировано под веко, что обеспечивает высвобождение клонидина для лечения глаукомы путем снижения или стабилизации ВГД. Высвобождение лекарственного средства из депо может происходить в течение одного или большего количества месяцев.
Термин «имплантируемый» в настоящем описании обозначает биосовместимый объект (например, депо лекарственного средства), сохраняющий потенциал для успешного размещения в теле млекопитающего. Выражение «имплантируемый объект (приспособление)» и подобные выражения в настоящем описании относятся к объекту, имплантируемому хирургическим путем, путем инъекции или другими приемлемыми способами, которое выполняет свою основную функцию за счет присутствия или проявления механических свойств.
Понятие «локализованная» доставка включает такую доставку, при которой один или большее количество лекарственных средств располагают в ткани, например, в корешках нервов нервной системы или в область мозга или в непосредственной близости (в пределах приблизительно 0,1 см или предпочтительно до приблизительно 10 см, например). Доза лекарственного средства, доставленного локально (местно) из депо лекарственного средства может быть, например, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 99,9% меньше, чем доза состава, вводимого перорально или посредством инъекции. В свою очередь системные побочные эффекты, такие как, например, повышение уровня трансаминазы печени, гепатит, печеночная недостаточность, миопатия, запоры и т.д., могут быть сокращены или ликвидированы.
Термин «млекопитающие» относится к представителям класса млекопитающих, включая, но не ограничиваясь перечисленными: человека, других приматов (таких как шимпанзе, человекообразных, обезьян, орангутанов и обезьян), крыс, мышей, кошек, собак, коров, лошадей и т.д.
Словосочетание «лекарственное средство для управления болью» включает один или более терапевтических агентов, которые вводят для предотвращения, облегчения или полного устранения боли. Такие средства включают противовоспалительные агенты, миорелаксанты, анальгетики, анестетики, наркотики и другие, а также их комбинации.
Словосочетание «профиль скорости высвобождения» обозначает процентную долю активного ингредиента, высвобождаемого в единицу времени, например, мкг/ч, мкг/день, по 10% в день в течение 10 дней и т.п. Специалистам средней квалификации известно, что профиль скорости может быть линейным, но не обязательно. В качестве примера, не ограничивающего объем изобретения, может быть рассмотрено депо лекарственного средства в виде лентообразного волокна, которое высвобождает клонидин в течение определенного периода времени (см. рисунки 5-34).
Термин «твердый» относится к твердому материалу, в то время как термин "полутвердый" означает, что материал имеет некоторую степень гибкости, что позволяет депо изгибаться и принимать форму, соответствующую требованиям окружающих тканей.
«Система направленной доставки» обеспечивает доставку одного или большего количества депо лекарственных средств, гелей или депо, диспергированных в геле, содержащих некоторое количество терапевтического агента, который может быть расположен в целевой области или около нее в соответствии с необходимостью для лечения боли, воспаления или других заболеваний или состояний.
Аббревиатура DLG (ДЛГ) обозначает поли(D,L-лактид-со-гликолид).
Аббревиатура DL обозначает поли(D,L-лактид).
Аббревиатура LG обозначает поли(L-лактид-со-гликолид).
Аббревиатура CL обозначает поликапролактон.
Аббревиатура DLCL обозначает поли(D,L-лактид-со-капролактон).
Аббревиатура LCL обозначает поли(L-лактид-со-капролактон).
Аббревиатура G (ПГА) обозначает полигликолид.
Аббревиатура PEG (ПЭГ) обозначает полиэтиленгликоль.
Аббревиатура PLGA (ПЛГА) обозначает поли(лактид-со-гликолид), также известный как поли(молочная-со-гликолевая кислота). Данные понятия равноценны.
Аббревиатура PLA (ПЛА) обозначает полилактид.
Аббревиатура РОЕ (ПОЭ) обозначает поли(ортоэфир).
Ниже приведены подробные описания некоторых вариантов осуществления изобретения, примеры которых проиллюстрированы сопровождающими рисунками. Следует понимать, что описание изобретения в совокупности с иллюстрируемыми вариантами не ограничивает объема изобретения. Наоборот, изобретение охваты