Средство, ингибирующее множественную лекарственную устойчивость опухолевых клеток
Иллюстрации
Показать всеИзобретение относится к медицине, ветеринарии и фармацевтической промышленности. Изобретение обеспечивает применение тритерпеновых гликозидов из голотурий фрондозида А или комплекса фрондозида А с холестерином в качестве средства, ингибирующего множественную лекарственную устойчивость опухолевых клеток, а также для приготовления фармацевтической композиции, ингибирующей множественную лекарственную устойчивость опухолевых клеток. Использование изобретения позволяет расширить арсенал средств, ингибирующих множественную лекарственную устойчивость опухолевых клеток. 2 н.п. ф-лы, 4 пр., 4 ил.
Реферат
Изобретение относится к медицине и ветеринарии и касается средств, ингибирующих множественную лекарственную устойчивость опухолевых клеток.
Устойчивость опухолевых клеток одновременно ко многим токсическим противоопухолевым препаратам, с помощью которых проводится химиотерапия онкологических заболеваний, несходным по химической структуре и механизму действия, достаточно давно известный феномен, получивший название множественной лекарственной устойчивости (МЛУ) [Endicott J.A., Ling V. The biochemistry of P-glycoprotein-mediated multidrug resistance // Annu. Rev. Biochem. 1989. V.58. P.137-171;
Ставровская А.А. Опухолевая клетка в обороне // Соросовский образовательный журнал. 2001. Т.7, №7. С.17-23; Ставровская А.А. Клеточные механизмы множественной лекарственной устойчивости опухолевых клеток // Биохимия. 2000. Т.65, Вып.1. С.112-126]. Клетки, обладающие МЛУ или приобретающие ее в ходе химиотерапии (путем искусственного отбора под действием ядов), становятся устойчивыми к действию лекарственных средств, а их уничтожение или ингибирование их пролиферации требует использования химиотерапевтических препаратов-цитостатиков, таких как циклофосфамид, доксорубицин, винбластин, этопозид, фторурацил, в столь больших дозах, которые зачастую несовместимы с выживанием пациентов.
Наиболее часто встречающимся механизмом МЛУ является активация трансмембранных транспортных белков, выводящих различные вещества из клетки. Основным белком такого типа является Р-гликопротеин [Endicott J.A., Ling V. The biochemistry of P-glycoprotein-mediated multidrug resistance // Annu. Rev. Biochem. 1989. V. 58. P. 137-171]. Р-гликопротеин выполняет роль насоса, который, используя энергию АТФ, может откачивать из клетки самые разнообразные вещества, включая и флюоресцентные красители, свободно проникающие через клеточные мембраны путем диффузии. Используя такие красители, можно определить функциональную активность Р-гликопротеина, сравнивая флуоресценцию резистентных клеток и клеток, обработанных ингибитором Р-гликопротеина. Флуоресценция клеток, у которых ингибирован Р-гликопротеин, будет существенно выше за счет отсутствия активного транспорта красителя из клеток.
Известны препараты, способствующие преодолению множественной лекарственной устойчивости опухолей. К таким веществам относятся верапамил, циклоспорин А, нифедипин и его производные, амиодарон, трифторкеразин, хинин и другие [Ford J.M., Halt W.N. Pharmacology of drugs that alter multidrug resistance in cancer. // Pharmacol. Res. 1990. V.42. P.155-199]. Недостатком указанных соединений является наличие серьезных побочных эффектов в дозах, необходимых для усиления действия противоопухолевых препаратов. В частности, верапамил, являющийся эффективным ингибитором Р-гликопротеина, вызывает сердечную недостаточность и мозговые нарушения, а циклоспорин А обладает иммунодепрессантной активностью.
В этой связи поиск ингибиторов МЛУ среди природных соединений, обладающих менее выраженным побочным действием, представляется актуальным. Так, среди природных веществ, ингибирующих МЛУ, упоминаются авермектины - вещества макролидной природы, получаемые путем микробиального биосинтеза [RU 2250775 С2, 2002.11.06].
Также известны синтетически модифицированные природные тритерпеноиды, ингибирующие пролиферацию клеток, обладающих МЛУ [RU 2393165 С2, 17.07.2008].
В качестве веществ, обладающих различными видами биологической активности, привлекают внимание природные соединения морского происхождения, включая тритерпеновые гликозиды из голотурий. Сапонины, или гликозиды, состоящие из углеводной цепи и тритерпенового или стероидного агликона, широко распространены в растениях. Однако присутствие тритерпеновых гликозидов характерно для большинства голотурий, относящихся к классу Holothurioidea (тип Echinodermata) и для некоторых губок. Тритерпеновые гликозиды голотурий имеют агликоны ланостанового типа, большинство имеет агликоны с 18(20)-лактонами и относится к голостановому ряду. Углеводные цепи гликозидов голотурий состоят из 2-6 моносахаридных остатков, включая ксилозу, хиновозу, глюкозу, 3-0-метилглюкозу, и (иногда) 3-O-метилксилозу, 3-O-метилхиновозу, 3-0-метилглюкуроновую кислоты, а также 6-O-ацетилглюкозу. Они могут содержать одну, две или три сульфатных группы. [Stonik V.A., Kalinin V.I., Avilov S.A., Toxins from sea cucumbers (Holothuroids): chemical structures, properties, taxonomic distribution, biosynthesis and evolution // J. Nat. Toxins. 1999. V.8. P.235-248; Kalinin V.I., Silchenko A.S., Avilov S.A., Stonik V.A., Smimov A.V. Sea cucumbers triterpene glycosides, the recent progress in structural elucidation and chemotaxonomy // Phytochemistry Reviews. 2005. V.4, No.2-3. P.221-236; Avilov S.A., Silchenko A.S, Antonov A.S., Kalinin V.I., Kalinovsky A.I., Smimov A.V., Dmitrenok P.S., Evtushenko E.V., Fedorov S.N., Savina A.S., Shubina L.K., Stonik V.A. Synaptosides A and Ai, two triterpene glycosides from the sea cucumber Synapta maculata containing 3-O-methylglucuronic acid and their cytotoxic activity against tumor Cells // J. Natural Prod. 2008. V.71, No.4. P.525-531; Antonov A.S., Avilov S.A., Kalinovsky A.I., Anastyuk S.D., Dmitrenok P.S., Evtushenko E.V., Kalinin V.I., Smirnov A.V., Taboada S., Ballesteros M., Avila C., Stonik V.A. Triterpene glycosides from Antarctic sea cucumbers I. Structure of liouvillosides A1, А2, А3, B1 and B2 from the sea cucumber Staurocucumis liouvillei, new procedure for separation of highly polar glycoside fractions and taxonomic revision // J. Nat. Prod. 2008. V.71. P.1677-1685].
Благодаря способности формировать комплекс с 5(6)-ненасыщенными стеринами клеточных мембран, гликозиды обладают широким спектром биологической активности, включая гемолитическую, антигрибковую, цитотоксическую, и многие другие виды мембранотропного действия [Kalinin V.I., Aminin D.L., Avilov S.A., Silchenko A.S., Stonik V.A. Triterpene glycosides from sea cucucmbers (Holothurioidae, Echinodermata), biological activities and functions // Studies in Natural Product Chemistry (Bioactive Natural Products) / Ed. Atta-ur-Rahman. V.35. P.135-196. The Netherlands: Elsevier Science Publisher, 2008].
Однако особый интерес представляет действие гликозидов голотурий в субцитотоксических дозах. Эти вещества характеризуются двумя константами связывания с биомембранами в цитотоксических и в субцитотоксических дозах [Pislyagin E.A., Gladkikh R.V., Kapustina I.I., Kim N.Yu. Shevchenko V.P., Nagaev I.Yu. Interaction of holothurian triterpene glycoside with biomembranes of mouse immune cells // International Immunopharmacology. 2012. V.14. P.1-8.].
Возможно, именно эти последние тонкие взаимодействия и связаны с их стимулирующим действием на клеточный иммунитет, а также и на противоопухолевое действие, при котором гликозиды могут вызывать апоптоз, как in vivo, так и in vitro [Marzouqi N., Iratni R., Nemmar A., Arafat K., Al Sultan M.A., Yasin J., Collin P., Mester J., Adrian Т.Е., Attoub S. Frondoside A inhibits human breast cancer cell survival, migration, invation and the growth of brest tumor xenografts // Eur. J. Pharmacology. 2011. V.668, No.1-2. P.25-34; Jin J.-O., Shastina V.V., Shin S.-W., Park J.-I., Rasskazov V.A., Avilov S.A., Fedorov S.N., Stonik V.A., Kwak J.-Y. Differential effects of triterpene glycosides, fromdoside A and cucumerioside A2-2 isolated from sea cucumbers on caspase activation and apoptosis of human leukemia cells // FEBS Lett. 2009. V.583. P.697-702; Jin J.-O., Shastina V.V., Shin S.-W., Park J.-I., Rasskazov V.A., Avilov S.A., Fedorov S.N., Stonik V.A., Kwak J.-Y. Differential effects of triterpene glycosides, frondoside A and cucumerioside А2-2 isolated from sea cucumbers on caspase activation and apoptosis of human leukemia cells // FEBS Lett. 2009. V.583. P.697-702].
Для того, чтобы уменьшить цитотоксическое действие гликозидов и сохранить их иммуномодулирующие и противоопухолевые свойства, был получен комплекс моносульфатированных гликозидов из голотурии Cucumaria japonica (преимущественно кукумариозид А2-2) с холестерином (препарат Кумазид) [Стоник В.А., Аминин Д.Л., Богуславский В.М., Авилов С.А., Агафонова И.Г., Сильченко А.С., Пономаренко Л.П., Прокофьева Н.Г., Чайкина Е.Л. Иммуномодулирующее средство "Кумазид" и фармацевтическая композиция на его основе // RU 2271820 С1, 02.07.2004; Aminin D.L., Pinegin B.V., Pichugina L.V., Zaporozhets T.S., Agafonova I.G., Boguslavsky V.M., Silchenko A.S., Avilov S.A., Stonik V.A. Immunomodulatory properties of Cumaside // Int. Immunopharm. 2006. V.6. P.1070-1082; Aminin D.L., Chaykina E.L., Agafonova I.G., Avilov S.A., Kalinin V.I., Stonik V.A. Antitumor activity of the immunomodulatory lead Cumaside // Intern. Immunopharm. 2010. V.10. P.648-654.]. Препарат Кумазид обладает противоопухолевым действием in vivo на карциному Эрлиха мыши, а также усиливает противоопухолевое действие фторурацила.
Известно, что кукумариозид А2-2 и его комплекс с холестерином (препарат Кумазид) блокируют мультилекарственную устойчивость опухолевых клеток [Д.Л. Аминин и др. Новое Иммуномодулирующее лекарственное средство Кумазид. // Материалы VI научно-практической конференции Фундаментальная наука - медицине. 2 июня 2011 г. Владивосток, C.11-12].
Тем не менее, данных об ингибировании МЛУ фрондозидом А и его комплексом с холестерином и композициями на их основе в доступной патентной и другой научно-технической литературе не обнаружено.
Задача изобретения - расширение арсенала средств, ингибирующих множественную лекарственную устойчивость опухолевых клеток.
Задача решена применением фрондозида А из охотоморской промысловой голотурии Cucumaria okhotensis или его комплекса с холестерином в качестве средства, ингибирующего множественную лекарственную устойчивость опухолевых клеток.
Задача решена также применением фрондозида А или его комплекса с холестерином для приготовления фармацевтической композиции, ингибирующей множественную лекарственную устойчивость опухолевых клеток.
Гликозиды получают путем выделения и очистки из природного сырья. Процесс выделения тритерпеновых гликозидов из голотурий, в частности, фрондозида А является стандартной процедурой, описанной, к примеру, Сильченко А.С. и соавторами [Сильченко А.С., Авилов С.А., Калинин В.И., Стоник В.А., Калиновский А.И., Дмитренок П.С., Степанов В.Г. Моносульфатированные тритерпеновые гликозиды Cucumaria okhotensis - нового вида голотурий из охотского моря // Биоорг. химия. 2007. Т.33, №1. С.81-90; Silchenko A.S., Avilov S.A., Kalinin V.I., Kalinovsky A.I., Dmitrenok P.S., Fedorov S.N., Stepanov V.G., Dong Z., Stonik V.A. Constituents of the sea cucumber Cucumaria okhotensis. Structures of okhotosides В1-B3 and cytotoxic activities of some glycosides from this species // J. Nat. Prod. 2008. V.71, No.3. P.351-356].
Сущность способа заключается в следующем: животных измельчают и экстрагируют дважды горячим этанолом; объединенные экстракты упаривают досуха на роторном испарителе и сухой остаток хроматографируют на колонке с тефлоновым порошком или другим гидрофобным носителем, уравновешенным в воде. Неорганические соли и полярные примеси вымывают с колонки водой, а фракцию, содержащую гликозиды, - 50% этанолом в воде. Затем фракцию наносят на колонку с силикагелем; элюент - система хлороформ-этанол-вода (100:100:17). В результате выделяют две главные фракции: первая содержит моносульфатированные гликозиды, а вторая - более полярные гликозиды. Затем индивидуальный моносульфатированный гликозид (фрондозид А) выделяют методом высокоэффективной колоночной хроматографии (HPLC) с использованием обращенно-фазовых колонок.
Сущность способа приготовления комплекса заключается в следующем: фрондозид А растворяют в бутаноле, затем к полученному раствору добавляют раствор холестерина в водном бутаноле (1 г холестерина в 60 мл бутанола, насыщенного водой). Смесь оставляют на ночь, после чего выпавший белый осадок отделяют центрифугированием, промывают небольшим количеством этанола и диэтилового эфира и сушат.
Фармацевтические композиции, ингибирующие множественную лекарственную устойчивость опухолевых клеток, получают, смешивая эффективное количество фрондозида А с традиционными фармацевтически или фармакологически приемлемыми наполнителями. Выражение «фармацевтически или фармакологически приемлемый» обозначает молекулярные компоненты и композиции, которые не вызывают негативных, аллергических или иных нежелательных реакций при введении их животному или человеку. Природа наполнителя зависит от способа введения. Например, если желательным является пероральное введение, то может быть выбран твердый наполнитель, тогда как для внутривенного введения может быть использован жидкий солевой раствор.
Технический результат, обеспечиваемый изобретением, заключается в способности фрондозида А или его комплекса с холестерином вызывать ингибирование множественной лекарственной устойчивости в опухолевых клетках, а также в возможности использования фрондозида А и его комплекса с холестерином для приготовления фармацевтических композиций, ингибирующих множественную лекарственную устойчивость опухолевых клеток.
Изобретение расширяет арсенал средств и фармацевтических композиций, ингибирующих множественную лекарственную устойчивость опухолевых клеток.
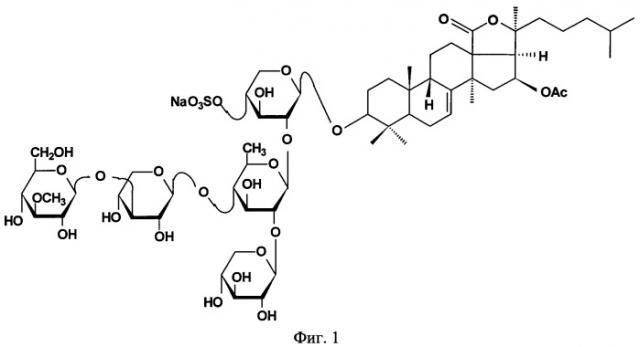
На фиг.1 представлена структура фрондозида А.
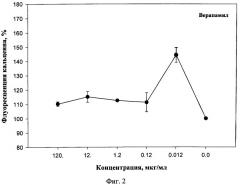
На фиг.2 представлено действие верапамила на мультилекарственную устойчивость клеток карциномы Эрлиха, определенное с помощью флюоресцентного зонда Calcein AM.
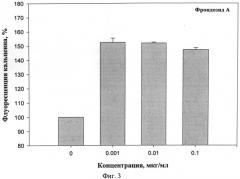
На фиг.3 представлено действие фрондозида А на мультилекарственную устойчивость клеток карциномы Эрлиха, определенное с помощью флюоресцентного зонда Calcein AM.
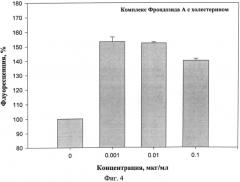
На фиг.4 представлено действие комплекса фрондозида А с холестерином на мультилекарственную устойчивость клеток карциномы Эрлиха, определенное с помощью флюоресцентного зонда Calcein AM.
Приготовление фармацевтических композиций иллюстрируется следующими примерами:
Пример 1. Фрондозид А в эффективном количестве смешивают с соответствующим количеством смеси крахмала и гипса и прессуют в таблетку.
Пример 2. Комплекс фрондозида-А с холестерином в эффективном количестве смешивают с соответствующим количеством крахмала и помещают в желатиновую капсулу.
Пример 3. Фрондозид А в эффективных концентрациях растворяют в физрастворе.
Пример 4. Комплекс фрондозида А с холестерином в эффективных концентрациях суспендируют в физрастворе на ультразвуковой бане.
Исследование биологической активности
I. Материалы и методы
1. Тритерпеновые гликозиды
Исследована способность фрондозида А, а также его комплекса с холестерином ингибировать множественную лекарственную устойчивость опухолевых клеток. По данным спектроскопии ЯМР 13С фрондозид А - индивидуальное соединение. В качестве контроля использовали верапамил, способность которого ингибировать МЛУ опухолевых клеток, а точнее Р-гликопротеин, была известна ранее.
Индивидуальные соединения растворяли в стерильной дистиллированной воде в концентрации 1 мг/мл (исходная концентрация). Из этой исходной концентрации сделали серию соответствующих разведении. Суспензии комплекса гликозида с холестерином готовили диспергированием комплексов в стерильной дистиллированной воде с помощью ультразвуковой бани в концентрации 1 мг/мл. Из этой исходной концентрации сделали серию соответствующих разведении.
2. Определение ингибирования множественной лекарственной устойчивости опухолевых клеток.
В экспериментах использовали музейный тетраплоидный штамм клеток мышиной асцитной карциномы Эрлиха, полученный из Всесоюзного онкологического центра РАМН (г.Москва). Клетки асцитной карциномы Эрлиха пассировали в брюшной полости белых беспородных мышей обоего пола весом 18-20 г. Для эксперимента клетки отбирали на 7-10 день после инокуляции опухоли. Для этого мышей забивали методом перивисцеральной дислокации и с помощью шприца собирали асцитическую жидкость, содержащую опухолевые клетки. Клетки трижды отмывали от экссудата центрифугированием при 1500 об/мин (450 g) в течение 5 мин в фосфатно-солевом буферном растворе Дульбекко (ФСБ) следующего состава: NaCl - 137 мМ; KCl - 2,68 мМ; Na2HPO4×7H2O - 8,06 мМ; NaH2PO4 - 1,47 мМ, рН 7.4. Конечная концентрация клеток в инкубационной среде составляла 2-5×106 клеток/мл.
Клетки асцитной карциномы Эрлиха в концентрации 5×105 кл/мл по 100 мкл добавляли в каждую лунку 96-луночной планшеты, содержащей 50 мкл исследуемых веществ в концентрации от 0,04 мкг/мл до 120 мкг/мл и инкубировали в течение 15 мин при 37°. Затем добавляли по 50 мкл Calcein AM (конечная концентрация 0,25 мкМ) и инкубировали 15 мин при 37°С. После чего планшеты центрифугировали по 5 мин при 4°С, 1500 об/мин 3 раза, каждый раз сливая супернатант и добавляя по 200 мкл культуральной среды в каждую лунку. Измеряли флуоресценцию с помощью спектрофлуориметра планшетного формата Fluoroscan Accent (Финляндия) при λех=494 nm, λem=517 nm. Интенсивность флуоресценции случайно выбранных 100 изображений клеток оценивалась с помощью программы AQM Advance 6 (Kinetic Imaging Ltd., UK) и вычислялась по средней интенсивности флуоресценции каждой клетки, выраженной в пикселях. Кроме того, оценивались геометрические параметры клеток (площадь, периметр, максимальная хорда и очертания).
Эксперимент повторяли трижды. Средние значения, стандартную ошибку и стандартные отклонения вычисляли и наносили на график с помощью программы SigmaPlot 3.02 (Jandel Scientific, USA).
II. Влияние фрондозида А, а также его комплекса с холестерином на множественную лекарственную устойчивость.
Изучение МЛУ проводили на клетках асцитной карциномы Эрлиха с помощью флуоресцентного зонда кальцеин AM. В нормальных клетках зонд легко проникает через плазматическую мембрану в цитоплазму и под действием эстераз он превращается в неэтерефицированную форму кальцеин, и начинает флуоресцировать в зеленой области спектра. В клетках с МЛУ наблюдается супер экспрессия Р-гликопротеина, который не дает проникнуть зонду в клетку. Известны стандартные блокаторы Р-гликопротеина, такие как верапамил, которые устраняют эффект МЛУ и тем самым увеличивают чувствительность опухолевых клеток к цитостатикам и цитотоксинам и могут выполнять роль положительного контроля.
Было изучено блокирование МЛУ изучаемымм гликозидом и его комплексом с холестерином. Полученные результаты представлены на фиг.3, 4.
Эксперименты показали, что фрондозида А, а также его комплекс с холестерином эффективно блокируют Р-гликопротеин в исследуемом диапазоне концентраций от 0,001 до 1 мкг/мл, вследствие чего увеличивается количество зонда в цитоплазме. Наибольшая флуоресценция зонда наблюдалось при действии фрондозида А или его комплекса с холестерином в концентрации 0,001 мкг/мл, и увеличение интенсивности составило около 54% по отношению к контролю. Как препарат сравнения использован верапамил в диапазоне концентраций от 0,012 до 120 мкг/мл (фиг.2). Было показано, что максимальная эффективная концентрация верапамила составила 0,012 мкг/мл. Это соответствовало увеличению флуоресценции зонда приблизительно на 45-50% относительно контроля.
Таким образом, фрондозид А, а также его комплекс с холестерином ингибируют множественную лекарственную устойчивость опухолевых клеток, что сопоставимо по действию с известным эффективным блокатором Р-гликопоротеина верапамилом, который вследствие высокой кардиотоксичности не нашел применения в терапии опухолевых заболеваний.
Исследуемый тритерпеновый гликозид, его комплекс с холестерином и фармацевтические композиции на их основе могут найти применение в качестве терапевтических средств, ингибирующих множественную лекарственную устойчивость опухолевых клеток в очень низких концентрациях.
1. Применение фрондозида А или комплекса фрондозида А с холестерином в качестве средства, ингибирующего множественную лекарственную устойчивость опухолевых клеток.
2. Применение фрондозида А или комплекса фрондозида А с холестерином для приготовления фармацевтической композиции, ингибирующей множественную лекарственную устойчивость опухолевых клеток.