Композиции для восстановления кожи, содержащие активаторы циркадных генов и синергическую комбинацию активаторов гена sirt1
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается композиции для ухода за кожей и способа ингибирования повреждения человеческих кератиноцитов, вызванного воздействием агрессивных факторов окружающей среды, и способа репарации повреждения человеческих кератиноцитов вследствие воздействия агрессивных факторов окружающей среды. Указанная композиция, содержит по меньшей мере одно средство, которое стимулирует экспрессию циркадных генов в клетках кожи и по меньшей мере один активатор циркадных генов кератиноцитов и по меньшей мере один активатор гена sirt1 кератиноцитов. Группа изобретений обеспечивает простоту в применении, эффективность, химическую, термодинамическую устойчивость и устойчивость к действию света, безопасность для топического применения, отсутствие побочных эффектов. 4 н. и 15 з.п. ф-лы, 4 пр., 3 ил.
Реферат
Настоящая заявка является частичным продолжением рассматриваемой заявки на патент США № 11/837658, поданной 13 августа 2007 года, и частичным продолжением рассматриваемой заявки US 12/367705, поданной 9 февраля 2009 года, которые обе полностью включены в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области лечения кожи. Конкретнее, изобретение относится к композициям и способам усиления репарации поврежденной ДНК в клетках кожи.
УРОВЕНЬ ТЕХНИКИ
В настоящее время хорошо известно, что кожа подвергается повседневному воздействию разнообразных факторов окружающей среды и образа жизни. Краткий перечень указанных факторов включает ультрафиолетовое излучение-A (УФ-A), ультрафиолетовое излучение-B (УФ-B), загрязнение внешней среды, сигаретный дым, неправильное питание, недостаточный отдых и физиологический стресс. Это неблагоприятное воздействие проявляется в виде повреждения ДНК и белков клеток кожи. Складки и морщины в коже относятся к менее серьезным исходам повреждения клеток кожи, тогда как меланома является одним из более серьезных поражений.
Повреждение ДНК
Некоторые факторы окружающей среды и образа жизни непосредственно взаимодействуют с ДНК и/или белками клеток кожи, вызывая их повреждение, некоторые факторы вызывают повреждение косвенно, а некоторые факторы способны оказывать оба вида воздействий. Примером непосредственного повреждения ДНК было бы поглощение фотонов УФ-B части ультрафиолетового спектра ДНК клеток кожи. Поглощение фотонов может вызвать мутации в последовательности ДНК. Например, примерно 8% всех случаев меланомы вызваны прямой мутацией ДНК.
Пример непосредственного повреждения ДНК и белков клеток кожи наблюдается, когда фотоны ультрафиолетового излучения поступают в кожу и абсорбируются хромофорами. В состоянии возбуждения хромофоры вступают в реакции, которые ведут к образованию реактивных видов кислорода. Например, в коже человека воздействие УФ-B связано с продукцией пероксида водорода, тогда как УФ-A связано с продукцией синглетного кислорода. Если кожа неспособна поддерживать гомеостаз нейтрализацией реактивных видов, то реактивные виды вызовут повреждение ДНК и белков клеток кожи посредством окисления. Это повреждение ДНК и белков называется окислительным стрессом и является основной причиной старения кожи. Также, примерно 92% всех случаев меланомы вызваны непрямым окислительным повреждением ДНК.
Повреждение ДНК: предотвращение и сдерживание в сравнении с репарацией
Содержащие ДНК клетки кожи включают стволовые клетки кератиноциты и меланоциты. По оценкам, один солнечный ожог приводит к сотням тысяч мутагенных модификаций оснований ДНК, таких как T-T (тиамин-тиамин) димеры; 8-оксо-7,8-дигидро-2'-дезоксигуанозин (8-оксо-DG); 06MeG (06-метилгуанин); циклобутан-пиримидиновые димеры (CPD); и 6-4 фотопродукты (6-4PP), в пораженных клетках. Указанные мутации запускают различные реакции внутри клеток кожи, которые могут привести к предотвращению дальнейшего повреждения ДНК или апоптозу клетки. Например, известно, что продукция меланина в меланоцитах стимулируется УФ излучением в качестве защитной меры. Для противодействия угрозе со стороны УФ излучения, меланин продуцируется меланоцитами в нижних отделах эпидермиса и с помощью мигрирующих кнаружи кератиноцитов, распределяется по всему верхнему и нижнему отделам эпидермиса. В первом случае, представляется, что меланин предотвращает дальнейшее повреждение ДНК, вызванное УФ, действием в качестве УФ фильтра, который ограничивает количество УФ, которое проникает в нижний отдел эпидермиса, где локализуются меланоциты и стволовые клетки кератиноциты. Однако, в качестве второй линии защиты, меланин сдерживает повреждение ДНК вследствие УФ излучения, вызывая апоптоз кератиноцитов. Путем содействия апоптозу, сдерживается поврежденная ДНК, которая имеет меньше шансов перехода на дочерние клетки (см., например, Yamaguchi et al., Melanin mediated apoptosis of epidermal cells damaged by ultraviolet radiation: factors influencing the incidence of skin cancer; Arch Dermatol Res. 2008 Apr; 300 Suppl 1: S43-S50).
Кроме предотвращения и сдерживания повреждения ДНК, здоровые кератиноциты и меланоциты имеют естественный внутренний механизм для репарации повреждений ДНК. Эти механизмы отличаются от механизмов предотвращения и сдерживания, которые вовлекают различные (хотя иногда перекрывающиеся) каскады реакций. Композиции и способы по настоящему изобретению в первую очередь касаются репарации повреждения ДНК.
Существуют клеточные механизмы восстановления для репарации повреждений ДНК в результате различных причин, не только повреждения, вызванного УФ, которое обсуждалось. Однако репарация повреждений ДНК требует времени. Например, репарация повреждений в виде ТТ димеров и 6-4PP, образованные воздействием УФ-B, может занимать соответственно до 48 и 8 часов, если она не ускоряется экзогенным влиянием. Репарация повреждений в виде 8-оксо-dG и 06MeG вследствие воздействия УФ-A или УФ-B, озона или дыма и загрязнения, может занимать до 2 часов. В идеале, репарация повреждений ДНК происходит перед клеточным делением. В противном случае, предпочтительным исходом является апоптоз. Но если случается, что повреждение ДНК оказывает неблагоприятное воздействие на стимуляцию апоптоза, или если мутация происходит без выявления, то поврежденная ДНК может переходить на следующее поколение. Композиции и способы по настоящему изобретению в первую очередь относятся к максимальному увеличению репарации повреждения ДНК перед тем, как произойдет клеточное деление.
Защитные и репаративные механизмы клетки регулируются циркадными часами.
В нормальных условиях клеточные функции, включая экспрессию и репарацию ДНК, не происходят в случайное время с равной вероятностью. Скорее, каждая клетка имеет эндогенный цикл (или часы) длительностью примерно 24 часа (т.е. циркадный ритм), и различные виды активности клетки регулируются данным эндогенным циклом. При отсутствии какого-либо внешнего стимула каждая клетка функционировала бы автономно в соответствии со своими эндогенными часами. Однако эндогенные часы клеток по всему организму синхронизированы. Для синхронизации видов активности клеток друг с другом и с окружающей средой, организм способен принять сигналы окружающей среды. Самым значительным сигналом окружающей среды является присутствие или отсутствие дневного света. Таким образом, циркадный цикл состоит из фаз света и темноты, которые грубо совпадают с фазами солнечного дня.
В настоящее время понятно, что циркадные ритмы позволяют клеткам предвидеть изменения в окружающей среде, которые могут воздействовать на клетки, и своевременно адаптироваться к тем изменениям. Пока генетические механизмы клеточных циркадных ритмов функционируют должным образом, клетки выполняют каждую из их многих функций синхронизированным образом, во время, которое является оптимальным для жизнеспособности и/или гомеостаза клеток. Например, по мере приближения дневного света (но даже перед тем, как на кожу воздействует УФ), активируются определенные гены для продукции белков, защищающих клетки против предполагаемого повреждения от УФ излучения. Затем, по мере того, как дневной свет убывает, эти гены выключаются. С другой стороны, сами циркадные гены могут подвергаться атаке факторов окружающей среды. Повреждение одного или более генов, которые регулируют циркадный ритм клетки, может изъять клетку из синхронизации с окружающей средой и с другими клетками.
Сердцевинный циркадный механизм
Факторы транскрипции представляют собой белки, которые связываются со специфическими последовательностями ДНК для регуляции передачи генетической информации от ДНК к РНК. Сердцевинный циркадный механизм, или «клеточные часы», состоит из факторов транскрипции, которые участвуют в петлях внефазной, негативной и позитивной обратной связей, которые ведут к осциллирующемуся характеру транскрипции генов.
В основном петли негативной обратной связи млекопитающих, гетеродимер факторов транскрипции CLOCK и BMAL1 активируют транскрипцию генов period (per) и cryptochrome (cry). У людей, период ген представляет собой в действительности семейство из трех генов per1, per2 и per3, а семейство генов cry включает cry1 и cry2. После их трансляции, PER- и CRY-белки мигрируют в цитоплазму и образуют комплексы PER/CRY.
Посттрансляционная регуляция создает преднамеренную задержку, после которой комплексы PER/CRY перемещаются в ядро клетки. Концентрации PER и CRY в ядре достигают пика в конце циркадного дневного времени, в которое CRY-белки затем действуют для ингибирования транскрипционной активности гетеродимера CLOCK/BMAL1. Таким образом, представляется, что CRY выключает свою собственную транскрипцию.
С другой стороны, представляется, что в одной петле позитивной обратной связи, PER2 после перемещения в ядро стимулирует транскрипцию BMAL1, в конечном счете, приводя к транскрипции генов period и cry. Также представляется, что димер CLOCK/BMAL1 стимулирует гены rev-erba и rora. Rora активирует транскрипцию BMAL1, тогда как rev-erba подавляет CLOCK и BMAL1. Максимальные величины активности так называемых «канонических часовых генов» (clock, bmal1, per1, per2, per3, cry1 и cry2) находятся вне фазы, так что в результате возникает самостоятельно поддерживающаяся петля, имеющая период приблизительно 24 часа.
Клеточный цикл
Клеточный цикл относится к серии явлений, которая происходит в клетке, приводя к делению и репликации клетки. Цикл обычно описывается в виде четырех или пяти последовательных фаз, требующих для завершения примерно 24 часа. В пределах каждой фазы клеточного цикла имеются контрольные точки, которые обеспечивают завершение всех необходимых процессов данной фазы перед началом следующей фазы. В клетках человека «первая» фаза представляет собой фазу синтеза (S), в которую копируется и синтезируется ДНК клетки. Фаза S может обычно длиться от 6 до 8 часов. В фазу G2, длящуюся 3-4 часа, синтезируются белки, и клетка удваивается в размере. В течение митоза (M) ядерная оболочка разрушается для того, чтобы каждая копия генетического материала могла отделиться к противоположным полюсам клетки. После образования новой ядерной оболочки вокруг каждого набора хромосом, клетка расщепляется надвое (цитокинез). Фаза M длится примерно 1 час. Четвертой и самой длинной фазой (6-12 часов) является фаза G1, которая характеризуется синтезом РНК и белка. От фазы G1 клетка может снова вступить в фазу S или она может вступить в фазу G0. В фазе G0 клетка находится в состоянии покоя. Фаза G0 может длиться в течение дней и лет. Стволовые клетки могут возвратиться от фазы G0, вступая в фазу G1. Дифференцированные клетки в целом не возвращаются из фазы G0. Также, клетки с поврежденной ДНК могут вступить в фазу G0, а не подвергнуться апоптозу.
Контрольные точки клеточного цикла ингибируют дальнейшее прохождение поврежденной ДНК.
Во время деления клеток контрольные точки используются для регуляции прохождения клетки по клеточному циклу. Контрольные точки предотвращают переход клетки к следующей фазе до завершения всех необходимых процессов, включая любую репарацию поврежденной ДНК. Таким образом, контрольные точки обеспечивают, чтобы поврежденная или неполная ДНК не перешла на дочерние клетки. Существует несколько контрольных точек. Контрольная точка G1/S (контрольная точка ограничения) прерывает клеточный цикл для того, чтобы могло быть принято «решение» о том, входить ли в фазу покоя или нет. В контрольной точке G2/M клеточный цикл останавливается, если выявляется поврежденная ДНК, что является необычной ситуацией. Пострепликационная контрольная точка относится к поврежденной ДНК, которая была реплицирована в фазу синтеза. Репликация поврежденной ДНК запускает клеточную реакцию, которая предотвращает прогрессирование клеточного цикла до завершения процессов пострепликационной репарации. В человеческих клетках пострепликационная контрольная точка предоставляет время для репарации задержкой начала фазы митоза. Ген chk1 осуществляет контроль над пострепликационной контрольной точкой, тогда как ген p53 играет важную роль в запуске контрольных механизмов и в контрольной точке G1/S, и в контрольной точке G2/M.
Циркадные часы также регулируют пролиферацию клеток.
В последние годы достигнуто понимание значения циркадных часов в регуляции клеточной пролиферации. Например:
«Нарушение циркадного регулирования времени... имеет далеко идущие последствия для нормального регулирования клеточного деления» (Reddy et al., 2005 Circadian clocks: neural and peripheral pacemakers that impact upon the cell division cycle. Mutation Research 574 76-91).
«Детальное понимание сущности механизмов, посредством которых компоненты часов взаимодействуют с регуляторными механизмами клеточного цикла, основано на результатах недавних исследований на мышах. Например,... задержка между удалением печеночной ткани (частичной гепатэктомией) и последующей первой волной митоза зависит от времени дня, когда была выполнена операция» (Vallone et al., 2007 Start the clock! Circadian rhythms and development. Developmental Dynamics 236 142-155).
«От цианобактерий до высших позвоночных имеется много примеров «синхронизации» циркадными часами S-фазы и митоза клеточного цикла для того, чтобы они происходили в течение ночного периода» (Vallone et al.). [Предположительно, синтез ДНК и митоз происходят ночью для защиты ДНК от вредного воздействия УФ излучения или другого ионизирующего излучения от солнца].
Таким образом, циркадные часы оказывают перекрывающее влияние на клеточный цикл синтеза ДНК и белка, митоз и цитокинез, синтез и репарацию РНК. Поэтому, когда факторы окружающей среды вмешиваются в циркадный механизм клетки, клеточная функция нарушается. Заявители утверждают, что когда лечение может задействовать или рассинхронизировать циркадные часы клетки, или когда лечение может восстановить «нормальные уровни» циркадной экспрессии генов, то клеточное функционирование может улучшиться, повреждение клеток может быть восстановлено ускоренным образом, или апоптоз может происходить более своевременным образом.
Окружающая среда может вывести циркадный ритм из синхронизации
Средства, которые воздействуют на один или более генов, которые регулируют циркадный ритм клетки, могут вывести клетку из синхронизации с окружающей средой и с другими клетками. Например, в часы после воздействия УФ излучения, возможно до 20 часов, уровни экспрессии генов clock, bmal1 и per1 в человеческих кератиноцитах значительно подавлены (см. фиг.1). Под термином «значительно подавлены» заявители подразумевают ниже минимальной экспрессии, который указанные гены проявляют при их нормальном циркадном цикле, как описано выше. Кроме того, после воздействия УФ излучения обычный тип генной экспрессии, который может быть описан как грубо синусоидальный, утрачивается.
На фиг.1 горизонтальная линия отмечает обычный средний уровень экспрессии гена clock; начиная примерно через 44 часа после воздействия УФ излучения, он проявляет типичное циркадное изменение около этой линии. Напротив, сразу после воздействия УФ-B, уровни генной экспрессии упали до уровня, значительно ниже нормального, и не возвращались к нормальным уровням в течение примерно 20 часов. В течение этих 20 часов нормальный тип генной экспрессии был утрачен для всех трех генов. И даже когда уровни генной экспрессии возвращались до почти нормальных уровней, требовался период от примерно 20 часов до примерно 44 часов для возврата нормального синусоидального типа экспрессии. Таким образом, воздействие УФ излучения действительно оказывало два эффекта. Один эффект состоит в резком снижении уровня экспрессии циркадных генов, а другой представляет тип, например, регулирование по времени их экспрессии. От 0 до примерно 44 часов после воздействия УФ излучения, все процессы - регулирование по времени синтеза ДНК и белка, митоз и цитокинез, синтез и репарация РНК и программируемая гибель клеток (апоптоз) - нарушены.
Конечно, воздействие УФ излучения происходит в дневное время, в частности, в течение особенно опасного периода с 10 часов утра до 2 часов дня. Как уже отмечено, концентрация белков PER и CRY в ядре достигает максимума в конце циркадного дневного времени, когда белки CRY действуют для ингибирования транскрипции гетеродимера CLOCK/BMAL1. Любая задержка в достижении критической концентрации, которая выключает экспрессию clock и bmal1, удлинит циркадный цикл. Таким образом, воздействие УФ излучения имеет тенденцию удлинять циркадный цикл. Это выбрасывает клеточный цикл из синхронизации с окружающей средой. Репликация ДНК и митоз могут не происходить ночью, что является оптимальным для клеточной репликации. Также может быть нарушено синхронизирующее влияние, которое циркадные гены оказывают на клеточный цикл, так что повреждение ДНК может не быть выявлено или может не быть подвергнуто репарации, и ему может быть предоставлена возможность перейти на дочерние клетки.
Сообщается, что сиртуины задерживают начало митоза.
Сиртуин 1 (также известный как SIRT1 или ортолог 1 молчащего информационного регулятора два) представляет собой фермент, который регулирует метаболизм и выживание клеток в ответ на стресс. Он связан с продолжительностью жизни клеток. Ген sirt1, который кодирует фермент SIRT1, не является циркадным геном. Chua et al. предположили, что SIRT1 стимулирует репликативную последовательность путем остановки клеточного цикла (Chua et al. (2005) Mammalian SIRT1 limits replicative life span in response to chronic genotoxic stress. Cell Metabolism 2, 67-76).
В US 2009-0082278 (полностью включенном в настоящее описание путем ссылки), кроме того, описывается этот ген и топические композиции для кожи, которые могут стимулировать его. В абзацах 8-13 указано:
«Заявители недавно обнаружили участие нового белка в механизмах клеток кожи, которые играют важную роль в процессе старения и клеточной защиты».
«Заявители продемонстрировали, что белок SIRT, а точнее, белок SIRT1, был экспрессирован в клетках кожи, и что его экспрессия была связана с различными стрессами, с которыми сталкиваются кожные клетки. Они, в частности, продемонстрировали, что индукция экспрессии этого белка с использованием различных агентов обеспечила возможность защиты клеток и помогала им лучше бороться против стресса и эндогенного старения».
«Белки SIRT являются частью семейства сиртуинов и представляют собой NAD+ зависимые ядерные белки, которые играют важную роль в деацетилировании гистона. Гены SIR (Молчащих Информационных Регуляторов), которые кодируют белки SIR, были впервые описаны у S. cerevisiae в 1979 г. (Rine J and A L, Genetics 1979). Позднее было продемонстрировано, что избыточная экспрессия белка SIR2P у C. elegans обеспечила возможность увеличения продолжительности жизни организма (Tissenbaum and A L, Nature 2001). Это исследование позволило предположить, что эти белки связаны с продолжительностью жизни».
«Белок SIRT1 представляет собой наилучшим образом охарактеризованный человеческий сиртуин, и он взаимодействует с многочисленными транскрипционными регуляторами. Человеческий белок SIRT1 был описан как участвующий в регуляции p53 (Cheng H L and A 1. Proc Natl Acad Sci USA. 2003), а позднее - как модулятор старения клеток (Langley E and A L, EMBO J. 2002). Были обнаружены другие человеческие белки SIRT (SIRT2, SIRT3, SIRT4-7). Человеческий белок SIRT2 был изучен очень мало; однако некоторые исследования продемонстрировали его роль в регуляции митотической активности (Dryden S C and A 1. Mol Cell Bio. 2003), а также его участие в регуляции белка p53 (Vaziri H and A L, Cell. 2001). До настоящего времени сиртуины деацетилазы считались семейством ферментов, играющих важную роль в регуляции клеточной гибели и ее жизненного цикла (Porcu M. and Chiarugi A, Trends Pharmacol Sci., 2005)».
«Настоящее изобретение [то есть US 2009-0082278] относится к косметической или фармацевтической композиции, содержащей, в косметически или фармацевтически приемлемой среде, по меньшей мере одно соединение, которое вероятно активирует синтез белков SIRT в клетках кожи. Предпочтительно, в соответствии с изобретением, соединения активируют конкретный класс белков SIRT, белки SIRT1».
До настоящего времени не были описаны соединения, которые служат в качестве индукторов синтеза семейства белков SIRT в клетках кожи».
В настоящем описании указано, что до настоящего времени даже в US2009-0082278 не было описано применение композиций, содержащих активаторы sirt1, в согласовании с активаторами циркадных генов. Насколько осведомлен заявитель, местная композиция, действие которой направлено на подавленные уровни белков CLOCK и PER1 в кератиноцитах человеческого эпидермиса, включающая один или более нециркадных агентов, задерживающих митоз, неизвестна.
Топические композиции для репарации ДНК
Топические продукты для нанесения на кожу с целью стимуляции процесса клеточной репарации известны. Например, такие продукты могут включать ферменты репарации ДНК для повышения эффективности естественной репарации клеточной ДНК, смачивающие ингредиенты для поддержания гидратации кератиноцитов, увлажняющие ингредиенты для улучшения барьерной функции кожи и т.д. Хотя указанные ингредиенты могут улучшить способность самостоятельного восстановления кератиноцитов, всегда остается возможность для улучшения. В отличие от предшествующего уровня техники настоящее изобретение относится к средствам восстановления уровней неповрежденных циркадных белков в клетках кожи и средствам восстановления нормального типа экспрессии циркадных генов в комбинации со средством ингибирования передачи поврежденной ДНК на дочерние клетки.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение топической композиции, которая при нанесении на кожу восстанавливает нормальные уровни циркадных белков в клетках кожи и восстанавливает нормальный тип экспрессии циркадных генов ускоренным образом.
Целью настоящего изобретения является получение композиции, которая восстанавливает подверженную световому и/или окислительному повреждению кожу, путем положительной регуляции экспрессии генов clock и per1 и задержкой митоза клеток кожи.
Целью настоящего изобретения является получение топической композиции, которая снижает вероятность пролиферации поврежденной ДНК клеток кожи.
Целью настоящего изобретения является получение топической композиции, которая снижает вероятность пролиферации ДНК клеток кожи, которая была повреждена агрессивными факторами окружающей среды.
Еще одной целью изобретения является получение композиции для лечения кожи, содержащей по меньшей мере один активатор генов clock и per1, по меньшей мере один нециркадный агент задержки митоза и, возможно, по меньшей мере один фермент репарации ДНК.
Резюме
Все указанные выше цели достигаются топической композицией, содержащей по меньшей мере одно средство, которое стимулирует экспрессию циркадных генов в клетках кожи и по меньшей мере одно нециркадное средство, которое задерживает митоз в клетках кожи. Было обнаружено, что композиции, содержащие средства, которые стимулируют (или активируют) гены clock и гены per1, в то же время также увеличивая уровни SIRT1, синергически усиливают клеточную жизнеспособность, клеточную долговечность, ингибируют клеточное повреждение, вызванное агрессивными факторами внешней среды, улучшают репарацию повреждения ДНК и синергически снижают вероятность пролиферации ДНК поврежденных клеток кожи. Композиция, возможно, содержит один или более ферментов репарации ДНК.
Предпочтительными вариантами осуществления настоящего изобретения являются топические композиции для нанесения на кожу, которые проявляют описанные выше эффекты. Предпочтительно, такие композиции содержат один или более активаторов генов clock и per1 кератиноцитов, наряду с SIRT1 или одним или более активаторами sirt1. Предпочтительно, такие композиции просты в применении, они эффективны, косметически приемлемы, химически, термодинамически устойчивы и устойчивы к действию света, безопасны для топического применения, имеют немного или лишены побочных эффектов и коммерчески целесообразны на рынке средств для личного ухода.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показаны уровни экспрессии генов clock, bmal1 и per1 в кератиноцитах человека в течение 72 часов после воздействия УФ излучения.
На фиг.2 показано воздействие активаторов sirt1, Орсиртина™ и ресвератрола, на выживание кератиноцитов человека.
На фиг.3 показано воздействие активаторов циркадных генов в комбинации с активаторами sirt1, Орсиртином™ и ресвератролом.
ДЕТАЛЬНОЕ ОПИСАНИЕ
Насколько известно заявителю, никогда не было описано применение топической композиции, содержащей активаторы sirt1 для содействия остановке клеточного цикла, в сочетании с топическим нанесением активаторов циркадных генов для восстановления нормального циркадного цикла.
Определения
Пока нет иных указаний, все процентные доли, приведенные в настоящем описании, представляют собой процентные доли по массе. В отношении генов термины «активировать» и «стимулировать» или этимологически связанные термины означают ингредиент, который вызывает экспрессию одного или более белков, кодируемых геном.
Термин «часовой ген» иногда используется в литературе для обозначения любого из так называемых «канонических» циркадных генов, включая гены clock, bmal1, period и cryptochrome. В настоящем описании «clock» (курсивом) всегда относится к гену, который кодирует белки CLOCK. В настоящем описании гены clock, bmal1, period и cryptochrome совместно именуются «циркадными генами».
Термин «фермент репарации ДНК» означает фермент, который способен восстановить мутагенное повреждение основания ДНК. Такие ферменты часто группируются по типу повреждения ДНК, которое они восстанавливают. Например, ферменты BER (эксцизионной репарации оснований), ферменты эксцизионной репарации нуклеотидов (NER); ферменты репарации ошибочного спаривания оснований (MMR); ДНК-геликазы; ДНК-полимеразы и т.д. Например, такие мутации, как 8-оксо-7,8-дигидро-2'-дезоксигуанозин, могут восстанавливаться OGG1 (8-оксо-гуанин-гликозилазой). T-T димеры могут восстанавливаться ферментом эксцизионной репарации нуклеотидов, фотолиазой. 6-4 фотопродукты могут восстанавливаться NER. 06-метил-гуанин может восстанавливаться 06-алкил-гуанин-трансферазой (AGT).
«Восстановление» в отношении кожи или клеток кожи означает, что в целом улучшается жизнеспособность, сила и долговечность кератиноцитов. Примеры восстановления включают репарацию поврежденной ДНК кератиноцитов и устранение потери клеточной гидратации вследствие УФ света, дыма или других агрессивных факторов окружающей среды.
Фраза «безопасные для топического применения» означает соответствующие всем региональным и местным нормативам, которые регулируют безопасность косметических продуктов. «Косметически приемлемая» означает, что внешний вид, ощущение и запах композиции находятся в пределах приемлемости для потребителя, как понятно среднему специалисту в данной области. Фразы «химически устойчивая», «термодинамически устойчивая» и «устойчивая к действию света» означают, что от момента изготовления до окончания периода по меньшей мере шести месяцев (предпочтительно, 3 лет) композиция остается косметически приемлемой. Фраза «коммерчески целесообразна на рынке средств для личного ухода» означает, что затраты на изготовление и распространение композиции не должны быть больше, чем те, которые по уже имеющемуся опыту характерны для промышленности, выпускающей средства для личного ухода.
Положительная регуляция CLOCK и PERIOD1
Композиция по изобретению содержит по меньшей мере одно средство, которое стимулирует гены clock и/или per1 кератиноцитов. Предлагаемые концентрации указанных генов в целом находятся в диапазоне от примерно 0,000001 до примерно 40%, предпочтительно, от примерно 0,000005 до 35%, более предпочтительно, от примерно 0,00001 до 25% в отношении общей массы готовой композиции. В целом, указанные диапазоны можно понимать как являющиеся эффективными количествами. Под «эффективным количеством» подразумевается, что концентрация указанных средств в композиции для местного нанесения на кожу человека в условиях воздействия внешней среды достаточна для улучшения выживаемости кератиноцитов по меньшей мере на 5%. Походящие активаторы clock или per1 могут присутствовать в форме растительных экстрактов, полипептидов, пептидов, аминокислот и тому подобных.
Особенно предпочтительный активатор генов clock и/или per1 содержит пептид формулы (I):
R1-(AA)n-X1-S-T-P-X2-(AA)P-R2
где (AA)n-X1-S-T-P-X2-(AA)P представляет собой (SEQ ID NO: 1) и:
X1 обозначает треонин или серин, или равен нулю,
X2 обозначает изолейцин или лейцин, или пролин, или валин, или аланин, или глицин, или равен нулю,
AA обозначает любую аминокислоту или ее производное, и n и p означают целые числа от 0 до 4 (0 и 4 включительно),
R1 обозначает функциональную группу первичного амина N-концевой аминокислоты, или свободной, или замещенной защитной группой, которая может быть выбрана или из ацетильной группы, бензоильной группы, тозильной группы, или из бензилоксикарбонильной группы,
R2 обозначает гидроксильную группу карбоксильной функциональной группы C-концевой аминокислоты, замещенной защитной группой, которая может быть выбрана или из C1-C20 алкильной цепи, или из группы NH2, NHY или NYY, причем Y обозначает C1-C4 алкильную цепь, и где последовательность общей формулы (I) содержит от примерно 3 до 13 аминокислотных остатков.
Последовательность общей формулы (I) может содержать замещения аминокислот X1 и X2 другими химически эквивалентными аминокислотами, где аминокислоты представляют собой: аланин (A), аргинин (R), аспарагин (N), аспарагиновую кислоту (D), цистеин (C), глутаминовую кислоту (E), глутамин (Q), глицин (G), гистидин (H), изолейцин (I), лейцин (L), лизин (K), метионин (M), фенилаланин (F), пролин (P), серин (S), треонин (T), триптофан (W), тирозин (Y) и валин (V).
Более предпочтительными вариантами формулы I являются следующие пептиды:
| (SEQ ID NO: 2) Y-V-S-T-P-Y-N-NH2 Tyr-Val-Ser-Thr-Pro-Tyr-Asn-NH2 | |
| (SEQ ID NO: 3) NH2-V-S-T-P-E-NH2 NH2-Val-Ser-Thr-Pro-Glu-NH2 | |
| S-T-P-NH2 Ser-Thr-Pro-NH2 | |
| (SEQ ID NO: 4) NH2-L-H-S-T-P-P-NH2 NH2-Leu-His-Ser-Thr-Pro-Pro-NH2 | |
| (SEQ ID NO: 5) CH3NH-R-H-S-T-P-E-NH2 CH3-NH-Arg-His-Ser-Thr-Pro-Glu-NH2 | |
| (SEQ ID NO: 6) CH3NH-H-S-T-P-E-CH3NHCH3-NH-His-Ser-Thr-Pro-Glu-CH3-NH2 |
Более предпочтителен пептид S-T-P-NH2, SEQ ID NO: 4, или его смеси. Наиболее предпочтителен пептид, выпускаемый компанией ISP-Vinscience под торговым знаком Chronolux®, имеющий название по номенклатуре INCI трипептид-32.
Фиг.1, 2 и 3 родственной заявки US12/367705 и текст, описывающий указанные чертежи, демонстрируют способность Chronolux® для улучшения выживания кератиноцитов, защищая против стресса, вызванного действием УФ излучения, особенно при комбинации по меньшей мере с одним ферментом репарации ДНК.
Нет прямых очевидных свидетельств того, что одновременное применение активаторов генов clock и per1 обеспечило бы получение благоприятного результата. В конце концов, при нормальном циркадном ритме клеточные концентрации белка CLOCK и PERIOD1 находятся вне фазы. Тем не менее, достигается благоприятный результат. Можно предположить, что истощение уровней белков CLOCK и PERIOD1 в клетках кожи под воздействием агрессивной внешней среды настолько велико, что благоприятный эффект достигается как можно более быстрой положительной регуляцией обоих белков.
Положительная регуляция SIRTUIN1
Заявители неожиданно обнаружили, что благоприятные результаты, достигаемые применением активаторов генов clock и per1 кератинов, модифицируются, иногда значительно улучшаются при комбинации с активатором sirt1 кератиноцитов. SIRT1 имеет тенденцию индуцировать остановку клеточного цикла. Учитывая сложность циркадного механизма и его регуляторное взаимодействие с клеточным циклом, в предшествующем уровне техники можно было бы не ожидать, что было бы благоприятным индуцировать остановку клеточного цикла при одновременном восстановлении нормальных уровней циркадных белков.
Без связи с какой-либо теорией следует понимать, что PER1 оказывает непосредственные воздействия на клеточный цикл, кроме воздействия посредством циркадного контроля. Например, PER1, кроме его роли в качестве сердцевинного компонента циркадного цикла, по имеющимся сообщениям способен активировать путь ATM-киназы, ведущий к остановке клеточного цикла. ATM- (мутированная при атаксии-телеангиэктазии) киназа представляет собой ядерную протеин-киназу, которая мобилизуется в ответ на двухнитевые разрывы ДНК. ATM-киназа фосфорилирует CHK1 и CHK2, регуляторы контрольных точек клеточного цикла, которые участвуют в остановке клеточного цикла и отсроченном вхождении в митоз. Когда PER1 недостаточно экспрессирован в результате некоторого стресса со стороны окружающей среды, то остановка клеточного цикла может не произойти или может быть отсрочена. Таким образом, может быть недостаточно времени для осуществления репараций поврежденной ДНК перед митозом или цитокинезом. В то же самое время, сниженная экспрессия PER1 связывалась с уменьшенным апоптозом. Таким образом, поврежденная клетка, которая должна погибнуть, может выжить и делиться. Поэтому, с учетом того, что стрессовое воздействие окружающей среды ведет к аномальному снижению уровней PER1, что приводит к неспособности вызвать остановку клеточного цикла и уменьшенному апоптозу, которые ведут к воспроизводству поврежденной ДНК, можно было ожидать, что активация per1 исправила бы эту проблему. Тем не менее, заявители наблюдали, что жизнеспособность кератиноцитов значительно улучшалась, когда активатор гена sirt1 используется в комбинации с активаторами генов clock и per1. Без связи с какой-либо теорией это наблюдение может подразумевать, что активация самого per1 не в состоянии достаточно быстро восстановить уровни PER1, чтобы воздействовать на реперацию перед тем, как поврежденная ДНК может распространяться на дочерние клетки.
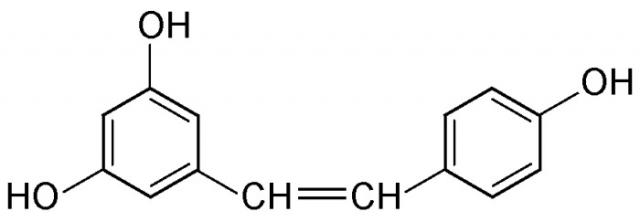
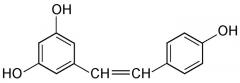
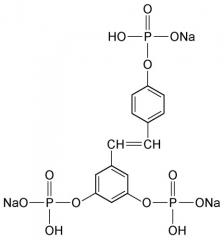
Под «активатором SIRT1» заявители подразумевают любое соединение, которое, вероятно, поддержит эндогенную продукцию белков SIRT1, в частности, молекул, участвующих в положительной регуляции таких предшественников, как ДНК или РНК. Среди указанных соединений, которые с вероятностью активируют синтез белков SIRT1 в клетках кожи, были описаны различные молекулы, такие как полифенолы. Более конкретно, можно указать производные транс-стилбена (такие как ресвератрол, пикеатаннол), производные хальконов (такие как изоликвиритигенин, бутеин) и производные флавонов (такие как фистеин, лютеолин, кверцетин). Эффективность ресвератрола или производного ресвератрола была показана в родственной заявке на патент США № 11/837658. Однако определенные пептиды, ввиду присущих им структурных аналогий с пептидами в коже, являются предпочтительными активаторами sirt1. Еще более предпочтительной является сингергическая комбинация пептидного активатора (активаторов) и ресвератрола (подробнее об этом речь идет ниже).
Пептидные активаторы sirt1
Пептиды, ввиду присущих им структурных аналогий с пептидами в коже, являются предпочтительными активаторами sirt1. Среди соединений пептидной природы можно указать белковые фрагменты, пептидные и полипептидные фрагменты, пептиды, а также все последовательности двух или более аминокислот, связанных вместе пептидными связями. В предпочтительном варианте осуществления настоящего изобретения размеры пептидных фрагментов находятся в диапазоне от 3 до 50 аминокислот, более предпочтительно, от 3 до 10 аминокислот. Все указанные пептидные фрагменты обладают биологической активностью. Предпочтительным пептидом является:
(SEQ ID NO: 7) (AA)n-G-L-Y-D-N-L-E-(AA)n
(AA)n-Gly-Leu-Tyr-Asp-Asn-Leu-Glu-(AA)n
где (AA) обозначает любую конкретную аминокислоту или ее производное, и n означает целое число от 0 до 3 (0 и 3 включительно). Особенно предпочтительным пептидом является:
(SEQ ID NO: 8) G-L-Y-D-N-L-E
Gly-Leu-Tyr-Asp-Asn-Leu-Glu
Этот пептид доступен в виде Орситрина™ GL (название по номенклатуре INCI: вода (и) глицерин (и) экстракт Oryza Sativa (риса), выпускаемый компанией ISP Vincience). В композициях по настоящему изобретению, пептидные активаторы SIRT1 п