Способ получения лантансодержащего покрытия
Иллюстрации
Показать всеИзобретение относится к челюстно-лицевой хирургии и травматологии и описывает способ получения лантансодержащего покрытия. При осуществлении способа помещают порошок гидроксиапатита в раствор 0,04 LaCl3, выдерживают порошок на воздухе при комнатной температуре в течение времени, необходимого для качественной пропитки частиц гидроксиапатита раствором LaCl3, отфильтровывают осадок на воронке Бюхнера, который затем промывают горячей водой, высушивают при 200-300°С в течение 4-6 часов и отжигают при 600-700°С в течение 2-3 часов, формирование лантансодержаего покрытия производят сначала напылением титанового подслоя, а затем лантансодержащего порошка гидроксиапатита. Способ обеспечивает создание развитой морфологии поверхности, а также антитромбоцитный и антимикробный эффект, что способствует остеоинтеграции имплантата. 3 з.п. ф-лы, 3 табл., 2 ил.
Реферат
Изобретение относится к медицине, а именно к челюстно-лицевой хирургии и травматологии, и может быть использовано для изготовления внутритканевых эндопротезов на титановой основе.
Известен способ получения биоактивного покрытия на имплантате из титана (заявка на патент РФ №2385740, МПК: A61L 27/54, A61F 2/02, А61С 8/00, опубл. 10.04.2010). Данное изобретение относится к медицине, конкретно к способу обработки поверхности титановых имплантатов, позволяющему формировать биоактивную поверхность. Биоактивное покрытие на имплантате из титана содержит кальций-фосфатные соединения и имеет многоуровневую пористую структуру с шероховатой поверхностью. Покрытие имеет толщину 10-40 мкм, общую пористость 35-45% со средним размером пор 3-8 мкм, шероховатость 2,5-5 мкм, адгезионную прочность 30-35 МПа. Способ получения биоактивного покрытия на имплантате из титана заключается в нанесении покрытия микродуговым оксидированием, но перед нанесением покрытия поверхность титанового имплантата подвергают механической и химической обработке, затем проводят микродуговое оксидирование с получением многоуровневой пористой структуры кальций-фосфатного покрытия.
Данный способ позволяет формировать биоактивное покрытие на имплантатах с высокими значениями шероховатости и адгезии, но не позволяет получить покрытие с антимикробными и антитромбоцитными свойствами, что ограничивает применение данного покрытия.
Наиболее близким к предлагаемому решению является способ получения лантансодержащего биопокрытия на имплантате из титана и его сплавов (заявка на патент РФ №2386454, МПК: A61L 31/08, A61F 2/02, 61L 27/06, A61L 27/30, опубл. 20.04.2010). Формирование покрытия на титане и гитан-содержащих сплавах (ВТ 1-0, ВТ 1-00, ВТ-6, ВТ-16 и др.) осуществляют предварительной подготовкой лантансодержащего раствора, подготовкой поверхности: электрохимическим путем последовательно в двух электролитах получают слой смеси оксидов титана и меди в электролите концентрацией 200 г/л серной кислоты с добавлением 50 г/л сульфата меди в дистиллированной воде при постоянном анодном токе, затем катодным внедрением создают слой лантана в виде фрагментов в электролите концентрацией 0,5 М салицилата лантана в диметилформамиде при постоянном катодном напряжении 3 В.
Способ позволяет получить остеоинтеграционное оксидное биопокрытие, обладающее бактерицидными и антикоагулянтными свойствами, однако в данном способе не решен вопрос о формировании развитой морфологии покрытия. Данный способ позволяет получать лантансодержащее покрытие при строгих фиксированных технологических операциях, что создает неудобство применения способа.
Задача заявляемого изобретения заключается в получении лантансодержащего покрытия, которое обеспечивает создание развитой морфологии поверхности, а также антитромбоцитного и антимикробного эффекта в прилежащих к эндопротезу тканях, что способствует повышению остеоинтеграции имплантата.
Поставленная задача решается тем, что при осуществлении способа получения лантансодержащего покрытия, заключающемся в подготовке лантансодержащего раствора, предварительной подготовке поверхности имплантата и формировании покрытия, новым является то, что осуществляют подготовку лантансодержащего раствора, помещают порошок гидроксиапатита в раствор 0,04 LaCl3, осуществляют выдержку порошка на воздухе при комнатной температуре в течение времени, необходимого для качественной пропитки частиц гидроксиапатита раствором LaCl3, отфильтровывают осадок на воронке Бюхнера, который затем промывают горячей водой, высушивают при 200-300°С в течение 4-6 часов и отжигают при 600-700°С в течение 2-3 часов, формирование лантансодержаего покрытия производят сначала напылением титанового подслоя, а затем лантансодержащего порошка гидроксиапатита.
Кроме этого предварительную обработку осуществляют струйной обработкой поверхности порошком электрокорунда с размером частиц 150-200 мкм под давлением 6,5 атм. Также плазменное напыление титанового подслоя осуществляют при напряжении 35 В, силе тока 450 А, дистанции напыления 90 мм и дисперсности титанового порошка 120 мкм, расход аргона 55-60 л/мин, а плазменное напыление лантансодержащего порошка гидроксиапатита производят при силе тока 450 А, напряжении 35 В, дистанции 80 мм, дисперсности 40-70 мкм и расходе аргона 60-65 л/мин.
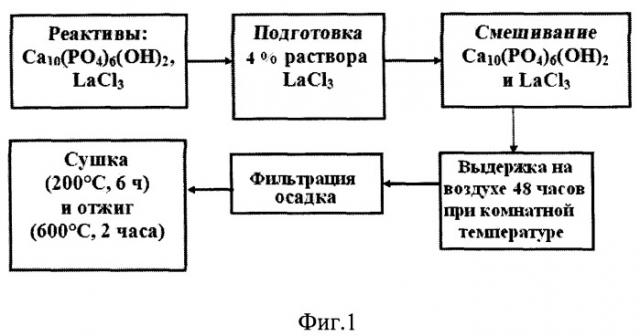
Изобретение поясняется схемами: фиг.1 - блок-схема получения лантансодержащего гидроксиапатита (ГА), фиг.2 - технология плазменного напыления лантансодержащего гидроксиапатитового покрытия.
Способ осуществляют следующим образом.
Подготовку лантансодержащего раствора осуществляют следующим образом: полученный гидроаммиачным методом порошок ГА помещают в раствор 0,04 LaCl3 и выдерживают при комнатной температуре в течение времени, необходимого для качественной пропитки частиц ГА раствором LaCl3, например, на воздухе в течение 48 часов. Осадок фильтруют на воронке Бюхнера, промывают горячей водой, высушивают при 200-300°С в течение 4-6 часов и отжигают при 600-700°С в течение 2-3 часов (фиг.1). Сушка и отжиг порошка ГА в течение указанного времени выбраны из условия, что при сушке порошка менее 4 часов он остается влажным, а более 6 часов - частицы порошка спекаются в конгломераты, при отжиге порошка ГА менее 2 часов количество аморфной фазы носит доминантный характер, а при отжиге более 3 часов при указанной температуре увеличивается количество кристаллической фазы. Таким образом, при указанном интервале температур достигается требуемое соотношение аморфной и кристаллической фаз.
| Таблица 1 | ||
| Экспериментальное определение температуры сушки порошка ГА | ||
| № п/п | Температура сушки, °С | Показатель |
| 1 | 150 | влажная смесь |
| 2 | 200 | образование таблетки |
| 3 | 250 | образование таблетки |
| 4 | 300 | образование таблетки |
| 5 | 350 | спекание таблетки в конгломераты |
Согласно результатам, приведенным в таблице 1, целесообразно использовать интервал температур для сушки порошка ГА 200-300°С, т.к. температура сушки менее 200°С не способствует полному удалению влаги из порошка, а температура сушки более 300°С приводит к спеканию таблетки порошка и образованию его в конгломераты.
Отжиг порошка ГА при указанном интервале температур (600-700°С) объясняется тем, что при этих температурах происходит закрепление частиц лантана на частицах порошка ГА.
| Таблица 2 | |||
| Экспериментальное определение температуры отжига порошка ГА | |||
| № п/п | Температура отжига, °С | Степень кристалличности, % | Качественный показатель |
| 1 | 500 | 24 | - |
| 2 | 550 | 29 | - |
| 3 | 600 | 31 | + |
| 4 | 700 | 36 | + |
| 5 | 750 | 40 | - |
Предварительную обработку поверхности имплантата осуществляют с помощью струйной обработки порошком электрокорунда с размером частиц 150-200 мкм под давлением 6,5 атм (Лясникова А.В. Стоматологические имплантаты. Исследование, разработка, производство, клиническое применение / А.В. Лясникова и др.. - Саратов: Сарат. гос. техн. ун-т, 2006. - 254 с.; Лясникова А.В. Биосовместимые материалы и покрытия нового поколения: особенности получения, наноструктурирование, исследование свойств, перспективы клинического применения / А.В. Лясникова и др. - Саратов: Научная книга, 2011. - 220 с.).
Далее осуществляют плазменное напыление титанового подслоя на опескоструенные пластинки титана на установке ВРЕС 744.3227.001. Напряжение при плазменном напылении, ток дуги и дистанция напыления были получены экспериментальным путем, результаты которого представлены в таблице.
| Таблица 3 | ||
| Экспериментальное определение технологических параметров плазменного напыления титана | ||
| Технологический параметр | Единицы измерения | Значение |
| при напылении титана | ||
| Ток плазменной дуги | А | 450 |
| Напряжение дуги | В | 35 |
| Дистанция напыления | мм | 90 |
| Дисперсность порошка | мкм | 120 |
| Расход плазмообразующего газа | л/мин | 55-60 |
Выбранные технологические режимы плазменного напыления объясняются следующим образом.
Увеличение мощности дуги значительно повышает энтальпию и температуру плазменной струи, температуру, скорость и дисперсность напыляемых частиц, что обусловливает рост плотности покрытия, производительности напыления и коэффициент использования материала. Наиболее рациональное регулирование мощности дуги, параметров напыления и качества получаемого покрытия обеспечивается при максимально возможном напряжении при 35 В и силы тока 450 А.
Слишком малые дистанции не обеспечивают необходимого прогрева частиц, а также значения их скорости, создают опасность перегрева напыляемой поверхности и всего изделия, а чрезмерно большая дистанция вызывает падение температуры и скорости плазменного потока в зоне формирования покрытия. Оптимальной является дистанция напыления 90 мм. Зернистость частиц порошка выбирается из условия необходимости их быстрого нагрева до температуры плавления и распыления, поэтому наиболее рациональным является использование порошка титана с дисперсностью 120 мкм.
Повышение расхода плазмообразующего газа снижает теплофизические характеристики потока частиц, плотность покрытия и эффективность напыления, увеличивая при этом дисперсность и скорость частиц. В зависимости от требуемых показателей дисперсности частиц и плотности покрытия следует устанавливать наименьший возможный расход плазмообразующего газа на уровне 55-60 л/мин.
Плазменное напыление лантансодержащего порошка ГА производят при силе тока 450 А, напряжении 35 В, дистанции 80 мм, дисперсности 40-70 мкм и расходе аргона 60-65 л/мин (фиг.2). Технологические режимы плазменного напыления лантансодержащего порошка ГА выбираются из соображений, описанных выше.
Таким образом, разработан способ получения лантансодержащего покрытия, который в результате позволяет получать покрытие с развитой морфологией, а также антитромбоцитными и антимикробными свойствами, что будет способствовать быстрой и надежной остеоинтеграции имплантата с биологическими тканями за счет наименьшего процента его отторжения.
1. Способ получения лантансодержащего покрытия, заключающийся в подготовке лантансодержащего раствора, предварительной подготовке поверхности имплантата с нанесением титанового подслоя, а затем лантансодержащего покрытия, отличающийся тем, что при подготовке лантансодержащего раствора помещают порошок гидроксиапатита в раствор 0,04 LaCl3, который выдерживают на воздухе при комнатной температуре в течение времени, необходимого для качественной пропитки частиц гидроксиапатита раствором LaCl3, отфильтровывают осадок, затем промывают горячей водой, высушивают при 200-300°С в течение 4-6 ч и отжигают при 600-700°С в течение 2-3 ч, нанесение титанового и лантансодержащего слоев осуществляют электроплазменным напылением.
2. Способ получения лантансодержащего покрытия по п.1, отличающийся тем, что подготовку поверхности имплантата осуществляют струйной обработкой порошком электрокорунда под давлением.
3. Способ получения лантансодержащего покрытия по п.1, отличающийся тем, что электроплазменное напыление титанового подслоя осуществляют при напряжении 35 В, силе тока 450 А, дистанции напыления 90 мм и дисперсности титанового порошка 120 мкм, расход аргона 55-60 л/мин.
4. Способ получения лантансодержащего покрытия по п.1, отличающийся тем, что электроплазменное напыление лантансодержащего порошка ГА производят при силе тока 450 А, напряжении 35 В, дистанции 80 мм, дисперсности 40-70 мкм и расходе аргона 60-65 л/мин.