Массив полых микроигл и способ его использования
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано при необходимости интрадермального введения препаратов. Для этого предложен способ, включающий этапы накладывания на кожу пациента массива микроигл, содержащего от 10 до 30 полых микроигл длиной более 100 мкм. Глубина проникновения микроигл менее 1 мм. Среднее расстояние между соседними микроиглами в массиве составляет в среднем не менее 1,5 мм. Через полые микроиглы вводят более чем 200 мкл лекарственного средства со скоростью, превышающей 20 мкл/мин. Способ обеспечивает эффективную трансдермальную доставку лекарственных препаратов при одновременном снижении уровня боли за счет использования определенных параметров микроигл в массиве. 11 з.п. ф-лы, 6 табл., 11 ил., 3 пр.
Реферат
Область применения
Настоящее изобретение относится к устройствам для введения лекарств с помощью полых микроигл.
Уровень техники
Для введения низкомолекулярных липофильных лекарств, которые быстро поглощаются через кожу, давно используются устройства трансдермального введения. Такой неинвазивный способ целесообразен для введения многих лекарств, которые не могут быть введены орально, так как он обеспечивает прямое поглощение лекарства системой кровообращения, минуя пищеварительный и печеночный входы, которые значительно снижают биологическую доступность многих лекарств. Трансдермальное введение позволяет также преодолеть многие проблемы, связанные с подкожными инъекциями, так как значительно снижается дискомфорт пациента, исключается боязнь укола, случайного ранения лица, производящего укол, иглой, а также устраняются вопросы, связанные с утилизацией игл как острых предметов.
Немсмотря на многие указанные выше преимущества, трансдермальное введение лекарств ограничено только теми их классами, молекулы которых могут поглощаться через кожу. Обычное трансдермальное введение низкомолекулярных солей и белков с терапевтическим действием, как правило, невозможно, так как кожа является достаточно эффективным барьером на пути попадания таких веществ в организм, даже в присутствии вспомогательных средств, усиливающих их поглощение.
Предложены также устройства для введения лекарств на основе микроигл и микролезвий, различных конструкций и изготавливаемые из различных материалов. Некоторые из них являются сплошными и содержат, например, нанесенное на их поверхность лекарство, а другие являются пустотелыми, и лекарство вводится через имеющиеся в них каналы из некоторого резервуара. Некоторые из них изготовлены из металла, другие - получены травлением из силиконового материала, а третьи изготовлены из пластмассы, например, из поликарбоната.
В предлагаемых устройствах значительно варьирует также количество, размер, форма и расположение используемых микроигл. В одних используется одна игла, в то время как в других, особенно в имеющих сплошные иглы, может использоваться массив из сотен игл. Размер большинства устройств составляет от 100 мкм до 2 мм.
Использование микроигл для интрадермального и трансдермального введения лекарств оказалось довольно многообещающим, особенно в тех случаях, когда требуется введение относительно небольшого количества лекарства, например, при вакцинации или введении сильнодействуещего препарата.
Одним из главных преимуществ использования микроигл является, бесспорно, возможность заменить ими, где это уместно, обычные иглы для подкожных инъекций, вызывающие тревожность и/или боль у многих пациентов. Введение некоторых лекарств с помощью микроигл, например, вакцин, предпочтительно также по сравнению с внутримышечными инъекциями. Однако способы и устройства введения лекарств с помощью микроигл часто рассматриваются как обеспечивающие довольно низкую скорость введения лекарства, что ограничивает масштабы их применения только случаями, когда требуется или малое количество лекарства, или допускается достаточно длительное время его введения. Так, например, типичная приводимая в литературе скорость введения лекарств трансдермально с помощью микроигл составляет менее чем 30 мкл/час, а максимальный объем вводимого таким образом лекарства составляет менее чем 20 мкл. В некоторых отчетах указывается, что при попытках трансдермального введения лекарств с большей скоростью пациенты испытывали значительную боль.
Сущность изобретения
Было определено, что за счет оптимального количества микроигл в массиве и их плотности на единицу площади можно получить гораздо более высокую скорость введения лекартсв практически без причинения какой-либо боли пациенту. Это действительно впервые открывает перспективу использования массивов микроигл вместо обычных игл для подкожного введения лекарств практически без причинения боли пациенту.
Предлагаемый способ обеспечивает быстрое и в большом объеме трансдермальное введение лекарства при причинении минимальной боли пациенту, путем приложения к коже пациента массива из от 10 до 30 полых микроигл длиной от 100 мкм до 1 мм, с расстоянием между соседними микроиглами не менее чем 1,5 мм (в среднем), и подачу через полые микроиглы более чем 200 мкл жидкости со скоростью более чем 20 мкл/мин.
Наиболее предпочтительные воплощения массивов микроигл в соответствии с настоящим изобретением позволяют вводить до 1 мл или даже более жидкого лекарственного средства при удивительно высокой скорости его введения, которая может составлять до 500 мкл/мин. Так, например, в отличие от других, описанных в литературе, масивов микроигл, позволяющих ввести только лишь 100 мкл со скоростью всего 10 мкл в час (не в минуту), предлагаемый массив микроигл обеспечивает интрадермальное введение целого 1 мкл жидкости за одну минуту или даже быстрее.
Массив микроигл в соответствии с настоящим изобретением содержит от 13 до 20 микроигл, расположенных с пространственной плотностью от 30 до 50 микроигл/см2. В одном из воплощений используется 18 микроигл. Соседние микроиглы должны предпочтительно находиться на расстоянии по меньшей мере 2 мм друг от друга.
Микроиглы имеют длину от 500 мкм до 750 мкм, и среднюю площадь канала от 20 до 50 мкм2 в поперечном сечении.
Способ в соответствии с настоящим изобретением может обеспечивать введение через микроиглы по меньшей мере 750 мкл жидкости. Жидкость может прокачиваться через полые микроиглы со скоростью по меньшей мере 400 мкл/мин. Противодавление во время прокачки обычно не выше, чем 25 футов/дюйм2, в большинстве случаев составляет примерно 20 футов/дюйм2.
Каждая из микроигл имеет выходное отверстие, расположенное на ее боковой стенке.
Микроиглы, как правило, проникают в дерму на глубину от 100 мкм до 400 мкм, то есть заходят под кожу не на всю их длину.
И хотя теоретически это не обязательно, в большинстве массивов микроигл в соответствии с существующим уровнем техники используется слишком большое число микроигл, расположенных слишком близко друг к другу, что может ограничивать объем и скорость введения через них жидкости в кожную ткань. Попытки слишком быстро ввести жидкость через такие устройства могут привести к значительному противодавлению, вытеканию жидкости обратно из кожи после ее введения, отдеолению массива от кожи, вздутию кожи и/или значительной боли.
В контексте настоящей заявки следующие термины следует рассматривать как имеющие следующее зачение:
"Микроигла" означает определенную микроскопическую структуру, используемую в составе массива, предназначенного для прокалывания рогового слоя кожи и последующего трансдермального введения лекарственных средств или образцов жидкости. Так, например, микроиглы могут включать структуру из игл или им подобные структуры, включая микролезвия, а также прочие структуры, которые могут прокалывать роговой слой.
Специфические черты и преимущества настоящего изобретения будут более понятны из нижеследующего подробного описания наиболее предпочтительных его воплощений, сопровождаемого прилагаемыми чертежами и формулой изобретения. Данные, а также прочие черты и преимущества будут подробно описаны ниже на примере типичных воплощений изобретения. Поэтому в настоящем разделе, излагающем сущность изобретения, не подразумевалось подробно описать каждое возможное воплощения изобретения. Более подробно возможные воплощения изобретения будут описаны в нижеследующем подробном описании со ссылкой на прилагаемые чертежи.
Краткое описание чертежей
Ниже будут подробно описаны наиболее предпочтительные воплощения изобретения со ссылкой на прилагаемые чертежи.
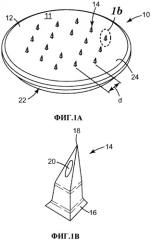
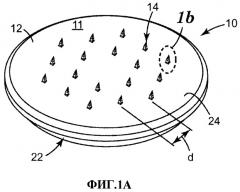
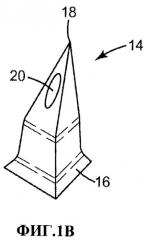
Фиг.1А и В. Аксонометрический вид одного из воплощений массива микроигл и увеличенный вид отдельной полой микроиглы.
Фиг.2А и В. Вид кожи бесшерстной морской свинки после наложения и снятия массива полых микроигл с применением окрашивания.
Фиг.3А и В. Вид участка кожи после проведения инъекции с помощью микроигл с применением красителя метилен голубой.
Фиг.4. График зависимости количества налоксона в крови с течением времени и при различной введенной дозе.
Фиг.5. Уровень боли при введении жидкости у различных категорий пациентов.
Фиг.6. Максимальное давление введения жидкости у различных категорий пациентов.
Фиг.7. Максимальная скорость введения жидкости у различных категорий пациентов.
Фиг.8 Объем введенной жидкости у различных категорий пациентов.
Фиг.9. Боль при введении жидкости при различном максимальном давлении введения.
Фиг.10. Боль при введении жидкости при различной максимальной скорости введения.
Фиг.11. Боль при введении жидкости при различном объеме введенной жидкости.
Несмотря на то, что на чертежах отображено несколько конкретных воплощений изобретения, предвидятся и иные воплощения, как будет отмечено ниже. В любом случае, целью настоящего описания является лишь дать примеры воплощений изобретения, а не ограничить его каким-либо образом. Следует понимать, что сведущими в данной области техники могут разработаны и многие другие модификации и воплощения настоящего изобретения без отхода от его масштабов и идей. Рисунки не обязательно приведены в масштабе. Аналогичные номера позиций на чертежах соответствуют аналогичным элементам.
Подробное описание изобретения
Ниже настоящее изобретение будет описано на примере следующего не ограничивающего его воплощения. Массив микроигл
Устройство 10 с микроиглами включает массив 11 микроигл, содержащий основу 12, от которой является протяженным множество из восемнадцати микроигл 14. Каждая микроигла 14 имеет высоту примерно 500 мкм, измереную от ее основания 16 до острия 18. Через основу 12 и микроиглу 14 проходит полый канал (не показан) заканчивающийся устьем 20 канала, расположеным возле острия микроиглы. Каналы обеспечивают возможность подачи жидкости с тыльной стороны стороны массива (например, из резервуара, которой не показан) через каждую из микроигл 14. Канал проходит вдоль центральной оси микроиглы 14, и выходит, подобно каналам в обычных иглах для подкожных инъекций, через наклонную боковую стенку микроиглы, что позволяет избежать его блокировку кожной тканью после наложения массива на кожу. Средняя площадь поперечного сечения канала составляет примерно 20-50 мкм2.
Микроиглы 14 расположены на некотором расстоянии друг от друга, и расстояние d между соседними микроиглами 14 составляет 2 мм. Основа 12 имеет форму диска и площадь примерно 1,27 см2, а микроиглы 14 расположены на участке основы площадью примерно 0,42 см2, измеренной по переметру данного участка, образованного самыми крайними рядами микроигл 14. Это обеспечивает плотность микроигл, составляющую примерно 14 микроигл/см2.
Массив 11 микроигл изготовлен способом термоциклического инжекционного формования из полимера для изделий медицинского назначения, например, из поликарбоната, с последующим лазерным сверлением каналов микроигл.
Структура 22 в виде бортика используется для крепления к основанию 12 массива микроигл подкладочного элемента (не показан), который включает клейкий диск (медицинская лента 1513 производства ЗМ Corporation, Сент-Пол, США), который немного выступает наружу за пределы периметра 24 основы 12 и предназначен для фиксации массива 11 микроигл на коже во время введения жидкости. Общая площадь устройства 10 с микроиглами, включая клейкий диск, составляет примерно 5,5 см2.
Устройство 10 с микроиглами накладывается на кожу, как правило, с использованием специального аппликатора (не показан). Апликатор обычно содержит пружинный механизм и предназначен для плавного введения массива вглубь кожи с определеной скоростью, так чтобы микроиглы действительно проникали в кожу, а не просто ложились на кожу, лишь деформируя ее. После должного наложения массива на кожу клейкий диск фиксирует массив на поверхности кожи. Предложены различные конструкции аппликаторов, в частности, их примеры описаны в публикациях W02005/123173, W02006/055802, W02006/05579, W02006/055771, W02006/108185, W02007/002521 и W02007/002522 (упоминаемых в настоящей заявке для ссылки).
Жидкость для введения через массив микроигл может изначально содержаться в резервуаре (не показан), или подаваться под давлением из внешнего источника, например, из шприца или иной емкости, связанной с массивом, например, посредством трубок или переходника для шприца. Вводимое лекарство может быть в форме раствора или суспензии, то есть практически в тех же лекарственных формах, что используются для подкожных инъекций через обычные иглы.
Так, для введения через предлагаемое устройство может использоваться любое вещество, изготовленное в форме для подкожных инъекций, включая вещества, обладающие каким-либо фармацевтическим, нутрицевтическим, космецевтическим, диагностическим и терапевтическим действим (далее для удобства в совокупности именуемые как «лекарства»). Примеры лекарств, которые, будучи изготовлены в форме, пригодной для инъекций, могут вводиться под кожу в соответствии с настоящим изобретением, включают, не ограничиваясь ими: аденокортикотропный гормон (например, кортикотропин), гормон, способствующий выделению лютеинизирующего гормона (например, гонадорелина гидрохлорид) и его аналоги, гормоны, способствующие выработке гормонов роста (например, серморелина ацетат), холецистокинин (синкалид), паратиреоидный гормон и его фрагменты (например, терипаратида ацетат), аналоги и антагонисты, гормоны, стимулирующие выработку гормонов щитовидной железы и их аналоги (например, протирелин), секретин и аналоги, α-1 анти-трипсин, антиангиогенезные препараты, антисмысловые препараты, буторфанол, кальцитонин и аналоги, цередазу, ингибиторы СОХ-II, вещества с дерматологическим действием, дигидроэрготамин, агонисты и антагонисты допамина, энкефалины и прочие опиоидные пептиды, факторы роста эпидермиса, эритропоэтин и его аналоги, гормоны-стимуляторы роста фолликулов, гранулоцито-колиниестимулирующий фактор, глюкагон, гранулоцито-макрофаго-колиниестимулирующий фактор, гранисетрон, гормоны роста и их аналоги (включая гормон, стимулирущий образование гормона роста), антагонисты гормонов роста, гирудин и его аналоги, например, гирулог, суппрессоры IgE, инсулин, инсулинотропин и его аналоги, инсулиноподобные факторы роста, интерфероны, интерлейкины, лютеинизирующий гормон, гепарины, низкомолекулярные гепарины и прочие натуральные, модифицированные или синтетические гликоаминогликаны, макрофаг-колониестимулирующий фактор, метоклопрамид, мидазолам, моноклональные антитела, пегилатированные антитела, пегилатированные белки или прочие белки, модифицированные гидрофильными или гидрофобными протеинами или дополнительными функциональными группами, составные белки, одноцепочечные фрагменты антител сами по себе или с прикрепленными к ним белками, макромолекулы или их функциональные группы, наркотические анальгетики, никотин, нестероидые вещества противовоспалительного действия, олигосахариды, ондансетрон, простагландины и их антагонисты, рекомбинантные растворимые рецепторы, скополамин, агонисты и антагонисты серотонина, силденафил, тербуталин, тромболитики, активаторы плазмогена тканей, опухолево-некрозные факторы и их антагонисты, вакцины сами по себе или с носителями/адъювантами, включая антигены профилактического и терапевтического действия (включая, но не ограничиваясь ими: субъедиицы белков, пептиды и полисахариды, коньюгаты полисахаридов, токсоиды, генно-инженерные вакцины, живые ослабленные, реассортантные, инактивированные, цельные клетки, вирусные и бактериальные векторы), вещества, применяемые для лечения алкогольной и наркотической зависимости, артрита, холеры, дифтерии, столбняка, гемофильного гриппа В, болезни Лайма, менингококковой инфекции, кори, свинки, краснухи, ветряной оспы, желтой лихорадки, респираторно-синцитиальной вирусной инфекции, переносимого клещами японского энцефалита, пневмококковой инфекции, тифа, гриппа, гепатита, включая гепатит А, В, С и Е, воспаления среднего уха, бешенства, полиомиелита, ВИЧ-инфекции, парагриппа, ротавирусной инфекции, инфекции, вызываемой вирусом Эпштейна-Бара, цитомегаловирусами, хламидийной инфекции, нетипируемой гемофильной инфекции, инфекции, вызываемой moraxella catarrhalis, вирусной папилломы человека, туберкулеза, включая БЦЖ, гонореи, астмы, атеросклероза, малярии, инфекций, вызываемых бактериями E-coli, болезни Альцгеймера, болезней, вызываемых Н. Pylori, сальмонеллеза, диабета, рака, простого герпеса; и прочие вещества, включая все основные лекарственные вещества, в том числе применяемые против обычной простуды, аллергии, рвоты, ожирения, остеопороза, инфекций; анальгетики и анестетики; вещества для повышения аппетита; вещества против артрита и астмы; противосудорожные препараты и антидепрессанты; антигистамины и противовоспалительные; средства от головной боли; средства от морской болезни и укачивания; противоопухолевые, лекарства от болезни Паркинсона, противозудные, антипсихотические, жаропонижающие, антихолинергические, антагонисты бензодиазепина, сосудорасширяющие, в том числе общего действия, для коронарных сосудов, периферийних сосудов и сосудов мозга, вещества для стимуляции костно-мышечной системы, стимуляторы нервной системы, гормоны, вещества гипнотического действия, иммунодепрессивные препараты, препараты, ослабляющие мышечный тонус, парасимпатолитики, парасимпатомиметрики, простагландины, белки, пептиды, полипептиды и прочие макромолекулы, психостимуляторы, седативные, транквилизаторы и подавители сексуальной функции.
В различных воплощениях может использоваться самый широкий диапазон форм полых микроигл, включая коническую форму, цилиндрическую форму, форму пирамиды, усеченную форму, асимметричную форму и их сочетания. Для изготовления устройства могут использоваться различные материалы, например, полимеры, металлы, материалы на основе силикона, а также различные способы их изготовления, например, инжекционное формование, штамповка и фотолитография. Микроиглы могут быть расположены на основании в виде любой структуры, например, произвольным образом, в виде многоугольника, квадрата и по кругу (если смотреть со стороны массива, прикладываемой к коже).
В дополнение к изложенному выше отметим, что дополнительная информация об устройствах с микроиглами, материалах и способах их изготовления, и способах применения таких массивов, которые (в непосредственном виде или после адаптации) могут быть использованы для реализации настоящего изобретения, содержится в патентных публикациях: патенты США 6,881,203; 6,908,453; патентная публикация США 2005-0261631; публикации WO2005/065765; WO2005/082596; WO2006/062974; WO2006/135794; US2006/048640; предварительная патентная заявка США 60/793611; публикации US2007/064789; WO2006/062848; WO2007/002523; предварительная патентная заявка США 60/793564.
Эксперименты
Устройство, представляющее собой массив из микроигл, описанное выше и изображенное на фиг.1А, было испытано в ходе следующих экспериментов и на следующих образцах.
Модельные системы на основе животных и подготовка кожи
Бесшерстные морские свинки
Для экспериментов в Charles River Laboratories (Вильмингтон, Массачусетс, США) в соответствии с протоколом ЗМ, утвержденным Комитетом по защите и использованию животных, были приобретены самцы бесшерстных морских свинок, и использовались также в соответствии с данным протоколом. Все использованные для настоящего исследования животные имели вес 0,8-1 кг.
Домашние свиньи
Испытания проводились также на самках домашних свиней возрастом примерно 6-18 недель и весом от 10 до 30 кг, также в соответствии с протоколом ЗМ, утвержденным Комитетом по защите и использованию животных. Во всех экспериментах во время проведения инъекций животные находились под анестизией (смесь кислорода и простого фторированного эфира (2-5%)). Верхнюю часть бедра животного брили с помощью лезвия №50, зажатого в хирургическом зажиме, а затем лезвием Schick 3 с нанесением небольшого количества крема для бритья Gillette. После бритья место для аппликации массива и инъекции ополаскивали водой, насухо промокали и после этого протирали изопропиловым спиртом (производства Phoenix Pharmaceutical, Inc., Сент-Джозеф, штат Миссури, США).
Определение количества налоксона в сыворотке крови
В определенные моменты времени из ушной вены животного отбиралось 1,5-2 мл цельной крови с помощью набора Vacutainer (Becton Dickenson & Co., Фрэнклин Лэйкс, штат Нью-Джерси, США). Образец крови оставляли по меньшей мере на 30 мин при комнатной температуре, после чего центрифугировали при 1500 об/мин в течение 10 мин. После центрифугирования из цельной крови отделяли сыворотку и хранили на холоде до выделения твердой фракции.
Для выделения из сыворотки твердой фракции использовали специльные картриджи для экстракции (Phenomenex, Торранс, штат Калифорния, США). Образцы сыворотки нагревали до комнатной температуры. В картриджи добавляли метанол (EMD Chemicals, Inc, Гиббстаун, штат Нью-Джерси, США) и уравновешивали водой (химически чистой), после чего в них погружали образцы сыворотки. Сыворотку омывали 2 мл 5%-ного раствора метанола в химически чистой воде и элюировали налоксон 100%-ным метанолом. Элюэнт собирали в стеклянную пробирку объемом 14 мл или трубку размером 16×100 мм и высушивали в атмосфере азота с давлением 37 футов/дюйм2 на водяной бане при температуре 37°С.
Экстракты доводили до исходной концентрации смесью 5% ацетонитрил/95% 0,1% раствор муравьиной кислоты (Alfa Aesar, Ward Hill, MA) в воде, переносили в пробирки (Eppendorf, Вестбури, штат Нью-Йорк, США) для микроцентрифуги и центрифугировали при 14 ООО об/мин в течение 10 минут.
Экстракты подвергали количественному анализу методом жидкостной хроматомасс-спектрометрии. Разделение на фракции производили в колонке Agilent Eclipse XDB-C18 (Agilent Technologies, Wilmington, DE), соединеной последовательно с колонкой Phenomenex CI 8 Guard (Phenomenex, Torrence, С А); подвижной фазой была смесь 0,1%-ного раствора муравьиной кислоты и ацетонитрила, причем доля муравьиной кислоты в фазе постепенноизменялась от 95% to 10% в течение 1 минуты. Для наблюдения за количеством ионов, образующихся в результате m/z-переходов 328.17→310.10 и 342.16→324.30, использовался трехквадрупольный масс-спектрометр Sciex API3000 (AppliedBiosystems, Фостер-Сити, Калифорния, США) в режиме положительных ионов, с использованием устройства Turbo IonSpray. Линейный диапазон изменения концентрации налоксона составлял от 0.1 до 100 нг/мл, по результатам анализа обратной кривой. Эксперименты проводились на свиньях различного размера, по этому для нормализации уровня уровня налоксона в крови с учетом веса животного измеренные уровни налоксона в крови умножали на переводной коэффициент 62 мл крови/кг веса свиньи, а затем умножали на вес свиньи (в кг) при введении дозы. Получение окончательные результаты (в мкг/животное) наносили на графики.
Глубина проникновения устройства в кожу морских свинок и домашних свиней
Исходя из анализа литературных данных и с учетом размера использованного устройства с микроиглами было определено, что для прохождения устройства через роговой слой кожи потребуется усилие 0.004-0.16 Н на микроиглу. (S.P. David, B.J. Landis, Z.H. Adams, M.G. Allen, M.R. Prausnitz. Insertion of microneedles into skin: measurement and prediction of insertion force and 30 needle fracture force. Journal of Biomechanics. 37:115-116 (2004)). Для предварительной проверки достаточной прочности микроигл массив придавливали к неэластичной поверхности, и этом острия микроигл начинали сгибаться, когда к массиву было приложено усилие примерно 245 H.
За тем исключением, что она не содержит потовых желез, кожа свиньи считается достаточно близкой к коже человека по толщине, плотности волос и скреплению с лежащими под ней тканями. Исходя из того, что глубина эпидермиса свиней, использованных в настоящем исследовании, примерно такая же, как у человека, результаты измерения глубины проникновения устройства с полыми микроиглами (изображенного на фиг.1), а именно, от 180 до 280 мкм (в среднем 250 мкм), позволяют предположить, что кончики игл будут находиться в дерме или эпидермисе, и этим будет определяться величина противодавления при введении препарата через микроиглы. Следует также понимать, что хотя длина микроигл составляла около 500 мкм, фактическая глубина их проникновения в кожу будет составлять примерно половину данной величины. Измерения глубины проникновения проводились как на морских свинках, так и на домашних свиньях, и их результаты обобщены в Таблице I.
| Таблица I | ||
| Результаты измерения глубины проникновения микроигл в кожу бесшерстных морских свинок и домашних свиней | ||
| Бесшерстные морские свинки | Домашние свиньи | |
| Число аппликаций* | 6 | 6 |
| Средняя глубина проникновения, мкм | 210 мкм% | 250 мкм |
| Среднеквадратичное отклонение, мкм | 30 мкм | 40 мкм |
| Среднеквадратичное отклонение, % | 15% | 16% |
| * В каждой аппликации использовался 1 массив из 18 микроигл |
Разлом микроигл не наблюдался в предварительном испытании устройства на прочность, и ни в каком из экспериментов после аппликации устройства на кожу животного обломаных игл также не было обнаружено.
На фиг.2А и 2В показано место аппликации устройства к коже бесшерстных морских свинок после его снятия. Так, на фиг.2А видны следы, оставленные на коже микроиглами, на которые был нанесен краситель родамин В. На фиг.2В видны следы, оставленные на коже микроиглами, на которые был нанесен краситель метилен голубой. Структура пятен красителя метилен голубой на фиг.2В свидетельствует о прохождении каждой из 18 микроигл через роговой слой кожи. Кровоподтек не наблюдался ни во время аппликации, но после нее.
В опытах с домашними свиньями проводили несколько инъекций объемом до 1 мл стерильного 5%-ного раствора декстрозы и 0,001%-ного раствора красителя метилен голубой. После введения препарата устройство оставляли на коже на некторое время (до 10 минут), чтобы противодавление в системе вернулось до уровня, который имел место до инъекции. На фиг.3А и 3В представлены результаты интрадермального введения 800 мкл 0,001%-ного раствора красителя метилен голубой под кожу свиней. После снятия устройства кожа была на ощупь сухой, и темно-голубая окраска вводимого препарата позволяла проводить некторую визуальную оценку эффективности его введения.
На фиг.3А и 3В показаны следы после трансдермального введения 0,001%-ного раствора красителя метилен голубой через Т=0 мин и Т=9 мин после снятия устройства с кожи соответственно. Кожа была на ощупь сухой.
Каждо голубое пятно на коже соответствует одной из 18 полых микроиглмассива. Несмотря на то, что через 9 минут пятна выглядели несколько размытыми, они оставались такими в сущности без изменения в течение последующих 24 часов, хотя припухлость кожи исчезала менее чем через час. Вероятно, краситель, попав в кожную ткань, загрязнялся или выпадал в осадок, что препятствовало его дальнейшему распространению, поэтому видимые его пятна не являются эффективным показателем распространения вводимого препарата спустя длительное время.
После введения препарата и снятия устройства с полыми микроиглами с кожи на ее поверхности наблюдалось небольшое количество (1-3 мкл) введенного препарата. После того, как эту жидкость нежно вытирали салфеткой, больше жидкости на поверхности кожи, как правило, не выделялось. После снятия устройства на коже оставалось розоватое пятно, размером такое же, как приложенное устройство, которое постелено исчезало и через 5 минут становилось практически незаметным. Наблюдалась также небольшая припухлость, такая же по размеру, как используемое устройство, которая была мягкой на ощупь, но при приложении небольшого давления пальцем не текла. Припухлость ичсезала (визуально и на ощупь) спустя 40 минут после снятия устройства с кожи. Осмотр места аппликации устройства спустя 24 и 48 часов показал полное отсутствие раздражения кожи и отека.
Пример 1. Введение большого объема раствора декстрозы через кожу свиней
Возможность введения больших объемов препарата была продемонстрирована на домашних свиньях. После аппликации на кожу устройства, содержащего массив полых микроигл, к нему подключали стандартный набор медицинского оборудования для подкожного введения лекарств. А именно, массив микроигл подключали к насосу Medfusion 3500 (Smiths Medical, Сент-Пол, штат Миннесота, США) посредством стерильного набора №4 из полиэтилена (Vygon Corporation, Экуан, Франция), который включает стерильный преобразователь давления «в линию» DTX Plus TNF-R (BD Infusion Therapy Systems, Inc, Сэнди, штат Юта, США).
Насос Medfusion 3500 стандартно применяется в больницах и имеет ряд функций безопасности, обеспечивающих его остановку в экстренных случаях. Примерно каждые две секунды записывалось значение давления в системе. Для инъекций использовался 5%-ный раствор декстрозы (по Фармакопеи США) производства Baxter Healthcare, Дирфилд, штат Иллинойс, США), непосредственно в поставляемом виде. 0,001%-ный раствор красителя метилен голубой готовился на стерильной воде и перед применением фильтровался.
Испытания проводились также на самках домашних свиней возрастом примерно 6-18 недель и весом от 10 до 30 кг, в соответствии с протоколом 3М, утвержденным Комитетом по защите и использованию животных. Во всех экспериментах во время проведения инъекций животные находились под анестизией (смесь кислорода и простого фторированного эфира (2-5%)). Верхнюю часть бедра животного брили с помощью лезвия №50, зажатого в хирургическом зажиме, а затем лезвием Schick 3 с нанесением небольшого количества крема для бритья Gillette. После бритья место для инъекции ополаскивали водой, насухо промокали и после этого протирали изопропиловым спиртом (производства Phoenix Pharmaceutical, Inc., Сент-Джозеф, штат Миссури, США).
В верхнюю часть бедра свиньи водили (в различных экспериментах) до 1 мл 5%-ного водного раствора декстрозы или до 425 мкл налоксона. Во время введения постоянно следили за противодавлением, чтобы убедиться в отсутствии утечек в системе. Полностью условия введения препаратов под кожу свиней приведены в Таблице II ниже.
| Таблица II | ||
| Условия введения декстрозы и налоксона под кожу свиней | ||
| Препарат и его количество | макс. скорость введения, мкл/мин | Схема введения, мкл/мин × мин |
| 1003 мкл декстрозы | 50 | 10 (5 мин), 20 (7,5 мин), 30 (10 мин), 40 (7,5 мин), 50 (4 мин) |
| 1003 мкл декстрозы | 75 | 10(1 мин), 25 (2 мин), 50 (4 мин),75 (примерно 10 мин) |
| 425 мкл налоксона | 100 | 10 (1 мин), 25 (1 мин), 50 (1 мин), 100 (сколько получится) |
| 330 мкл налоксона | 75 | 10(1 мин), 25 (2 мин), 50 (5 мин), 75 (сколько получится) |
После введения препарата устройство снималось с кожи и в месте его приложения под кожей оставался небольшой пузырек. Пузырек исчезал (визуально и на ощупь) спустя 40 минут после снятия устройства с кожи. Осмотр места аппликации устройства спустя 48 часов показал полное отсутствие какой-либо реакции со стороны кожи.
Во время инъекций декстрозы и метилена голубого постоянно измерялось и записывалось противодавление. Максимальное значение противодавления, а также прочие условия введения препаратов для трех опытов приводятся в таблице III.
| Таблица III | |||
| Условия введения декстрозы и метилена голубого | |||
| Препарат | макс. скорость введения, мкл/мин | макс. противодавление, фунтов/ дюйм2 | Схема введения, мкл/мин × мин |
| 1003 кл декстрозы | 50 | 9,1 | 10 (5 мин), 20 (7,5 мин), 30 (10 мин), 40 (7,5 мин), 50 (4 мин) |
| 1003 мкл декстрозы | 75 | 4,4 | 10 (1 мин), 25 (2 мин), 50 (4 мин), 75 (примерно 10 мин) |
| 750 мкл метилен голубой | 100 | 16,2 | 10 (1 мин), 25 (1 мин), 50 (1 мин),100 (сколько получится) |
Пример 2. Введение налоксона и измерение его концентрации в крови
Для получения лучших количественных характеристик введения препарата с помощью устройства с полыми микроиглами в свиней вводили имеющуюся в продаже форму налоксона в концентрации 1 мг/мл. Налоксон является конкурентным антагонистом µ-опиоидного рецептора, применяемым в основном при передозировке наркотиков, таких как героин. Для получения быстрой реакции организма налоксон, как правило, вводится внутривенно, а его биологическая доступность при оральном приеме составляет всего лишь 2%. Налоксон хорошо поглощается, но при первом прохождении через организм 90% его выводится. Анализ литературных данных показывает, что время полу-выведения налоксона из организма взрослого человека составляет 30-81 минут, а время полу-выведения из детского организма намного больше (около 3 часов). Налоксон выводится из организма с мочой в виде метаболитов.
Образцы крови отбирались из ушной вены свиней до введения препарата и в определенные моменты времени после его введения (всего в течение 2 часов). По отобранным образцам определялся уровень налоксона в сыворотке крови. Для сравнения часть свиней получала такие же дозы того же самого препарата налоксона способами обычного подкожного введения и внутривенно. У них также отбирались образцы крови и анализировались на содержание налоксона.
Для сравнения уровня налоксона в крови и его изменений с течением времени при введении с помощью микроигл, подкожно и внутривенно использовали трех разных животных. На время проведения эксперимента свиньи весили 10-22 кг, а их возраст составлял от 1,5 до 3 месяцев. Для введения использовали имеющуюся в продаже форму налоксона гидрохлорида в концентрации 1 мг/мл (International Medication Systems, Ltd, So. Эль-Монте, штат Калифорния, США). Условия введения налоксона с помощью устройства с полыми микроиглами приведены в Таблице IV.
| Таблица IV | ||
| Условия введения налоксона | ||
| Объем дозы | макс. скорость введения, мкл/мин | Схема введения, мкл/мин × мин |
| 425 мкл | 30 мкл/мин | 10 (5 мин), 20 (7,5 мин), 30 (сколько получится) |
| 200 мкл | 75 мкл/мин | 25 (1 мин), 50(2 мин), 75 (сколько получится) |
| 330 мкл | 75 мкл/мин | 10 (1 мин), 25 (2 мин), 50 (5 мин), 75 (сколько получится) |
Сравнение уровней налоксона в крови с течением времени при различных дозах введенного препарата приведено на фиг.4. Как было сказано выше, налоксон вводили свиньям и подкожно. Используемые для этого свиньи имели примерно такой же возраст и вес, как и свиньи, которым препарат вводился с помощью микроигл. Результаты анализа образцов, собранных в течение 2 часов после начала введения препарата показывают, что биодоступность налоксона при введении с помощью полых микроигл составляет примерно 107±35% биодоступности при подкожном введении.
Пример 3. Исследование введения декстрозы на людях
Применение того же устройства, что было описано выше, на людях, также показало возможность введения большого количества препарата и с большой скоростью. В клиническом испытании участвовало 28 человек, которым последовательно делалось введение плацебо с помощью микроигл в верхнюю часть плеча и/или бедра. В ходе введения препарата постоянно следили за противодавлением. При этом каждого участника просили оценить боль при наложении и снятии устройства с микроиглами, а также каждые 10 минут во время введения препарата (или в конце его введения, есло оно длилось менее 10 минут).
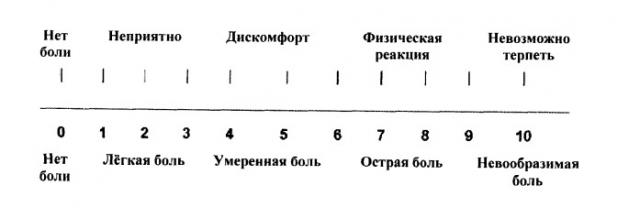
Результаты исследования уровня боли (в соответствии с приведенной ниже шкалой) приведены на графиках на фиг.5-11.
Всего было проведено 125 процедур трансдермального введения препарата, из них в 46 процедурах вводилось не менее 750 мкл перепарата. При этом использовались различные схемы введения по времени, так что в различных экспериментах и на различных их этапах применялась скорость введения от 10 до 433 мкл/мин. Статистически значимой разницы между уровнем ощущения боли при различной скорости введения препарата обнаружено не было. Результаты экспериментов, с указанием количества препарата, максимальной скорости его введения и уровня дискомфорта по ощущению пациентов, по категориям пациентов (категория соответствовала диапазону дозы) представлены в Таблице V.
| Таблица V |
| Результаты опытов по трансдермальному |