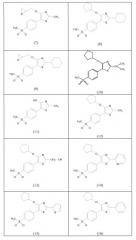
Производные 5-(4-метансульфонилфенил)тиазола для лечения острых и хронических воспалительных заболеваний
Иллюстрации
Показать всеИзобретение относится к применению соединений формулы (I), где R1 выбирают из C1-C6 алкила, необязательно замещенного циано, незамещенного C3-C8циклоалкила, фенила, необязательно замещенного галогеном, и незамещенного 3-8-членного гетероциклила, содержащего один гетероатом, выбранный из азота и серы; R2 выбирают из С1-С6 алкила, необязательно замещенного 3-членным гетероциклилом, содержащим один гетероатом кислорода, и незамещенного С3-С8циклоалкила, и R3 представляет собой C1-C6 алкильный радикал, для получения лекарственного средства для лечения острого или хронического воспалительного заболевания посредством ингибирования продуцирования по меньшей мере одного провоспалительного цитокина, выбранного из TNF-альфа и IFN-гамма, или посредством иммуномодулирования хемокина IL-8 и/или регуляторного цитокина IL-10. Изобретение также относится к соединениям формулы (I') и фармацевтической композиции на их основе. Технический результат - производные 5-(4-метансульфонилфенил)тиазола для лечения острых и хронических воспалительных заболеваний или состояний. 4 н. и 10 з.п. ф-лы, 51 табл., 12 ил., 25 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, к которой относится ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к применению соединений, полученных из 5-(4-метансульфонилфенил)тиазола, для получения лекарственного препарата для лечения острых и хронических воспалительных заболеваний или состояний, таких как ревматоидный артрит.
СОСТОЯНИЕ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
Иммунология представляет собой научное исследование распознавания «своего» и «не своего». Утрата толерантности к «своему» лежит в основе происхождения аутоиммунных заболеваний. Кроме того, другие состояния, такие как трансплантация, атеросклероз, септические и несептические острые и хронические воспалительные патологии и многие другие заболевания, вплоть до настоящего времени не рассматриваемые как аутоиммунные, проявляют иммунный клеточно-опосредованный патогенный механизм. Активация иммунных воспалительных эффекторных реакций рассматривается большинством авторов как основанная на двух сигналах:
- Сигнал 1 включает триггерное действие рецептора клонального антигена (Т-клеточный рецепторный комплекс TCR-CD3), который распознает когнантный антиген, включенный в молекулы Главного Комплекса ГистоСовместимости (MHC = ГКГС). В бета-клетках внеклеточные растворимые или мембраносвязанные антигены сшивают клональный рецепторный комплекс Иммуноглобулин CD79 (Ig/CD79), доставляя сигнал 1 к секретирующей антитела популяции лимфоцитов.
- Второй сигнал, в дополнение к доставленному антигенами сигналу 1, требуется для того, чтобы избежать толерантность в результате анергии или клональной делеции. Сигнал 2 доставляется костимуляторами, такими как CD86, экспрессированными на поверхности профессиональных антиген-презентирующих клеток (APC), таких как моноциты человека и потомки линии их дифференцировки.
В генетически детерминированных иммунных воспалительных реакциях сигналы опасности промотируются микробиальными и самомодифицируемыми антигенами или митогенами, которые вызывают триггерное действие Образраспознающих Рецепторов (PRR). Пути передачи сигнала PRR, такие как через TLR4 (рецептор для липополисахарида или LPS клеточной стенки грам-отрицательных бактерий) доставляют экспрессию высоких уровней костимуляторных поверхностных молекул (т.е CD80 или CD86). В свою очередь, костимуляторные лиганды CD80-CD86 пришивают CD28 на поверхности Т-клеток-хелперов. Комбинация: сигнал 1 (т.е. сшивание анти-CD3 и антитела) плюс сигнал 2 (т.е. сшивание CD28 посредством специфических антител) экспериментально имитирует естественные условия протекания ярко выраженной воспалительной эффекторной иммунной реакции. Примечательно, что апробированные лекарственные средства, подавляющие иммунную систему, имеют некоторые нарушения правильности действия в ингибировании активации каскадов провоспалительных цитокинов в условиях высоких уровней костимуляции. Последние происходят в аутоиммунных заболеваниях и во многих других тяжелых острых и хронических воспалительных состояниях.
Антиген-презентирующие клетки (APC) являются не только важными в определении класса иммунной реакции для приобретенной иммунной системы, поскольку они сильно влияют на то, существует ли эффекторная (т.е. Т-клетка-хелпер, Th (тиенил), клеточная цитотоксичность, Th, образование антител, В-клетка) реакция или толерантная реакция (в результате анэргии или апоптоза), опосредованная клоном сенсибилизированных клеток. Антиген-презентирующие клетки (APC) также могут сами по себе доставлять эффекторные мгновенные иммунные реакции. Хорошо описанный в документации пример включает продуцирование и высвобождение высоких количеств Фактора Некроза Опухоли Альфа (TNF-альфа) моноцитами у раковых пациентов. У этих пациентов TNF-альфа промотирует усиленные реакцию и активацию эндотелия сосудов, сопровождаемые секрецией Интерлейкина 8 (IL-8) и других провоспалительных цитокинов, а также активных веществ-прокоагулянтов. В общей сложности TNF-альфа промотирует тромбоз и ишемию посредством некроза раковой опухоли, что и дало в результате первоначальное определение кахектин или TNF-альфа. Однако, TNF-альфа представляет собой плейотропный цитокин, участвующий во многих других болезненных состояниях. Существуют устоявшиеся представления того, что в моноцитах липополисахарид может вызывать секрецию громадных количеств TNF-альфа, который дает большой вклад в развитие септического шока. В последнее время продуцирование и секрецию неадекватно больших количеств TNF-альфа рассматривают как терапевтическую мишень в аутоиммунных воспалительных заболеваниях, таких как ревматоидный артрит, спондилоартропатии, болезнь Крона, увеит и псориаз. В связи с этим применение анти-TNF-альфа на текущий момент было широко рассмотрено в качестве стратегии современного состояния науки и техники с тем, чтобы справиться с теми заболеваниями, в которых снижение достижимых уровней биоактивного TNF-альфа могло бы внести свой вклад в улучшение состояния пациента.
В этом отношении, число заболеваний, которые могли бы быть побеждены посредством лечения антагонистами TNF-альфа, быстро растет и включает атеросклероз, метаболический синдром, энцефалит, вирусный гепатит, гломерулонефрит, неадекватную воспалительную реакцию на опухоли и септический шок, из числа нескольких прочих.
В дополнение к тому, что продуцируется некоторыми соматическими клетками, существует два главных источника продуцирования TNF-альфа, моноциотов и Т-лимфоцитов. В ходе приобретенной иммунной реакции экспозиция антиген-презентирующих клеток в отношении сигналов опасности в условиях провоспалительных инструктивных сценариев вызывает секрецию IL-12 р70 (гетеродимер, состоящий из фрагментов р35 и р40), являющегося последней костимуляторной молекулой, которая поляризует профиль секреции цитокина, обеспечиваемый активированными Th-клетками по Th-1-типу. Th1-клетки проявляют характерный цитокиновый профиль, в котором секреция интерферон-гамма (IFN-гамма) имеет bona fide (истинное) отображение. Эти клетки секретируют высокие количества и TNF-альфа также.
IFN-гамма, продуцированный Th1-клетками, промотирует многие эффекты, которые могут быть значимыми в понимании воспалительных заболеваний. С одной стороны, он дополнительно активирует моноциты и повышает уровень секреции TNF-альфа посредством данного стимула. С другой стороны, он промотирует более мощный путь передачи сигнала через рецепторы TNF-альфа. В общей сложности, IFN-гамма в дополнение к его собственным непосредственным эффектам, таким как противовирусная активность, повышает экспрессию MHC-II (Главный Комплекс Гистосовместимости) и вносит вклад в воспалительные процессы и в очаги повреждений посредством увеличения так и так сильных эффектов TNF-альфа.
Провоспалительный каскад, инициируемый продуцированием TNF-альфа в моноцитах или IFN-гамма и TNF-альфа в Th-1 клетках, становится амплифицированным через другие провоспалительные цитокиновые пути, такие как IL-8. IL-8, вопреки его подлинному названию, был описан как хемокин, продуцированный макрофагами и другими типами клеток, такими как эпителиальные клетки, и также он синтезируется эндотелиальными клетками и, в связи с этим, также называется CXCL8. Хотя нейтрофильные гранулоциты представляют собой основные клетки-мишени IL-8, существует сравнительно широкий ряд клеток (эндотелиальные клетки, макрофаги, тучные клетки, кератиноциты), тоже реагирующих на этот хемокин. Основной функцией IL-8 является индукция хемотаксиса в его клетках-мишенях (например, в нейтрофильных гранулоцитах). В нейтрофилах также индуцируется ряд клеточно-физиологических реакций, необходимых для миграции и для функции фагоцитоза его мишеней, например, увеличение внутриклеточного Са2+, экзоцитоз (например, высвобождение гистамина), окислительный всплеск. IL-8 может быть секретирован любыми клетками посредством TLR, которые участвуют в генетически детерминированной реакции. Основной функцией IL-8 является рекрутирование нейтрофилов для фагоцитоза антигена, который вызывает триггерное действие TLR образа антигена. В результате перемещения клеток-мишеней IL-8 в эндотелий и другие целевые ткани IL-8 оказывается, таким образом, вовлеченным в амплификацию и в исполнение многих патогенных ролей TNF-альфа, в дополнение к своей роли защиты организма.
Миграция и хоуминг лейкоцитов регулируются не только хемокинами и их рецепторами, но также рядом адгезивных молекул. Среди них селектин CD62L известен в качестве терапевтической мишени для предотвращения миграции лейкоцитов в лимфоузлы, и поэтому его расценивают как критерий классифицирования эффектов in vitro нестероидных противовоспалительных лекарственных средств (NSAID).
Многие молекулы фактора супрессии иммунного ответа и анти-TNF-альфа затрагивают нормальные иммунные механизмы защиты, так как они промотируют цитотоксические эффекты в отношении иммунных клеток или ингибируют пролиферативный механизм, которые лежат в основе клональной экспансии, предшествующей успешно протекающим эффекторным иммунным реакциям.
Учитывая важность TNF-альфа, секретированного межклеточным пространством (либо встроенные в цитоплазматическую мембрану, либо секретированные растворимые формы), было предпринято много усилий для разработки терапевтических средств, которые блокируют взаимодействие внеклеточного TNF-альфа как с TNF-рецептором I типа, так и/или TNF-рецептором II типа. Наиболее релевантные подходы представляли собой применение растворимого TNF-рецептора-приманки, который захватывает TNF-альфа и благодаря длительному времени диссоциации предотвращает провоспалительное взаимодействие лиганда с клеточными рецепторами.
Второй стратегией было получение гуманизированных антител против TNF-альфа человека, либо обычных, либо создаваемых в виде биспецифических одноцепочечных молекул, которые выявляют мишени также, как другие молекулы, релевантные в данном заболевании (т.е. анти-VEGF (ингибитор фактора роста эндотелия сосудов)/анти-TNF-альфа (ингибитор фактора некроза опухоли) в ревматоидном артрите). Несмотря на то, что молекулы, описанные выше, являются антагонистами TNF-альфа, они ограничивают свой механизм действия блокадой внеклеточного секретированного TNF-альфа.
Обширный, но не исчерпывающий перечень мишеней, которые управляют продуцированием и секрецией TNF-альфа, мог бы быть следующим: а) молекулы, управляющие транскрипциональной экспрессией TNF-альфа; b) молекулы, управляющие транспортировкой TNF-альфа-РНК от ядер к цитоплазме и сплайсингом РНК; с) молекулы, направляющие трансляцию TNF-альфа; d) молекулы, регулирующие стабильность TNF-альфа-мРНК; е) молекулы, направляющие везикулы Golgi к мембране, где закреплена поверхностная форма про-TNF-альфа; f) молекулы, такие как TNF-альфа-превращающий фермент (TACE), вовлеченные в секреторный шеддинг TNF-альфа и g) молекулы, регулирующие интернализацию поверхностной формы про-TNF-альфа и передачу его сигнала. Все они относятся к клеточным мишеням продуцирования и секреции TNF-альфа.
Несмотря на различные подходы к разработке терапевтических средств, которые блокируют продуцирование TNF-альфа, было бы весьма желательно найти новые лекарственные средства, которые селективно блокируют не только продуцирование TNF-альфа, но также продуцирование других ключевых провоспалительных цитокинов, например, IFN-гамма.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что соединения формулы (I) показали ряд очень интересных иммунных модулирующих эффектов, потенциально полезных для регулирования патогенеза (развития патологического процесса) острых и хронических воспалительных заболеваний и, следовательно, с возможными клиническими применениями. В частности, соединения, используемые в изобретении, были способны ингибировать продуцирование TNF-альфа мононуклеарными клетками периферической крови (PBMC) пациентов, страдающих от хронического воспалительного заболевания, такого как ревматоидный артрит, а также ингибировать секрецию IFN-гамма теми клетками после стимуляции Т-клеток. Кроме того, соединения формулы (I) были способны модулировать профили секреции хемокинов (т.е. IL-8) и регуляторных цитокинов (т.е. IL-10) при биологической реакции, и делать это дифференциальным способом в отношении здорового состояния и болезненного состояния. Все эти иммунные модулирующие эффекты соединений формулы (I) не были связаны ни с каким токсическим эффектом на мононуклеарные клетки из периферической крови, и, кроме того, активация и пролиферативная реакция после митогенной стимуляции не были модифицированы этими соединениями.
Комбинация, только в одной небольшой молекуле, ингибирующих эффектов в отношении нескольких провоспалительных цитокинов, таких как TNF-альфа и IFN-гамма, и возможности модулировать хемокин IL-8 и/или регуляторный цитокин IL-10, поскольку все они имеют важнейшее значение в патофизиологии системных и органоспецифических аутоиммунных нарушений, трансплантации, острых и хронических воспалительных заболеваний, некоторых метаболических и дегенеративных заболеваний и атеросклероза, дает возможность соединениям формулы (I) принадлежать к новой категории иммунных модуляторов для нацеливания на каскад провоспалительных/регуляторных цитокинов и хемокинов при различных потенциально репрограммирующихся уровнях клинической и терапевтической релевантности.
В значительной мере иммунные клетки являются малоподвижными, и поступают в органы для «инспектирования» тканей организма, которые подвергаются инфильтрации в воспаленных состояниях, где они концентрируются в очагах повреждения, распределенных в соответствии с активностью заболевания, с органами-мишенями и с распространением поражения. Поскольку соединения, используемые в изобретении, как ожидают, модулируют некоторый аспект патофизиологического процесса, то для охарактеризовывания ряда рецепторов, эффективности связывания, оккупации рецепторов и концентрации пробы лекарственного препарата может быть использовано изучение с получением изображений. С учетом свойств хоуминга для лейкоцитов обнаружение терапевтической мишени дает информацию и о локализации клеток-мишеней, и о центрах очагов повреждения.
Таким образом, соединения формулы (I) также можно применять в качестве биомаркеров для получения изображений (визуализации) при разработке лекарственных средств, в клинических испытаниях и в индивидуальном подборе лекарственного препарата, что позволяет обеспечить информацию не только о фармакокинетических свойствах, распределении и о дозировке, но также и о релевантных данных по характеристикам индивидуальных реакций в предклинических и клинических испытаниях. Последнее может приводить к определению валидированных, желательных, индивидуальных суррогатных биомаркеров, которые вводят в клиническом испытании для оценки конечных точек пациенту, который нуждается в такой прогностической и индивидуальной оценке эффективного количества соединения формулы (I) или его фармацевтической композиции, оптимизированного для технологии получения четкой биовизуализации, известной специалистам в данной области.
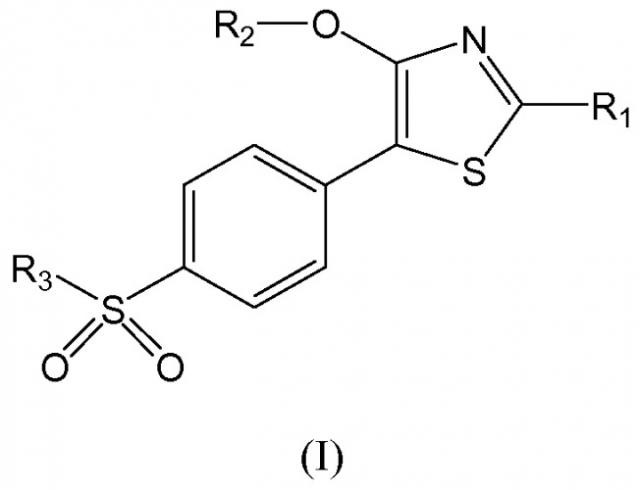
В соответствии с первым аспектом, настоящее изобретение относится к применению соединения формулы (I):
в которой
R1 выбирают из водорода, замещенного или незамещенного С1-С6 алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероциклила;
R2 выбирают из водорода, замещенного или незамещенного С1-С6 алкила, замещенного или незамещенного циклоалкила, и N(R'R''), где R' и R'' представляют собой независимо водород или С1-С6 алкил; и
R3 представляет собой С1-С6 алкильную радикальную группу,
или его фармацевтически приемлемой соли, пролекарства и/или сольвата, для получения лекарственного препарата для лечения острого или хронического воспалительного заболевания, путем ингибирования продуцирования по меньшей мере одного провоспалительного цитокина, выбранного из TNF-альфа и IFN-гамма, или путем иммуномодулирования хемокина IL-8 и/или регуляторного цитокина IL-10.
В конкретном аспекте изобретения острое или хроническое воспалительное заболевание выбирают из острого и хронического серопозитивного или серонегативного олигоартрита и полиартрита, спондилоартропатий, гломерулонефрита, колагенопатий, тубулоинтерстициального нефрита, метаболического синдрома, атеросклероза, остеоартрита, астмы, хронического обструктивного заболевания легких, интерстициальной легочной болезни, множественного склероза, демиелинизирующего заболевания, менингита, энцефалита, менингоэнцефалита, воспалительных радикулопатий и периферических невропатий, воспалительного заболевания кишечника, цирроза, гепатита, сердечной недостаточности, ишемического заболевания, почечной недостаточности, воспалительного цистита, доброкачественной гиперплазии предстательной железы, простатита, миокардита, перикардита, увеита, атопического дерматита, экземы, уртикарии, псориаза, розацеи, аллергического ринита, сепсиса, септического шока, мультиорганной недостаточности, системных аутоиммунных заболеваний, таких как системная эритематозная волчанка, васкулит, дерматомиозит, амилоидоз или саркоидоз, органоспецифических аутоиммунных заболеваний, таких как тяжелая псевдопаралитическая миастения, воспаление щитовидной железы или диабет 1 типа, трансплантации органов, инфекционного воспаления, вызванного опухолью после укуса муравья, TNF-альфа-зависимой целлюлярной дегенерации, некроза, апоптоза, реакции трансплантат-против-хозяина, кахексии и аутокринного и паракринного патологического роста клетки.
Такие терапевтические показания являются следствием по меньшей мере аномальной иммунной реакции, иммунной дисрегуляции, иммунного нарушения, иммунного патогенеза, иммунной терапии, иммунной супрессии или иммуномодулирующей биологической реакции.
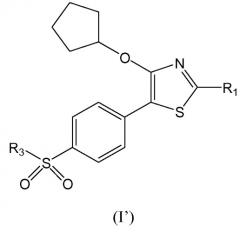
В другом аспекте настоящее изобретение относится к соединению формулы (I'):
в которой
R1 выбирают из водорода, замещенного или незамещенного С1-С6 алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероциклила; и
R3 представляет собой С1-С6 алкильный радикал,
или к его фармацевтически приемлемой соли, пролекарству и/или сольвату.
В третьем аспекте изобретение направлено на фармацевтическую композицию, содержащую соединение формулы (I'), которое определено выше, или его фармацевтически приемлемую соль, пролекарство или сольват, и по меньшей мере один фармацевтически приемлемый носитель, адъювант и/или разбавитель.
Другой аспект настоящего изобретения относится к соединению формулы (I'), которое определено выше, для его применения в качестве лекарственного средства.
Наконец, еще один аспект настоящего изобретения относится к применению соединения формулы (I), которое определено выше, в качестве биомаркера визуализации в технологиях получения визуализации и фармаковизуализации, для обнаружения иммунологических очагов повреждения, клеток-мишеней и молекул-мишеней.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлены различные флуоресцентные характеристики выбранных микрочастиц для разработки системы «Cytometric Bead Array» (CBA) для определения цитокинов и других аналитов в биологических жидкостях с использованием мультиплексных технологий анализа.
На фиг.2 показано влияние на продуцирование TNF-альфа в стимулированной липополисахаридом (LPS) культуре мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=10) соединения 12. Колонки представляют среднее значение и стандартную ошибку для дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого экспериментального условия.
На фиг.3 показано влияние на продуцирование TNF-альфа в стимулированной липополисахаридом (LPS) или комплексом Т-клеточный рецептор/поверхностные антигены Т-клетки (TCR/CD3+CD28) культуре мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=13) соединения 12. Колонки представляют среднее значение и стандартную ошибку для дуплицированных культур клеток, вычисленные в пробах в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого из различных экспериментальных условий.
На фиг.4 показано влияние на продуцирование TNF-альфа в культуре мононуклеарных клеток периферической крови (PBMC) от пациентов с ревматоидным артритом (n=7) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого из различных экспериментальных условий.
На фиг.5 показано влияние на продуцирование IFN-гамма в культуре мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=13) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для указанного экспериментального условия.
На фиг.6 показано влияние на продуцирование IFN-гамма в культуре мононуклеарных клеток периферической крови (PBMC) от пациентов с ревматоидным артритом (n=8) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого из различных экспериментальных условий.
На фиг.7 показано влияние на продуцирование IL-8 в культуре мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=13) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого экспериментального условия.
На фиг.8 показано влияние на продуцирование IL-8 в культуре мононуклеарных клеток периферической крови (PBMC) от пациентов с ревматоидным артритом (n=8) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя для каждого экспериментального условия.
На фиг.9 показано влияние на продуцирование IL-10 в культуре мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=13) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Статистические расхождения не были обнаружены.
На фиг.10 показано влияние на продуцирование IL-10 в культуре мононуклеарных клеток периферической крови (PBMC) от пациентов с ревматоидным артритом (n=8) соединения 12. Колонки представляют среднее значение и стандартную ошибку дуплицированных культур клеток, вычисленные для каждой пробы в различных экспериментальных условиях. Символы «звездочка» представляют статистически достоверную разницу (р<0,05) соответствующих данных в отношении разбавителя.
На фиг.11 показан эффект соединения 12 (а) и разбавителя (b) на пролиферативную реакцию культуры мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров (n=8) в присутствии и в отсутствие стимуляции посредством либо фитогемагглютинина (PHA), PHA плюс IL-2, либо комбинации анти-CD3 (Т3) и анти-CD28 моноклональных антител.
На фиг.12 показано действие соединения 12 на шеддинг CD62L в лимфоцитах (а) и моноцитах (b) культуры мононуклеарных клеток периферической крови (PBMC) от здоровых волонтеров.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения следующие термины имеют значение, подробно описанное ниже:
Термин «С1-6 алкил» относится к радикалу с линейной или разветвленной углеводородной цепью, состоящей из атомов углерода и водорода, не содержащей ненасыщенности, имеющей один-шесть атомов углерода, и которая присоединена к остальной части молекулы посредством одинарной связи, например, к метилу, этилу, н-пропилу, изопропилу, н-бутилу, трет-бутилу, н-пентилу, и т.д. С1-6 алкильные радикалы могут быть необязательно замещены одним или более заместителями, такими как циклоалкил, арил, гетероциклил, галоген, гидроксигруппа, алкоксигруппа, цианогруппа, аминогруппа, нитрогруппа или алкилтиогруппа.
Термин «циклоалкил» относится к стабильному 3-8-членному кольцевому радикалу, который насыщен или частично насыщен, и который состоит исключительно из атомов углерода и водорода, такому как циклогексил или циклопентил. Если не установлено конкретно иное в описании изобретения, термин «циклоалкил», как подразумевают, включает циклоалкильные радикалы, которые необязательно замещены по меньшей мере одним заместителем, независимо выбранным из группы, состоящей из водорода, С1-6 алкильного радикала, галогена, гидроксила, -N(R3)(R4), где R3 и R4 независимо выбирают из водорода и линейного или разветвленного С1-6 алкильного радикала.
Термин «арил» относится к стабильному 5-8-членному ароматическому кольцевому радикалу, который состоит исключительно из атомов углерода и водорода, такому как фенил или циклооктатетраен. Если не установлено специально иное в описании изобретения, термин «арил», как подразумевают, включает арильные радикалы, которые необязательно замещены по меньшей мере одним заместителем, независимо выбранным из группы, состоящей из водорода, С1-6 алкильного радикала, галогена, гидроксила, -N(R3)(R4), где R3 и R4 независимо выбирают из водорода и линейного или разветвленного С1-6 алкильного радикала.
Термин «гетероциклил» относится к стабильному 3-8-членному кольцевому радикалу, который состоит из атомов углерода и из одного-пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода, и серы. Для целей этого изобретения гетероциклил может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклилов включают пирролидин, пиридин, тиофен, фуран, и т.д., но не ограничиваются этим. Если не установлено конкретно иное в описании изобретения, термин «гетероциклил», как подразумевают, включает гетероциклильные радикалы, которые необязательно замещены по меньшей мере одним заместителем, независимо выбранным из группы, состоящей из водорода, С1-6 алкильного радикала, галогена, гидроксила, -N(R3)(R4), где R3 и R4 независимо выбирают из водорода и линейного или разветвленного С1-6 алкильного радикала.
Термин «галоген» относится к брому, хлору, йоду или фтору.
Термин «острый и хронический серопозитивный или серонегативный олигоартрит и полиартрит» относится к заболеваниям с воспалением синовиальной оболочки, захватывающим один или несколько диартродиальных суставов, либо с позитивным, либо с негативным ревматоидным фактором, включая ревматоидный артрит и как первичный, так и вторичный синдром Sjögren.
Термин «спондилоартропатии» относится к воспалительным заболеваниям, связанным с иммунопатологией главного комплекса гистосовместимости у человека, с вовлечением сакро-илеакальных суставов, и/или спинных, и/или периферических суставов, также включая увеит.
Термин «гломерулонефрит» относится к воспалительным очаговым повреждениям в клубочках почек.
Термин «тубуло-интерстициальный нефрит» относится к воспалительным заболеваниям, захватывающим канальцы и интерстициальную ткань почек.
Термин «колагенопатии» относится к системным воспалительным заболеваниям с иммунным развитием патологического процесса, включающим системную эриматозную волчанку (SLE), дерматомиозит и склеродермию.
Термин «воспалительное заболевание кишечника» относится к воспалительным заболеваниям желудочно-кишечного тракта с иммунным развитием патологического процесса, либо с системными признаками, либо без таковых, включающим болезнь Крона и неспецифический язвенный колит.
Термин «обструктивное заболевание легких» относится к бронхиальным заболеваниям либо с обратимым, либо с необратимым снижением объема выдоха (FEV), включающим астму и хроническое обструктивное заболевание легких.
Термин «интерстициальная легочная болезнь» относится к воспалительным заболеваниям, захватывающим интерстициальную ткань легких.
Термин «демиелинизирующие заболевания» относится к воспалительным заболеваниям центральной нервной системы с развитием иммуннопатологическим процессам, провоцирующим лизис миелина, включающим множественный склероз и оптический неврит.
Термин «менингит, энцефалит и менингоэнцефалит» относится к воспалительным заболеваниям оболочек головного мозга и/или других структур центральной нервной системы.
Термин «воспалительные радикулопатии и периферические невропатии» относится к воспалительным заболеваниям периферической нервной системы.
Термин «воспалительный цистит» относится к воспалительным заболеваниям мочевого пузыря.
Термин «доброкачественная гиперплазия предстательной железы» относится к незлокачественной гипертрофии и/или гиперплазии предстательной железы.
Термин «атопический дерматит, экзема и уртикария» относится к аллергическим заболеваниям кожи с развитием иммунопатологического процесса с вовлечением иммуноглобулина Е (IgE) или без вовлечения такового.
Термин «псориаз» относится к реакции гиперкератозной и эритематозной кожи с системным развитием иммунопатологического процесса.
Термин «розацеа» относится к обычному воспалительному состоянию кожи, характеризующемуся эритемой (быстрое изменение цвета и покраснение) в центральной части лица и на щеках, носу или лобной части, реже затрагивающей также шею и грудную клетку.
Термин «аллергический ринит» относится к интермиттирующим (также называемым как сезонные) или персистирующим (также называемым как длительные) воспалительным заболеваниям слизистой оболочки носа с развитием иммунопатологического процесса с реакцией гиперчувствительности.
Термин «сепсис, септический шок и мультиорганная недостаточность» относится к системным воспалительным заболеваниям, обусловленным аномальной иммунной реакцией на микробные агенты и другие этиологические факторы.
Термин «саркоидоз и амилоидоз» относится к идиопатическим иммунологическим заболеваниям с вовлечением в опухолевый процесс органов и/или с вовлечением в опухолевый процесс всего организма и с не вполне определенной этиологией, в которой может быть прослежена аномальная иммунная реакция.
Термин «органоспецифические аутоиммунные заболевания» относится к обусловленному иммунной системой очаговому повреждению органов с неопределенными этиологическими факторами, включающему миастению гравис, тироидит, гипофизит, адреналит и другие заболевания.
Термин «трансплантация органов» относится к предотвращению и лечению отторжения трансплантированных клеток, тканей и органов.
Термин «инфекционное и вызванное развитием опухоли воспаление» относится к аномальным иммунным реакциям, вторичным к микробным агентам или к стимулирующим развитие рака веществам.
Термин «TNF-альфа-зависимая целлюлярная дегенерация, апоптоз или некроз» относится к дегенерации ткани или к омертвению ткани, вызванной посредством TNF-альфа.
Термин «реакция трансплантат-против-хозяина» относится к воспалительным иммунным реакциям, вызванным трансплантированными клетками.
Термин «кахексия» относится к системной анорексии или к нарушению питания и к потере веса, вызванными воспалительными или неопластическими заболеваниями.
Термин «атеросклероз» относится к любому затвердеванию артерий, вторичному к атероме или к аккумулированию в стенках артерий, которые состоят из воспалительных клеток (в основном клетки-макрофаги), и к клеточному детриту, который содержит липиды.
Термин «ишемические заболевания» относится к очаговому повреждению органов, вторичному к сниженным оксигенации ткани и/или кровообращения, включающему сердечную и церебрально-васкулярную ишемию.
Термин «аутокринный и паракринный патологический рост клетки» относится к злокачественным и доброкачественным заболеваниям с использованием клеткой TNF-альфа в качестве цитокина, регулирующего фактор активации и пролиферации для клеток.
Если не указано иное, соединения, используемые в изобретении, как подразумевают, включают соединения, которые различаются только наличием одного или более изотопически обогащенных атомов. Например, соединения, имеющие настоящие структуры за исключением структур с замещением водорода дейтерием или тритием, или с замещением углерода 13С- или 14С-обогащенным углеродом или 15N-обогащенным азотом, находятся в пределах объема этого изобретения.
Термин «их фармацевтически приемлемые соли, сольваты или пролекарства» относятся к солям, сольватам или пролекарствам, которые при введении реципиенту могут обеспечивать (прямо или непрямо) соединение, такое как соединение, описанное в этом документе. Тем не менее, следует отметить, что фармацевтически неприемлемые соли также попадают в объем изобретения, так как они могут быть полезными в приготовлении фармацевтически приемлемых солей. Соли, пролекарства и производные могут быть приготовлены посредством способов, известных в существующем уровне техники. «Фармацевтически приемлемый» предпочтительно относится к молекулярным частицам и композициям, которые являются физиологически переносимыми и обычно не вызывают аллергической реакции или подобной нежелательной реакции, такой как желудочные расстройства, головокружение и тому подобное, при введении человеку или животному. Термин «фармацевтически приемлемый» означает, что оно (вещество) одобрено федеральным или государственным агентством по регулированию лекарственных средств и включено в фармакопею США или в другую общепризнанную фармакопею для применения на животных, и в большей степени на людях.
Например, фармацевтически приемлемые соли соединений, описанные ранее в этом документе, синтезируют из ранее описанного соединения, содержащего основное или кислотное звено, посредством общепринятых традиционных химических способов. Такие соли, как правило, получают, например, путем проведения реакции свободных кислотных или основных форм этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в смеси того и другого. Неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил, как правило, являются предпочтительными. Примеры солей присоединения кислоты включают соли присоединения минеральной кислоты, такие как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, например, и соли присоединения органической кислоты, такие как ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, соль или эфир яблочной кислоты (малат), манделат, метансульфонат и п-толуолсульфонат, например. Примеры солей присоединения основания включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и соли органических оснований, таких как этилендиам