Диэфирные пролекарства налмефена
Иллюстрации
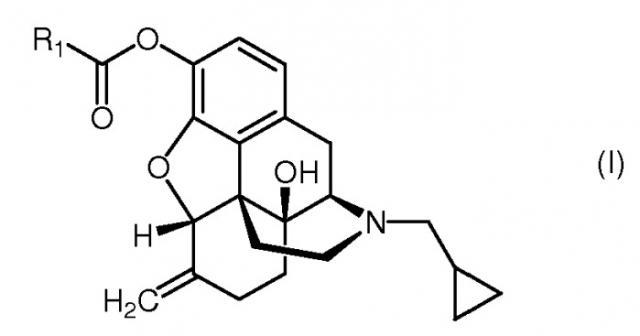
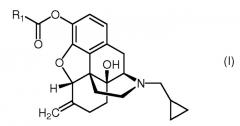
Показать всеНастоящее изобретение относится к новым соединениям, а именно пролекарствам налмефена формулы (I), где R1 обозначает C16-20алкилоксикарбонилC2-4алкил, а также к фармацевтическим композициям, включающим указанные соединения, и способу получения таких соединений. Указанные соединения обладают действием антагониста опиоидного рецептора и могут быть использованы при лечении расстройств, вызванных злоупотребления веществами, где указанные расстройства представляет собой расстройства такие как алкоголизм и алкогольную зависимость.
4 н. и 4 з.п. ф-лы, 1 табл., 2 пр., 1 ил.
Реферат
Настоящее изобретение относится к пролекарствам налмефена формулы (I), к фармацевтическим композициям, содержащим указанные соединения, к химическим способам получения таких соединений и к их применению при лечении расстройств, вызванных злоупотреблением веществами, таких как алкоголизм и алкогольная зависимость, и расстройств контроля над побуждениями, таких как патологическое увлечение азартными играми и шопомания.
Налмефен представляет собой антагонист опиоидного рецептора, который был доступен в течение нескольких лет как инъекционный препарат ревекс (Revex®), применяемый для реверсирования эффектов опиоидов и в случаях передозировки опиоидов. Налмефен также описан в литературе как препарат для лечения расстройств, вызванных злоупотреблением веществами, таких как алкогольная зависимость и алкоголизм, а также расстройств контроля над побуждениями, таких как патологическое увлечение азартными играми и шопономания. Согласно системе IUPAC он имеет следующее название: 17-циклопропилметил-4,5α-эпокси-6-метиленморфинан-3,14-диол и описывается указанной ниже структурой:
В Arch. Gen. Psychiatry, 56, 719-724 (1999) описывается исследование алкогольной зависимости с двойной слепой меткой и с контролем плацебо, где волонтеры принимали пероральные дозы налмефена по 20 или 80 мг ежедневно в течение 12 недель, для оценки безопасности и эффективности этого препарата.
В статье «Алкоголизм»: в Clinical and Experimental Research, 31, 1179-1187 (2007), описывается многоцентровое, рандомизированное исследование с двойной слепой меткой, проведенное на запущенных алкоголиках, которым было рекомендовано принимать перорально от 10 до 40 мг налмефена, когда они считали, что у них есть потребность в приеме алкоголя. Исследование показало, что налмефен, по всей видимости, является эффективным и безопасным препаратом для ослабления пьянства у запущенных алкоголиков.
В EP-0250796 описываются пролекарства на основе алифатического, ароматического, карбонатного, карбаматного и сульфонатного сложного эфира большого числа 3-гидроксиморфинанов, которые не имеют горького вкуса и, в этой связи, подходят для использования в режиме перорального введения, такого как буккальное, назальное или сублингвальное введение.
В WO-03/070191 описывается устройство для устойчивой к уплотнению трансдермальной доставки, используемое при лечении или профилактике боли, включающее опиоид. Описываемое устройство для доставки содержит также ацилопиоидный антагонист, который высвобождается, когда токсикоман трясет устройство, с тем чтобы извлечь опиоид из устройства для доставки. При этом опиоидный антагонист притупляет или подавляет эйфорические эффекты опиоида.
К сожалению, коммерчески используемые препараты налмефена создают терапевтически эффективные уровни в плазме крови лишь в течение ограниченного периода времени. Длительно действующие лекарственные формы налмефена могли бы быть полезными для терапевтических целей и способствовать соблюдению пациентом предписанной схемы лечения, что очень важно при лечении расстройств злоупотребления веществами и расстройств импульсивного контроля.
Авторы обнаружили, что пролекарственные формы налмефена формулы (I) обеспечивают поддержание терапевтически релевантных уровней налмефена в плазме крови в течение длительного периода времени. В том случае когда соединения формулы (I) вводятся внутримышечно, они могут обеспечивать поддержание терапевтически релевантных уровней налмефена в плазме крови в течение периода времени от нескольких недель до нескольких месяцев. А в том случае когда соединения формулы (I) вводятся перорально, они могут обеспечивать поддержание терапевтически релевантных уровней налмефена в плазме крови в течение нескольких дней.
Настоящее изобретение относится к соединению формулы (I)
включающему его любую стереохимически изомерную форму, где
R1 обозначает C16-20алкилоксикарбонилC2-4алкил;
или его фармацевтически приемлемую аддитивную соль кислоты или сольват.
В контексте настоящего описания действительны следующие определения:
- C2-4алкил обозначает линейноцепочечные и разветвленные насыщенные углеводородные радикалы, содержащие от 2 до 4 атомов углерода, такие как, например, этил, пропил, бутил, 1-метилэтил, 2-метилпропил и т.п.;
- C3алкил обозначает линейноцепочечные и разветвленные насыщенные углеводородные радикалы, содержащие 3 атома углерода, такие как, например, пропил или метилэтил;
- C16-20алкил обозначает линейноцепочечные и разветвленные насыщенные углеводородные радикалы, содержащие от 16 до 20 атомов углерода, такие как, например, гексадецил, гептадецил, октадецил, нонадецил, эйкозил и т.п.
Термин "стереохимически изомерные формы" в контексте настоящего описания обозначает все возможные изомерные формы, которые могут существовать у соединений формулы (I). Если особо не оговорено или конкретно не указано иное, химическое название соединений относится к смеси всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию. Стереохимически изомерные формы соединений формулы (I) вполне определенно входят в область настоящего изобретения.
Абсолютная стереохимическая конфигурация соединений формулы (I) и используемых при их изготовлении промежуточных соединений может быть без труда определена специалистами в данной области с помощью известных методов, таких как, например, дифракция рентгеновских лучей.
Указанные выше фармацевтически приемлемые кислотно-аддитивные соли включают, в контексте настоящего описания, терапевтически активные нетоксичные формы кислотно-аддитивной соли, которые способны образовать соединения формулы (I). Указанные фармацевтически приемлемые кислотно-аддитивные соли могут быть получены при обработке основной формы соединения подходящей кислотой. Подходящие для этого кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная или бромистоводородная кислота, серную, азотную, фосфорную и аналогичные кислоты; или органические кислоты, такие как, например, уксусная, пропаноевая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиоевая кислота), малоновая, янтарная (т.е. бутандиоевая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, пара-толуолсульфоновая, цикламовая, салициловая, пара-аминосалициловая, памоевая и другие кислоты.
И, наоборот, указанные солевые формы при обработке соответствующим основанием могут быть превращены в свою свободную основную форму.
Соединения формулы (I) могут существовать как в виде несольватированных, так и сольватированных форм. Термин «сольват» используется в настоящем описании для обозначения молекулярной ассоциации, включающей соединение по настоящему изобретению и одну или несколько молекул фармацевтически приемлемого растворителя, например, воды или этанола. Термин «гидрат» используется в тексте настоящего описания, когда указанный растворитель представляет собой воду.
Пролекарство представляет собой фармакологическое вещество (лекарственное средство), которое вводится в неактивной (или в значительно менее активной) форме. Будучи введенным, пролекарство метаболизируется in vivo до своей активной исходной лекарственной формы. Применение пролекарств зачастую полезно, поскольку в некоторых ситуациях их легче ввести в организм, чем исходное лекарственное средство. Они могут, например, демонстрировать биодоступность при пероральном введении, тогда как исходное средство такой способностью не обладает. Пролекарство может также иметь повышенную растворимость в составе фармацевтических композиций в сравнении с исходным лекарственным средством или может обладать улучшенными вкусовыми качествами или его удобнее ввести в состав композиции.
Настоящее изобретение, в одном варианте своего осуществления, относится к тем соединениям формулы (I), где применимы одно или несколько из указанных ниже ограничений:
а) R1 обозначает C18aлкилоксикарбонилC3aлкил; или
b) R1 обозначает н-октадецилоксикарбонилпропил.
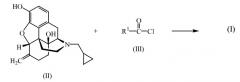
Соединения формулы (I) могут быть получены по известным методам этерификации при осуществлении реакции налмефена (II) с ацилгалогенидом формулы (III) в присутствии основания, с удалением кислоты, образующейся в ходе реакции. Заместитель R1 в ацилгалогениде формулы (III) определяется как C16-20aлкилоксикарбонилC2-4алкил.
Соединения по настоящему изобретению демонстрируют преимущества, определяемые тем, что они представляют собой длительно действующий антагонист опиоидного рецептора, которые применимы при лечении расстройств, вызванных злоупотреблением веществами, таких как алкоголизм и алкогольная зависимость, и расстройств контроля над побуждениями, таких как патологическое увлечение азартными играми и шопомания. Эта их способность может быть подтверждена, например, при измерении уровней содержания в плазме данных соединений после внутримышечного введения собакам, как описано в примере С.1.
Было также показано, что при пероральном введении пролекарственного соединения формулы (I) уровни содержания в плазме налмефена определяются в течение более чем 8 дней после введения пролекарственного соединения формулы (I), в сравнении с ситуацией, где пероральное введение налмефена как такового приводило лишь к нескольким часам такого выявления, как описано в примере С.2.
В этой связи соединения по настоящему изобретению дают возможность осуществлять введение с относительно длительными временными интервалами, такими как несколько дней, несколько недель, вплоть до нескольких месяцев, при этом фактическое время введения зависит от физической природы используемого соединения, способа введения, состава фармацевтической лекарственной формы и состояния субъекта, подлежащего лечению. Соответственно, соединения по настоящему изобретению позволяют осуществлять более эффективную терапию: пролонгированное высвобождение налмефена облегчает поддержание стабильной плазменной концентрации при наличии нетоксичного терапевтически эффективного уровня, а способ введения способствует соблюдение субъектом предписанной схемы лечения. Соответственно, соединения по настоящему изобретению могут использоваться в качестве лекарственного средства, характеризующегося замедленным высвобождением, или в качестве лекарственного средства пролонгированного действия.
Выражение, относящееся к «терапевтически релевантным» или «терапевтически эффективным» уровням содержания в плазме налмефена означает, что концентрация в плазме налмефена (свободного налмефена, который высвободился из пролекарственных соединений формулы (I) по настоящему изобретению) должна быть выше примерно 0,1 нг/мл.
В этой связи соединения формулы (I) по настоящему изобретению или их фармацевтически приемлемая аддитивная соль кислоты или сольват могут использоваться в качестве лекарственного средства, в частности, могут использоваться в качестве лекарственного средства, применяемого для лечения расстройств, вызванных злоупотреблением веществами, таких как алкогольная зависимость и алкоголизм, и расстройств импульсивного контроля, таких как патологическое увлечение азартными играми и шопомании. Кроме того, соединения формулы (I) по настоящему изобретению могут использоваться в качестве лекарственного средства, применяемого для ослабления потребности в алкоголе и его употребления у зависимых от алкоголя пациентов, а также для уменьшения приема алкоголя у зависимых пациентов.
Настоящее изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в производстве лекарственного средства, предназначенного для лечения расстройств злоупотребления веществами, таких как алкогольная зависимость и алкоголизм, и расстройств импульсивного контроля, таких как патологическое увлечение азартными играми и шопомания.
Кроме того, настоящее изобретение относится к способу лечения расстройств злоупотребления веществами или расстройств импульсивного контроля у субъекта-млекопитающего, где указанный способ включает введение такому млекопитающему при необходимости указанного лечения терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Расстройства злоупотребления веществами включают алкогольную зависимость и алкоголизм. Расстройства импульсивного контроля включают патологическое увлечение азартными играми и шопоманию.
Термины «лечение» и «терапия» в контексте настоящего описания обозначают лечебный, паллиативный и профилактический варианты лечения, которые включают реверсирование, облегчение, подавление прогрессирования или предупреждение развития заболевания, расстройства или состояния, к которым такой термин относится, или одного или нескольких симптомов такого заболевания, расстройства или состояния.
Дополнительно, настоящее изобретение относится к фармацевтическим композициям, включающим по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I).
Для целей получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения в форме свободного основания или аддитивной соли кислоты в качестве активного ингредиента объединяют при тщательном перемешивании по меньшей мере с одним фармацевтически приемлемым носителем, где указанный носитель может быть представлен в виде множества различных форм, в зависимости от формы желательного для введения препарата. В таком желательном варианте указанные фармацевтические композиции имеют стандартную лекарственную форму, подходящую предпочтительно для перорального введения, ректального введения, чрескожного введения или для парентерального введения инъекцией.
Так, например, при изготовлении композиций в виде пероральных лекарственных форм могут использоваться любые стандартные жидкие фармацевтические носители, такие как, например, вода, гликоли, масла, спирты и т.п., в случае изготовления жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые фармацевтические носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, средства, способствующие разложению, и т.п., в случае порошков, пилюль, капсул и таблеток. В связи с легкостью введения таблетки и капсулы представляют собой наиболее удобную пероральную стандартную лекарственную форму, и в этом случае, что очевидно, используются твердые фармацевтические носители. В случае парентеральных инъецируемых композиций используемый фармацевтический носитель может в основном включать стерильную воду, хотя в композицию могут быть включены и другие ингредиенты для повышения растворимости активного ингредиента. Инъецируемые растворы могут быть получены, например, при использовании фармацевтического носителя, который включает солевой раствор, раствор глюкозы или их смесь. Инъецируемые суспензии могут быть также получены при использовании соответствующих жидких носителей, суспендирующих агентов и т.п. В композициях, подходящих для чрескожного введения, указанный фармацевтический носитель может необязательно включать средство, усиливающее проникновение, и/или подходящий смачивающий агент, необязательно в сочетании с небольшими пропорциями подходящих добавок, которые не оказывают выраженного неблагоприятного эффекта на кожу. Такие добавки могут быть выбраны для того, чтобы сделать более удобным нанесение активного ингредиента на кожу и/или облегчить получение желательных композиций. Указанные местные композиции могут вводиться различными способами, такими как трансдермальный пластырь, пластырь спот-он или мазь. Аддитивные соли соединений формулы (I), в связи с их повышенной водорастворимостью относительно соответствующей формы основания, в большей мере подходят для изготовления водных композиций.
Это является особенно благоприятным свойством в процессе изготовления фармацевтических композиций по настоящему изобретению в стандартной лекарственной форме, в связи с легкостью введения и однородностью получаемой дозировки. Выражение «лекарственная стандартная форма» в контексте настоящего описания относится к физически дискретным единицам, подходящим в качестве стандартных дозировок, где каждая единица содержит заданное количество активного ингредиента, рассчитанного таким образом, чтобы это количество создавало желательный терапевтический эффект в сочетании с требуемым фармацевтическим носителем. Примеры таких лекарственных стандартных форм включают таблетки (в том числе таблетки с насечкой или с нанесенным на них покрытием), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии, мерные дозы, соответствующие чайной ложке, столовой ложке и т.п., а также их определенные сочетанные варианты.
Для целей перорального введения фармацевтические композиции по настоящему изобретению могут иметь вид твердых лекарственных форм, например, таблеток (как проглатываемых, так и жевательных таблеток), капсул или гель-капсул, получаемых традиционными способами, в сочетании с фармацевтически приемлемыми эксципиентами и носителями, такими как связующие вещества (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлоза и т.п.), наполнители (например, лактоза, микрокристаллическая целлюлоза, фосфат кальция и т.п.), смазывающие вещества (например, стеарат магния, тальк, силикагель и т.п.), средства, способствующие разложению (например, картофельный крахмал, натрий-крахмалгликолят и т.п.), смачивающие вещества (например, лаурилсульфат натрия) и т.п. Такие таблетки могут также содержать покрытие, нанесенное по известным в данной области способам.
Жидкие препараты для перорального введения могут иметь вид, например, растворов, сиропов или суспензий, или они могут быть изготовлены в виде сухого продукта, который впоследствии смешивается с водой и/или другим подходящим жидким носителем перед употреблением. Такие жидкие препараты могут быть получены стандартными способами, необязательно при использовании других фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или аравийская камедь), неводные носители (например, миндальное масло, сложные масляные эфиры или этиловый спирт), подсластители, вкусовые вещества, средства, улучшающие вкус, и консерванты (например, метил- или пропил-пара-гидроксибензоат или сорбиновая кислота).
Фармацевтически приемлемые подсластители, используемые в фармацевтических композициях по настоящему изобретению, предпочтительно включают по меньшей мере один подсластитель с интенсивным вкусом, такой как аспартам, калий-ацесульфам, натрий-цикламат, алитам, гидроксихалконовый подсластитель, монелин, стевиозид-сукралоза (4,1'6'-трихлор-4,1',6'-тридезоксигалактосахароза) или, предпочтительно, сахарин, натрий- или кальций-сахарин, и, необязательно, по меньшей мере один объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальтоза, глюкоза, гидрогенизированный глюкозный сироп, ксилит, карамель или мед. Подсластители с интенсивным вкусом традиционно используются в низких концентрациях. Так, например, в случае натрий-сахарина указанная концентрация может варьировать от примерно 0,04% до 0,1% (вес/объем) от готовой композиции. Объемный подсластитель может эффективно использоваться в более высоких концентрациях и варьировать от примерно 10% до примерно 35%, предпочтительно от примерно 10% до примерно 15% (вес/объем).
Фармацевтически приемлемые вкусовые вещества, которые могут маскировать ингредиенты с горьким вкусом в композициях с низкой дозой, предпочтительно включают вкусовые вещества на основе фруктов, такие как вкусовые вещества на основе вишни, малины, черной смородины или клубники. Сочетание двух вкусовых веществ может приводить к очень хорошим результатам. В композициях с высокой дозой могут потребоваться более сильные фармацевтически приемлемые вкусовые вещества, такие как карамель, шоколад, освежающая мята, фантазийные композиции и т.п. Каждое вкусовое вещество может присутствовать в готовой композиции в концентрации, варьирующей от примерно 0,05% до 1% (вес/объем). При этом с успехом используются сочетания указанных более сильных вкусовых веществ. Предпочтительно, используются вкусовые вещества, которые не подвергаются какому-либо изменению или не теряют свой вкус и/или цвет в условиях данной композиции.
Соединения формулы (I) могут быть изготовлены с получением композиции для парентерального введения путем инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например, инъекции болюсом или непрерывной внутривенной инфузии. Композиции для инъекции могут быть представлены в стандартной лекарственной форме, например, могут иметь вид ампул или многодозовых контейнеров, включающих добавленный в них консервант. Они могут иметь вид суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать включаемые при изготовлении композиций средства, такие как средства, способствующие поддержанию изотонических свойств, суспендирующие агенты, стабилизирующие средства и/или средства, способствующие диспергированию. В альтернативном варианте активный ингредиент может присутствовать в порошковой форме, которая впоследствии смешивается с подходящим носителем, например, стерильной, свободной от пирогенов водой, перед употреблением. Композиции для внутримышечного или подкожного введения представляют особый интерес. Такие фармацевтические композиции не должны вызывать выраженного раздражения тканей, или они вообще не должны вызывать раздражение тканей или воспаление в месте инъекции. Подходящие растворители включают, например, кунжутное масло или миглиол.
Соединения формулы (I) могут быть также изготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, которые, например, содержат стандартные основы для суппозиториев, такие как какао-масло и/или другие глицериды.
Экспериментальная часть
А. Синтез промежуточных продуктов
Пример А1
а) Получение промежуточного продукта (1)
Раствор 1-октадеканола (16,4 г, 60,6 ммоль), толуола (800 мл, 49 мл/г), глутаровой кислоты (80,1 г, 10 экв.) и пара-толуолсульфоновой кислоты (1,0 г, 0,1 экв.) нагревают до температуры 100°C в течение 16 часов. Реакционную смесь охлаждают до температуры окружающей среды и промывают водой. Органический слой сушат над сульфатом магния, фильтруют и концентрируют досуха с получением 21,5 г (92%) промежуточного продукта (1).
ЯМР:
1H-ЯМР (400 МГц, хлороформ-d) δ м.д. 0,90 (т, J=6,55 Гц, 3H), 1,19-1,41 (м, 30H), 1,59-1,68 (м, J=7,05, 7,05, 7,05, 7,05 Гц, 2H), 1,93-2,03 (м, J=7,05, 7,05, 7,05, 7,05 Гц, 2H), 2,41 (т, J=7,30 Гц, 2H), 2,45 (т, J=7,30 Гц, 2H), 4,09 (т, J=6,67 Гц, 2H), 9,57 (ушир.с, 1H).
b) Получение промежуточного продукта (2)
Тионилхлорид (8,8 мл, 2,0 экв.) добавляют по каплям к раствору промежуточного продукта (1) (23,3 г, 60,6 ммоль), толуола (233 мл, 10 мл/г) и триэтиламина (8,5 мл, 1,0 экв.) при температуре окружающей среды в инертной атмосфере. Смесь нагревают в течение 2 часов при температуре 80°C. После охлаждения до температуры окружающей среды соли отфильтровывают и промывают толуолом. Фильтрат концентрируют при выпаривании с получением 24,4 г (100%) промежуточного продукта (2), который сразу же используют на следующей стадии.
B. Синтез конечных соединений
Пример B.1
Раствор промежуточного продукта (2) (21,4 г, 1 экв.) в толуоле (200 мл, 10 мл/г) добавляют по каплям в течение 1,5 часа к суспензии гидрохлорида налмефена (20 г, 53,2 ммоль), толуола (200 мл, 10 мл/г) и триэтиламина (16,3 мл, 2,2 экв.). Реакционную смесь перемешивают при температуре окружающей среды в течение 16 часов. После этого ее промывают водой (400 мл, 20 мл/г). Водный слой экстрагируют дважды толуолом и затем отбрасывают. Объединенные органические слои выпаривают после их высушивания над сульфатом магния и фильтруют. Остаток растирают с метанолом (100 мл, 5 мл/г). Осадок фильтруют, промывают метанолом (100 мл, 5 мл/г) и сушат в течение 16 часов при температуре 50°C при пониженном давлении с получением 30,5 г (81%) соединения (1).
ЯМР:
1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,06-0,17 (м, 2H), 0,42-0,54 (м, 2H), 0,80-0,89 (м, 4H), 1,14-1,34 (м, 32H), 1,49-1,60 (м, 3H), 1,83-1,92 (м, J=7,30, 7,30, 7,30, 7,30 Гц, 2H), 1,97 (тд, J=11,90, 3,90 Гц, 1H), 2,07 (дт, J=13,53, 3,34, 3,02 Гц, 1H), 2,24 (тд, J=12,59, 5,04 Гц, 1H), 2,35 (т, J=6,04 Гц, 2H), 2,44 (т, J=7,30 Гц, 2H), 2,47-2,53 (м, 1H), 2,54-2,60 (м, 1H), 2,60 (т, J=7,18 Гц, 2H), 2,63-2,68 (м, 1H), 3,03 (дд, J=11,96, 6,67 Гц, 2H), 4,02 (т, J=6,55 Гц, 2H), 4,80 (д, J=1,26 Гц, 1H), 4,90 (с, 1H), 4,97 (с, 1H), 5,05 (д, J=1,01 Гц, 1H), 6,67 (д, J=8,31 Гц, 1H), 6,78 (д, J=8,31 Гц, 1H).
LC-MS:
HR-MS (ES+): Рассчитано для C44H68NO6 +: 706,5047. Найдено: 706,5034.
Элементный анализ:
Аналитически рассчитано для C44H67NO6 (%): C, 74,85; H, 9,57; N, 1,98. Найдено: C, 75,88; H, 10,13; N, 1,50.
| Таблица F-l: Готовые соединения | |
С.1 Фармакокинетические (ФК) исследования in vivo на собаках (в/м инъекция): плазменные уровни налмефена
Проводят однократную внутримышечную инъекцию налмефена, т.е. соединения (1), в концентрации 20 мг экв. налмефена/мл в кунжутном масле или в миглиоле трем собакам в дозе, равной 1 мг эквивалента налмефена/кг веса тела.
В качестве оцениваемого варианта сравнения используют композицию с быстрым высвобождением (IR) налмефена в концентрации 0,40 мг/мл в солевом растворе, путем внутримышечной инъекции (в/м) однократной дозы в количестве 0,02 мг эквивалента налмефена/кг веса тела.
Отбирают образцы крови в течение 27 дней в случае введения дозы композиции пролекарства и в течение 48 часов после введения дозы композиции с быстрым высвобождением налмефена. Образцы крови обрабатывают с получением плазмы. Далее указанные образцы плазмы анализируют по отдельности на наличие налмефена с использованием установленного LC-MS/MS-метода.
Анализ полученных фармакокинетических данных проводят на профилях индивидуальных концентраций плазмы по методу фармакокинетического анализа без компартментализации с использованием валидированного программного обеспечения WinNonlin (v. 4.0.1a).
Результаты:
Плазменные профили налмефена (нг/мл) после внутримышечного (в/м) введения дозы одной из пролекарственных форм соединений по настоящему изобретению или IR композиции налмефена показаны на фиг.1.
Плазменная концентрация налмефена определялась количественно в течение 27 дней после введения дозы соединения (1).
C.2. Фармакокинетические (ФК) исследования in vivo на собаках (пероральное введение): плазменные уровни налмефена
Дозы по 10 мг/кг или 20 мг/кг веса тела соединения формулы (I) или самого налмефена в растворе 20% HP-β-CD (гидроксипропил-β-циклодекстрины) вводили собакам перорально.
Образцы крови отбирали в течение 192 часов после перорального введения. Образцы крови обрабатывали с получением плазмы. Плазменные образцы анализировали по отдельности на наличие налмефена с использованием установленного LC-MS/MS-метода.
Концентрация налмефена в плазме определялась количественно в течение 192 часов после введения дозы соединения (1).
Описание чертежей
На фиг.1 показана плазменная концентрация налмефена (нг/мл), определяемая при измерении в течение 28-дневного периода после в/м введения композиции, содержащей налмефен или соединение (1).
1. Соединение формулы (I) где R1 обозначает C16-20алкилоксикарбонилC2-4алкил;или его фармацевтически приемлемая аддитивная соль кислоты.
2. Соединение по п.1, где R1 обозначает С18алкилоксикарбонилC3алкил.
3. Соединение по п.1, где указанное соединение представляет собой
4. Фармацевтическая композиция, обладающая действием антагониста опиоидного рецептора, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-3.
5. Способ получения фармацевтической композиции по п.4, отличающийся тем, что терапевтически активное количество соединения по любому из пп.1-3 тщательно перемешивают с фармацевтически приемлемым носителем.
6. Соединение по любому из пп.1-3, предназначенное для лечения расстройств, вызванных злоупотреблением веществами, где указанное расстройство представляет собой алкоголизм или алкогольную зависимость.
7. Соединение по любому из пп.1-3, предназначенное для ослабления потребности в алкоголе и для снижения употребления алкоголя зависимых от алкоголя пациентов.
8. Способ получения соединения формулы (I) по п.1 путем взаимодействия налмефена (II) с ацилгалогенидом формулы (III) R1 имеет значения, определенные в п.1, в присутствии основания, с удалением кислоты, высвобождаемой в ходе реакции или, в случае необходимости, путем превращения соединения формулы (I) в фармацевтически приемлемую кислотно-аддитивную соль или, наоборот, превращения кислотно-аддитивной соли соединения (I) в форму свободного основания с использованием щелочи.