Вакцина против пептида ch3 ige
Иллюстрации
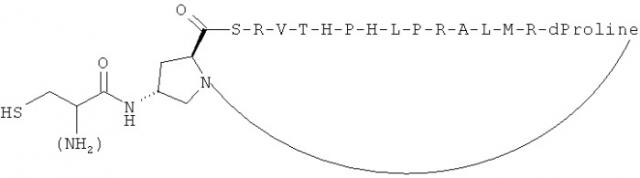
Показать всеИзобретение относится к области биотехнологии и медицины. Описан иммуноген, для индукции иммунного ответа на IgE. Иммуноген содержит по меньшей мере один антигенный пептид IgE, связанный с иммуногенным носителем. В качестве иммуногенных носителей могут быть использованы вирусоподобные частицы, выбранные из группы, состоящей из HBcAg, HBsAg и Qbeta VLP. Описаны также композиции и способ предупреждения, облегчения или лечения IgE-ассоциированного расстройства у индивидуума с использованием такого иммуногена. Предложенная группа изобретений может быть использована в медицине для лечения аллергических заболеваний. 10 н. и 10 з.п. ф-лы, 2 ил., 13 табл., 14 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к представлению новых иммуногенов, содержащих антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, для предупреждения, лечения или облегчения IgE-опосредованных расстройств. Изобретение также относится к способам изготовления этих лекарственных средств, их иммуногенных композиций и фармацевтических композиций и их применению в медицине.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В течение последних нескольких десятилетий число аллергических заболеваний увеличилось до почти эпидемических масштабов и расчеты показывают, что 20-30% от общей численности населения во многих западных странах подвержены этим заболеваниям. Ключевая роль, которую играет IgE в инициации аллергических ответов, убедительно подтверждена. После высвобождения из В-лимфоцитов IgE связывается с высокоаффинным рецептором IgE (FceRI), представленным на тучных клетках и базофилах. Последующее поперечное сшивание соседних молекул IgE на этих клетках специфическими аллергенами затем приводит к их активации, что приводит к высвобождению целого ряда провоспалительных медиаторов (например, гистамина, лейкотриенов, простагландинов), а также ключевых цитокинов и хемокинов. Таким образом, острые локальные ответы сопровождаются рекрутингом и активацией других воспалительных клеток (например, эозинофилов, Т-лимфоцитов), тем самым усиливая аллергический каскад. Дендритные клетки, например, присутствующие в участках аллергического воспаления (например, в легких), также могут экспрессировать FceR1 и могут использовать этот рецептор для селективного и эффективного связывания аллергенов, присутствующих в иммунных комплексах, c IgE и селективного процессинга этих аллергенов для представления аллерген-специфическим Т-клеткам, таким образом обеспечивая механизм постоянной активации Т-клеток и патологических воспалительных реакций.
Большинство современных схем лечения направлены на облегчение симптомов, а не лечение причины заболевания и основаны, главным образом, на применении антигистаминных препаратов, антилейкотриенов, кромогликатов, бета-агонистов и на общих противовоспалительных соединениях, таких как кортикостероиды. Хотя некоторые из подверженных этим заболеваниям пациентов относительно хорошо контролируют свое заболевание с помощью этих лекарственных препаратов, частота их приема (часто ежедневно или даже несколько раз в день) приводит к плохому соблюдению пациентом режима и схемы лечения и последующему ухудшению заболевания. Кроме того, в некоторых случаях, таких как тяжелая астма и тяжелый атопический дерматит, существующие способы лечения являются недостаточными для контроля заболевания.
Совсем недавно моноклональное антитело (омализумаб, также названный Е25, продаваемый под торговым наименованием Xolair®; Presta et al. J Immunol. 1993 Sep 1; 151 (5):2623-32) получило одобрение от нескольких агенств по всему свету, главным образом, для лечения тяжелой астмы и ринита. Несмотря на продемонстрированную эффективность против тяжелой астмы, это антитело все же имеет некоторые недостатки. Во-первых, оно представляет собой гуманизированное мышиное моноклональное антитело и, как таковое, полностью не предотвращает иммунологические реакции у пациентов-людей, таким образом, по-видимому, поднимая некоторые проблемы безопасности. Во-вторых, доза омализумаба, используемая для лечения тяжелой астмы, основана как на массе теле, так и на уровне циркулирующего свободного IgE. Пациентам, масса тела и циркулирующий свободный IgE которых отличаются от указанного диапазона, не рекомендуется использовать это лечение. Те пациенты, которых можно лечить, могут нуждаться в получении вплоть до трех подкожных инъекций один раз в две недели. Это сильно влияет на расходы на лечение (по оценкам варьирует от 15000 до 44000 американских долларов в год на одного пациента) у а также на качество жизни пациентов, затрудняя применение в качестве эснрвной стратегии для лечения аллергий.
Альтернативой для преодоления проблем высокой стоимости и частых введений является запуск нашей собственной иммунной системы для продукции терапевтических антител посредством вакцинации.
В ходе своих исследований предыдущие исследователи в области аллергии столкнулись с рядом обстоятельств и проблем, которые должны быть приняты во внимание при разработке новых способов лечения аллергии. Одна из наиболее опасных проблем относится к вовлечению перекрестного связывания IgE в высвобождении гистаминного сигнала. Наиболее часто случается, что образование антител против IgE во время активной вакцинации способно само по себе запускать высвобождение гистамина посредством поперечного сшивания соседних IgE-рецепторных комплексов в отсутствие аллергена. Это явление называется анафилактогенностью. Действительно, многие имеющиеся в продаже моноклональные антитела против IgE, которые обычно используются в анализах для выявления IgE, являются анафилактогенными и, следовательно, непригодны и потенциально опасны при введении пациенту. Поэтому для безопасности и эффективности при пассивном введении или при индукции вакциной, антитела должны связываться в области IgE, которая способна ингибировать активности IgE, но не является анафилактической сама по себе.
Была разгадана структура константных доменов СН3-СН4 человеческого IgE, взаимодействующих с альфа-субъединицей высокоаффинного рецептора IgE FceRI (Wurzburg BA et a. (2000) Immunity 13 (3) 375-85; Garman SC et al., (2000) Nature 20; 406 (6793):259-66). В предыдущей работе также определили ряд пептидов IgE или производных пептидов или мимеотопов, считающихся полезными для индукции неанафилактогенных антител против IgE (WO 1993/005810; WO 99/67293; WO 2004/058799, WO 9731948, WO 2000/25722, WO 05/075504, US 2002/0645525, US 2004/146504 и US 2006/062782; WO 00/050461, WO 02/34288 и WO 2003/092714; Chen et al. (2008) J. Immunologic. Meth. 333:10-23; Hellman Expert Rev. Vaccines 7 (2): 193-208 (2008)). Такие домены или пептиды lgE, как правило, связаны с носителями для увеличения их иммуногенности с целью подавления аутотолерантности к IgE у индивидуума.
Следовательно, желательно создать композицию, такую как антигенный пептид IgE или комбинация нескольких из них, связанных с иммуногенным носителем, и возможно вводимую с одним или более адъювантами, способными индуцировать эффективные неанафилактогенные анти-IgE антитела у индивидуума, способные в значительной степени снижать уровни циркулирующего свободного IgE. Повышенная эффективность, как правило, приводит к следующим преимуществам: более низкие дозы, необходимые для достижения клинически полезных результатов, более низкий объем инъекции, необходимый, например, для подкожного или внутримышечного введения (по сравнению, например, с терапиями с использованием моноклональных антител), более низкая стоимость лечения, повышенные шансы успешного лечения, уменьшенная частота введения в схеме лечения, обеспечение таким образом доступа к лечению более широкой популяции пациентов, включая пациентов с более высокой массой тела и/или высокими уровнями циркулирующего IgE, а также улучшение качества жизни пациентов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногену, содержащему антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем. Указанный антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. Указанный антигенный пептид IgE может быть модифицирован для целей конъюгирования, предпочтительно путем добавления остатков цистеина или лизина и/или добавления линкеров, таких как GC/GGC-линкеры. В предпочтительных воплощениях указанный антигенный пептид IgE является конформационно ограниченным, предпочтительно просто ограниченным. Указанный иммуногенный носитель представляет собой гетерологичный белок, предпочтительно вирусоподобную частицу (VLP), более предпочтительно VLP HBcAg, HBsAg или Qbeta. Изобретение также относится к способам получения такого антигенного пептида IgE, предпочтительно связанного с иммуногенным носителем.
Изобретение также относится к иммуногенным композициям, содержащим такой антигенный пептид IgE, предпочтительно связанный с иммуногенным носителемт предпочтительно к иммуногенным композициям, возможно содержащим адъювант, предпочтительно выбранный из группы, состоящей из квасцов; CpG-содержащих олигонуклеотидов, предпочтительно CpG7909 и CpG24555; и адъювантов на основе сапонина, предпочтительно Iscomatrix. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи.
Другой аспект изобретения относится к фармацевтическим композициям, содержащим антигенный пептид IgE в соответствии с изобретением или его иммуногенную композицию, а также к медицинским применениям таких композиций.
В частности, изобретение относится к антигенному пептиду IgE по изобретению или его иммуногенной или фармацевтической композиции для применения в качестве лекарственного стредства, предпочтительно для лечения, облегчения или профилактики IgE-опосредованных расстройств. Изобретение также относится к способам индукции иммунного ответа у индивидуума на собственный IgE и к способам лечения, облегчения или предупреждения IgE-опосредованных расстройств, включающим введение эффективного количества указанного антигенного пептида lgE или его иммуногенной или фармацевтической композиции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Структурное изображение взаимодействия между областью СН3-СН4 человеческого IgE с его высокоаффинным рецептором FceRI. Показаны 4 петли (синяя, пурпурная, оранжевая и желтая), соответствующие 4 пептидам с SEQ ID NO: 165, 312, 1 и 220, соответственно.
Фиг.2. Графические изображения пептидных форматов для индукции антительных ответов на структурно определенные эпитопы человеческого IgE.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и основные методы
Если иначе не определено в данной заявке, то научные и технические термины, используемые в связи с настоящим изобретением, имеют значения, которые обычно понятны специалистам в данной области. Как правило, номенклатура, используемая в этой связиу и методы клеточных и тканевых культур, молекулярной биологии, иммунологии, микробиологии,генетики и химии белка и нуклеиновых кислот и гибридизации, описанные в данной заявке, хорошо известны специалистам в данной области.
Способы и методы по настоящему изобретению, как правило, осуществляют в соответствии с традиционными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании, если не указано иное. См., например, Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и методы очистки осуществляют в соответствии с описаниями производителя, как обычно выполняется в данной области или как описано в данной заявке.
Номенклатура, используемая в этой связи, и лабораторные процедуры и методы аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанные в данной заявке, хорошо известны и широко используются в данной области.
Во всем этом описании и формуле изобретения будет понятно, что слово "содержат" или варианты, такие как "содержит" или "содержающий", означает включение установленного целого или группы целых, но не исключение любого другого целого или группы целых. Подразумевается, что термины "включающий", "состоящий из" и "состоящий по существу из" являются взаимозаменяемыми. Когда в данном описании используются термины, означающие единственное число, тогда они означают "по меньшей мере один" или "один или более", если не указано иное. Кроме того, если иное не предусмотрено контекстом, термины в единственном числе включают множества, и термины во множественном числе включают единственное число, если содержание ясно не диктует иное.
Все публикации, патенты и патентные заявки, процитированные в данном описаниит выше или ниже, включены в данную заявкупосредством ссылки во всей своей полноте.
Основные определения:
Термин "пептид" или "полипептид" относится к полимеру из аминокислот независимо от длины полимера, таким образом, пептиды, олигопептиды и белки включены в определение полипептида. Этот термин также не описывает и не исключает постэкспрессионные модификации полипептидов, например, полипептиды, которые включают ковалентное присоединение гликозильных групп, ацетильных групп, фосфатных групп, липидных групп и тому подобного, прямо охвачены термином полипептид. В определение также включены полипептиды, которые содержат один или более аналогов аминокислоты (включая, например, не встречающиеся в природе аминокислоты, аминокислоты, которые встречаются в природе только в неродственной биологической системе, модифицированные аминокислоты из систем млекопитающих и т.д.), полипептиды с замещенными связями, а также другие модификации, известные в данной области, как природные, так и неприродные.
Термин "выделенный белок", "выделенный полипептид" или "выделенный пептид" представляет собой белок, полипептид или пептид, который в силу своего происхождения или источника получения (1) не ассоциирован с естественно ассоциированными компонентами, которые сопровождают его в его нативном состоянии, (2) свободен от других белков того же вида, (3) экспрессируются клеткой из других видов или (4) не встречаются в природе. Таким образом, пептид, который химически синтезируют или синтезируют в клеточной системе, отличной от клетки, из которой он естественно происходит, будет "отделен" от его естественно ассоциированных компонентов. Белок также может оказаться по существу свободным от естественно ассоциированных компонентов благодаря выделению с использованием методов очистки белка, хорошо известных в данной области.
Используемый в данной заявке термин "очищенный", используемый в отношении молекулы (например, пептид, полипептид или белок), означает, что концентрация молекулы, которую очищают, была увеличена относительно молекул, ассоциированных с ним в его природном окружении или окружении, в котором его продуцируют, обнаруживают или синтезируют. Природно ассоциированные молекулы включают белки, нуклеиновые кислоты, липиды и сахара, но обычно не включают водуу буферы и реагенты, добавленные для поддержания целостности или облегчения очистки очищаемой молекулы.
В некоторых воплощениях соединение является по существу чистым или очищенным, когда оно по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 60% по массе свободно от органических молекул, с которыми оно ассоциировано в природе или с которыми оно ассоциировано в процессе изготовления. В некоторых воплощениях препарат состоит по меньшей мере из 70%, по меньшей мере из 75%, по меньшей мере из 90%, по меньшей мере из 95% или по меньшей мере из 99% по массе из интересующего компонента относительно его загрязнений.
По существу чистое или очищенное соединение может быть получено, например, посредством экстракции из природного источника (например, бактерий), посредством химического синтеза соединения или объединения очистки и химической модификации. По существу чистое или очищенное соединение также может быть получено, например, посредством обогащения образца, содержащего соединение, которое связывается с антителом, представляющим интерес. Чистоту можно измерить любым подходящим способом, например, посредством анализа хроматографии, масс-спектрометрии, высокоэффективной жидкостной хроматографии и т.д.
Термин "гетерологичный", используемый в данной заявке в контексте пептида или полипептида IgE, где полипептидный слитый белок IgE содержит пептид или полипептид IgE и "гетерологичный" полипептид, относится к полипептиду, отличному от пептида или полипептида IgE, например, полипептиду, который обычно не связан в природе с пептидом или полипептидом IgE. Например, гетерологичный полипептид не несет значительной идентичности аминокислотной последовательности с пептидом или полипептидом IgE, например, гетерологичный полипептид имеет менее чем примерно 50%, менее чем примерно 40%, менее чем примерно 30% или менее чем примерно 20% идентичности аминокислотной последовательности с пептидом или полипептидом IgE.
Используемый в данной заявке термин "IgE-опосредованное расстройство" или "IgE-ассоциированное расстройство" означает состояние или заболевание, которое характеризуется сверхпродукцией и/или гиперчувствительноетью к иммуноглобулину IgE. В частности, это можно истолковывать как включeниe состояний, ассоциированных с анафилактической гиперчувствительностью и атопическими аллергиями, включая, например: астму, аллергическую астму, аллергический ринит и конъюнктивит (сенную лихорадку), экзему, крапивницу, атопический дерматит и пищевые аллергии, включающие аллергию на арахис. Серьезное физиологическое состояние анафилактического шока, вызванного, например, укусами пчел, укусами змей, пищей или лекарственным препаратом, также входят в объем этого термина. Другие IgE-опосредованные расстройства включают анафилаксию, контактный дерматит, аллергическую гастроэнтеропатию, аллергический легочный аспергиллез, аллергическую пурпуру, экзему, гипер-IgE синдром (Джоба), анафилактическую гиперчувствительность, IgE миелому, воспалительное заболевание кишечника (например, болезнь Крона, неспецифический язвенный колит, неопределенный колит и инфекционный колит), крапивницу и псориаз.
Антигенный пептид IgE по изобретению
Настоящее изобретение относится к пептидам IgE и пептидам, полученным из них, которые были идентифицированы в виде участков СН3 домена IgE, способных образовывать петли, участвующие во взаимодействии СН3-СН4 области с его высокоаффинным рецептором FceRI (см. Фиг.1). Было показано, что такие пептиды IgE являются иммуногенными и неанафилактогенными.
Такие антигенные пептиды IgE могут быть использованы отдельно или в комбинации, предпочтительно, когда они конъюгированы с иммуногенным носителем, для индукции аутоантител против IgE у субъекта для лечения, предупреждения или облегчения IgE-ассоциированных расстройств.
В частности, настоящее изобретение относится к иммуногену, состоящему из, состоящему по существу из или содержащему антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем.
В одном из воплощений антигенный пептид IgE по изобретению состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 1-430. В другом воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID-NO: 1-153, и его функционально" активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 1-153. В другом воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 154-219. В еще одном воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 220-310. В еще одном воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 311-430.
Термин "антигенный пептид IgE" в пределах значения настоящего изобретения включает все СН3-производные пептиды IgE, предпочтительно из видов млекопитающих, более предпочтительно из человека, а также их варианты, аналоги, ортологи, гомологи и производные, а также их фрагменты, которые демонстрируют "биологическую активность антигенного пептида IgE". Предпочтительно, термин "антигенный пептид IgE" относится к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-430, а также к их вариантам, гомологам и производным, демонстрирующим по существу такую же биологическую активность. Более предпочтительно, термин "антигенный пептид IgE" относится к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID 1-430, более предпочтительно к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220-430.
В воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152 и 153. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 88, 89, 90, 91, 92, 93, 94, 95, 96, 99, 100, 101, 102, 103, 104, 105, 106, 109, 110, 111, 112, 113, 114, 115, 118, 119, 120, 121, 122, 123, 126, 127, 128, 129, 130, 133, 134, 135, 136, 139, 140, 141, 144, 145 и 148. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 49, 50, 51, 52, 53, 54, 55, 56, 57, 63, 64, 65, 66, 67, 68, 69, 70, 76, 77, 78, 79, 80, 81, 82, 88, 89, 90, 91, 92, 93, 99, 100, 101, 102, 103, 109, 110, 111, 112, 118, 119, 120, 126, 127, 133 и 139. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 18, 19, 20, 21, 22, 23, 24, 25, 34, 35, 36, 37, 38, 39, 40, 49, 50, 51, 52, 53, 54, 63, 64, 65, 66, 67, 76, 77, 78, 79, 88, 89, 90, 99, 100, 101 и 109. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 18, 19, 20, 21, 22, 34, 35, 36, 37, 49, 50, 51, 63, 64 и 76. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 18, 19 и 34. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 1 или 18.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218 и 219. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 165, 166, 167, 168, 169, 170, 171, 172, 175, 176, 177, 178, 179, 180, 181, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 199, 200, 201, 202, 205, 206, 207, 210, 211, 214 и 217. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 165, 166, 167, 168, 169, 175, 176, 177, 178, 184, 185, 186, 192, 193, 199 и 200. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 165, 166 и 175. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 154 или 165.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 2597 2607 2667 267, 268, 269, 275, 276, 277, 283, 284 и 290. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 220 или 233.
В еще одном воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410, 411, 412, 413, 416, 417, 418, 421, 422 и 425. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312 и 326. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 311 или 312.
Термин "биологическая активность антигенного пептида IgE", используемый в данной заявке, относится к способности антигенных пептидов IgE по изобретению индуцировать аутоантитела против IgE у пациента с антагонистическим профилем, где такие аутоантитела способны снижать уровень циркулирующего свободного IgE, не вызывая какого-либо существенного IgE-опосредованного высвобождения воспалительных медиаторов, и в то же время по существу не способны связываться с IgE, связанным с его высокоаффинным рецептором. Специалисту в данной области очевидно, какие методы можно использовать для подтверждения того, находится ли конкретная конструкция в пределах объема настоящего изобретения. Такие методы включают, но не ограничиваются этим, методы, описанные в разделе примеров настоящей заявки, а также следующие. Предполагаемый пептид может быть проанализирован для выяснения иммуногенности конструкции в том смысле, что антисыворотки, индуцированные предполагаемым пептидом, перекрестно реагируют с нативной молекулой IgE, а также являются функциональными в блокировании высвобождения аллергического медиатора из аллергических эффекторных клеток.
Специфичность этих реакций можно подтвердить функциональными анализами, где снижение IgE можно определить количественно и/или по ингибированию дегрануляции клеток, экспрессирующих рецептор IgE, или в экспериментах с конкуренцией по блокированию активности антисыворотки самим пептидом или нативным IgE, и/или специфическими моноклональными антителами, которые, как известно, связываются с эпитопом в IgE. Методы, устанавливающие связывание с IgE-FcRI, хорошо известны специалистам в данной области.
В воплощении антигенные пептиды IgE по настоящему изобретению имеют такой размер, что они имитируют область, выбранную из целого домена IgE, в котором находится нативный эпитоп.В конкретном воплощении антигенные пептиды IgE по изобретению имеют длину менее 100 аминокислот, предпочтительно менее 75 аминокислот, более предпочтительно менее 50 аминокислот, еще более предпочтительно менее 40 аминокислот. Антигенные пептиды IgE по изобретению обычно имеют длину 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот, предпочтительно от 4 до 20 аминокислот, например, 6-12 или 6-9 аминокислот.
Конкретные примеры антигенных пептидов IgE по изобретению представлены в перечне последовательностей и включают пептиды, длина которых варьируется от 4 до 20 аминокислот.
Антигенные пептиды по изобретению включают аминокислотную последовательность, происходящую из участка человеческого СН3 IgE, где такой производный участок человеческого СН3 либо соответствует аминокислотной последовательности природного IgE, либо соответствует варианту IgE, т.е. аминокислотной последовательности природного IgE, в которой небольшое число аминокислот было замещено, добавлено или делетировано, но которая сохраняют по существу те же иммунологические свойства. Кроме того, такой производный участок СН3 IgE может быть дополнительно модифицирован аминокислотами, особенно на N- и С-концах, для обеспечения конформационного ограничения антигенного пептида IgE и/или обеспечения сочетания антигенного пептида IgE с иммуногенным носителем после проведения соответствующей химии.
Антигенные пептиды IgE по настоящему изобретению охватывают функционально активные вариантные пептиды, происходящие из аминокислотной последовательности СН3 IgE, в которой аминокислоты были делегированы, встроены или замещены без существенного уменьшения их иммунологических свойств, т.е. такие функционально активные вариантные пептиды сохраняют существенную биологическую активность антигенного пептида IgE. Как правило, такие функционально активные вариантные пептиды имеют аминокислотную последовательность, гомологичную, предпочтительно высокогомологичную, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220-430.
В одном из воплощений такие функционально активные вариантные пептиды демонстрируют по меньшей мере 60%-, 65%-, 70%-, 75%-, 80%-, 85%-, 90%- или 95%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 220-430.
Сходство последовательностей для полипептидов, которую также называют идентичностью последовательностей, как правило, измеряют с использованием программного обеспечения для анализа последовательностей. Программное обеспечение для белкового анализа сравнивает сходные последовательности с использованием критериев сходства, определенных для различных замен, делеций и других модификаций, включая консервативные аминокислотные замены. Например, GCG содержит такие программы, как "Gap" и "Bestfit", которые могут быть использованы с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды из различных видов организмов, или между белком дикого типа и его мутеином. См., например, GCG версию 6.1. Полипептидные последовательности также можно сравнивать с помощью FASTA с использованием стандартных или рекомендованных параметров, программа в GCG версии 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивание и процент идентичности областей последовательностей с наилучшим перекрыванием между заданной и поисковой последовательностями (Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000)). Альтернативный алгоритм при сравнении последовательности по изобретению с базой данных, содержащей большое число последовательностей из различных организмов, представляет собой компьютерную программу BLAST, особенно blastp или tbiastn. с использованием параметров по умолчанию. См., например, Altschul et al., J. Mol. Biol. 215:403-410 (1990); Altschul et al., Nucleic Acids Res. 25:3389-402 (1997).
Функционально активные варианты содержат природные функционально активные варианты, такие как аллельные варианты и видовые варианты и неприродные функциона