Композиции для лечения воспалительного состояния кишечника
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению популяции Tr1 клеток человека, направленных против пищевого антигена из обычного рациона человека, и может быть использовано в медицине. Выделяют популяцию Tr1 клеток, направленных против пищевого антигена из обычного рациона человека и имеющих в состоянии покоя фенотип CD4+CD25-FoxP3-. Полученную популяцию Tr1 клеток в комбинации с одним или несколькими фармацевтически приемлемыми носителями, либо в комбинации с одним или более фармацевтическим средством, применяемым для лечения воспалительных состояний кишечника и выбираемым из группы, включающей анти-TNF, натализумаб, анти-IL1, анти-IL-6, анти-IL-12, анти-IL-17 и анти-IL-23, аналоги антагониста рецептора IL-1,5 аминосалициловую кислоту и ее аналоги, кортикоиды, пробиотики, метотрексат, азатиоприн, 6-меркаптопурин, талидомид, лефлуномид, используют в составе фармацевтических композиций для лечения воспалительных состояний кишечника. Изобретение позволяет получить эффективное средство для лечения воспалительных состояний кишечника. 3 н. и 12 з.п. ф-лы, 8 ил., 1 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к области лечения воспалительного состояния кишечника. Изобретение в частности относится к способам лечения воспалительных заболеваний кишечника и кишечного воспаления, связанного с пищевой непереносимостью или аллергией, с помощью медикамента, включающего человеческие Тr1 клетки, направленные против пищевого антигена из обычного рациона человека.
Уровень техники
Термин «воспалительное состояние кишечника», как применяется здесь, относится к воспалительному заболеванию кишечника и воспалению, связанному с пищевой непереносимостью или аллергией.
Воспалительное заболевание кишечника (ВЗК) относится к группе заболеваний, включающей болезнь Крона и язвенный колит. Эти два заболевания часто объединяют вместе из-за сходного патогенеза и клинических проявлений. При отсутствии инвазивных исследований для получения изображения невозможно различить эти два заболевания, которые часто рассматриваются как одно заболевание в ряде публикаций и исследований. Окончательный диагноз того и другого заболевания требует таких исследований для получения изображения, как эндоскопия (сигмоидоскопия или колоноскопия), ирригоскопия с двойным контрастированием и компьютерная томография (КТ), объединенных с лабораторными анализами, включающими полный анализ крови для выявления повышенных уровней лейкоцитов, определение скорости осаждения эритроцитов и концентрации сывороточного альбумина.
Оба заболевания являются хроническими, рецидивирующими/ремитирующими воспалительными заболеваниями желудочно-кишечного тракта. Участками желудочно-кишечного тракта, наиболее часто поражаемыми при болезни Крона, являются тонкий кишечник и толстый кишечник, также называемый толстой кишкой, включая прямую кишку; однако при болезни Крона может поражаться весь желудочно-кишечный тракт от рта до анального отверстия. Могут присутствовать единичные или множественные участки воспаления. При язвенном колите поражается только толстая кишка. Воспаления и изъязвление при язвенном колите ограничено слизистым и подслизистым слоем, двумя самыми внутренними слоями из четырех слоев толстого кишечника. Воспаление и изъязвление при болезни Крона может распространяться на все слои стенки кишечника, как в тонком, так и в толстом кишечнике. Общие симптомы заболеваний включают диарею, боль в животе, кровотечение из прямой кишки и потерю веса. Осложнения болезни Крона включают кишечные абсцессы, свищи, нарушение прохождения из одной части кишечника в другую с прохождением жидкостей или секретов, и непроходимость кишечника. Обычно течение обоих заболеваний является перемежающимся, с обострениями заболевания, сопровождающимися периодами ремиссии. Однако язвенный колит может быть единичным событием или длительным с неослабевающими симптомами.
Хотя имеется много вариантов выбора для терапевтических вмешательств при ВЗК, многие из них обладают нежелательными побочными эффектами, что делает их менее подходящими для лечения хронического заболевания. При умеренном язвенном колите первой линией лечения типично являются перорально или местно (т.е. клизмой) доставляемые аминосалицилаты. Класс аминосалицилатов состоит из агентов, содержащих 5-аминосалициловую кислоту (5-АСА), одно из самых старых противовоспалительных соединений, применяющихся при ВЗК. Применяемые в высоких дозах 5-АСА могут вызвать ремиссию при острых приступах. Хотя 5-АСА обычно применяют для поддерживающей терапии, не было продемонстрировано, что они являются эффективными для поддержания ремиссии. Обычно применяемые рецептуры 5-АСА включают сульфасалазин, пероральный и местный мезаламин, ольсалазин и балсалазид. Различные рецептуры модифицированы для обеспечения доступного активного лекарственного средства для интересующего участка (например, тонкого или толстого кишечника). Однако побочные эффекты для 5-АСА не являются редкими.
Кортикостероиды относятся к наиболее эффективным агентам для индукции ремиссии при приступах ВЗК и обычно являются вторым терапевтическим вариантом при неудачном лечении с 5-АСА. Соединения доставляют в первую очередь перорально или ректально, с сопутствующим применением 5-АСА или без него. При неудачной пероральной доставке соединения применяют внутривенно. В идеале кортикостероиды применяют только в течение короткого курса лечения и постепенно снижают при ремиссии заболевания. Кортикостероиды, обычно применяемые для лечения ВЗК, включают преднизон, будесонид и гидрокортизон. Применение кортикостероидов ограничено рядом тяжелых и существенных побочных эффектов, связанных с их использованием. Обычные побочные эффекты при кратковременном применении включают бессонницу, ночную испарину, изменения настроения и нарушенный метаболизм глюкозы. Длительная поддерживающая терапия обычно откладывается только для тяжелых, невосприимчивых случаев. Длительная терапия может вести к атрофии надпочечников, в то время как резкое прекращение может вызывать недостаточность надпочечников, гипотензию и даже смерть. Другие побочные эффекты включают угревую сыпь, аномальное отложение жира, избыточный рост волос и остеопороз. При болезни Крона кортикостероиды могут нарушать заживление свища, обостряя болезненное состояние.
Индивидуумам, отвечающим на пероральные или ректальные кортикостероиды, часто назначают поддерживающую дозу 5-АСА. Однако некоторые врачи не обеспечивают фармакологические вмешательства во время периодов ремиссии. Индивидуумы, которым необходима терапия внутривенными кортикостероидами, обычно поддерживаются такими иммуносупрессивными агентами, как 6-меркаптопурин и/или азатиоприн, в комбинации с 5-АСА. При таком тяжелом заболевании обычно назначают парентеральное питание. Когда пациент не отвечает на вышеуказанные виды терапии, может применяться иммуносупрессант циклоспорин, чтобы попытаться избежать хирургического вмешательства для удаления отрезка пораженной кишки. Иммуносупрессивное вмешательство не лишено побочных эффектов. 6-Меркаптопурин и азатиоприн могут вызывать жар, сыпь, тошноту и головную боль, с более тяжелыми побочными эффектами, включающими лейкопению, панкреатит, тяжелые инфекции и супрессию костного мозга. Циклоспорин может оказывать более тяжелые побочные эффекты, включая парестезии (аномальные ощущения, такие как чувство жжения или покалывания), избыточный рост волос, гипертензию, тремор, почечную недостаточность, головную боль и оппортунистические инфекции.
Антибиотики, обычно ципрофлоксацин или метронидазол, применяют в качестве дополнения к терапии 5-АСА или кортикостероидами, особенно у пациентов со свищами или заболеванием толстой кишки. Как и при других видах терапии, при долговременном лечении антибиотиками имеются побочные эффекты.
Инфликсимаб и адалимумаб в настоящее время являются последним средством фармакотерапии воспалительных заболеваний кишечника. Инфликсимаб является химерным моноклональным антителом, состоящим из 75% человеческого и 25% мышиного белка, в то время как адалимумаб является полностью гуманизированным антителом. Инфликсимаб и адалимумаб являются ингибиторами фактора некроза опухоли-альфа (ФНО-α), мощного воспалительного цитокина. Лекарство действует как акцептор, связывающий как растворимый, так и мембранно-связанный ФНО-α. Путем ингибирования активатора, высоко активного в воспалительном каскаде, можно ингибировать ряд воспалительных путей. Лекарственное средство применяют внутривенно в начале лечения и далее в качестве поддерживающего лекарственного средства каждые восемь недель, как указано на этикетке продукта. Однако, поскольку он является биологическим агентом, иммунный ответ может ограничивать пользу лекарственного средства.
Таким образом, иммуносупрессивные агенты обычно назначают вместе с поддерживающей терапией инфликсимабом. Как и у всех других видов лечения воспалительных заболеваний кишечника, у инфликсимаба имеются существенные побочные эффекты. ФНО-α играет важную роль в удалении неопластических клеток; таким образом, его супрессия может вести к оппортунистическим инфекциям, новообразованиям и другим осложнениям, в особенности при долговременной стратегии.
Хирургические вмешательства являются способом обработки при воспалительных заболеваниях кишечника, но не способом излечения. Из-за хронической природы ВЗК и относительно раннего возраста проявления, могут требоваться множественные вмешательства на протяжении жизни пациентов, не отвечающих на фармакологические вмешательства. Удаление коротких участков кишечника возможно без существенных побочных эффектов. Однако удаление больших или многочисленных сегментов кишечника может привести к синдрому короткого кишечника, при котором индивидуумы неспособны абсорбировать питательные вещества. Удаление частей толстого кишечника может приводить к необходимости колостомии или других дополнительных хирургических процедур. Таким образом, хирургия не является предпочтительным способом лечения воспалительных заболеваний кишечника. Хирургические вмешательства для лечения воспалительных заболеваний кишечника могут приводить к другому заболеванию. При полном удалении толстой кишки хирургом может быть сконструирован карман подвздошной кишки из тонкого кишечника, чтобы обеспечить выведение кала через анальное отверстие, не требующее постоянной стомы. Паучит является неспецифическим воспалением кармана подвздошной кишки, обычно развивающимся в пределах первых двух лет после реконструкции. Симптомы включают постоянно возрастающую частоту стула, которая может сопровождаться недержанием, кровотечением, жаром и/или ощущением позыва. У тех, кто страдает язвенным колитом, примерно у 20-30 процентов отмечается, по крайней мере, один эпизод. Антибиотики могут быть достаточными для лечения паучита; однако требуются другие более агрессивные виды лечения, подобные применяемым при ВЗК.
Среди недавних новых терапевтических подходов к лечению воспалительных заболеваний кишечника, W02007/027132 раскрывает способ лечения указанных заболеваний, включающий применение регуляторных CD4+CD25+Т-клеток, собранных из сигнальных лимфоузлов пациента и выращенных in vitro.
Другой тип воспалительного состояния кишечника обусловлен пищевой непереносимостью или аллергией. Люди часто страдают от более или менее тяжелых аллергических реакций или реакций непереносимости после потребления пищевых белков. Распространенность пищевой аллергии или непереносимости составляет примерно 1-2% у взрослых и 6-8% у детей. Пищевая аллергия или непереносимость главным образом связана с ограниченным диапазоном пищевых продуктов, главным образом с арахисом, древесными орехами, куриными яйцами, коровьим молоком, пшеницей (глютеном), соей, рыбой и моллюсками.
На сегодняшний день нет эффективного лечения пищевой аллергии или непереносимости. Большинство индивидуумов, страдающих аллергией или непереносимостью, приспосабливаются к своему положению, избегая потребления продуктов питания, к которым у них развита аллергия или непереносимость. Виды лечения, включающие лекарственные средства, такие как антигистаминные средства, деконгестанты или стероиды, являются доступными, но противодействуют только симптомам непереносимости или аллергической реакции. Они не предотвращают новые аллергические реакции или новые реакции непереносимости при дальнейшем воздействии аллергена или пищевых белков.
Таким образом, в настоящем изобретении Заявитель ставит целью обеспечение лечения воспалительного состояния кишечника на основе применения Тr1 клеток, которые отличаются от регуляторных CD4+CD25+Т-клеток.
Groux et al. (Nature 1997, 389: 737-742) описывает, что перенос антиген(овальбумин)-специфических Тr1 клеток предотвращает развитие воспалительного заболевания кишечника, индуцированного патогенными Т-клетками с высокой экспрессией CD4+CD45RB у мышей, только когда указанные Тr1 клетки стимулированы in vivo антигеном (в данном случае, путем скармливания мышам овальбумина). Кроме того, Foussat et al. (Journal of Immunology 2003, 171: 5018-5026) описывает, что совместное применение антиген(овальбумин)-специфических Тr1 клеток и антигена (овальбумина в питьевой воде) лечит имеющееся воспалительное заболевание кишечника у мышей. Совместное применение антигена было необходимым, чтобы Тr1 клетки были эффективными.
В соответствии с настоящим изобретением изобретатели намереваются обеспечить лечение воспалительного состояния кишечника у субъекта, нуждающегося в лечении, где указанное лечение основано на уникальном применении Тr1 клеток, направленных против пищевого антигена из обычного рациона человека. В частности, изобретатели удивительно установили, что указанные Тr1 клетки, направленные против пищевого антигена из обычного рациона человека, не нуждаются в совместном применении с антигеном, в отношении которого Тr1 клетки являются эффективными.
Раскрытие изобретения
Настоящее изобретение направлено на композицию, включающую, по крайней мере, одну популяцию Тr1 клеток человека, направленных против пищевого антигена из обычного рациона человека.
Указанный пищевой антиген из обычного рациона человека предпочтительно выбран из группы, включающей бычьи антигены, Сa-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин, казенны, антигены атлантического лосося, куриные антигены, овальбумин, Ag22, кональбумин, лизоцим или куриный сывороточный альбумин, антигены креветки, антигены пшеницы, антигены сельдерея, антигены моркови, антигены яблока, липидпереносящий белок яблока, профилин яблока, антигены груши, изофлавон-редуктазу, антигены авокадо, антигены абрикоса, антигены персика, антигены сои, арахиса, овальбумин, их фрагменты, варианты и смеси. Предпочтительно указанный пищевой антиген является овальбумином, казеином, бета-лактоглобулином, соевым белком, глиадином, антигеном арахиса, их фрагментами, вариантами и смесями.
Другой задачей настоящего изобретения является обеспечение медикамента или фармацевтической композиции, включающей композицию изобретения.
Настоящее изобретение также относится к способу лечения воспалительного состояния кишечника у нуждающегося в лечении субъекта, включающему применение у указанного субъекта эффективного количества медикамента или фармацевтической композиции изобретения.
В предпочтительном воплощении изобретения указанный способ предназначен для лечения воспалительного заболевания кишечника. В одном воплощении изобретения указанное воспалительное заболевание кишечника является болезнью Крона. В другом воплощении изобретения указанное воспалительное заболевание кишечника является язвенным колитом.
В другом предпочтительном воплощении изобретения указанный способ предназначен для лечения воспаления кишечника, связанного с пищевой аллергией или непереносимостью. В одном воплощении указанная пищевая непереносимость является целиакией. В другом воплощении указанная пищевая аллергия является аллергией на молочный белок. В другом воплощении указанная пищевая аллергия является аллергией на арахис. В другом воплощении указанная пищевая аллергия является аллергией на овальбумин.
В предпочтительном воплощении медикамент или фармацевтическая композиция для применения у субъекта, нуждающегося в лечении, включает человеческие Тr1 клетки, аутологичные клеткам указанного субъекта.
В другом воплощении настоящего изобретения способ лечения воспалительного состояния кишечника у субъекта, нуждающегося в лечении, включает применение у указанного субъекта эффективного количества медикамента или фармацевтической композиции изобретения в комбинации с другим терапевтическим агентом, применяемым для лечения воспалительных состояний кишечника.
Краткое описание чертежей
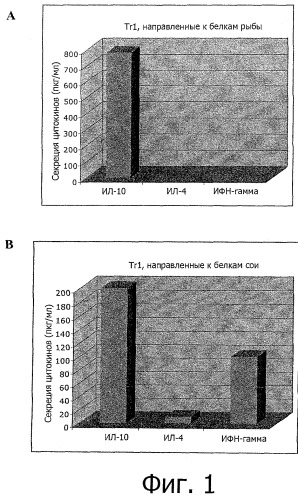
Фигура 1: Профиль экспрессии цитокинов мышиными Тr1 лимфоцитами против белков рыбы и мышиными Тr1 лимфоцитами против белков сои. (А)
Продукция ИЛ-4, ИЛ-10 и ИФН-γ мышиными Тr1 клетками против белков рыбы. (В) Продукция ИЛ-4, ИЛ-10 и ИФН-γ мышиными Тr1 клетками против белков сои.
Фигура 2: Контроль воспалительного колита у мышей мышиными Тr1 клетками против белков рыбы и против белков сои. (А и В) Анализ потери веса. (С) Продукция ИФН-γ мышиными Тr1 клетками против белков сои.
Фигура 3: Профили цитокинов и профили экспансии овальбумин-специфических Тr1 клонов от здоровых доноров. Пример 2 различных клонов. (А) Выходы экспансии специфичных к овальбумину Тr1 клонов оценивали подсчетом клеток раз в неделю при еженедельной стимуляции с искусственной линией фидерных клеток, полученных от дрозофилы. (В) Тr1 клоны оценивали на их специфичность к овальбумину после специфической активации в течение двух суток в присутствии антиген-презентирующих клеток. Овальбумин-специфическую продукцию ИЛ-10 измеряли в надосадочной жидкости с помощью ИФА на трех клонах, взятых в качестве примера качественного контроля анализа. Результаты выражены в виде дельта-функции продукции ИЛ-10 между условиями стимуляции с овальбумином и без него. (С) Тr1-специфический профиль продукции цитокинов оценивали с помощью ИФА в надосадочной жидкости анти-СВ3+анти СП28-активированных Тr1 клонов.
Фигура 4: Супрессивная активность овальбумин-специфического Тr1 клона. Пример 2 различных клонов. (А) Супрессивная активность ступенчато изменяющейся концентрации альбумин-специфических Тr1 клонов в отношении пролиферации аутологичных CD4+Т-клеток в совместной культуре. (В) Супрессивная активность разбавленных надосад очных жидкостей от культур активированных овальбумином Тr1 клонов в отношении аутологичных CD4+Т-клеток. (С) Блокада Т-клеточной пролиферации, опосредованной надосадочными жидкостями культур Tr1, с помощью моноклональных антител к ИЛ-10 и ТРФ-бета.
Фигура 5: Фенотип овальбумин-специфических Tr1 клонов. Экспрессию поверхностных CD25, GITR и внутриклеточных Fox3 и CTLA-4 оценивали проточной цитометрией овальбумин-специфических Tr1 клонов. (В) Кинетику экспрессии маркеров оценивали после активации (0 сутки) и в течение 14 суток в культуре при отсутствии стимулов.
Фигура 6: Исследование кариотипа овальбумин-специфического Tr1 клона, размноженного in vitro с фидерными клетками, полученными от дрозофилы, после более чем 30 делений.
Фигура 7: Профили цитокинов и экспансии овальбумин-специфических Tr1 клонов от пациентов с болезнью Крона. (А) Tr1 клоны оценивали на их специфичность к овальбумину после антиген-специфической активации в течение двух суток в присутствии антиген-презентирующих клеток. Овальбумин-специфическую продукцию ИЛ-10 измеряли в надосадочной жидкости с помощью ИФА у трех клонов, взятых в качестве примера качественного контроля анализа. Результаты выражены в виде дельта-функции продукции ИЛ-10 между условиями стимуляции с овальбумином и без него. (В) Tr1-специфический профиль продукции цитокинов оценивали с помощью ИФА в надосадочной жидкости анти-СВ3+анти СВ28-активированных Tr1 клонов. (С) Выходы экспансии двух специфичных к овальбумину Tr1 клонов оценивали путем подсчета клеток раз в неделю после недельной стимуляции с искусственной линией фидерных клеток, полученных от дрозофилы.
Фигура 8: Анализ ремиссии пациентов. Анализ ИАБК (А), боли в животе (В) или частоты жидкого или мягкого стула в неделю (С) и шкалы самочувствия (D).
Осуществление изобретения
Определения
Термин «Tr1 клетки», применяемый здесь, относится к клеткам, имеющим следующий фенотип в состоянии покоя CD4+CD25-FoxP3- и способным секретировать высокие уровни ИЛ-10 и низкие или средние уровни ТРФ-(3 при активации. Tr1 клетки характеризуются, в частности, своим уникальным цитокиновым профилем: они продуцируют высокие уровни ИЛ-10, значительные уровни ТРФ-β и промежуточные уровни ИФН-γ, но продуцируют мало или совсем не продуцируют ИЛ-4 и ИЛ-2,
Продукцию цитокинов обычно оценивают в культурах клеток после активации поликлональными активаторами Т-лимфоцитов, такими как анти-СВ3+анти-СВ28 антитела или интерлейкин-2, ФМА+иономицин. Альтернативно, продукцию цитокнов оценивают в культурах клеток после активации специфическим Т-клеточным антигеном, представленным антиген-презентирующими клетками. Высокие уровни ИЛ-10 соответствуют, по крайней мере, 500 мкг/мл, обычно больше примерно 1, 2, 4, 6, 8, 10, 12, 14, 16, 18 или 20 тысяч пкг/мл или больше. Значительные уровни ТРФ-β соответствуют, по крайней мере, примерно 100 пкг/мл, обычно выше примерно 200, 300, 400, 600, 800 или 1000 пкг/мл или больше. Промежуточные уровни ИФН-γ соответствуют концентрациям, включающим между 0 пкг/мл и, по крайней мере, 400 пкг/мл, обычно выше примерно 600, 800, 1000, 1200, 1400, 1600, 1800 или 200 пкг/мл или больше. Малые или отсутствующие концентрации ИЛ-4 и ИЛ-2 соответствуют менее чем примерно 500 пкг/мл, предпочтительно меньше примерно 250, 100, 75 или 50 пкг/мл, или меньше.
Термин «антиген», применяемый здесь, относится к белку или пептиду, для модуляции которого применяются клетки данного изобретения, или предназначенному для применения в любом из способов настоящего изобретения. В одном воплощении термин «антиген» может относиться с синтетически полученной молекуле, или к природной молекуле, разделяющей гомологию последовательности с интересующим антигеном, или структурную гомологию с интересующим антигеном, или их комбинацию. В одном воплощении антиген может быть миметопом. «Фрагмент» антигена относится к любой субпопуляции антигена, в виде более короткого пептида. «Вариант» антигена относится к молекуле, по существу подобной целому антигену или его фрагменту. Варианты антигенов могут быть просто приготовлены прямым химическим синтезом варианта пептида, с помощью способов, хорошо известных в данной области техники.
Термин «субъект», применяемый здесь, относится к человеку.
Термин «эффективное количество», применяемый здесь, относится к количеству, достаточному для того, чтобы добиться благоприятного или необходимого клинического результата (например, улучшения клинического состояния).
Термин «клон» или «популяция клона», применяемый здесь, относится к популяции дифференцированных клеток, полученных из одной дифференцированной клетки.
Термин «лечение» или «обработка», применяемый здесь, в целом относится к клиническому вмешательству с целью изменения природного течения болезни у индивидуума, которого лечат, и может выполняться при клинической патологии. Необходимые эффекты включают без ограничения, облегчение симптомов, супрессию, уменьшение или подавление любого прямого или непрямого патологического последствия заболевания, снижение скорости прогрессирования заболевания, улучшение или смягчение болезненного состояния, и индукцию ремиссии или улучшение прогноза.
Настоящее изобретение
Настоящее изобретение относится к способу лечения воспалительного состояния кишечника у нуждающегося субъекта, включающему применение у указанного субъекта композиции, включающей человеческие Tr1 клетки, направленные против пищевого антигена из обычного рациона человека.
В соответствии с изобретением, изобретатели намереваются обеспечить лечение воспалительного состояния кишечника у нуждающегося субъекта, где указанное лечение основано на уникальном применении Tr1 клеток, направленных против пищевого антигена из обычного рациона человека. В частности, изобретатели удивительно установили, что указанные Tr1 клетки, направленные против пищевого антигена из обычного рациона человека, не нуждаются в совместном применении с антигеном, в отношении которого Tr1 клетки эффективны.
Таким образом, настоящее изобретение представляет преимущество в отсутствии потребности в совместном применении или совместном лечении, которые являются сложными в плане регуляторных вопросов.
Термин «пищевой антиген из обычного рациона человека» относится к иммуногенному пептиду из пищевых продуктов, обычных для человека, таких как пищевые антигены из следующего не-ограничивающего перечня: бычьи антигены, такие как липокаин, Са-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин, казеины. Пищевыми антигенами могут также быть антигены атлантического лосося, такие как парвальбумин, куриные антигены, такие как овомукоид, овальбумин, Ag22, кональбумин, лизоцим или куриный сывороточный альбумин, антигены арахиса, антигены креветки, такие как тропомиозин, антигены пшеницы, такие как агглютинин или глиадин, антигены сельдерея, такие как профилин сельдерея, антигены моркови, такие как профили моркови, антигены яблока, такие как тауматн, липидпереносящий белок яблока, профилин яблока, антигены груши, такие как профилин груши, изофлавон-редуктаза, антигены авокадо, такие как эндохитиназа, антигены абрикоса, такие как липидпереносящий белок абрикоса, антигены персика, такие как липидпереносящий белок персика или профилин персика, антигены сои, такие как HPS, профилин сои или белок (SAM22) PR-10.
Не желая связываться теорией. Заявитель предполагает, что введенная популяция Tr1 клеток, направленных к пищевому антигену из обычного рациона человека, будет активироваться in vivo пищевым антигеном, присутствующим в ткани кишечника после потребления обычного рациона, и затем будет способна контролировать воспалительные состояния кишечника, такие как воспалительное заболевание кишечника и воспаление, связанное с пищевой аллергией или непереносимостью.
Настоящее изобретение относится к композиции, включающей, по крайней мере, одну популяцию, направленную против пищевого антигена из обычного рациона человека.
В одном воплощении изобретения человеческие Tr1 могут быть получены путем:
a) выделения популяции клеток-предшественников у субъекта;
b) получения популяции дендритных клеток при культивировании популяции указанных клеток-предшественников в присутствии IL-10;
c) осуществления контакта клеток с этапа b) с популяцией CD4+Т-лимфоцитов, выделенных от указанного субъекта в присутствии пищевого антигена для обеспечения дифференцировки CD4+Т-клеток, направленных к указанному антигену, в популяцию Tr1 клеток, и
d) извлечения популяции Tr1 клеток с этапа с).
На этапе b) ИЛ-10 присутствует в культуральной среде в количестве от 50 до 250 Ед/мл, предпочтительно 100 Ед/мл. Указанный способ получения Tr1 клеток описан Wakkach et al. (Immunity 2003 May; 18(5):605-17).
Указанный способ может также проводиться с применением дексаметазона и витамина D3 или толерогенизованных или незрелых ДК вместо ДК с этапа b).
В другом воплощении настоящего изобретения Tr1 клетки человека могут быть получены путем:
a) культивирования популяции CD4+Т-клеток, направленных к пищевому антигену, выделенному у субъекта, в среде с подходящим количеством IFN-α,
b) извлечения популяции Tr1 клеток.
ИФН-α предпочтительно присутствует в среде в количестве 5 нг/мл. На этапе а) среда может дополнительно включать подходящее количество IL-10, предпочтительно 100 Ед/мл.
На этапе b) популяцию Tr1 клеток культивируют в среде, включающей ИЛ-15 для обеспечения пролиферации, при этом IL-15 содержится в среде предпочтительно в количестве 5 нг/мл. Указанный способ получения Tr1 клеток описан в патенте US6746670.
В еще одном воплощении изобретения Tr1 клетки человека могут быть получены путем:
а) in vitro активации популяции CD4+Т-клеток в присутствии пищевого антигена, представленного клетками, презентирующими искусственный антиген,
b) извлечения активированных CD4+Т-клеток, включающих по крайней мере 10% Tr1 клеток.
Предпочтительно клетки, презентирующие искусственный антиген, экспрессируют молекулу HLA II системы человеческую LFA-3 молекулу и не экспрессируют ко-стимулирующие молекулы В7-1, В7-2, В7-Н1, CD40, CD23 и ICAM-1.
Указанный процесс получения Tr1 клеток описан в заявке на патент W002/092793.
В еще одном воплощении изобретения человеческие Tri клетки могут быть получены путем:
a) in vitro активации популяции CD4+Т-клеток в присутствии пищевого антигена и подходящего количества ИЛ-10;
b) извлечения популяции Tr1i клеток.
Предпочтительно ИЛ-10 присутствует в среде в концентрации 100 Ед/мл. Указанный способ описан Groux et al. (Nature 1997, 389(6652):737-42).
В еще одном воплощении изобретения человеческие Tr1 клетки могут быть получены путем:
a) стимуляции популяции лейкоцитов или мононуклеарных клеток периферической крови (МНК ПК) пищевым антигеном;
b) извлечения популяции антиген-специфических Tr1 клеток из стимулированной популяции;
c) факультативно размножения указанной популяции антиген-специфических Tr1 клеток.
Лейкоциты охватывают несколько типов клеток, которые характеризуются по своей значимости, своему распределению, своему количеству, своей продолжительности жизни и своему потенциалу. Их типы являются следующими: полинуклеарные или гранулярные лейкоциты, среди которых находятся эозинофильные, нейтрофильные и базофильные лейкоциты и мононуклеарные клетки или мононуклеарные клетки периферической крови (МНК ПК), которые являются большими белыми клетками крови и составляют типы клеток иммунной системы (лимфоциты и моноциты). Лейкоциты или МНК ПК могут быть отделены от периферической крови любым способом, известным специалистам в данной области техники. Для выделения МНК ПК может выгодно применяться центрифугирование, предпочтительно центрифугирование в градиенте плотности. Альтернативой является применение специфических моноклональных антител. В конкретных воплощениях МНК ПК типично выделяются типично выделяют из цельной крови с помощью Ficoll-Hypaque, с применением стандартных процедур. В других воплощениях МНК ПК выделяют с помощью лейкофереза. Указанный способ описан в заявке на патент W02007/010406.
В еще одном воплощении, человеческие Tr1 клетки могут быть получены путем:
a) культивирования популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (МНК ПК) с мезенхимальными стволовыми клетками в присутствии пищевого антигена,
b) извлечения популяции Tr1 клеток.
Указанный способ может также осуществляться с наивными Т-клетками или Т-клетками памяти вместо МНК ПК или лейкоцитов.
Популяция Tr1 клеток, полученная таким образом, может дополнительно быть размножена в культуре в присутствии цитокинов, таких как интерлейкин-2 и интерлейкин-4. Альтернативно, интерлейкин-15 и интерлейкин-13 также могут применяться в культурах для размножения Tr1 клеток.
В способах, описанных выше, человеческие Tr1 клетки могут быть охарактеризованы путем способа идентификации, описанного в W02005/000344. Указанный способ идентификации Tr1 клеток основан на обнаружении одновременного присутствия продуктов экспрессии генов, кодирующих CD4 молекулу и молекулы из группы, включающей CD 18 и/или CD 11а, и CD49b. Tr1 клетки могут быть идентифицированы и/или очищены путем ИФА, проточной цитометрии, или иммуноаффинными способами с антителами, направленными против указанных маркеров.
Tr1 клетки также могут быть обогащены путем позитивной селекции или негативной селекции с применением проточной цитометрии или магнитных бус. Такие способы также описаны в W02005/000344.
В другом воплощении настоящего изобретения Tr1 клетки, направленные к пищевому антигену из обычного рациона человека, могут быть размножены с помощью in vitro способа, описанного BW02006/108882. Указанный способ включает:
а) культивацию при температуре Т1 ниже 35°С, в культуральной среде Mf, фидерных клеток, таких как фидерные клетки насекомых, где указанная температура Т1 обеспечивает пролиферацию фидерных клеток и где указанные фидерные клетки экспрессируют факторы, взаимодействующие со следующими белками клеточной поверхности:
- CD3/TCR комплекс,
- CD28 белок,
- IL-2 рецептор,
- CD2 белок,
- IL-2 рецептор,
b) осуществления контакта фидерных клеток, полученных на этапе а), отмытых или не отмытых от их культуральной среды Mf, с популяцией Tr1 клеток, содержащейся в культуральной среде Мр, где указанная культуральная среда Мр исходно не содержит факторы, перечисленные на этапе а), чтобы получить смесь, содержащую популяцию Tr1 клеток, фидерных клеток и культуральной среды Мр,
c) культивации смеси, полученной на этапе b), при температуре Т2, составляющей, по крайней мере, 35°С, где указанная температура выбрана так, чтобы популяция Tr1 клеток пролиферировала, а фидерные клетки не пролиферировали,
d) извлечения популяции Tr1 клеток, размноженных таким образом.
Примеры факторов, взаимодействующих с вышеупомянутыми поверхностными клеточными белками, включают:
- модифицированные анти-СВ3 антитела, в которых анти-СВ3 внутрицитоплазматический домен CD3 тяжелой цепи заменен трансмембранным доменом,
- CD80 или CD86 белок,
- IL-2, секретируемый фидерными клетками,
- CD58 белок,
- интерлейкин, выбранный из группы, включающей IL-4 и IL-13.
В предпочтительном воплощении настоящего изобретения указанные Tr1 клетки, направленные к пищевому антигену из обычного рациона человека, могут быть клонированы с применением обычных способов клонирования Т-клеток.
В предпочтительном воплощении настоящего изобретения указанная композиция, включающая, по крайней мере, одну популяцию Tr1 клеток человека, направленных против пищевого антигена из обычного рациона человека, или, по крайней мере, один клон Tr1 клеток человека, направленных против пищевого антигена из обычного рациона человека, может быть заморожена для хранения.
В предпочтительном воплощении настоящего изобретения указанный пищевой антиген из обычного рациона человека выбран из группы, включающей бычьи антигены, Са-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин, казеины, антигены атлантического лосося, куриные антигены, овальбумин, Ag22, кональбумин, лизоцим или куриный сывороточный альбумин, антигены креветки, антигены пшеницы, такие как глютеновые белки: глиадин, антигены сельдерея, антигены моркови, антигены яблока, липидпереносящий белок яблока, профилин яблока, антигены груши, изофлавон-редуктазу, антигены авокадо, антигены абрикоса, антигены персика, антигены сои, арахиса, их фрагменты, варианты и смеси. Предпочтительно пищевой антиген является рекомбинантньш или синтезированным антигеном. Предпочтительно указанный пищевой антиген из обычного рациона человека не является глиадином.
Предпочтительно указанным пищевым антигеном из обычного рациона человека является овальбумин, казеин, бета-лактоглобулин, соевый белок, глиадин, антиген арахиса, их фрагменты, варианты и смеси.
Более предпочтительно указанным пищевым антигеном из обычного рациона человека является овальбумин, его фрагменты и варианты.
Более предпочтительно указанным пищевым антигеном из обычного рациона человека является глиадин, его фрагменты и варианты.
Более предпочтительно указанным пищевым антигеном из обычного рациона человека является казеин, его фрагменты и варианты.
Более предпочтительно указанным пищевым антигеном из обычного рациона человека является бета-лактоглобулин, его фрагменты и варианты.
Более предпочтительно указанным пищевым антигеном из обычного рациона человека является антиген арахиса, его фрагменты и варианты.
Термин «варианты» пищевого антигена из обычного рациона человека относится здесь к антигену, почти идентичному природному антигену и разделяющему ту же самую биологическую активность. Минимальное различие между природным антигеном и его вариантом может состоять, например, в замещении, удалении и/или добавлении аминокислоты. Такие варианты могут сдержать, например, консервативные замещения аминокислоты, в которых аминокислотные остатки замещены аминокислотными остатками, имеющими подобную боковую цепь. Семейства аминокислотных остатков, имеющих подобные боковые цепи, определены в данной области техники, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боков