Способ получения модифицированной формы триптофанил-трнк-синтетазы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Измельчают ткани поджелудочной железы животных и экстрагируют. Отделяют экстракт от жмыха. Осаждают и удаляют примесные нуклеиновые кислоты с помощью стрептомицин сульфата. Повторно осаждают примеси из супернатанта высаливанием сульфатом аммония. Проводят постадийное фракционирование экстракта. На первой стадии фракционирования используют метод ионообменной хроматографии с использованием ДЕАЕ-целлюлозы ДЕ-52. Проводят ступенчатую элюцию буферным раствором, содержащим 25 мМ трис-HCl при pH 7,5, 1 мM ЭДТА, 0,1 мМ 2-меркаптоэтанола и стабилизатор модифицированной формы ТРСазы в виде комплекса субстратов 0,2 мМ L-триптофана и 1,0 мМ Mg-АТФ. Элюирование проводят до достижения значения оптической плотности не выше 0,1 о.е./мл при 280 нм. Удаляют примесные белки буферным раствором, содержащим 0,09М NH4Cl. Очищенную фракцию промывают буферным раствором, содержащим 0,16М NH4Cl. Полученную смесь осаждают сульфатом аммония до достижения 60% насыщения. Центрифугируют и растворяют осадок буферным раствором, содержащим 0,1М NH4Cl. Добавляют к раствору ингибитор протеаз 1 мМ фенилметилсульфонилфторида (ФМСФ) или 5 мМ диизопропилфторфосфата (ДФФ). Проводят вторую стадию фракционирования методом ионообменной хроматографии с использованием ДЕАЕ-целлюлозы ДЕ-52 при ступенчатой элюции с использованием линейного градиента соли хлорида аммония 0,01 - 0,16М. Отбирают фракции с модифицированной формой триптофанил-тРНК-синтетазы (ТРСазы). Концентрируют целевой продукт высаливанием сульфатом аммония до достижения 100% насыщения. Изобретение позволяет увеличить выход модифицированной формы триптофанил-тРНК-синтетазы до 90% с чистотой 99%. 1 з.п. ф-лы, 2 ил., 1 табл., 10 пр.
Реферат
Изобретение относится к области медицины и касается получения биологически активных веществ из органов убойных животных, используемых для производства диагностикумов и лекарственных средств.
Триптофанил-тРНК-синтетаза (ТРСаза) [1] является одним из важнейших ферментов, катализирующих реакцию специфического аминоацилирования тРНК-мессенджера, одну из критических стадий белкового синтеза, аминокислотой триптофаном. Фермент осуществляет один из важнейших процессов обмена веществ - реакцию специфического аминоацилирования тРНК. Ферменты этого класса эукариотического происхождения состоят из центральной «ядерной» части, сходной по первичной и вторичной структурам с аналогичными ферментами из прокариот, и дополнительного домена, присоединенного к «ядру» с N-конца или с С-конца. Скорее всего, дополнительные неканонические регуляторные функции эукариотические ферменты «приобрели» в ходе эволюции через модификацию фермента путем регулируемого присоединения или удаления вышеуказанных доменов. Тирозил-тРНК-синтетаза (ТирРСаза) млекопитающих, например, содержит дополнительный домен с цитокинной функцией, не встречающийся у ТирРСазы более низких по развитию организмов, таких как Caenorhabditis elegans или дрожжи [2]. Этот домен стимулирует хемотаксис мононуклеарных фагоцитов и продукцию фактора некроза опухоли альфа, также как эндотелиальный моноцит активирующий полипептид II (EMAP II) [2]. Приведенные данные демонстрируют тесную связь процессов белкового синтеза с сигнальными функциями.
ТРСаза млекопитающих, близкий гомолог ТирРСазы, как установлено, активно участвует в организации межклеточных сигнальных маршрутов [3]. Для клеток и тканей млекопитающих, включая человека, выявлено наличие двух различающихся по молекулярной массе форм ТРСазы: исходная нативная ТРСаза (471аа) и мини-ТРСаза (424аа), которые, как полагалось, возникают путем альтернативного сплайсинга мРНК [4]. Кроме того, установлен важный факт сильной индукции синтеза ТРСазы и модифицированной мини-ТРСазы под действием антипролиферативного цитокина интерферона-γ [5]. Большое значение этих эффектов стало проясняться после демонстрации наличия совершенно новой, не связанной напрямую с основной исходной функции ТРСазы, а именно наличие у мини-ТРСазы мощной подавляющей патологический ангиогенез активности в различных in vitro и in vivo экспериментах. Например, мини-ТРСаза блокировала миграцию клеток эндотелия пупочной вены человека, вызванную эндотелиальными факторами роста. Кроме того, мини-ТРСаза блокировала ангиогенез, стимулированный факторами роста эндотелия в тестах на адгезивных молекулах клеток цыплят и тесте на мышиный матригель в естественных условиях [5]. Однако, несмотря на наличие столь мощных активностей у модифицированной формы, полноразмерная ТРСаза не имела цитокинных активностей [4, 5]. Модифицированная ТРСаза обладала также сильным антиангиогенным действием при воздействии препарата на ретину неонатальной мыши в месте локализации кровеносных сосудов. Все эти приведенные данные позволяют сделать четкий вывод, что непосредственной мишенью мини-ТРСазы в тканях испытуемых организмов являются именно клетки эндотелия.
Центральная роль катализируемой реакции объясняется тем, что вся точность белкового синтеза и точность реализации генетического кода, позволяющая воспроизводить в потомстве все видовое разнообразие на земле, определяется именно на данном этапе белкового синтеза. В дальнейшем все процессы «сборки» белковых молекул из аминокислот осуществляются практически автоматически.
Указанные свойства ТРСазы делают фермент важным объектом научных исследований и разработок с перспективой практического применения в медицине модифицированной формы фермента.
Способ получения модифицированной формы ТРСазы описан, например, в Methods Enzymol. 1979; 59:234-57, Kisselev L.L. et al., Tryptophanyl-tRNA synthetase from beef pancreas.
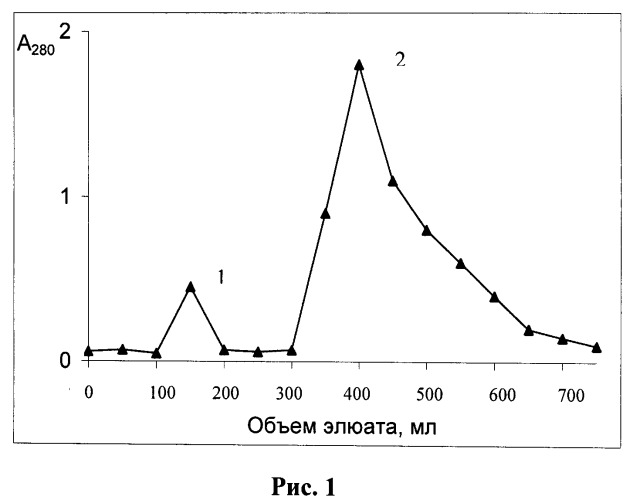
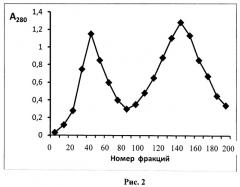
Известен также способ получения модифицированной формы ТРСазы, который может быть указан в качестве прототипа, описанный в Eur. J. Biochem., (1976), 61, 139-146. Epely S., Gros С., Labouesse J., and Lemaire G. Limited Proteolysis of Tryptophanyl-tRNA Synthetase from Beef Pancreas. Способ включает существенную модификацию основной базовой методики выделения фермента, заключающейся в исключении на стадии экстракции ингибиторов протеаз и введением дополнительной стадии ионообменной хроматографии с одновременным исключением стадии хроматографии на Сефадексе Г-100 и присутствием на всех стадиях фракционирования повышенных концентраций субстратов (L-триптофана 2×10-4 М, и Mg-АТФ (1×10-3 М)). После проведения процедур экстракции и ступенчатого солевого фракционирования с сульфатом аммония (40% насыщения и 60% насыщения) смесь наносили на колонку с ионообменной смолой ДЕ-52 и смывали фракции ступенчатым градиентом соли хлорида аммония (0,09 М; 0,16 М; 0,2 М) в буфере А (25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТА, 0,1 мМ 2-меркаптоэтанол, 0,2 мМ L-триптофана, и 1,0 мМ Mg-АТФ) (фиг.1). Фракцию, отобранную при 0,14 М соли, подвергали еще одному циклу разделения при линейном градиенте соли 0,1-0,16 М хлорида аммония в буфере А. Выход составил 0,002%-0,003%, то есть получалось 40-45 мг модифицированного фермента с чистотой 99% по данным денатурирующего белкового электрофореза в полиакриламидном геле (ПААГ)(фиг.2).
Во втором подходе уже очищенный стандартной процедурой фермент подвергали обработке с активированным углем (5%-ной водной суспензией в буфере А, без L-триптофана и АТФ) для снятия эндогенного триптофана, при этом фермент переходил в модифицированную форму под действием остаточных примесей эндогенных протеаз в течение суток при 8°С.
Мини-метод получения модифицированной ТРСазы включал нанесение препарата исходной ТРСазы концентрацией 15 мг/мл в 20 мМ трис-HCl, рН 7,5, объемом 0,3 мл на угольный фильтр. Угольный фильтр с нанесенным ферментом инкубировали при 4°С в течение 30 мин и смывали 1 мл буфера А, без L-триптофана и АТФ, затем разбавленный раствор инкубировали в холодильнике при 8°С в течение ночи. Исходную ТРСазу брали в количестве 5 мг. После проведения процедуры получено 4,5 мг - выход 90%.
Модифицированный фермент также получали ограниченным протеолизом исходного фермента эластазой. Для этого исходный фермент ТРСазы в концентрации 2,5 мг/мл, предварительно обработанный активированным углем для удаления эндогенного триптофана (см. выше), инкубировали с низкими концентрациями эластазы (0,12 мг/мл в буфере трис-HCl, рН 7,5) в течение 20 мин при 25°С в присутствии 0,1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола и субстратов - 0,2 мМ L-триптофана, 5,0 мМ АТФ. Реакцию останавливали добавлением ингибитора протеаз 1 мМ ФМСФ или 5 мМ диизопропилфторфосфата (ДФФ). В случае ДФФ добавление осуществляли в очках и перчатках под тягой и оставляли под тягой при комнатной температуре, при перемешивании на качалке для полного разрушения ДФФ, быстро разлагающегося в водной среде.
Контроль образования модифицированной формы осуществляли с помощью денатурирующего электрофореза в ПААГ. На эксперимент было взято 5 мг исходного препарата ТРСазы, после проведения процедуры ограниченного протеолиза в присутствии субстратов получено 4,0 мг, то есть выход составил 80%, чистота препарата составила 98%.
Функциональную активность биологически активной модифицированной формы оценивали по стандартному МТТ тесту (Lee W.S., Harder J.A., Yoshizumi M. et al. Progesterone inhibits arterial smooth cell proliferation // Nat.Med. - 1997. - №3. - P. 1005-1008.)
Задача настоящего изобретения в получении биологически активной модифицированной формы ТРСазы.
Задача решается усовершенствованным способом, заключающемся в следующем.
Проводят подготовку сырья - поджелудочной железы путем удаления частичек жира. После экстракции и осаждения жмыха удаляют примеси нуклеиновых кислот стрептомицин сульфатом. Способ заключается в неприменении на стадии экстракции ингибиторов протеаз, применении двух последовательных стадий ионообменной хроматографии и присутствием на всех стадиях фракционирования повышенных концентраций субстратов (0,2 мМ L-триптофана и 1,0 мМ Mg-АТФ). Проводят процедуры ступенчатого солевого фракционирования с сульфатом аммония (40% насыщения и 60% насыщения), затем осадок при 60% насыщения растворяли в буфере для нанесения (буфер А, содержащий 0,05 M NH4Cl), смесь наносили на колонку с ионообменной смолой ДЕ-52 и смывали фракции ступенчатым градиентом солей хлорида аммония (0,09 M; 0,14 M; 0,2 M) в буфере А (фиг.1), фракцию, отобранную при 0,14 М соли, подвергали еще одному циклу разделения при линейном градиенте соли 0,1-0,16 М хлорида аммония, предварительно разбавив отобранные фракции до концентрации 0,1 М по NH4Cl (фиг.2). Контроль образования модифицированной формы осуществляли с помощью денатурирующего электрофореза в ПААГ. Выход составил 0,002% - 0,003%, то есть получалось 40-45 мг модифицированного фермента с чистотой 99% по данным денатурирующего белкового электрофореза в полиакриламидном геле (ПААГ).
Функциональную активность биологически активной модифицированной формы оценивали по стандартному МТТ тесту (Lee W.S., Harder J.A., Yoshizumi M. et al. Progesterone inhibits arterial smooth cell proliferation // Nat.Med. - 1997. - №3. - P. 1005-1008.).
Во втором методе уже очищенный стандартной процедурой фермент подвергали обработке с активированным углем (5%-ной водной суспензией в буфере А, без L-триптофана и АТФ) для снятия эндогенного триптофана, при этом фермент переходил в модифицированную форму под действием остаточных примесей эндогенных протеаз в течение суток при 8°С. Фермент концентрацией 5 мг/мл инкубировали при перемешивании на холоду (+4°С) в течение 30 мин в буфере состава 20 мМ трис-HCl, рН 7,5, 0,1 мМ 2-меркаптоэтанол в присутствии 5%-ной суспензии активированного угля. Суспензию центрифугировали на холоду (+4°С) при 10000 g в течение 5 мин, супернатант разбавляли тем же буфером до 2,0-2,5 мг/мл и оставляли на ночь при 8°С. Из взятых 5,0 мг препарата ТРСазы получали 4,5 мг модифицированной формы с выходом 90% и чистотой 99%.
Мини-метод получения модифицированной ТРСазы включал нанесение препарата исходной ТРСазы концентрацией 15 мг/мл в 20 мМ трис-HCl, рН 7,5, объемом 0,3 мл на угольный фильтр. Угольный фильтр с нанесенным ферментом инкубировали при 4°С в течение 30 мин и смывали 1 мл буфера А, без L-триптофана и АТФ, затем разбавленный раствор инкубировали в холодильнике при 8°С в течение ночи. Исходную ТРСазу брали в количестве 5 мг. После проведения процедуры получено 4,5 мг - выход 90%.
Модифицированный фермент также получали ограниченным протеолизом исходного фермента эластазой. Для этого исходный фермент ТРСазы в концентрации 2,5 мг/мл, предварительно обработанный активированным углем для удаления эндогенного триптофана (см. выше), инкубировали с низкими концентрациями эластазы (0,12 мг/мл в буфере трис-HCl, рН 7,5) в течение 20 мин при 25°С в присутствии 0,1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола и субстратов - 0,1 мМ L-триптофана, 1,0 мМ АТФ. Реакцию останавливали добавлением ингибитора протеаз 1 мМ ФМСФ или 5 мМ диизопропилфторфосфата (ДФФ). В случае ДФФ добавление осуществляли в очках и перчатках под тягой и оставляли под тягой при комнатной температуре, при перемешивании на качалке для полного разрушения ДФФ быстро разлагающегося в водной среде. Контроль образования модифицированной формы осуществляли с помощью денатурирующего электрофореза в ПААГ. Функциональную активность биологически активной модифицированной формы оценивали по стандартному МТТ тесту (Lee W.S., Harder J.A., Yoshizumi M. et al. Progesterone inhibits arterial smooth cell proliferation // Nat.Med. - 1997. - №3. - P. 1005-1008.)
Технический результат изобретения: получение чистой биологически активной модифицированной формы фермента.
Сущность изобретения
Разработка способа получения модифицированной формы триптофанил-тРНК-синтетазы (ТРС-азы) для выявления ее антиангиогенной и антионкогенной биологической активности с последующими испытаниями с целью получения нового препарата для лечения ряда распространенных (в частности, онкологических заболеваний).
Это достигается тем, что в способе получения ТРС-азы, включающем измельчение поджелудочной железы КРС или свиней, экстракцию, фракционирование сульфатом аммония, хроматографию на колонках с ионообменными смолами, тщательно осуществляли подбор исходного сырья - поджелудочной железы, а именно, - железа крупного рогатого скота (КРС) берется не позднее 30-40 мин после забоя животного. Тщательно отбираются железы с минимальным количеством жира, примеси которого ингибируют фермент. Для транспортировки к месту обработки, железы в количестве около 2-3 кг (около 15 желез КРС, или 40 желез свиней) помещали в лед, железы измельчали, пропуская через (предварительно промытую и охлажденную) мясорубку в течение 5 мин прямо в бадью с охлажденным буфером А (25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТА, 0,1 мМ 2-меркаптоэтанол, 0,2 мМ L-триптофана, и 1,0 мМ Mg-АТФ). Все дальнейшие процедуры проводили на холоду при +4°С (в холодной комнате или в холодильном шкафу). Экстракт перемешивали в течение 20 мин и отделяли экстракт от жмыха центрифугированием при 7000-8000 g, к экстракту при перемешивании добавляли стрептомицин сульфат до конечной концентрации 1%. После 20 мин инкубации без перемешивания осадок нуклеиновых кислот удаляли центрифугированием при 3000 об/мин или 7000-8000 g. Осадок отбрасывали. Для получения модифицированной формы на стадии получения экстракта не использовались ингибиторы протеаз.
Следующим этапом являлось непосредственное фракционирование ТРС-азы с помощью ступенчатого высаливания сульфатом аммония. Сульфат аммония, предварительно перетертый до состояния порошка, добавляли медленно при умеренном перемешивании на холоде до конечной концентрации 40%-насыщения в течение 20 мин. Оставляли для формирования осадка на 20 мин. Затем осадок осаждали центрифугированием при среднем ускорении 10000-15000 g. Супернатант сливали в отдельную бадью и добавляли на холоде, как указано выше сульфат аммония до 60%-насыщения. На этом этапе суспензию оставляли при 4°С в холодильнике на ночь для формирования осадка.
На следующем этапе осуществляется хроматография на колонках, с использованием анионообменных смол - целлюлозы, типа диэтиламиноэтилцеллюлозы (ДЕАЕ-целлюлозы, ДЕ-52). Смолу перед использованием рекомендуется активировать с целью повышения выхода целевого продукта. Для этого независимо от микроструктуры ионообменник обрабатывают следующим образом: сначала его перемешивают с 15-кратным количеством (сухой вес/объем) 0,5 М HCl в течение 30 мин при комнатной температуре, затем на воронке или декантацией отмывают дистиллированной водой до рН 4. После этого смолу перемешивают с 15-кратным количеством 0,5 М NaOH в течение 30 мин при комнатной температуре и отмывают дистиллированной водой до тех пор, пока суспензия не будет давать нейтральную реакцию. Обработанную таким образом смолу уравновешивают стартовым буферным раствором. Часть супернатанта аккуратно сливают через край бадьи, стараясь не взмутить осадок. Оставшуюся смесь центрифугируют при 15000 g. Супернатант отбрасывают, остаток жидкости тщательно удаляют со стенок центрифужных стаканов фильтровальной бумагой. Осадок затем растворяют в 30-50 мл буфера А, содержащего 0,05 М хлорид аммония NH4Cl. Раствор наслаивают на колонку с ДЕ-52 объемом 150 мл и элюируют до достижения минимальной оптической плотности (не выше 0,1 о.е./мл при 280 нм). Примесные белки удаляли элюцией буфером А, содержащим стабилизатор (0,09 М NH4Cl). Вышедший белковый пик отбрасывали. После снижения оптической плотности до минимума (около 0,1 о.е./мл), очищенную фракцию исходной и модифицированной форм ТРСазы снимали буфером А, содержащим повышенную концентрацию стабилизатора (0,16 М NH4Cl). Профиль элюции с колонки изображен на фиг.1. Отбирали центральную часть пика и концентрировали препарат ТРС-азы сульфатом аммония, доведя его до 60% насыщения. Для этого добавляли по каплям на холоде насыщенный 100-ный раствор сульфата аммония до выпадения осадка, продолжали добавлять до 60% насыщения и оставляли на ночь в холодильнике для формирования осадка. Смесь центрифугировали при 10000 g, остатки супернатанта убирали фильтровальной бумагой. Осадок растворяли в буфере А, содержащем стабилизатор (0,1 NH4Cl), и затем раствор наносили на другую ионообменную колонку с ДЕАЕ-целлюлозой ДЕ-52 объемом 50 мл, уравновешенного буфером А, содержащим 0,1 М хлорид аммония и 1 мМ ингибитора протеаз - фенилметилсульфонилфторида (ФМСФ). Элюировали линейным градиентом NH4Cl 0,1-0,16 М со скоростью 25 мл/час. Собирали фракции по 2,5 мл. Профиль элюции приведен на фиг.2. Фермент выходил в виде большого пика вначале, последующие пики представляли собой либо примесные белки, либо продукты более глубокого расщепления ТРСазы. Фракции, обладающие слабой ферментативной активностью, и модифицированную форму по данным денатурирующего электрофореза в полиакриламидном геле (ПААГ). К 30 мл объединенного элюата добавляли по каплям при перемешивании 20 мл раствора сульфата аммония 100%-насыщения. После формирования осадка центрифугировали при 10000 g. Супернатант отбрасывали. Осадок растворяли в минимальном объеме буфера А, в концентрации не ниже 20 мг на мл и хранили замороженным в аликвотах по 1 мл при - 70°С, или при -20°С в 30%-ном глицерине. Получено 40,5 мг модифицированной формы фермента с чистотой 99%.
Технологическая схема предлагаемого способа может быть представлена в следующем виде: сбор и подготовка поджелудочной железы КРС или свиней → измельчение и экстракция → осаждения примесей нуклеиновых кислот и клеточного дебриса → ступенчатое солевое фракционирование сульфатом аммония → фракционирование на анионообменной хроматографической колонке ступенчатым градиентом элюента хлорида аммония → фракционирование на второй ионообменной колонке ДЕ 52 → концентрирование препарата ТРСазы и оценка его биологической активности.
Выход препарата составляет 0,0020-0,005% от свежего органа животного. Описанные стадии технологического процесса в предлагаемом способе являются логически обоснованными.
Одним из основных моментов в методике выделения модифицированной формы ТРСазы является выбор объекта - поджелудочной железы КРС и свиней, в которых, как установлено, существенно (почти в 100 крат) повышено его содержание по сравнению с другими тканями (в частности, в печени). На стадии отбора железы, важным является его свежесть (время забоя животного до отбора железы должно быть минимальным), железа должна быть постной, тщательно очищенной от жира.
Все стадии фракционирования до добавления ингибитора протеаз должны осуществляться в минимальные сроки. На ранних стадиях фракционирования желательно избегать сильного вспенивания экстрактов (в частности, на стадии солевого фракционирования сульфатом аммония), так как это может привести к частичной денатурации и инактивации модифицированных форм фермента, и может сказаться на его выходе. При центрифугированиях на ранних этапах плавающие на супернатанте частички жира удаляют, сливая супернатант в бадью через несколько слоев марли. Излишнее количество жира также может приводить к снижению биологической активности и выхода модифицированных форм ТРСазы.
Очень важным для получения модифицированных форм ТРСазы является наличие в буфере А L-триптофана и АТФ, которые способствуют образованию модифицированной формы и препятствуют дальнейшей деградации форм ТРСазы с потерей неканонических дополнительных функций.
На стадии второго фракционирования на ионообменной колонке ДЕ-52 нужно добавлять ингибитор протеаз ФМСФ в концентрации 1 мМ, так как, в силу обогащенности поджелудочной железы протеазами, модифицированная форма ТРСазы, в противном случае, будет полностью расщеплена.
На стадии ионообменной хроматографии может быть проведена процедура активации ионообменной смолы, в противном случае выход препарата существенно снижается, а эффективность фракционирования резко снижается. Необходимо добиваться достаточно полного вымывания неспецифически связанного белка перед сбором нужной фракции, и отбирать для дальнейшей работы именно среднюю часть пика. В конечной части пика следуют частично протеолизованные формы ТРСазы. Собранные фракции желательно сразу концентрировать, так как в разбавленных растворах фермент существенно менее стабилен.
Ион аммония (NH4+) стабилизирует ТРСазу, поэтому фермент можно перед колоночными стадиями долго (1-2 месяца) хранить в виде осадка в сульфате аммония при -20°С. Это важно при испытаниях эффективности новых колоночных методик и их сравнения, так как предыдущие стадии, при соблюдении методики, не вносят изменений в выход препарата и его чистоту.
Дальнейшие направления повышения эффективности методики лежат в рамках основных стадий и требуют их усовершенствования либо опускания некоторых стадий, путем их объединения в одну, либо полного исключения определенных стадий в силу повышения эффективности предыдущих.
Изменения методики могут быть адаптированы для конкретных целей дальнейшего использования модифицированных форм фермента.
Кроме основной аминоацилирующей активности ТРСаза обладает еще, по крайней мере, одной важной функцией, а именно принимает участие в цепочке биохимических процессов, стимулирующих защитные реакции организма на внедрение вирусных инфекций (в частности разрушающих специфически вирусные РНК). Через образование диаденозинтрифосфата (Ар3А) и, возможно других ApnA, ТРСаза может принимать участие в регуляции таких процессов, как стимуляция секреции белков железами, активностей ферментов, участвующих в регуляции сердечно-сосудистой системы и передаче нервного сигнала (через мембранные АТФазы). В этом плане, становится, отчасти, ясным относительно высокое содержание ТРСазы в поджелудочной железе, которая является мощным секретирующим органом. Предстоит более точно установить сложную сеть реакций, регулирующих процессы жизнедеятельности и роль и место ТРСазы в них. Открывается перспектива конкретных направлений применения этого фермента в медицине.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1
Берут 2 кг железы не позднее 30-40 мин после забоя животного, тщательно отбираются железы с минимальным количеством жира, железу дополнительно очищали от жира. Для транспортировки к месту обработки железу помещали в лед, железу измельчали, пропуская через (предварительно промытую и охлажденную) мясорубку в течение 5 мин прямо в бадью с 2,2 л охлажденного буфера А (25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТА, 0,1 мМ 2-меркаптоэтанол, 0,2 мМ L-триптофана 2×10-4 М, и 1,0 мМ Mg-АТФ). Все дальнейшие процедуры проводили на холоде при +4°С. Экстракт перемешивали в течение 20 мин и отделяли экстракт от жмыха центрифугированием. К полученным 2 л экстракта при перемешивании добавляли 0,5 л 5%-ного стрептомицин сульфата до конечной концентрации 1% (прерывающейся тонкой струей). После 20 мин инкубации без перемешивания осадок нуклеиновых кислот удаляли центрифугированием при 3000 об/мин (5000 g). Осадок отбрасывали. К супернатанту добавляли 690 г сульфата аммония, (предварительно перетертый до порошкового состояния), медленно при умеренном перемешивании на холоде до конечной концентрации 40%-насыщения в течение 20 мин. Оставляли для формирования осадка на 20 мин. Затем осадок осаждали центрифугированием при среднем ускорении 10000-12000 g. Супернатант сливали в отдельную бадью и к полученным 3,2 л добавляли на холоде, как указано выше, 316 г сульфата аммония до 60%-насыщения. Оставляли экстракт для формирования осадка на ночь.
Часть супернатанта аккуратно сливают через край бадьи, стараясь не взмутить осадок. Оставшуюся смесь 1,5 л центрифугируют при 15000 g. Супернатант отбрасывают, остаток жидкости тщательно удаляют со стенок центрифужных стаканов фильтровальной бумагой. Осадок затем растворяют в 50 мл буфера А, содержащего 0,05 М хлорид аммония NH4Cl. Раствор наслаивают на колонку с ДЕ-52 объемом 150 мл и элюируют до достижения минимальной оптической плотности (не выше 0,1 о.е./мл при 280 нм). Примесные белки удаляли элюцией буфером А, содержащим 0,09 М NH4Cl. Вышедший белковый пик отбрасывали. После снижения оптической плотности до минимума (около 0,1 о.е./мл), очищенную фракцию исходной и модифицированной форм ТРСазы снимали буфером А, содержащим 0,16 М NH4Cl. Профиль элюции с колонки изображен на фиг.1. Отбирали центральную часть пика в объеме 80 мл и осаждали смесь исходной (около 20%) и модифицированных форм ТРСазы (около 75% формы и 5% формы 24+14 кД, добавляя 54 мл насыщенного (100% насыщения) сульфата аммония, до достижения 60% насыщения. Для этого добавляли по каплям на холоду насыщенный 100%-й раствор сульфата аммония до выпадения осадка, продолжали добавлять до 60% насыщения и оставляли на ночь в холодильнике для формирования осадка. Смесь центрифугировали при 10000 g, остатки супернатанта убирали фильтровальной бумагой. Осадок растворяли в 40 мл буфера А, содержащего 0,1 М NH4Cl. К раствору добавляли 40 мкл 1 М раствора ФМСФ для ингибирования протеаз (из расчета 1 мкл на 1 мл раствора). Оставляли на 20 мин в вытяжном шкафу при перемешивании для полного растворения ПМСФ. Затем раствор наносили на колонку с ионообменной смолой ДЕ-52 объемом 50 мл уравновешенную буфером А, содержащим 0,1 М NH4Cl, 1 мМ ПМСФ, смывали не связавшейся на колонке белок до достижения оптической плотности в элюате не выше 0,1 о.е./мл при 280 нм, затем смывали фракции линейным градиентом соли хлорида аммония (0,1 М - 0,16 М соли). Элюировали со скоростью 25 мл/час. Собирали фракции по 2,5 мл. Профиль элюции приведен на фиг.2. Чистая модифицированная форма фермента выделялась в виде большого пика во второй половине градиента. Последующие пики представляли собой либо примесные белки и форму 40×40 кД, либо протеолизованную форму ТРСазы (24+14 кД). Собирали фракции №22-35, обладающие слабой ферментативной активностью и представляющие гомогенную форму по данным денатурирующего электрофореза в полиакриламидном геле. К 30 мл объединенного элюата добавляли по каплям при перемешивании 20 мл раствора сульфата аммония 100%-насыщения. После сформирования осадка центрифугировали при 10000 g. Супернатант отбрасывали. Осадок растворяли в 2,5 мл буфера А. Концентрация белка составила 15,2 мг/мл, конечный объем - 3 мл, то есть получено 45,6 мг модифицированной формы фермента ТРСазы. Модифицированную форму фермента хранили в аликвотах по 1 мл при -70°С. Выход модифицированной формы фермента, исходя из массы железы в 2 кг, составил около 0,0023%, со степенью чистоты 98%.
Во втором подходе уже очищенный стандартной процедурой фермент подвергали обработке с активированным углем (5%-ной водной суспензией в буфере А, без L-триптофана и АТФ) для снятия эндогенного триптофана, при этом фермент переходил в модифицированную форму под действием остаточных примесей эндогенных протеаз в течение суток при 8°С. Фермент концентрацией 5 мг/мл инкубировали при перемешивании на холоду (+4°С) в течение 30 мин в буфере состава 20 мМ трис-HCl, рН 7,5, 0,1 мМ 2 - меркаптоэтанол в присутствии 5%-ной суспензии активированного угля. Суспензию центрифугировали на холоду (+4°С) при 10000 g в течение 5 мин, супернатант разбавляли тем же буфером до 2,5 мг/мл и оставляли на ночь при 8°С. Из взятых 5,0 мг препарата ТРСазы получали 4,5 мг модифицированной формы с выходом 90% и чистотой 99%.
Мини-метод получения модифицированной ТРСазы включал нанесение препарата исходной ТРСазы концентрацией 15 мг/мл в 20 мМ трис-HCl, рН 7,5, объемом 0,1 мл на угольный фильтр. Угольный фильтр с нанесенным ферментом инкубировали при 4°С в течение 30 мин и смывали 1 мл буфера А, без L-триптофана и АТФ, затем разбавленный раствор инкубировали в холодильнике при 8°С в течение ночи.
Исходную ТРСазу брали в количестве 5 мг. После проведения процедуры получено 4,5 мг - выход 90%.
Модифицированный фермент также получали ограниченным протеолизом исходного фермента эластазой. Для этого исходный фермент ТРСазы в концентрации 2,5 мг/мл, предварительно обработанный активированным углем для удаления эндогенного триптофана (см. выше), инкубировали с низкими концентрациями эластазы (0,12 мг/мл в буфере трис-HCl, рН 7,5) в течение 20 мин при 25°С в присутствии 0,1 мМ ЭДТА, 1 мМ 2 - меркаптоэтанола и субстратов - 0,1 мМ L-триптофана, 1,0 мМ АТФ. Реакцию останавливали добавлением ингибитора протеаз 1 мМ ФМСФ или 5 мМ диизопропилфторфосфата (ДФФ). В случае ДФФ добавление осуществляли в очках и перчатках под тягой и оставляли под тягой при комнатной температуре, при перемешивании на качалке для полного разрушения ДФФ быстро разлагающегося в водной среде. Контроль образования модифицированной формы осуществляли с помощью денатурирующего электрофореза в ПААГ. Выход составил 4,5 мг модифицированного фермента, то есть 90% с чистотой 99% по данным денатурирующего белкового электрофореза в полиакриламидном геле (ПААГ).
Функциональную активность биологически активной модифицированной формы оценивали по стандартному МТТ тесту (Lee W.S., Harder J.A., Yoshizumi M. et al. Progesterone inhibits arterial smooth cell proliferation // Nat. Med. - 1997. - №3. - P. 1005-1008.)
Пример 2
Аналогичен примеру 1, за исключением того, что первое солевое фракционирование осуществляли при 50% насыщения сульфата аммония. Было получено 40,3 мг модифицированной формы фермента со степенью чистоты - 99%.
Второй метод получения модифицированной ТРСазы аналогичен соответствующему разделу примера 1, за исключением инкубации освобожденной от эндогенного триптофана препарата фермента в течение 2 суток при 8°С. Из взятых на эксперимент 5 мг исходной формы получилось 4 мг модифицированной формы, то есть выход составил 80%. Мини-метод при использовании инкубации при 8°С в течение 2-х суток - получалось 3,8 мг модифицированной формы, то есть выход составлял 76%.
Пример 3
Аналогичен примеру 1, за исключением того, что первое солевое фракционирование осуществляли при 30% насыщения сульфата аммония. Было получено 42,10 мг препарата со степенью чистоты 90%(по данным электрофореза в денатурирующем ПААГ).
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 1, но инкубация в 5%-ном активированном угле длилась 3 часа. Выход составил 3,2 мг и 3,5 мг или 64% и 70%, соответственно.
Пример 4
Аналогичен примеру 1, за исключением того, что второе солевое фракционирование осуществляли при 50% насыщения сульфата аммония. Было получено 38,92 мг препарата фермента (выход - 0,0019%) со степенью чистоты 99%.
Методику получения модифицированной формы проводили, как в примере 1, но удаляли из буфера инкубации L-триптофан и АТФ. При этом получено 2,0 мг (выход 40%) модифицированной ТРСазы с чистотой 50%.
Пример 5
Аналогичен примеру 1, за исключением того, что второе солевое фракционирование осуществляли при 70% насыщения сульфата аммония.
Было получено 42,14 мг препарата (выход 0,0021%) со степенью чистоты 90%.
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 1, но инкубация в 5%-ном активированном угле длилась 3 часа. Выход составил 3,2% и 3,5% или 64% и 70%, соответственно.
Пример 6
Аналогичен примеру 2, за исключением того, что опускалась стадия элюции при ионообменной хроматографии при 0,09 М NH4Cl. Было получено 38,09 мг (выход 0,0019%) препарата со степенью чистоты 90%.
Получение модифицированной формы методом ограниченного протеолиза в присутствии субстратов проводили, как в случае 1, но использовали вдвое большие концентрации эластазы - 0,24 мг/мл. Выход составил 3,0 мг или 60%, с чистотой 90%.
Пример 7
Аналогичен примеру 2, за исключением того, что ионная сила раствора при элюции основной фракции была увеличена до 0,16 М NH4Cl, а градиент по соли NH4Cl торой ионообменной колонке составлял от 0,1 М до 0,2 М. Было получено 35,10 мг препарата (выход 0,00175%) со степенью чистоты 90%.
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 1, но концентрации исходных препаратов ТРСазы разбавлялись в 5 раз (1 мг/мл и 0,5 мг/мл, соответственно). Выходы составил 3,8 мг и 3,5 мг или 76% и 70%, соответственно.
Пример 8
Аналогичен примеру 1, за исключением того, что была включена стадия добавления ингибитора протеаз ФМСФ после стадии удаления примесных нуклеиновых кислот. Было получено 10,60 мг препарата со степенью чистоты 80%. То есть добавление ингибитора протеаз на этой стадии резко снижает выход модифицированной формы ТРСазы.
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 1, но после обработки активированным углем в смесь добавляли ингибитор протеаз ФМСФ до 1,0 мМ. Выход составил по модифицированной форме ТРСазы 1,2 мг (24%) с чистотой 20%. То есть добавление ингибитора протеаз на данной стадии фактически блокировало переход к модифицированной форме.
Пример 9
Аналогичен примеру 1, за исключением того, что была исключена стадия добавления ФМСФ перед нанесением на вторую ионообменную колонку с линейным градиентом элюции. Выход составил 22 мг со степенью чистоты 75%. То есть использование ингибиторов протеаз на последней колоночной стадии важна для получения хорошего выхода и чистоты модифицированной формы ТРСазы.
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 8, но после обработки активированным углем в смесь добавляли эластазу в концентрации 0,12 мг/мл с последующей инкубацией в течение ночи при 8°С. Выход составил по модифицированной форме ТРСазы 0,5 мг (то есть 10%) с чистотой 10% по отношению к модифицированной форме. То есть добавление эластазы на данной стадии приводила фактически к полному протеолизу ТРСазы.
Пример 10
Аналогичен примеру 9, за исключением того, что отбирали все пики фермента при втором фракционировании на ионообменнике, получаемые при линейном градиенте соли хлорида аммония. Выход модифицированной формы фермента составил 31,55 мг (0,0016%) со степенью чистоты 80%.
Второй и мини-метод получения модифицированной ТРСазы аналогичен примеру 9, также после обработки активированным углем в препарат после удаления активированного угля добавляли эластазу в концентрации 0,12 мг/мл, но инкубацию осуществляли при 8°С в течение 1 часа. Выход составил по модифицированной форме ТРСазы 2,5 мг (то есть 50%) с чистотой 80% по отношению к модифицированной форме.
Сравнительный анализ технико-экономических показателей предлагаемого и известного способа приведен в таблице 1.
| Таблица 1 | ||
| Способ | Выход (% от исходного сырья) | Содержание примесных белков и продуктов протеолиза |
| Предлагаемый | 0,0025 | 1% |
| Известный | 0,00025 | 3% |
Изобретение позволит получить препарат высокой чистоты и биологической активности по ингибированию процессов ангиогенеза. Метод представляет собой одну из первых методик получения препаративных количеств модифицированной формы ТРСазы, обладающей дополнительной неканонической антиангиогенной активностью.
Способ получения модифицированной формы ТРСазы отличается от известного существенно большим выходом препарата (в 10 раз) за счет оптимизации процедур и применения буферов с субстратами катализируемой реакции, которые и обеспечивали накопление по ходу фракционирования модифицированной формы ТРСазы в осаждаемых и элюируемых с колонок фракциях. Цикл экспериментов по разработке методик был проведен на двух источниках сырья - крупный рогатый скот (КРС) и свиньи.
Способ, представляя собой один из первых методик получения модифицированной биологически активной формы ТРСазы, существенно сокращен по времени исполнения за счет замены нескольких колоночных стадий на 1-2. Использована оригинальная схема получения модифицированной формы, основанная на применении природных эндогенных примесных протеаз, которые моделируя процессы, происходящие in vivo в тканях, приводят к получению препаративных количеств гомогенного модифицированного препарата ТРСазы.
Литература
1. Methods Enzymol. 1979; 59:234-257, Kisselev L.L. et al., Tryptophanyl-tRNA synthetase from beef pancreas.
2. Nat Rev Mol Cell Biol. 2010, 11(9):668-674. Gum M., Yang X.L., Schimmel P. New functions of aminoacyl-tRNA synthetases beyond translation.
3. Nat Rev Cancer. 2011, 11(10):708-18. Kirn S., You S., Hwang D. Aminoacyl-tRNA synthetases and tumorigenesis: more than housekeeping.
4. Heart Vessels. 2011, 26(1):69-80. Zeng R, Chen Y.C, Zeng Z., Liu W.Q., Jiang X.F., Liu R., Qiang O., Li X. Effect of mini-tyrosyl-tRNA synthetase/mini-tryptophanyl-tRNA synthetase on ischemic angiogenesis in rats: proliferation and migration of endothelial cells.
5. Proc Nati Acad Sci USA. 2008, 105(32):11043-11049. Park S.G., Schimmel P., Kim S. Aminoacyi tRNA synthetases and their connections to disease.
1. Способ получения модифицированной формы триптофанил-тРНК-синтетазы (ТРСазы), включающий измельчение тканей поджелудочной железы животных, экстрагирование, отделение экстракта от жмыха, осаждение и удаление примесных нуклеиновых кислот с помощью стрептомицин сульфата, повторное осажден