Вектор экспрессии для трансгенного введения в клетки и ткани млекопитающих с регулируемым невирусным промотором
Иллюстрации
Показать всеИзобретение относится к области молекулярной генетики и клеточной биологии и касается вектора экспрессии для трансгенного введения в клетки и ткани млекопитающих. Представленный вектор сконструирован на основе векторной плазмиды pEGFP-N1, содержащий фрагмент ДНК, кодирующий промотор гена белка теплового шока hsp70 Drosophila melanogaster и регуляторную последовательность перед ним, содержащую элементы теплового шока (HSE) в различном количестве, зону полилинкера, ген зеленого флуоресцентного белка (GFP) и ген устойчивости к неомицину, при этом промотор способен активироваться под действием температуры теплового шока млекопитающих или при токсическом воздействии. Такой вектор активируется при повышении температуры до 38°С или токсическом воздействии на трансгенные клетки или ткань млекопитающих. Активность входящего в состав вектора промотора можно регулировать, то есть можно вызвать или его гиперактивность, или его слабое «подтекание» или блокировать активность данного промотора путем насыщения регуляторной области элементами HSE. Изобретение может быть использовано для получения трансгенных препаратов, где исследуемый или используемый ген будет находиться под контролем регулируемого невирусного промотора. 2 з.п. ф-лы, 20 ил., 2 пр.
Реферат
Изобретение относится к биотехнологии и медицины, в частности генной инженерии (молекулярной генетике и клеточной технологии), и касается векторов экспрессии для введения терапевтических генов в клетки и ткани млекопитающих, содержащих регулируемый невирусный промотор, в частности промотор, активируемый повышением температуры или токсическим воздействием на трансгенные клетки или ткань млекопитающих. Изобретение предназначено для получения трансгенных препаратов, где исследуемый ген будет находиться под контролем регулируемого промотора.
Широкое распространение при лечении различных заболеваний приобретают методы клеточной и генной терапии с использованием стволовых клеток, которые обладают большим потенциалом к развитию в различных направлениях. Существенное значение при этом имеет разработка способов повышения их жизнеспособности и управления путями их специализации при операциях трансплантации. Совершенно очевидно, что в таком случае необходим поиск генетических регуляторных элементов, способных трансформировать стволовые клетки в направлении, нужном для успешного осуществления клеточно- и генно-терапевтического лечения. В данном изобретении предлагаются регуляторные элементы генома дрозофилы, которые имеют определенные преимущества перед ретровирусными элементами в силу своей большей безопасности для терапевтического применения. В результате появляется возможность повышения эффективности генной и клеточной терапии при лечении многих заболеваний, требующих использования метода трансплантации тканей. Кроме того, данные векторы можно использовать в исследовательских работах, направленных на изучение последствий временного воздействия того или иного гена на клетку или ткань.
В ходе исследований было обнаружено, что промотор гена белка теплового шока Drosophila melanogaster может активизироваться не только в тканях дрозофилы, но и в клетках и тканях млекопитающих (1-3) Павлова и др., 2005; Андреева и др. 2006). Описанные в статьях исследования были проведены при использовании только промотора без элементов теплового шока (HSE). Таким образом, на основании полученных результатов был получен вектор, содержащий промотор гена белка теплового шока дрозофилы для активизации вводимых генов с целью использования его в клетках млекопитающих.
Далее было обнаружено, что активность промотора изменяется при использовании в регуляторной зоне элементов теплового шока. При использовании элементов теплового шока активация данного промотора отличается от активации промотора гена белка теплового шока млекопитающих снижением градусности (для Phsp70 человека - 41-42°С, для Phsp70 дрозофилы в тканях млекопитающих - 39°С). Было получено два вектора, содержащих промотор гена белка теплового шока Hsp70 Drosophila melanogaster с регуляторной последовательностью (4 элемента теплового шока (HSE) в одном случае и 8 элементов теплового шока в другом), зону полилинкера, ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину. Полученные векторы отличаются регуляторной зоной промотора гена белка теплового шока Drosophila т., что сказывается на изменении их активации. В регуляторной зоне данного промотора обнаруживали консервативные последовательности - 5'-CNNGAANNTTCNNG-3', где N - любой нуклеотид (Amin, 1988) (4), основное значение в данной последовательности имеет наличие 3-нуклеотидный фрагмент GAA, названного HSE элементом. Мы обнаружили, что насыщенность регуляторной области HSE элементами влияет на активность промотора гена белка теплового шока Hsp70 Drosophila melanogaster в клетках млекопитающих. Промотор гена белка теплового шока дрозофилы с регуляторной зоной, богатой элементами теплового шока (HSE), выгодно отличается от ранее известных промоторов, используемых в векторах для трансгенного введения в клетки и ткани. Разработанные векторы обладают промотор-регулируемой областью и промотором, который не имеет вирусной природы, активность данного промотора можно регулировать, то есть можно вызвать или его гиперактивность, или его слабое «подтекание» или блокировать активность данного промотора. Данные элементы теплового шока (HSE) необходимы для модуляции активности гена hsp70, которая происходит через связывание с HSE белковыми транскрипционными факторами HSF или HSTF (heat shock transcription factors). Такая регуляция позволяет контролировать активность данного промотора как при тепловом шоке, так и при токсическом воздействии на организм. При этом данный регуляторный эффект играет огромную роль при эмбриональном развитии организма и дифференцировки органов и тканей. У млекопитающих обнаружены HSF1, 2 и 4 (Morimoto 1998, Wu et al. 1995) (13).
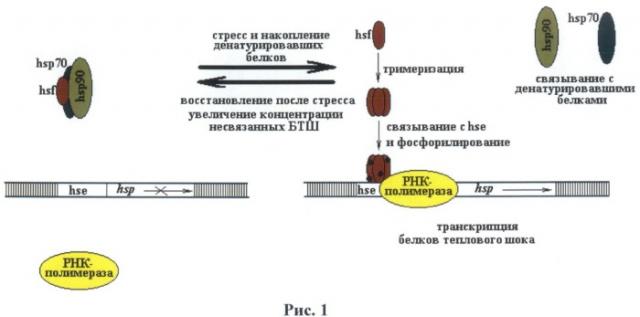
Недостающий HSF3 описан только у птиц. HSF2 принимает участие в конститутивной экспрессии белка теплового шока, а также участвует в эмбриогенезе (Loones et al. 1997). HSF4 участвует в дифференцировке клеток и тканей, один из известных примеров его участия это развитие линзы глаза у млекопитающих (Wu et al., 1995; Mitsuaki Fujimoto et al., 2008) (6). Таким образом, основным участником процесса активации экспрессии гена белка теплового шока при изменении температуры, стрессе или токсичности является HSF1. HSF1 участвует в индуцибельном характере транскрипции hsp70 при тепловом шоке, токсичности или стрессе. Обнаружено, что последовательность HSF1 довольно консервативна в эволюции, так HSF1 D melanogaster может индуцировать транскрипцию hsp70 млекопитающих. Также описано и обратное взаимодействие (HSF1 млекопитающих индуцирует транскрипцию hsp70 D. melanogaster). При тепловом шоке HSF1 тримеризуется, транспортируется в ядро и связывается с HSE. При этом обнаружено, что количество HSE зон коррелирует с изменением активации промотора hsp70 (интервал времени активации, срок активации и эффективность повторной активации). На рисунке 1 представлена схема процесса активации hsp70 промотора млекопитающих.
При нашем исследовании клеток млекопитающих, трансфицированных конструкциями с маркерными белками под управлением hsp70 дрозофилы, было обнаружено, что данный промотор способен активировать чужеродный ген в клетках млекопитающих. Было обнаружено, что при помещении промотора hsp70 дрозофилы в клетки млекопитающих активация промотора происходила при температуре теплового шока млекопитающих: 41-44°С.
Полученные данные свидетельствуют о том, что HSF млекопитающих способен взаимодействовать с промотором HSP70 гена и активировать его. Однако было обнаружено, что использование увеличенного количества встроенных HSE зон в регуляторную область промотора hsp70 дрозофилы снижало температуру активации до 39°С и изменяло активность экспрессии контролируемого гена. Данные результаты являются новыми, так как ранее утверждалось, что исследуемый промотор в клетках млекопитающих активизируется при 42°С, что крайне травматично для клеток, и снижает возможности использования данного промотора в практике (Glazenburg К et al.l992, Roigas J. Et al. 1997) (8). По всей видимости, данные отклонения в регулируемости промотора гена белка теплового шока hsp70 дрозофилы объясняется тем, что помимо триммера HSF в регуляции изучаемого промотора также участвует белок CHBF (constitutive HSE-binding factor). Данный белок в отсутствие воздействия теплового шока конститутивно связан с регуляторной областью промотора hsp70, причем было обнаружено, что даже если спровоцировать тримеризацию HSF, активации hsp70 все равно не произойдет. Белок CHBF освободит место для триммера только после воздействия теплового шока (или другого стрессового воздействия) (Jacoby et al., 1994) (11). В условиях теплового шока CHBF вытесняется HSF. Было обнаружено, что нормальных клетках млекопитающих мягкий тепловой шок (41°С), хотя и вызывает активацию HSF, но не приводит к индукции Hsp70, и CHBF остается связанным с промотором гена hsp70. При воздействии более высоких температур CHBF покидает промотор и замещается HSF. Вероятно, на этом и основано изменение температурного интервала для промотора hsp70 дрозофилы в трансфицированных клетках млекопитающих. CHBF млекопитающих имеет меньшую гомологию с участком связывания и соответственно освобождает место для триммера при более низкой температуре, чем температура теплового шока млекопитающих, сдвигая таким образом температурный интервал активности промотора до 39°С.
В генетических конструкциях, используемых для введения гена в клетку, обычно применяются вирусные промоторы (Loser et al., 1998) (12). Одним из таких промоторов, применяемых in vitro, является CMV-промотор человеческого цитомегаловируса. Промотор состоит из, по крайней мере, 4-х типов повторных элементов, которые присутствуют 3-5 раз в энхансерной части промотора и которые формируют комплексы с ядерными белками. Однако следует отметить, что подобные промоторы обладают рядом недостатков: вирусная природа промотора и его нерегулируемость. Гиперэспрессия так же вредна, как и отсутствие экспрессии «терапевтического» гена. Для решения данных проблем специалисты занимаются поиском регулируемых невирусных промоторов. Один из предложенных вариантов регулируемого промотора - это использование трансактиваторных систем с подавлением тетрациклином US 2009149409. Недостаток такого промотора - это использование антибиотика (тетрациклина) для регуляции. Как известно, тетрациклин - это антибиотик широкого спектра действия. Его применяют для лечения самых различных инфекционных заболеваний: пневмонии, гнойного плеврита, ангины, бронхита, дифтерии, коклюша, скарлатины, дизентерии, остеомиелита, менингита и других. При этом данный антибиотик имеет ряд побочных эффектов. Со стороны пищеварительной системы: снижение аппетита, рвота, диарея, тошнота, глоссит, эзофагит, гастрит, изъязвление желудка и 12-перстной кишки, гипертрофия сосочков языка, дисфагия, гепатотоксическое действие, повышение активности «печеночных» трансаминаз, панкреатит, кишечный дисбактериоз. Со стороны нервной системы: повышение внутричерепного стороны органов кроветворения: гемолитическая анемия, тромбоцитопения, нейтропения. Со стороны мочевыделительной системы: азотемия, гиперкреатининемия. Аллергические и иммунопатологические реакции: макулопапулезная сыпь, гиперемия кожи, ангионевротический отек, анафилактоидные реакции, лекарственная СКВ, фотосенсибилизация. Прочие: суперинфекция, кандидоз, гиповитаминоз В, гипербилирубинемия. При этом следует отметить, что опасно также привыкание к антибиотику и нарушение длительного регулирования данного промотора. Таким образом, в качестве терапевтического регулируемого промотора данная система не подходит.
Вообще на сегодняшний день используемые регулируемые промоторы можно подразделить на три группы: 1. промоторы регулируемые антибиотиками (к данной группе относится и тетрациклинзависимая экспрессия) (Gossen and Bujard, 1992; Fussenegger et al., 2000; Weber et al, 2002) (9). Известны как минимум три транскрипционные системы управления экспрессии промоторов антибиотиком тетрациклином (Gossen and Bujard, 1992) (9), стрептограмином (Fussenegger etal., 2000)(7), и макролиды (Weber et al., 2002) (19), 2. гормониндуцибельные экспрессии. Известны как минимум три гормониндуцирующихся системы для регуляции экспрессии: с использованием эстрогенов (Braselmann., 1993) (15), с использованием антагониста прогестерона (мифепристон) (Wang et al., 1994) (18), и с использованием экдизона гормона линьки насекомых (No et al., 1996) и химически индуцибельные экспрессии. Например, использование химически димеризации FKBP (FK506-связывающий белок) и FRAP (FKBP рапамицин-ассоциированный белок) (Pollock and Clackson, 2002) (16).
Все эти способы замкнуты на участие некого вещества, активирующего или подавляющего активность исследуемого промотора. Однако и антибиотики и прогестероновые антагонисты и тем более химически синтезированные вещества не могут не влиять на организм в целом. Данный недостаток отсутствует при использовании промотора, активируемого повышением температуры.
Таким образом, технической задачей изобретения является получение вектора для введения терапевтических генов в клетки млекопитающих под контроль невирусного промотора гена белка теплового шока с регуляторной последовательностью.
Поставленная техническая задача и технический результат достигается вектором экспрессии для трансгенного введения в клетки и ткани млекопитающих, сконструированный на основе векторной плазмиды pEGFP-N1, содержащий фрагмент ДНК, кодирующий промотор гена белка теплового шока hsp70 Drosophila melanogaster и регуляторные последовательности перед ним, содержащую элементы теплового шока HSE, зону полилинкера, ген зеленого флуоресцентного белка (GFP) и ген устойчивости к неомицину, при этом промотор способен активироваться под действием температуры теплового шока млекопитающих или токсическом воздействии.
Вектор экспрессии содержит фрагмент ДНК, который имеет размер 553 п.о., и регуляторную последовательность, содержащую четыре элемента теплового шока HSE.
Вектор экспрессии содержит фрагмент ДНК, который имеет размер 953 п.о., и регуляторную последовательность, содержащую восемь элементов теплового шока HSE.
В частности, согласно изобретению получено два вектора, содержащих промотор гена белка теплового шока hsp70 Drosophila melanogaster с регуляторной последовательностью, содержащей 4 элемента теплового шока (HSE) в одном случае (В7) и 8 элементов теплового шока (HSE) в другом (7), зону полилинкера, ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину.
Полученные векторы отличаются регуляторной зоной промотора гена белка теплового шока Drosophila т., что сказывается на изменении их активации. В регуляторной зоне данного промотора введены 3-нуклеотидные фрагменты GAA, называемые HSE элементами.
В частности, заявленное изобретение касается вектора экспрессии В7 размером 4,684 кб, сконструированного на основе векторной плазмиды pEGFP-Nl, в который вставлен фрагмент ДНК размером 553 п.о., содержащий фрагмент ДНК, кодирующий промотор гена белка теплового шока hsp70 Drosophila melanogaster и регуляторную последовательность перед ним, содержащую четыре элемента теплового шока (HSE), обеспечивающий регулируемую экспрессию поставленных под его контроль генов при повышении температуры в клетках и тканях млекопитающих. Данный вектор также содержит зону полилинкера и ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину.
Изобретение касается также, в частности, и вектора экспрессии F7 размером 5,067 кб, сконструированный на основе векторной плазмиды pEGFP-Nl, в который вставлен фрагмент ДНК размером 953 п.о., содержащий фрагмент ДНК, кодирующий промотор гена белка теплового шока hsp70 Drosophila melanogaster и регуляторную последовательность перед ним, содержащую восемь элементов теплового шока (HSE), обеспечивающий регулируемую экспрессию поставленных под его контроль генов при повышении температуры в клетках и тканях млекопитающих. Данный вектор также содержит зону полилинкера и ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину.
Ниже приводится общий пример получения векторов по изобретению.
Получение векторов.
Рестрикцию плазмидной ДНК проводили в пластиковых пробирках объемом 1,5 мл производства фирмы «Eppendorf». Реакционная смесь общим объемом 20 мкл включала в себя: 0,5-5 мкг плазмидной ДНК, рестриктазу производства фирм Promega или Fermentas из расчета 1 единица фермента на 1 мкг ДНК, соответствующий 1х буферный раствор производства тех же фирм. Рестрикцию проводили в течение 1 ч при 37°С. Полученные продукты анализировали при помощи электрофореза в агарозном геле.
Для разделения фрагментов ДНК и определения количества выделенной ДНК использовали в зависимости от размера фрагментов, 0,7-1,5% агарозный гель с добавлением бромистого этидия (10 мкг на 1 мл геля). Электрофорез проводили в однократном буфере ТАЕ при напряжении 1,5-2 В на см2 геля.
Выделение фрагментов ДНК из геля проводили с помощью набора реагентов GFX PCR DNA and Gel Band Purification Kit, предоставляемого фирмой Amersham.
После проведения электрофореза из геля вырезали необходимые для дальнейшей работы фрагменты ДНК и помещали их в отдельные пробирки. В каждую пробирку добавляли по 300 мкл Capture Buffer(1:1) и помещали в термостат (65°С) на 10-15 мин. Тщательно перемешивали и переносили раствор на колонку, помещенную в коллекционную пробирку. Выдерживали 1 минуту при комнатной температуре, центрифугировали 30 с, 13000 об/мин. Жидкость из коллекционной пробирки сливали, в колонку приливали 500 мкл Wash Buffer, центрифугировали 30 с, 13000 об/мин. Колонку переносили в чистую пробирку объемом 1,5 мл, на мембрану колонки аккуратно наносили 50 мкл бидистиллированной воды, инкубировали 1 мин при комнатной температуре. Центрифугировали 1 мин, таким образом происходила элюция ДНК. Концентрацию ДНК в полученном растворе определяли при помощи электрофореза в агарозном геле.
Вставку лигаровали. К 100-200 нг вектора добавляли соответствующее количество вставки в молярном соотношении от 1:1 до 1:8, 1 мкл 10х буфера для Т4 ДНК-лигазы, 1 мкл Т4 ДНК-лигазы и доводили объем до 10 мкл бидистиллированной водой. Смесь инкубировали в течение ночи при Т=+4°С, далее ею трансформировали компетентные клетки.
Приготовление компетентных клеток.
Выращивали ночную культуру E.coli штамма XL-Blue-1 на среде SOB. После этого заражали 50 мл среды SOB ночной культурой и выращивали до плотности: 0,35-0,4 при 600 нм. Полученную культуру клеток переносили в охлажденный центрифужный стакан (объем 50 мл) и инкубировали на льду 15 мин. Затем клетки осаждали центрифугированием (3000 об/мин, 10 мин) и тщательно удаляли супернатант. Клетки суспендировали в 15 мл раствора RF-1 и инкубировали суспензию в ледяной бане в течение 15 минут. Затем клетки осаждали центрифугированием (3000 об/мин, 15 мин) и тщательно удаляли супернатант. Осадок суспендировали в 4 мл раствора RF-2). После этого суспензию клеток разливали порциями по 200 мкл по предварительно охлажденным криопробиркам фирмы «Eppendorf» и хранили при -70°С. Все операции, кроме центрифугирования, проводили под ламинаром.
Трансформация компетентных клеток плазмидами.
Порции компетентных клеток (200 мкл) размораживали при 0°С в течение 15 мин. Далее в каждую пластиковую пробирку, содержащую компетентные клетки, добавляли 5-50 нг плазмидной ДНК и инкубировали при 42°С 2 мин. Далее смесь инкубировали при 0°С в течение 15 мин. После этого в каждую пробирку добавляли 0,8 мл среды LB и инкубировали на шейкере 1 ч при 37°С. Затем клетки сеяли на чашки с селективной средой (50 мкг/мл ампициллина или канамицина) в зависимости от наличия в плазмиде гена устойчивости к тому или иному антибиотику) и инкубировали в термостате при 37°С в течение ночи. Выросшие одиночные колонии переносили в 2 мл среды LB (50 мкг/мл ампициллина или канамицина) и растили 12-14 ч при 37°С на шейкере.
Для анализа полученных конструкций использовали выделение плазмидной ДНК в малом и большом объеме.
Выделение плазмидной ДНК из Е. coli в малом объеме.
1,5 мл ночной культуры осаждали 5 мин при 13000 об/мин в центрифуге фирмы «Eppendorf». Осадок ресуспендировали в 100 мкл TELT с добавлением 10 мкл лизоцима (10 мг/мл) и инкубировали пробирки при 95°С 3 мин, а затем 5 мин во льду. После этого пробирки с лизатом клеток центрифугировали 15 мин при 13000 об/мин. Супернатант отбирали в отдельные пробирки и добавляли равный объем смеси фенол/хлороформ (1:1), тщательно встряхивали и центрифугировали 10 мин, 13000 об/мин. Верхнюю фазу отбирали, переносили в чистую пробирку, добавляли равный объем хлороформа, центрифугировали 10 мин, 13000 об/мин. Верхнюю фазу отбирали, добавляли 1/10 объема 3 М ацетата натрия, рН 4,8 и равный объем изопропанола. Пробирки выдерживали 20 мин при -20°С, центрифугировали 20 мин при 13000 об/мин, супернатант удаляли, осадок промывали 75% этиловым спиртом и после высушивания растворяли в 20 мкл деионизированной воды.
Выделение плазмидной ДНК из E.coli в большом объеме.
Выращивали ночную культуру в 50 мл среды LB с добавлением 50 мкг/мл ампициллина или канамицина (в зависимости от наличия в плазмиде гена устойчивости к тому или иному антибиотику). Полученную культуру помещали в пластиковую пробирку на 50 мл и центрифугировали 15 мин при 4000 об/мин, 4°С. Супернатант удаляли, осадок ресуспендировали в 2,4 мл раствора 1 с добавлением 20 мкл лизоцима (до конечной концентрации 2-3 мкг/мл) и инкубировали 20 мин на льду. Затем добавляли 4,8 мл раствора 2, аккуратно перемешивали, выдерживали на льду 10 мин. После этого приливали 3 мл 3 М ацетата натрия, рН 4,8, перемешивали, инкубировали при 0°С 20 мин, центрифугировали 20 мин (8900 об/мин, 4°С). Супернатант переносили в чистую пробирку, добавляли равный объем изопропанола, выдерживали 1 ч при -20°С, затем центрифугировали 20 мин (8900 об/мин, 4°С). Супернатант удаляли, осадок промывали 75% этиловым спиртом и высушивали. Далее осадок растворяли в 0,5 мл бидистиллированной воды и переносили в пробирку на 1,5 мл фирмы «Eppendorf» (данную процедуру повторяли дважды), добавляли 10 мкл РНКазы (10 мг/мл) и инкубировали 30 мин при 37°С. После этого приливали равный объем фенола, встряхивали, центрифугировали 10 мин в центрифуге фирмы «Eppendorf» при 13000 об/мин, верхнюю фазу переносили в чистую пробирку и приливали равный объем смеси фенол/хлороформ (1:1), тщательно перемешивали и центрифугировали 10 мин, 13000 об/мин. Верхнюю фазу отбирали, добавляли к ней равный объем хлороформа, встряхивали, центрифугировали при тех же условиях. Верхнюю фазу переносили в чистую пробирку, добавляли 1/10 объема 3 М ацетата натрия, рН 4,8, и равный объем изопропанола, выдерживали 20 мин при -20°С, центрифугировали 20 мин при 13000 об/мин, супернатант сливали, осадок промывали 75% этанолом, высушивали и растворяли в 50 мкл бидистиллированной воды. Раствор выделенных плазмид хранили при -20°С.
Клонирование.
Эффективность формирования комплекса инициации транскрипции его стабильности зависит от присутствия ТАТА-подобной последовательности в окрестностях пары оснований. Такие последовательности существуют в промоторе hsp70A D. melanogaster до точки старта транскрипции (+1). В векторах были использованы HSE (4 или 8), ТАТА-подобные последовательности и промотор гена hsp70 дрозофилы. На рис.2 представлена последовательность с использованием четырех HSE (рис.2).
В нашей работе мы использовали плазмиду pCasper, из которого был вырезан промотор гена белка теплового шока hsp70 и была добавлена область регуляции промотора. Для сравнения мы взяли различную область регуляции промотора. В этом вопросе нас интересовало различное число транскрипционных факторов, которые воздействуют на работу промотора. Так, например, основного транскрипционного фактора HSF, который обеспечивает транскрипцию генов hsp при гипертермии (HSF1) имеет общие этапы у разных организмов. Система ответа на тепловой шок эволюционно весьма консервативна, например HSF D.melanogaster способен индуцировать транскрипцию генов hsp млекопитающих.
На основании предыдущих исследований нами были синтезированы два вектора, которые имеют две разные области регуляции промотора. Один из векторов включает в своем составе +100 пар нуклеотидов перед промотором (В7) (4 HSE области), а другой +500, соответственно.(F7) (8 HSE области). Данные векторы отличаются лишь количеством транскрипционных факторов HSF, необходимых для активации данного промотора, а также в конструкции с+500 зоной регуляции находится транскрипционный фактор С\ЕВР, который обладает характеристиками энхансера и возможно будет влиять на работу данного промотора. Данные векторы, содержат ген флуоресцентного белка GFP, который будет выступать в качестве маркера, а также ген неомицина, что позволит производить селекцию трансфицированных клеток на G418.
Для создания данных векторов был использован вектор pCasper-hs-act, из которого были вырезаны фрагменты по сайтам HindIII-EcoRI, содержащие промотор hsp70 и регуляторную область промотора +100 и +500 пар нуклеотидов соответственно. Фрагменты вставки были клонированы с помощью метода ПЦР с использованием специфических праймеров: phsR (5'taacgaattcccaattccctattcag 3')
phs1F (5'gatcaagcttgttcaatgatatccagtgc 3')
phs5F (5'cccaaagcttggatttttcacactttcccc 3')
Полученные фрагменты были клонированы в вектор pGEM-T Easy (Promega, # 1360) согласно протоколу. Далее по сайтам рестрикции HindIII-EcoRI были вырезаны фрагметы: hsp70+100 upstream, hsp70+500 upstream соответственно (рис.3)
Данные фрагменты были переклонированы в вектор pbGrPP-N1 (рис.5), по сайтам рестрикции HindIII-EcoRI. Наличие вставки в данных конструкциях были проверены с помощью рестрикционого анализа с последующим секвенированием полученных конструкций.
После выделения и очистки эти конструкции были введены в культуру клеток НЕК293 методом трансфекции с использованием реагента ExGene 500 (Fermentas, R05 11).
Изобретение иллюстрируется далее конкретными примерами, не ограничивающими его.
Пример 1
Получен вектор В7, содержащий промотор гена белка теплового шока hsp70 Drosophila melanogaster и область регуляции промотора (+100 пар нуклеотидов) с четырьмя регуляторными последовательностями (HSE), зону полилинкера. Для исследования эффективности работы данного промотора под промотор hsp70 встроен ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину, что позволит производить селекцию трансфицированных клеток на G418. Полученный вектор отличается регуляторной зоной промотора гена белка теплового шока Drosophila m., что сказывается на изменении их активации.
Фрагменты вставки были клонированы с помощью метода ПЦР с использованием специфических праймеров: phsR (5'taacgaattcccaattccctattcag 3')
phs1F (5'gatcaagcttgttcaatgatatccagtgc 3')
На рис. 6 представлена последовательность промотора гена белка теплового шока hsp70 с регуляторной областью, используемой в векторе В7.
Наличие вставки в данной конструкции была проверена с помощью рестрикционого анализа с последующим секвенированием полученных конструкций. После выделения и очистки эта конструкция была введена в культуру клеток НЕК293 методом трансфекции с использованием реагента ExGene 500 (Fermentas, R0511). Для культивирования НЕК293 использовался ДМЕМ (ПанЭко, Россия), при добавлении 10% фетальной сыворотки крови (Perbio HyClone, США), при добавлении 146 млг L-глутамина (ПанЭко, Россия) на 500 мл среды при добавлении 4% гентамицина (ПанЭко, Россия) и инкубировались при 37°С в СО2-инкубаторе. Культура клеток после трансфекции исследуемыми векторами и селекции на гентамицине (G418, Invitrogen,# In-15750045), в течение 10 дней были рассеяны на 3 см культуральные чашечки (Costar).
Трансфицированные клетки линии НЕК293 были выведены в линию по устойчивости к неомицину. Наличие строенного маркерного гена (gfp) и экспрессия белка в выведенной трансгенной культуре подтверждалось методом Вестерн-блот гибридизации. Из культуры клеток был выделен белок в SDS буфере по протоколу (Amersham Bioscience). Далее данные белки были разогнаны в 10% акриламидном геле и и проанализированы с помощью Westem-bloot гибридизации. Для переноса была использована нитроцеллюлозная мембрана (Amersham Bioscience, # RPN68D), Данная мембрана была обработана антителами: Rabbit polyclonal anti-GFP (Abeam #ab 290, 1:2000), и вторичными anti-Rabbit, конъюгированными с пероксидазой хрена (HRP, 1:2000). Детекция белков осуществлялась при помощи реагента ECL (Amersham Biocsience, #RPN2109) на пероксидазу. Доказано наличие конструкта в клетках.
После 24 часов культивирования анализировали воздействие температуры на культуру клеток. Клетки были прогреты в инкубаторе при температурах в диапазоне от 37° до 42°С в течение 60 минут. Экспрессию маркерного белка GFP наблюдали с помощью флуоресцентного микроскопа Olympus (рис.10).
Было обнаружено, что наблюдается зеленое свечение клеточной культуры после воздействия температуры. Было обнаружено, что максимальная экспрессия белка GFP наблюдалась при 41°С уже спустя 24 часа после прогрева. Другая 1/3 часть исследуемых клеток после воздействия температуры были зафиксированы в 4% растворе параформа и использовались для измерения интенсивности свечения при помощи метода проточной цитофлуориметрии на приборе FACScan (Becton Dickinson, США). Данные приведены для двух температур 40 и 42°С с различным интервалом послетемпературного воздействия. Следует отметить, что по данным цитофлуориметра экспрессия маркерного зеленого флуоресцентного гена наблюдалась уже при 39°С (рис.12), что является результатом использования в регуляции промотора 4 элементов теплового шока (HSE). Следует отметить еще один факт: при активации 40°С наблюдается снижение свечения (т.е. активности промотора) через 48 часов, что также может быть связано с использованием в регуляции промотора 4 элементов теплового шока (HSE).
После 72 часов наблюдается уменьшение синтеза бела GFP. Однако при повторном нагревании наблюдается вторичная активация синтеза белка. Также 1/3 клеток были использованы для выделения тотальной ДНК согласно протоколу. Полученная тотальная ДНК была исследована методом ПЦР анализа на наличие гена GFP в клеточной линии НЕК293. Для метода ПЦР использовался амплификатор фирмы BioRad, праймеры: gfpF (5'-cgtcagatccgctagcgctaccgg-3') и gfpR (5'-aataaagcttgcatggcggtaatacg-3'). Программа: 95°С - 3 мин, 94°С - 20 сек, 55°С - 15 сек, 72°С - 30 сек, 72°С - 5 мин, количество циклов: 30.
Таким образом, нами показано, что данная система активации температурнозависимого промотора работает в культуре клеток НЕК293. Нами установлено, что оптимальное время действия температурной активации составляет 60 минут, а максимальное свечение зеленого флуоресцентного белка GFP наблюдается через 24 часа после воздействия температуры. Был выявлен эффект повторного включения промотора и возникновения свечения зеленого флуоресцентного белка после повторного воздействия температуры.
Пример 2
Получен вектор F7, содержащий промотор гена белка теплового шока hsp70 Drosophila melanogaster и область регуляции промотора (+500 пар нуклеотидов) с восемью регуляторными последовательностями (HSE), зону полилинкера. Для исследования эффективности работы данного промотора под промотор hsp70 встроен ген зеленого флуоресцентного белка (GFP). Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину, что позволит производить селекцию трансфицированных клеток на G418. Полученный вектор отличается регуляторной зоной промотора гена белка теплового шока Drosophila m., что сказывается на изменении их активации.
Фрагменты вставки были клонированы с помощью метода ПЦР с использованием специфических праймеров: phsR (5'taacgaattcccaattccctattcag 3')
phs5F (5'cccaaagcttggatttttcacactttcccc 3')
На рис. 14 представлена последовательность промотора гена белка теплового шока hsp 70 с регуляторной областью, используемой в векторе F7.
Наличие вставки в данной конструкции была проверена с помощью рестрикционого анализа с последующим секвенированием полученных конструкций. После выделения и очистки эта конструкция была введена в культуру клеток НЕК293 методом трансфекции с использованием реагента ExGene 500 (Fermentas, R0511). Для культивирования НЕК293 использовался ДМЕМ (ПанЭко, Россия) при добавлении 10% фетальной сыворотки крови (Perbio HyClone, США), при добавлении 146 млг L-глутамина (ПанЭко, Россия) на 500 мл среды при добавлении 4% гентамицина (ПанЭко, Россия) и инкубировались при 37°С в CО2- инкубаторе. Культура клеток после трансфекции исследуемыми векторами и селекции на гентамицине (G418, Invitrogen,# In-15750045), в течение 10 дней были рассеяны на 3 см культуральные чашечки (Costar).
Трансфицированные клетки линии НЕК293 были выведены в линию по устойчивости к неомицину. Наличие строенного маркерного гена (gfp) и экспрессия белка в выведенной трансгенной культуре подтверждалось методом Вестерн-блот гибридизации. Из культуры клеток был выделен белок в SDS буфере по протоколу (Amersham Bioscience). Далее данные белки были разогнаны в 10% акриламидном геле и и проанализированы с помощью Western-Moot гибридизации. Для переноса была использована нитроцеллюлозная мембрана (Amersham Bioscience, # RPN68D), Данная мембрана была обработана антителами: Rabbit polyclonal anti-GFP (Abeam #ab 290, 1:2000), и вторичными anti-Rabbit, конъюгированными с пероксидазой хрена (HRP, 1:2000). Детекция белков осуществлялась при помощи реагента ECL (Amersham Biocsience, #RPN2109) на пероксидазу. Доказано наличие конструкта в клетках.
После 24 часов культивирования анализировали воздействие температуры на культуру клеток. Клетки были прогреты в инкубаторе при температурах в диапазоне от 37° до 42°С в течение 60 минут. Экспрессию маркерного белка GFP наблюдали с помощью флуоресцентного микроскопа Olympus (рис.18).
Было обнаружено, что наблюдается зеленое свечение клеточной культуры после воздействия температуры. Исследуемые клетки после воздействия температуры были зафиксированы в 4% растворе параформа и использовались для измерения интенсивности свечения при помощи метода проточной цитофлуориметрии на приборе FACScan (Becton Dickinson, США). В таблице на рис.19 приведены данные для двух температур 40 и 42°С с различным интервалом после температурного воздействия. Наличие восьми элементов теплового шока (HSE) в регулируемой зоне промотора гена белка теплового шока hsp70 сказывается на изменениях активации данного промотора. В полученном векторе наблюдается более интенсивное накопление светящихся клеток в трансгенной культуре. Так например, при воздействии температуры в 40°С на клеточную культуру через 24 часа обнаруживалось 23,2% светящихся клеток причем этот процент оставался таким же (в пределах ошибки) и через 48 часов в отличие от стимуляции промотора в В 7. При воздействии температуры в 42°С наблюдается значительное увеличение светящихся клеток (49,9%), и их количество незначительно уменьшается через 48 часов (47,4%). Исследование при помощи цитофлуориметрии экспрессии данного промотора с восемью регуляторными последовательностями (HSE) при более низких температурах показал, что экспрессия маркерного гена наблюдается уже при температуре 38°С (12%) и увеличивалась при повышении температуры. Таким образом, можно утверждать, что увеличение элементов теплового шока (до восьми) в регуляторной зоне промотора гена белка теплового шока hsp70 дрозофилы усиливает чувствительность данного промотора к повышению температуры даже на 2°С (до 38°С) и усиливает экспрессию при воздействии повышенного порога температурного режима в интервале 38-42°С.
Таким образом, обнаружено, что насыщенность регуляторной области HSE элементами влияет на активность промотора гена белка теплового шока hsp70 Drosophila melanogaster в клетках млекопитающих. Промотр гена белка теплового шока дрозофилы с регуляторной зоной, богатой элементами теплового шока (HSE), выгодно отличается от ранее известных промоторов, используемых в векторах для трансгенного введения в клетки и ткани. Разработанные векторы обладают промотр-регулируемой областью и промотором, который не имеет вирусной природы. Активность данного промотора можно регулировать, то есть можно вызвать или его гиперактивность, или его слабое «подтекание» или блокировать активность данного промотора.
Оригинальность предложенного изобретения заключается в получении векторов, активирующихся при повышении температуры до 38°С или токсическом воздействии на трансгенные клетки или ткань млекопитающих.
Нижепредставленные рисунки также иллюстрируют изобретение.
На рис.1 показан процесс активации промотора и участие HSE зоны.
На рис.2 показана последовательность промотора hsp70 D. melanogaster до точки старта транскрипции (+1). Красным выделены HSE и ТАТА. HSE, у которых перед GAA находится А (или, соответственно, после ТТС-Т, по идее, более сильные (выделено зеленым). Подчеркиванием обозначены GAGA-элементы и комплементарные СТСТ (с ними связывается GAF, дестабилизирующий ДНК-дуплекс при инициации).
На рис.3 показана последовательность встроенного фрагмента hsp70+500 нуклеотидов в pGem-T Easy. Заглавными буквами выделена последовательность промотора hsp70 (453 нуклеотида). Синим отмечена область регуляции 100 нуклеотидов, которая входит в зону регуляции 500 нуклеотидов. Сиквенс был сделан с обратным праймером:
phsR (5'taacgaattcccaattccctattcag 3')
На рис.4 приведена схема расположения элементов теплового шока (HSE) в регуляторной области полученных векторов В7(вверху) и F7 (внизу).
На рис.5 приведена схема генно-инженерных конструкций, содержащих в себе ген зеленого флуоресцентного белка под контролем гена промотора белка теплового шока hsp70 с разной областью регуляции трансгена А. +100 нуклеотидов (В7) Б. +500 нуклеотидов (F7).
На рис.6 - последовательность встроенного фрагмента hsp70+100 нуклеотидов в pGem-T Easy. Заглавными буквами выделена последовательность промотора hsp70 (453 нуклеотида). Синим отмечена область регуляции 100 нуклеотидов.
На рис.7 приведена схема полученного