Промоторы lactococcus и их применение:
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к рекомбинантной нуклеиновой кислоте, экспрессирующей один или несколько представляющих интерес полипептидов, вектору экспрессии и бактерии, которые содержат данную рекомбинантную нуклеиновую кислоту, и их применению, а также к фармацевтической композиции для доставки одного или нескольких представляющих интерес полипептидов человеку или животному. Рекомбинантная нуклеиновая кислота содержит природный промотор гена HU-подобного ДНК-связывающего белка (PhIIA) вида Lactococcus с последовательностью SEQ ID NO:28, или его гомологичный или функциональный вариант, который по меньшей мере на 95% идентичен промотору с последовательностью SEQ ID NO:28, функционально связанный с одной или несколькими открытыми рамками считывания, гетерологичными для промотора PhIIA, где промотор PhIIA расположен выше одной или нескольких открытых рамок считывания. Вектор экспрессии содержит вышеуказанную рекомбинантную нуклеиновую кислоту, предпочтительно, указанный вектор получают из pT1NX. Бактерия содержит вышеуказанную рекомбинантную нуклеиновую кислоту или вышеуказанный вектор. Предложенное изобретение позволяет повысить уровень экспрессии представляющих интерес генов полипептидов и таким образом получить достаточное количество экспрессированных белков. 11 н. и 8 з.п.ф-лы, 26 ил., 12 табл., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к молекулярной биологии и относится к рекомбинатной технологии и экспрессии белков. Более конкретно, изобретение относится к нуклеиновым кислотам для рекомбинантной экспрессии белков, содержащим последовательности, полученные из Lactococcus и подходящие в качестве промоторов. Настоящее изобретение, кроме того, относится к векторам, содержащим указанные нуклеиновые кислоты, и к клеткам-хозяевам, трансформированным ими. Изобретение также относится к применению клеток-хозяев, содержащих указанные нуклеиновые кислоты или векторы, для экспрессии гетерологичных или гомологичных белков, а также для доставки, особенно терапевтической доставки, указанных белков индивидам.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Молочнокислые бактерии становятся все более или более важными в качестве хозяев для рекомбинантной экспрессии гетерологичных полипептидов in vitro (например, патент США 5559007), а также для экспрессии in vivo или in situ и доставки антигенов и/или терапевтических полипептидов (например, WO 97/14806).
Полагают, что молочнокислые бактерии, в частности Lactococcus, являются полностью безвредными микроорганизмами (т.е. их рассматривают как в целом безопасные) и, таким образом, могут относительно просто вводиться людям и животным.
Однако для достижения устойчивого уровня гетерологичной экспрессии в молочнокислых бактериях часто требуется введение промоторов и других последовательностей, которые являются экзогенными для этих бактерий (например, смотри Wells et al., 1993A) и, следовательно, могут ставить под угрозу восприятие их как полностью безвредных.
Соответственно, существует потребность в дополнительных промоторах, которые получают из молочнокислых бактерий, более предпочтительно из Lactococcus, и которые можно успешно использовать для экспрессии белков, предпочтительно экспрессии гетерологичных белков, в молочнокислых бактериях.
Также необходимы такие промоторы, с помощью которых можно добиться высоких уровней экспрессии и таким образом получить достаточное количество экспрессированных белков для промышленного и/или терапевтического использования.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Аспекты по настоящему изобретению относятся по крайней мере к некоторым, например, одной или нескольким, указанным выше потребностям данной области.
В частности, авторы настоящего изобретения идентифицировали нуклеиновые кислоты и последовательности нуклеиновых кислот, происходящие из Lactococcus, использование которых в качестве дополнительных промоторов для рекомбинантной экспрессии, такой как предпочтительно экспрессия полипептидов, в клетках-хозяевах, предпочтительно в бактериях и более предпочтительно в Lactococcus, может иметь преимущества.
Более конкретно, авторы настоящего изобретения были намерены идентифицировать нуклеиновые кислоты и последовательности нуклеиновых кислот из Lactococcus, которые могут действовать в качестве сильных промоторов, т.е. промоторов, с помощью которых достигается высокий уровень экспрессии, для рекомбинантной экспрессии, например предпочтительно экспрессии полипептидов, в клетках-хозяевах, предпочтительно в бактериях и более предпочтительно в Lactococcus, и осуществили поставленную цель. Преимуществом стабильной экспрессии является увеличение количества продуктов экспрессии, например, полипептидов, рекомбинантно продуцируемых клетками-хозяевами, которые становятся доступными для дальнейшего использования, например, для очистки из клеток-хозяев или для терапевтической доставки в такие клетки.
Еще более неожиданно для авторов настоящего изобретения стало ясно, что нуклеиновые кислоты и их последовательности по настоящему изобретению могут действовать в качестве промоторов, которые сильней, особенно при использовании в Lactococcus, чем промоторы, ранее полученные из Lactococcus. Более конкретно, нуклеиновые кислоты и последовательности по настоящему изобретению могут так функционировать в качестве более сильных промоторов, например, более сильных конститутивных промоторов, чем промотор гена тимидилатсинтазы (thyA) из Lactococcus lactis, который, как известно авторам настоящего изобретения, является самым сильным промотором, полученным из Lactococcus, более конкретно самым сильным конструктивным промотором, полученным из Lactococcus, на сегодняшний день. Промотор thyA Lactococcus lactis является, как известно авторам настоящего изобретения, также самым сильным промотором, который известен в настоящее время, для рекомбинантной, например гетерологичной, экспрессии генов в Lactococcus и предпочтительно в Lactococcus lactis.
Неожиданно было отмечено, что комбинированный транскриптомный анализ, описанный в примерах, вместе со сложными данными протеомного анализа не обладал большой возможностью в предположении силы или активности промоторов-кандидатов. В частности, некоторые идентифицированные промоторы были слабо активными при проведении проверки. Кроме того, некоторые последовательности возможных промоторов были неактивны вне природного окружения или природной конфигурации, т.е. при поверке с гетерологичными генами.
В качестве дополнительного преимущества особенно высокая экспрессия наблюдается при использовании промоторов по настоящему изобретению, в числе прочих, для IL-10 человека, пептида YY человека (PYY), глюкагоноподобного пептида-1 человека (GLP-1), GLP-2 человека (GLP-2) и факторов «трилистника» человека (TTF) в качестве предпочтительных целей.
Следует также принимать во внимание, что нуклеиновые кислоты и их последовательности, идентифицированные авторами настоящего изобретения, были получены из Lactococcus, который утвержден как микроорганизм GRAS, т.е. «G (обычно) R (рассматриваемого) A (как) S (безопасный)». Следовательно, композиции, например, клетки-хозяева, содержащие такие промоторы, могут вводиться людям или животным с меньшим беспокойством относительно биологической безопасности, чем при введении последовательностей, полученных, например, из микроорганизмов, не являющихся GRAS, или из других источников.
Таким образом, настоящее изобретение относится к полученным из Lactococcus, которые имеют определенные преимущества, т.е. сравнительно безопасные, нуклеиновым кислотам и последовательностям, которые составляют дополнительные промоторы, более предпочтительно к дополнительным сильным промоторам и еще более предпочтительно к промоторам, которые сильнее промотора thyA, для использования для большого числа применений, включая рекомбинантную экспрессию, например, полипептидов, в клетках-хозяевах, предпочтительно в бактериях и еще более предпочтительно в Lactococcus.
Настоящее изобретение включает вышеприведенные релевантные варианты осуществления в разнообразных аспектах.
Соответственно, в одном из аспектов настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей промотор (Р), который является природным промотором вида Lactococcus, или его функциональный вариант или функциональный фрагмент, функционально связанный с одной или несколькими открытыми рамками считывания (ORF), являющимися гетерологичными для промотора (Р), отличающийся тем, что промотор (Р) сильнее промотора гена тимидилатсинтазы (thyA) Lactococcus lactis в Lactococcus.
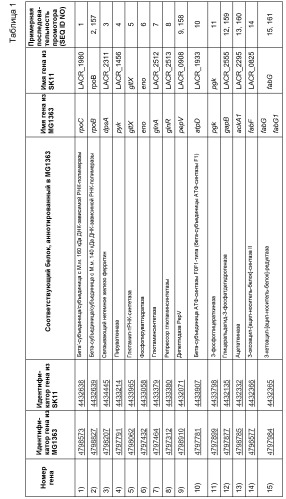
В связанном аспекте настоящее изобретение, таким образом, также относится к рекомбинантной нуклеиновой кислоте, содержащей промотор (Р), функционально связанный с одной или несколькими открытыми рамками считывания, являющимися гетерологичными для промотора (Р), причем промотор (Р) выбран из группы, включающей или состоящей из природных промоторов генов Lactococcus для 1) бета'-субъединицы/субъединицы с М.м. 160 кДа ДНК-зависимой РНК-полимеразы (rpoC), 2) бета-субъединицы/субъединицы с М.м. 140 кДа ДНК-зависимой РНК-полимеразы (rpb2), 3) ДНК-связывающего ферритиноподобного белка (защитного средства от окислительной деградации) (dps), 4) пируваткиназы (pyk), 5) глютамил- и глютаминил-тРНК-синтетаз (glnS), 6) энолазы (eno), 7) глютаминсинтетазы (glnA), 8) регулятора транскрипции НТН-типа (glnR), 9) (Xaa-His)-дипептидазы (argE или pepV), 10) бета-субъединицы АТФ-синтазы F0F1-типа (бета-субъединицы АТФ-синтазы F1) (atpD), 11) 3-фосфоглицераткиназы (pgk), 12) глицеральдегид-3-фосфатдегидрогеназы/эритрозо-4-фосфатдегидрогеназы (gapA), 13) ацетаткиназы (ackA), 14) 3-оксоацил-[ацил-носитель-белок]-синтазы (fabB), 15) 3-оксоацил-[ацил-носитель-белок]-редуктазы (fabG), 16) альфа-субъединицы/субъединицы с М.м. 40 кДа ДНК-зависимой РНК-полимеразы (rpoА), 17) (Xaa-Pro)-аминопептидазы (pepP), 18) фруктозо/тагатозобифосфатальдолазы (tbp), 19) рибосомного белка S4 (rpsD), 20) супероксиддисмутазы (sodA), 21) рибосомного белка S12 (rpsL) и рибосомного белка S7 (rpsG), 22) рибосомного белка L18 (rplR) и рибосомного белка S5 (rpsE) и рибосомного белка L30/L7E (rpmD), 23) S-рибозилгомоцистеинлиазы (luxS), 24) рибосомного белка L19 (rplS), 25) рибосомного белка S11 (rpsK), 26) рибосомного белка L10 (rplJ), 27) рибосомного белка L7/L12 (rplL), 28) ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU (hup), 29) белка L28 50S-субъединицы рибосомы (rpmB), 30) специфичного в отношении целлобиозы компонента фосфотрансферазной системы IIB (lacE), 31) альфа-субъединицы АТФ-синтазы F0F1-типа (atpA), 32) транспортной системы сахаров АВС-типа (компонента АТФазы) (malK), 33) альфа-субъединицы компонента ацетоиндегидрогеназного комплекса Е1 (acoA), 34) белка клеточного деления (diflVA или ftsA), 35) UDP-галактопиранозомутазы (glf), 36) глютамиламинопептидазы (frvX), 37) спрогнозированного относящегося к дегидрогеназе белка (mviM), 38) рибосомного белка S2, 39) фактора 3 инициации трансляции (IF-3) (infC), 40) рибосомного белка L4 (rplD) и рибосомного белка L23 (rplW) и рибосомного белка L2 (rplB), 41) домена EMAP (ydjD), 42) фактора элонгации транскрипции (greA), 43) субъединицы АТФ-зависимой протеазы Clp (clpP), 44) рибосомного белка L15 (rplO), 45) рибосомного белка L11 (rplK), 46) рибосомного белка S8 (rpsH), 47) рибосомного белка L21 (rplU), 48) рибосомного белка S13 (rpsM), 49) рибосомного белка S19 (rpsS) и рибосомного белка L22 (rplU) и рибосомного белка L16 (rplP) и рибосомного белка L14 (rplN), 50) рибосомного белка S10 (rpsJ), 51) шаперонина GroES (Hsp10) (cpn10), 52) рибосомного белка L24 (rplX) и 53) гипотетического белка LACR_0137 (duf965), и их функциональных вариантов и функциональных фрагментов указанных природных промоторов.
Настоящее изобретение также относится к рекомбинантной нуклеиновой кислоте, причем промотор (Р) выбран из группы, состоящей из природных промоторов генов Lactococcus, предпочтительно Lactococcus lactis, для 1) бета'-субъединицы/субъединицы с М.м. 160 кДа ДНК-зависимой РНК-полимеразы (rpoC), 3) связывающего негемное железо ферритина (dpsA), 4) пируваткиназы (pyk), 5) глютаминил-тРНК-синтетаз (gltX), 6) фосфопируватгидрaтазы (eno), 9) дипептидазы PepV (pepV), 12) глицеральдегид-3-фосфатдегидрогеназы (gapB), 13) ацетаткиназы (ackA), 18) фруктозобифосфатальдолазы (fbaA), 20) супероксиддисмутазы (sodA), 21) рибосомного белка S12 (rpsL) и рибосомного белка S7 (rpsG), 22) рибосомного белка L18 (rplR) и рибосомного белка S5 (rpsE) и рибосомного белка L30/L7E (rpmD), 24) рибосомного белка L19 (rplS), 26) рибосомного белка L10 (rplJ), 28) HU-подобного ДНК-связывающего белка (hllA), 29) белка L28 50S-субъединицы рибосомы (rpmB), 30) компонента фосфотрансферазной системы IIB (ptcB), 31) альфа-субъединицы АТФ-синтазы F0F1-типа (atpA), 32) связывающего множество сахаров транспортного АТФ-связывающего белка (msmK), 33) альфа-субъединицы компонента пируватдегидрогеназы Е1 (pdhA), 34) белка клеточного деления (diflVA или ftsA), 35) UDP-галактопиранозомутазы (glf1), 36) глютамиламинопептидазы (pepA), 37) спрогнозированного относящегося к дегидрогеназе белка (llmg 0272), 38) рибосомного белка S2 (rpsB), 39) фактора 3 инициации трансляции (IF-3) (infC), 40) рибосомного белка L4 (rplD) и рибосомного белка L23 (rplW) и рибосомного белка L2 (rplB), 41) бета-цепи фенилаланил-тРНК-синтетазы (pheT), 42) фактора элонгации транскрипции GreA (greA), 43) протеолитической субъединицы АТФ-зависимой протеазы Clp (clpP), 44) рибосомного белка L15 (rplO), 45) рибосомного белка L11 (rplK), 46) рибосомного белка S8 (rpsH), 47) рибосомного белка L21 (rplU), 48) рибосомного белка S13 (rpsM), 49) рибосомного белка S19 (rpsS) и рибосомного белка L22 (rplU) и рибосомного белка L16 (rplP) и рибосомного белка L14 (rplN), 50) рибосомного белка S10 (rpsJ), 51) шаперонина GroES (Hsp10) (groES), 52) рибосомного белка L24 (rplX) и 53) предполагаемой резольвазы, осуществляющей разделение-соединение (llmg_0151), и их функциональных вариантов и функциональных фрагментов указанных природных промоторов.
В более предпочтительном варианте осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, причем промотор (Р) выбран из группы, состоящей из природных промоторов генов Lactococcus, предпочтительно Lactococcus lactis, для 1) бета'-субъединицы/субъединицы с М.м. 160 кДа ДНК-зависимой РНК-полимеразы (rpoC), 3) связывающего негемное железо ферритина (dpsA), 4) пируваткиназы (pyk), 5) глютаминил-тРНК-синтетаз (gltX), 6) фосфопируватгидрaтазы (eno), 9) дипептидазы PepV (pepV), 12) глицеральдегид-3-фосфатдегидрогеназы (gapB), 13) ацетаткиназы (ackA), 18) фруктозобифосфатальдолазы (fbaA), 20) супероксиддисмутазы (sodA), 21) рибосомного белка S12 (rpsL) и рибосомного белка S7 (rpsG), 22) рибосомного белка L18 (rplR) и рибосомного белка S5 (rpsE) и рибосомного белка L30/L7E (rpmD), 24) рибосомного белка L19 (rplS), 26) рибосомного белка L10 (rplJ), 28) HU-подобного ДНК-связывающего белка (hllA), 29) белка L28 50S-субъединицы рибосомы (rpmB), 30) компонента фосфотрансферазной системы IIB (ptcB), которые определены в таблице 1.
В другом предпочтительном варианте осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей промотор гена для 28) ДНК-связывающего белка бактериального ядра/HU-подобного ДНК-связывающего белка (hlla или hup); функционально связанный с одной или несколькими открытыми рамками считывания, которые являются гетерологичными для промотора. Еще более предпочтительно указанный промотор является промотором PhllA.
В другом предпочтительном варианте осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей промотор гена для 3) связывающего негемное железо ферритина (dpsA или LACR_2311), промотор гена 9) дипептидазы PepV (pepV или LACR_0908) или промотор гена 20) супероксиддисмутазы (sodA или LACR_0458), соответственно; функционально связанный с одной или несколькими открытыми рамками считывания, гетерологичными для промотора. Еще более предпочтительно указанный промотор является промотором PdpsA, PpepV или PsodA.
В предпочтительном варианте осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей промотор (Р), функционально связанный с одной или несколькими открытыми рамками считывания, гетерологичными для промотора (Р), причем промотор (Р) выбран из группы, включающей или состоящей из природных промоторов генов Lactococcus, перечисленных выше или в таблице 1 под номерами 1-30, предпочтительно промотора PhllA, PdpsA, PpepV или PsodA, и функциональных вариантов и функциональных фрагментов указанных природных промоторов.
В еще одном предпочтительном варианте осуществления указанные выше гены и соответствующие им природные промоторы и их функциональные варианты и функциональные фрагменты получены из Lactococcus lactis.
В связанных, приводимых в качестве примеров аспектах, также предложены векторы, содержащие рекомбинантные нуклеиновые кислоты по настоящему изобретению; интегрированные в хромосомы экспрессионные кассеты, клетки-хозяева, трансформированные рекомбинантными нуклеиновыми кислотами по настоящему изобретению или векторами, их содержащими; к применению рекомбинантных нуклеиновых кислот по настоящему изобретению для экспрессии продуктов экспрессии, предпочтительно одного или нескольких полипептидов, кодируемых указанными открытыми рамками считывания, в клетке-хозяине; к способам рекомбинантной экспрессии и выделения представляющих интерес продуктов экспрессии, предпочтительно полипептидов, используя указанные клетки-хозяева; к способам лечения, включая in situ доставку терапевтически значимых продуктов экспрессии, предпочтительно полипептидов, например, антигенов и/или невакциногенных терапевтически активных полипептидов, людям или животным с помощью таких клеток-хозяев; и связанные применения клеток-хозяев для получения лекарственных средств для облегчения указанной доставки; к фармацевтическим композициям, содержащим указанные клетки-хозяева; и тому подобное.
Эти и другие аспекты и предпочтительные варианты осуществления по настоящему изобретению описаны в следующих далее разделах и в прилагаемой формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 (А-Н) представлены последовательности предпочтительных промоторов.
На фиг.2 показано электрофоретическое разделение полипептидов Lactococcus lactis MG1363.
На фиг.3 предложена стратегия клонирования.
Фиг.4. Суклонирование слитых конструкций промотор-Usp45-h[Gly2]GLP2. Р обозначает любой из следующих промоторов: P1 (Waterfield et al., 1995), PthyA (промотор тимидилатсинтазы) и PhllA (промотор ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU); usp45 означает сигнал секреции usp45 дикого типа (van Asseldonk et al., 1990) или его мутант (в том числе Usp45 N4, в котором лизин в положении 4 заменен аспарагином); Em означает селектируемый маркер - маркер устойчивости к эритромицину; ori означает точку начала репликации.
Фиг.5. Продукция и секреция h[Gly2]GLP-2 рекомбинантными штаммами L. lactis, обнаруживаемые с помощью антитела против hGLP-2. (А) секреция h[Gly2]GLP-2. В качестве положительного контроля использовали 1 мкг рекомбинантного hGLP-2. (В) Продукция и секреция h[Gly2]GLP-2 клетками. Каждая линия на блоте представляет 1 мл клеточной фракции или супернатанта культуры клеток L. lactis, полученных через три часа роста. SeeBlue® Plus2 (invitrogen) использовали в качестве маркеров молекулярной массы (Маркеры М.м.).
Фиг.6. Схематическое сравнение L. lactis MG1369 и различных экспрессирующих штаммов hIL-10, используемых в этом исследовании. Во время конструирования экспрессирующие hIL-10 кассеты интегрировали в хромосому L. lactis MG1369 путем гомологичной рекомбинации идентичных последовательностей, находящихся 5' от thyA и экспрессирующих hIL-10 кассет, а также 3' от них, соответственно. Места рекомбинации схематически представлены как «\». Это предполагает, что все последовательности ДНК вне экспрессионных кассет являются идентичными для описанных выше штаммов. Генетические элементы не масштабированы.
Фиг.7. Сравнение экспрессии hIL-10 c PthyA (промотора тимидилатсинтазы, штаммы sAGX0005 и Thy12) c экспрессией hIL-10 с (A) промотора PdpsA (ДНК-связывающего ферритиноподобного белка, SEQ ID NO: 3; sAGX0012), (B) PpepV (промотора (Xaa-His)-дипептидазы, SEQ ID NO: 9 или 158; штамм sAGX0018), (C) PsodA (промотора супероксиддисмутазы, SEQ ID NO: 20; sAGX0029) и (D) PhllA (промотора ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU; SEQ ID NO: 28; штамм sAGX0037). «Промотор» означает промотор, расположенный перед геном hIL-10.
Фиг.8. Сравнение экспрессии hIL-10 в 109 клеток MG1363, sAGX0005 и sAGX0037.
Фиг.9. Схематическое сравнение L. lactis MG1363 и различных экспрессирующих hTFF штаммов, используемых в этом исследовании. Во время конструирования экспрессирующие TFF кассеты интегрировали в хромосому L. lactis MG1363 путем гомологичной рекомбинации идентичных последовательностей, находящихся 5' от thyA и экспрессирующих TFF кассет, а также 3' от них, соответственно. Места рекомбинации схематически представлены как «\». Это предполагает, что все последовательности ДНК вне экспрессионных кассет являются идентичными для описанных выше штаммов. Мутант usp45 указан *. Генетические элементы не масштабированы.
Фиг.10. Сравнение
(А) экспрессии hTFF1 c PthyA (промотора тимидилатсинтазы), связанного с сигналом секреции usp45 дикого типа и hTFF1 (штамм sAGX0041), PhllA (промотора ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU; SEQ ID NO: 28), связанного с мутантным (mut) сигналом секреции usp45 и hTFF1 (штамм sAGX0049), или PhllA, связанного с сигналом секреции usp45 дикого типа и hTFF1 (штамм sAGX0048);
(B) экспрессии hTFF3 c PthyA (промотора тимидилатсинтазы), связанного с сигналом секреции usp45 дикого типа и hTFF3 (штамм sAGX0043), промотора PdpsA (ДНК-связывающего ферритиноподобного белка, SEQ ID NO: 3), связанного с сигналом секреции usp45 дикого типа и hTFF3 (sAGX0059) и PhllA, связанного с мутантным сигналом секреции usp45 и hTFF3 (штамм sAGX0047).
«Промотор» и «сигнал секреции» означают промотор и сигнал секреции, которые расположены перед геном TFF.
Фиг.11. Анализ Вестерн-блоттинг супернатантов различных указанных штаммов. На линии, содержащие эталонные белки, указаны как «hTFF1» (эталон hTFF3) и «Маркеры М.м.» (маркеры молекулярной массы, «кДа» означает молекулярные массы). Все другие линии содержат эквивалент 0,5 мл супернатанта культуры указанных штаммов, полученного, как указано выше. Первым антителом было мышиное моноклональное антитело против hTFF1: 1/1000 (Abnova: номер в каталоге Н00007031-М02). Вторым антителом было козье антимышиное антитело, конъюгированное с АР: 1/1000 (Southern Biotech: 4050-04), и обнаружение проводили с использованием NBT/BCIP (Roche 11 697 471 0001). Маркерами М.м. является предварительно окрашенный стандарт Invitrogen SeeBlue plus2 (номер в каталоге LC5925).
Фиг.12. Схематический обзор структуры pT1NX и различных экспрессирующих hPYY G9 (3-36) плазмид, используемых в этом исследовании. Экспрессионные плазмиды pAGX0211, pAGX0212 и pAGX0213 получены встраиванием соответствующих экспрессионных кассет в виде EcoRI-SpeI-фрагментов в плазмиду pT1NX, открытую расщеплением ферментами EcoRI и SpeI. Как таковые, структура и положение всех последовательностей ДНК вне экспрессионных кассет, таких как точка начала репликации (ori) и маркер устойчивости к эритромицину (EmR), идентичны для всех плазмид. Генетические элементы не масштабированы.
Фиг.13. Сравнение экспрессии hPYY G9 (3-36) c P1 (Waterfield et al., 1995) (плазмида pAGX0211), PthyA (промотора тимидилатсинтазы, плазмида pAGX0212) и PhllA (промотора ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU; SEQ ID NO: 28; плазмида pAGX0213), связанных с сигналом секреции ups45 и hPYY G9 (3-36). Все плазмиды присутствовали в L. lactis MG1369. «Промотор» означает промотор, который находится в направлении 3'-5' от гена hPYY G9 (3-36) или присутствует в эквивалентном сайте в pT1NX.
Фиг.14. Схематический обзор структуры pT1NX и различных экспрессирующих hGLP-1 G8 (7-36) плазмид, используемых в этом исследовании. Экспрессионные плазмиды pAGX0233 и pAGX0234 получены встраиванием соответствующих экспрессионных кассет в виде EcoRI-SpeI-фрагментов в плазмиду pT1NX, открытую расщеплением ферментами EcoRI и SpeI. Как таковые, структура и положение всех последовательностей ДНК вне экспрессионных кассет, таких как точка начала репликации (ori) и маркер устойчивости к эритромицину (EmR), идентичны для всех плазмид. Генетические элементы не масштабированы.
Фиг.15. Сравнение экспрессии hGLP-1 G8 (7-36) c P1 (Waterfield et al., 1995) (плазмида pAGX0211), PthyA (промотора тимидилатсинтазы, плазмида pAGX0212) и PhllA (промотора ДНК-связывающего белка бактериального ядра/ДНК-связывающего белка HU; SEQ ID NO: 28; плазмида pAGX0213), связанных с сигналом секреции ups45 и hGLP-1 G8 (7-36). Все плазмиды присутствовали в L. lactis MG1369. «Промотор» означает промотор, который находится в направлении 3'-5' от гена hGLP-1 G8 (7-36) или присутствует в эквивалентном сайте в pT1NX.
Фиг.16. Схематическое сравнение L. lactis MG1363 и различных экспрессирующих hIL-10 штаммов, используемых в этом исследовании. Во время конструирования экспрессирующие hIL-10 кассеты подвергают интеграции в хромосому L. lactis MG1363 с помощью гомологичной рекомбинации между идентичными последовательностями, находящимися 5' от thyA и экспрессирующих hIL-10 кассет, а также 3' от них, соответственно. Места рекомбинации схематически представлены «\». Это предполагает, что все последовательности ДНК вне экспрессионных кассет являются идентичными для описанных выше штаммов. В настоящем описании «промотором» является любой один из промоторов, представленных в штамме «sAGX00xx» (таблица 11). Генетические элементы не масштабированы.
Фиг.17. Сравнение экспрессии hIL-10 c PthyA (промотора тимидилатсинтазы, штамм sAGX0005) c экспрессией hIL-10 с любого другого промотора ряда штаммов (смотри фиг.16 и таблицу 11), в которых эти промоторы Lactococcus помещены 5' от слитого гена usp45-hIL-10.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемые в настоящем описании формы единственного числа подразумевают как единичное, так и множественное число, если из контекста явно не следует другое. Например, «клетка» относится к одной клетке или к более, чем одной клетке.
Используемые в настоящем описании термины «содержит» и «содержащий» являются синонимами терминов «включающий» и «включает», являются «содержащими» или «открытыми» формами, не исключают дополнительные, не указанные члены, элементы или стадии способов.
Перечисление численных диапазонов с помощью конечных точек включает все числа и доли, находящиеся в пределах этого диапазона, включая указанные конечные значения.
Под термином «приблизительно» понимают, если этот термин используют в описании в отношении измеряемой величины, такой как параметр, количество, период времени и тому подобные отклонения, составляющие +/-20% или меньше, предпочтительно +/-10% или меньше, более предпочтительно +/-5% или меньше, еще более предпочтительно +/-1% или меньше или даже еще более предпочтительно +/-0,1% или меньше, от определенной величины до таких пределов, при которых такие отклонения подходят для осуществления раскрытого изобретении.
Все приведенные в настоящем описании документы включены в качестве ссылки в полном объеме. В частности, описания всех документов, на которые в описании дана ссылка, включены в качестве ссылки.
Кроме случаев оговоренных особо, значения всех терминов, используемых при раскрытии по настоящему изобретению, в том числе технических и научных термины, такие же, как значения, обычно понимаемые средним специалистом в данной области, к которой относится это изобретение. Посредством дополнительного определения далее приведены определения для лучшего понимания сущности по настоящему изобретению.
Используемый в настоящем описании термин «нуклеиновая кислота» означает полимер любой длины, по существу состоящий из нуклеотидов, например, дезоксирибонуклеотидов и/или рибонуклеотидов. Нуклеиновые кислоты могут включать пуриновые и/или пиримидиновые основания и/или другие природные (например, ксантин, инозин, гипоксантин), химически или биохимически модифицированные (например, метилированные), неприродные или производные нуклеотидные основания. Остов нуклеиновых кислот может включать сахара и фосфатные группы, которые обычно встречаются в РНК или ДНК, и/или один или несколько модифицированных или замещенных сахаров и/или одну или несколько модифицированных или замещенных фосфатных групп. Термин «нуклеиновая кислота», кроме того, предпочтительно включает ДНК, РНК или гибридные молекулы ДНК/РНК, конкретно, включая яРНК человека, пре-мРНК, мРНК, кДНК, геномную ДНК, продукты амплификации, олигонуклеотиды и синтетическую (например, химически синтезированную) ДНК, РНК или гибриды ДНК/РНК. «Нуклеиновая кислота» может быть двухцепочечной, частично двухцепочечной или одноцепочечной. Если нуклеиновая кислота является одноцепочечной, то она может быть смысловой цепью или антисмысловой цепью. Кроме того, нуклеиновая кислота может быть кольцевой или линейной.
В предпочтительном варианте осуществления нуклеиновая кислота, содержащая промотор по настоящему изобретению, является ДНК или РНК, более предпочтительно ДНК.
Термин «рекомбинантная нуклеиновая кислота» обычно относится к нуклеиновой кислоте, которая состоит из сегментов, соединенных вместе, используя технологию рекомбинантных ДНК. Если рекомбинантная нуклеиновая кислота подвергается репликации в организме-хозяине, то нуклеиновые кислоты потомства также входят в определение термина «рекомбинантная нуклеиновая кислота».
Стандартные ссылки, в которых описаны общие принципы технологии рекомбинантных ДНК, включают Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; Current Protocols in Molecular Biology, ed. Ausubel et al., Greene Publishing and Wiley-Interscience, New York, 1992 (с периодическими обновлениями) (“Ausubel et al. 1992”); Innis et al., PCR Protocols: A Guide to Methods and Applications, Academic Press: San Diego, 1990. Основные принципы микробиологии изложены, например, в Davis, B.D. et al. В Microbiology, 3rd edition, Harper & Row, издательство Philadelphia, PA (1980).
Под промотором обычно понимают участок на молекуле нуклеиновой кислоты, предпочтительно на молекуле ДНК, с которым связывается РНК-полимераза, инициируя транскрипцию. Промотор предпочтительно, но не обязательно, располагается выше, т.е. в направлении 5' от последовательности, транскрипцию которой он контролирует. В настоящем изобретении конкретные промоторы обозначают термином «Р», за которым следует название гена, из которых они получены. Например, «PthyA» обозначает промотор гена thyA, а «PhllA» обозначает промотор гена hllA.
Термин «природный промотор» относится к промотору, нуклеотидная последовательность которого идентична нуклеотидной последовательности природного промотора, например, в клетке или организме в природе. Термин «природный промотор», таким образом, относится к последовательности промотора и не должен истолковаться как требование того, чтобы промотор был получен или продуцирован каким-либо конкретным способом. Наример, но не ограничиваясь, термин таким образом включает промоторы природных хозяев, выделенных из них, клонированных и репродуцированных с использованием технологии рекомбинантных ДНК, продуцированных способом амплификации или полученных синтетическим способом и тому подобное, если последовательность таких промоторов остается одинаковой последовательностям их природных копий (смотри, например, таблицу 1).
Специалисту в данной области будет понятно, что природная последовательность промотора данного гена может отличаться у различных видов Lactococcus и/или различных подвидов внутри одного вида Lactococcus и/или различных штаммов внутри одного вида или подвида Lactococcus из-за природной генетической дивергенции указанных видов, подвидов и/или штаммов. Таким образом, такие дивергентные, но обнаруживаемые в природе последовательности промоторов могли бы считаться природными.
Специалист в данной области обычно может спрогнозировать и идентифицировать природные бактериальные промоторы, такие как промоторы Lactococcus. Тем не менее, в качестве дополнительного руководства природный промотор можно, как правило, идентифицировать путем анализа геномной последовательности или ее части из бактерии, предпочтительно из вида Lactococcus; идентификации в ней открытой рамки считывания, т.е. последовательности кодирующих нуклеотидных триплетов, начинающейся с кодона инициации трансляции (предпочтительно ATG) и заканчивающейся кодоном терминации трансляции (например, TAA, TAG или TGA), и не содержащей какого-либо внутреннего, находящегося в рамке кодона терминации трансляции, и анализа последовательности, находящейся в направлении 5' от указанного кодона инициации трансляции, для того, чтобы локализовать самый верхний кодон инициации трансляции, в направлении 5' от которого наблюдается в рамке кодон терминациии трансляции. Предпочтительно транскрипцию идентифицированной таким образом открытой рамки считывания можно подтвердить экспериментально, например с помощью Норзерн-блоттинга или ОТ-ПЦР, а сайт инициации транскрипции (например, прилегающий к самому верхнему и/или, возможно, одному или нескольким из более нижних кодонов инициации трансляции) можно определить, используя, например, способ быстрой амплификации 5'-концов кДНК (5'-RACE).
Как правило, последовательности, прилегающие и ближайшие в направлении 3'-5' к самому верхнему кодону инициации трансляции (и/или, если экспериментальные данные указывают на это, одному или нескольким из более нижних кодонов инициации трансляции) могут включать природный промотор, ответственный за транскрибирование указанной ORF. В качестве предпочтительного примера, если первый нуклеотид кодона инициации трансляции обозначают «+1» (например, нуклеотид А кодона ATG - +1), а нуклеотид, находящийся непосредственно в направлении 5' от него, обозначают «-1», то термин «природный промотор» может относиться к последовательности приблизительно от «-500» до приблизительно «+50», например приблизительно от «-500» до приблизительно «+20», приблизительно от «-500» до приблизительно «+10», приблизительно от «-500» до приблизительно «+5», приблизительно от -«500» до приблизительно «+2» или приблизительно от «-500» до приблизительно «-1», предпочтительно приблизительно от «-400» до приблизительно «+50», например, в предпочтительных примерах приблизительно от «-400» до приблизительно «+20», например приблизительно от «-400» до приблизительно «+10», приблизительно от «-400» до приблизительно «+5», приблизительно от «-400» до приблизительно «+2» или приблизительно от «-400» до приблизительно «-1», более предпочтительно приблизительно от «-300» до приблизительно «+50», например, в предпочтительных примерах приблизительно от «-300» до приблизительно «+20», например приблизительно от «-300» до приблизительно «+10», приблизительно от «-300» до приблизительно «+5», приблизительно от «-300» до приблизительно «+2» или приблизительно от «-300» до приблизительно «-1», такой как, например, в предпочтительных примерах приблизительно от «-200» до приблизительно «+50» или дальнейших предпочтительных примерах приблизительно от «-200» до приблизительно «+20», например приблизительно от «-200» до приблизительно «+10», приблизительно от «-200» до приблизительно «+5», приблизительно от «-200» до приблизительно «+2» или приблизительно от «-200» до приблизительно «-1», или такой как, например, в других предпочтительных примерах приблизительно от «-100» до приблизительно «+50» и в дальнейших предпочтительных примерах приблизительно от «-100» до приблизительно «+20», например приблизительно от «-100» до приблизительно «+10», приблизительно от «-100» до приблизительно «+5», приблизительно от «-100» до приблизительно «+2» или приблизительно от «-100» до приблизительно «-1», если указанная последовательность демонстрирует промоторную активность.
Также предусматривается использование функциональных вариантов природных промоторов Lactococcus в рекомбинантных нуклеиновых кислотах по настоящему изобретению. Термин «вариант» относится к последовательности, которая по существу идентична (т.е. в основном, но не полностью идентична) соответствующей природной последовательности, например последовательности соответствующего природного промотора Lactococcus. «По существу идентична» обозначает идентичность по крайней мере на 60%, предпочтительно по крайней мере на 70%, более предпочтительно по крайней мере на 80%, например по крайней мере на 85%, более предпочтительно по крайней мере на 90%, например по крайней мере на 91%, 92%, еще более предпочтительно по крайней мере на 93%, например, 94%, еще более предпочтительно по крайней мере на 95%, например по крайней мере на 96%, более предпочтительно по крайней мере на 97%, например по крайней мере на 98%, и наиболее предпочтительно по крайней мере на 99%. Выравнивание последовательностей и определение идентичности последовательностей можно осуществить, например, используя инструмент Basic Local Alignment Search Tool (BLAST), первоначально описанный Altschul et al. (1990), такой как алгоритм «Blast 2 sequences», описанный Tatusova и Madden (1999).
Изобретение также относится к использованию функциональных фрагментов природных промоторов Lactococcus в рекомбинантных нуклеиновых кислотах по настоящему изобретению. Используемый в настоящем описании термин «фрагмент» относится к последовательности, которая имеет 5' и/или 3' делецию одного или нескольких нуклеотидов по сравнению с природной последовательностью, например, природным промотором Lactococcus или его вариантом, но в которой остальная последовательность нуклеиновой кислоты фрагмента идентична соответствующим положениям в последовательности природного промотора Lactococcus или его варианта. Остальная последовательность фрагмента может представлять предпочтительно по крайней мере 30%, например по крайней мере 40%, более предпочтительно по крайней мере 50%, например по крайней мере 60%, даже более предпочтительно по крайней мере 70%, например по крайней мере 80% или по крайней мере 85%, и еще более предпочтительно по крайней мере 90%, например по крайней мере 95% или более от последовательности нуклеиновой кислоты соответствующего природного промотора Lactococcus или его варианта, например, идентифицированного способами по настоящему изобретению, например, приведенными конкретными последовательностями SEQ ID NO: в таблице 1.
Термин «функциональный» относительно вариантов и фрагментов промоторов, указ