Комбинированная мазевая композиция с репарирующим эффектом
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой комбинированную мазевую композицию для стимуляции регенерации кожи, содержащую ретинола пальмитат, метилурацил, α-токоферол, воск эмульсионный, масло вазелиновое, глицерин, этанол и воду, отличающуюся тем, что содержит компоненты при следующем соотношении, мас.%: ретинола пальмитат 0,5-1,0; метилурацил 2,0-3,5; α-токоферол 0,15-0,2; воск эмульсионный 5,0-15,0; масло вазелиновое 5,0-15,0; глицерин 5,0-15,0; этанол 95% 5,0-15,0; вода дистиллированная до 100,0. Изобретение обеспечивает повышение устойчивости ретинола пальмитата. 2 ил., 2 пр., 5 табл.
Реферат
Изобретение относится к фармацевтике и касается мазевой композиции, содержащей две активные фармацевтические субстанции, стимулирующие процессы регенерации, предназначенной для лечения повреждений кожи (обморожения, ожоги, эрозии, ссадины, язвы, трещины, раны, в том числе хирургические, др.).
Травматические повреждения кожи различного генеза представляют собой широко распространенный вид патологии человека. Восстановление целостности кожного покрова происходит за счет процессов репаративной регенерации, в основе которой лежат механизмы регенерации физиологической [1]. Поиск возможностей стимулировать эти процессы с целью более быстрого заживления дефекта и уменьшения вероятности возникновения осложнений остается актуальным и в настоящее время.
Ретинола пальмитат (РП) является одним из синтетических аналогов витамина А, обладает широким спектром фармакологической активности, в том числе дерматотропной. Он активизирует пролиферативные процессы в эпидермисе, тормозит терминальную дифференцировку кератиноцитов, усиливает синтез гликозаминогликанов в соединительнотканном слое кожи, стимулирует иммунные процессы в организме. Метилурацил (МУ) является производным пиримидина, представляет собой полученный путем синтеза структурный аналог тимина. Он стимулирует процессы регенерации в органах и тканях, в частности, в коже, печени, миокарде, эпителиях слизистых оболочек и др. [2]. Известен препарат Редецил®, в состав которого входят МУ (диоксометилтетрагидропиримидин) 3 г, ретинола пальмитат 0,5 г, вспомогательные вещества (бутилгидроксианизол 0,05 г, бутилгидрокситолуол 0,05 г, вода очищенная до 100 г, воск эмульсионный 8 г, глицерол 10 г, этанол 95% 10 г) - 100 г [3]. В экспериментах, проведенных на животных, было показано, что эта мазевая композиция, объединяющая в своем составе два стимулятора регенерации - РП и МУ, - способствует более ранней (в сравнении с мазями, содержащими только РП или только МУ) инициации репара-тивных процессов в экспериментальной ожоговой ране, сокращению сроков ее заживления и формированию более полноценного регенерата [4]. Применение этой мази в хирургической практике позволяет оптимизировать сроки лечения (особенно ожогов и гнойных и инфицированных ран), добиться более раннего наступления регенеративных процессов в течении трофических язв и более быстрого их заживления.
Известны составы лекарственных средств для наружного применения, содержащие в качестве стимулятора регенерации только РП [5] или только МУ [6]. Наиболее близким по медицинским показаниям и технической сущности к заявляемому составу является препарат для заживления ран, который содержит три биологически активные фармацевтические субстанции - РП, МУ и диметилсульфоксид (ДМСО), а в качестве стабилизаторов - бутилок-ситолуол (син. - бутилгидрокситолуол, БОТ) и бутилоксианизол (син. - бу-тилгидроксианизол, БОА) [7].
ДМСО, как известно, в значительной степени повышает проникновение веществ через кожу, увеличивая таким образом биодоступность наносимых на нее соединений, может усиливать не только активность, но и токсичность некоторых лекарств, способствует депонированию содержащихся в лекарственных средствах веществ, обладает рядом системных побочных эффектов [8]. Так как мазевые композиции, предназначенные для заживления повреждений кожи, должны быть поверхностно действующими, наличие в их составе соединения, усиливающего системное действие и кумуляцию фармацевтических субстанций, представляется неоправданным.
БОТ и БОА как антиоксиданты широко применяются в фармации и пищевой промышленности, однако известно, что им присущи и некоторые нежелательные эффекты, например, потенциальные канцерогенные свойства, способность повышать уровень холестерина, оказывать раздражающее действие на кожу, глаза и слизистые оболочки, в связи с чем их содержание в лекарственных средствах и пищевых продуктах должно быть регламентировано [9]. Задачей настоящего изобретения является разработка мазевой композиции с репарирующим эффектом, лишенной указанных недостатков.
В соответствии с изобретением описывается комбинированная мазевая композиция для наружного применения, стимулирующая регенераторные процессы в коже, содержащая в качестве активных веществ ретинола пальмитат и метилурацил, а в качестве вспомогательных веществ эмульсионный воск, вазелиновое масло, глицерин, α-токоферол, спирт этиловый и воду при следующем соотношении компонентов, мас.%:
| Ретинола пальмитат | 0,5-1,0 |
| Метилурацил | 2,0-3,5 |
| α-токоферол | 0,15-0,2 |
| Воск эмульсионный | 5,0-15,0 |
| Масло вазелиновое | 5,0-15,0 |
| Глицерин | 5,0-15,0 |
| Этанол 95% | 5,0-15,0 |
| Вода дистиллированная | до 100,0 |
Использование α-токоферола позволяет избежать использования таких компонентов, как ДМСО, бутилгидрокситолуол и бутилгидроксианизол при сохранении высоких ранозаживляющих и эксплуатационных свойств лекарственного препарата.
Лабораторные исследования
Эксперимент 1
Цель: изучить ранозаживляющую способность мази с РП и МУ, содержащей и не содержащей ДМСО.
Материал и методы. Опыты проводили на крысах-самках популяции Вистар со средней массой 200-210 г. Термический ожог вызывали путем наложения под гексеналовым наркозом на 20 сек на лишенную волосяного покрова кожу межлопаточной области спины нагретого в течение 1 мин в кипящей воде (100°С) медного куба массой 50 г с площадью соприкосновения 4 см2. Через сутки на месте ожогов возникали раны в виде изъязвлений, заполненных полненных некротическими массами. На раневую поверхность, начиная с третьего дня эксперимента, наносили мази в количестве 0,5 г, приготовленные на эмульсионной основе, содержащие в качестве активных субстанций 0,5% РП, 3% МУ и 10% ДМСО (1-й вариант) или 0,5% РП и 3% МУ (2-й вариант). Аппликации проводили 6 раз в неделю до полного заживления ран в одной из групп животных. Контролем служили крысы с ожоговыми ранами, не получавшие мазевых аппликаций. На 11-е сутки опыта у всех крыс с поверхности ран удаляли первичный струп. В ходе эксперимента у каждого животного измеряли площадь раневой поверхности. Для этого с помощью аппаратно-программного комплекса «ДиаМорф» (Россия) получали видеоизображения ран, которые затем обрабатывали методом компьютерной морфометрии. Рассчитывали абсолютные значения параметра. Статистическую обработку результатов исследований проводили с использованием t-критерия Стьюдента. Различия средних считали значимыми с уровнем вероятности не менее 95% (в таблицах отмечены звездочкой).
Результаты. Уменьшение площади ран у животных экспериментальных групп в сравнении с контрольными животными отмечалось уже через 4 дня после начала аппликаций мазей. Обе мази на всех исследованных сроках продемонстрировали выраженный репаративный дерматотропный эффект при некоторой вариабельности динамики процесса (табл.1).
| Таблица 1 | ||||
| Динамика абсолютной площади ожоговых ран (в см2) | ||||
| Группы | Дни наблюдений после начала аппликаций мазей | |||
| 4-й | 11-й | 18-й | 35-й | |
| Без воздействия | 6,2±0,2 | 4,9±0,5 | 3,2±0,1 | 1,2±0,2 |
| Аппликации мази с РП, МУ и ДМСО | 5,3±0,3 | 4,2±0,3 | 1,2±0,3* | 0,3±0,07* |
| Аппликации мази с РП и МУ | 5,3±0,2* | 3,0±0,1* | 2,2±0,3* | 0,6±0,1* |
| Примечание:* - достоверное отклонение от контроля при Р<0,05. |
Нанесение на раневую поверхность обоих вариантов мази позволило почти в два раза сократить сроки заживления ран по сравнению с показателями контрольной группы.
Таким образом, выведение ДМСО из состава мазевой композиции, содержащей РП и МУ, не внесло существенных изменений в специфическую фармакологическую активность лекарственного препарата.
Эксперимент 2
В заявляемый состав мазевой композиции α-токоферол введен с целью стабилизации ретиноида, и поэтому на первом этапе лабораторных исследований стабильность РП была изучена на примере модельных смесей.
Цель: изучить устойчивость субстанции РП, стабилизированной α-токоферолом.
Объект исследования составили модельные смеси - субстанция РП в вазелиновом масле без антиоксиданта (1) - контроль - и аналогичная комбинация, отличающаяся наличием в ней α-токоферола (2). Начальная концентрация РП в модельных смесях равнялась 1%, концентрация α-токоферола - 0,05%. Образцы были заложены на «ускоренное старение» в стеклянных банках с широким горлом при свободном доступе воздуха в условиях повышенной температуры.
Метод: спектрофотометрия по отношению к раствору стандартного образца.
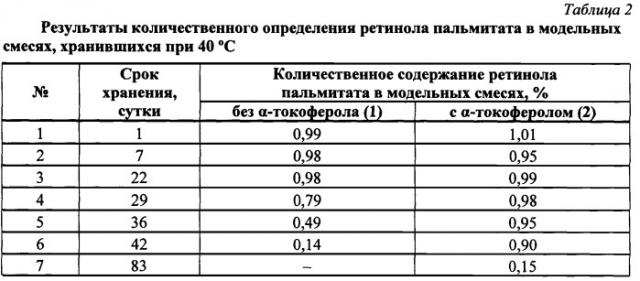
Результаты анализа количественного содержания РП в модельных смесях, хранившихся при 40°С, представлены в таблице 2.
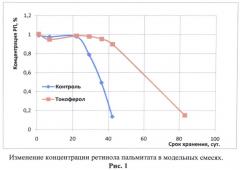
Из представленных данных следует, что содержание РП в образцах обеих модельных смесей до 22-го дня наблюдения оставалось практически на одном уровне. В дальнейшем концентрация субстанции в контрольном образце, т.е. в модельной смеси без антиоксиданта (1) стала снижаться. Анализ, проведенный в последующие дни, зафиксировал лавинообразное падение концентрации ретиноида в контрольных образцах (рис.1). В модельной смеси с антиоксидантом (2) концентрация ретиноида сохранялась на первоначальном уровне до 36-го дня наблюдения, и только впоследствии было отмечено ее снижение (см. табл.2, рис.1).
Полученный результат показывает, что присутствие в модельной смеси даже незначительного количества α-токоферола (0,05%) почти в два раза продлевает исходную устойчивость РП, что свидетельствует о наличии у α-токоферола в исследованных условиях выраженного антиокислительного эффекта и, в связи с этим, о перспективности его введения в состав лекарственных средств с целью стабилизации ретиноидов.
Эксперимент 3
Цель: установить эффективную концентрацию α-токоферола, способную затормозить окисление РП на длительный срок.
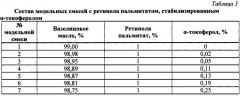
Объект исследования составили модельные смеси - субстанция РП в вазелиновом масле без антиоксиданта (1) и аналогичные комбинации (2-7), отличающиеся тем, что в них был добавлен α-токоферол в различных концентрациях (табл.3). Начальная концентрация ретиноида в модельных смесях равнялась 1%, α-токоферола - 0,02-0,25%. Образцы были заложены на хранение в стеклянных банках с широким горлом при свободном доступе воздуха при более жестких, чем в 1-м эксперименте, условиях «ускоренного старения» (50°С).
Метод: спектрофотометрия по отношению к стандартному образцу.
Результаты количественного определения РП в модельных смесях через 53 дня хранения при температуре 50°С представлены на рис.2.
На диаграмме видно, что разные количества α-токоферола в модельных смесях оказывают неравнозначное влияние на устойчивость ретиноида. Добавление антиоксиданта в диапазоне концентраций от 0,02 до 0,05% при хранении при 50°С в течение 53 суток в условиях доступа воздуха оказалось неэффективным. В количестве 0,11% α-токоферол стабилизировал ретиноид, но не в желаемой степени. Наиболее высокие показатели устойчивости РП в исследованных условиях наблюдались при концентрациях α-токоферола в модельных смесях от 0,13 до 0,25% включительно. Т. е. чем больше в смеси антиоксиданта, тем сильнее проявляется его свойство препятствовать окислению/разрушению фармацевтической субстанции (РП); иными словами, стабилизирующий эффект напрямую зависит от концентрации α-токоферола.
Таким образом, экспериментальные исследования стабильности РП при его хранении в условиях ускоренного старения в составе модельных смесей, содержащих в качестве антиоксиданта α-токоферол, продемонстрировали эффективность выбранного подхода к стабилизации ретиноида, т.е. замены в составе лекарственного препарата комбинации антиоксидантов фенольного типа (БОТ и БОА) на синтетический аналог природного витамина Е, и позволили перейти к изучению стабильности РП в составе мазевой композиции заявляемого состава.
Эксперимент 3
Цель: установить продолжительность стабильности фармацевтических субстанций (РП и МУ) в составе мазевых композиций, содержащих разные концентрации α-токоферола.
Объект исследования составили образцы комбинированных мазевых композиций, различающихся по содержанию α-токоферола (0,15; 0,2%).
Метод: высокоэффективная жидкостная хроматография.
Технология приготовления мази
1. Необходимое количество воды помещают в реактор и нагревают до 80°С. Затем в воду высыпают навеску метилурацила и перемешивают до растворения.
2. Параллельно в другой реактор помещают необходимые количества вазелинового масла (часть от общего содержания в препарате) и эмульсионного воска. Нагревают до температуры 75°С, расплавляя их.
3. В небольшое количество вазелинового масла помещают расчетные количества ретинола пальмитата и α-токоферола и смесь тщательно перемешивают.
4. После расплавления жировых компонентов основы (п.2) в реактор добавляют смесь ретинола пальмитата и α-токоферола и перемешивают.
5. В раствор метилурацила в воде (п.1) опускают головку гомогенизатора, включают его (8-10 тыс об./мин) и при активном перемешивании смеси медленно, тонкой струйкой добавляют расплав жировых компонентов мази (п.4). Через 2-5 минут [в зависимости от объема использованного реактора (0,5-3,0 л)] после смешивания всех компонентов препарата мазь окончательно гомогенизируют. Спустя 2-5 минут в реактор добавляют смесь этанола и глицерина, после чего мазь дополнительно гомогенизируют в течение 2 минут.
6. В связи с тем, что мазь содержит термолабильные компоненты (ретинола пальмитат, α-токоферол), разрушение которых усиливается при высоких температурах, ее следует принудительно охладить. После охлаждения мази до 35-40°С ее передают на участок фасовки в тубы.
Мазь должна храниться в сухом месте при температуре от 2 до 8°С. Замораживание не допускается.
Примеры приготовления конкретных композиций
Пример 1.
В реактор 1 с эффективной загрузкой в 100 кг мази отмеривают 62,35 л очищенной воды и нагревают ее до температуры 75-80°С. Включают двигатель рамной мешалки, добавляют 3,0 кг метилурацила и перемешивают до растворения при вращении рамной мешалки.
В реактор 2 отвешивают 8 кг эмульсионного воска, 5 кг вазелинового масла, включают двигатель рамной мешалки и, нагревая смесь до температуры 75-80°С, расплавляют ее.
В специальную емкость отвешивают 1 кг вазелинового масла, 0,5 кг ретинола пальмитата и 0,15 кг α-токоферола. Нагревают смесь до температуры 45-50°С, тщательно перемешивают и переносят в реактор 2.
С помощью роторно-пульсационного аппарата проточного типа смешивают компоненты двух реакторов до получения однородной эмульсии, в которую постепенно добавляют смесь 10 кг этилового спирта и 10 кг глицерина.
Полученную смесь окончательно гомогенизируют, охлаждают до температуры 30-35°С и фасуют в алюминиевые тубы.
Аналогично (по такой же схеме) получена мазь (пример 2), состав которой представлен в таблице 4.
| Таблица 4 | ||
| Составы мазей с репарирующим эффектом | ||
| Наименование компонентов | Количество компонента в примере, % | |
| 1 | 2 | |
| Ретинола пальмитат | 0,5 | 0,5 |
| Метилурацил | 3,0 | 3,0 |
| α-токоферол | 0,15 | 0,2 |
| Воск эмульсионный | 8,0 | 8,0 |
| Масло вазелиновое | 6,0 | 6,0 |
| Глицерин | 10,0 | 10,0 |
| Этанол 95% | 10,0 | 10,0 |
| Вода очищенная | до 100,0 | до 100,0 |
Мазевые композиции по примерам 1 и 2, расфасованные в алюминиевые тубы, были заложены на длительное хранение при температуре 2-8°С.
Результаты количественного определения концентраций фармацевтических субстанций (РП и МУ) в этих мазях на разных сроках хранения представлены в таблице 5.
| Таблица 5 | |||||
| Концентрации ретинола пальмитата и метилурацила в экспериментальных мазях, % | |||||
| № | Срок хранения, годы | Количественное содержание ретинола пальмитата, % | Количественное содержание метилурацила, % | ||
| Пример 1 | Пример 2 | Пример 1 | Пример 2 | ||
| 1 | Сразу после приготовления | 0,54 | 0,53 | 3,10 | 3,23 |
| 2 | 0,5 | 0,52 | 0,53 | 3,00 | 3,15 |
| 3 | 1,0 | 0,51 | 0,52 | 2,90 | 3,30 |
| 4 | 1,5 | 0,50 | 0,51 | 2,85 | 3,19 |
| 5 | 2,0 | 0,48 | 0,50 | 3,10 | 3,20 |
| 6 | 2,5 | 0,46 | 0,50 | 3,10 | 3,20 |
Как видно из результатов анализа, в процессе хранения образцов мазей, приготовленных по примерам 1 и 2, концентрация МУ на протяжении 2,5 лет хранения сохраняется на первоначальном уровне. Содержание РП в обеих мазях выдерживает необходимый срок хранения: через 2 года концентрация РП в них не снижается ниже допустимого предела. Мази, приготовленные по примерам 1 и 2, достаточно устойчивы и обеспечивают сохранность обеих фармацевтических субстанций в лекарственном препарате на протяжении необходимого срока годности.
Литература
1. Бабаева А.Г. Регенерация: факты и перспективы. - М.: Изд-во РАМН, 2009-336 с.
2. Белоусова Т.А. Фармакологические свойства метилурацила (обзор литературы) // Альманах "Ретиноиды". - М.: ЗАО "Ретиноиды", 2009. - Вып. 28. - С.11-43.
3. Альманах "Ретиноиды". - М.: ЗАО "Ретиноиды", 2010. - Вып.30. - С.4-11.
4. Ноздрин В.И., Яцковский А.Н., Белоусова Т.А. и др. Исследование специфической фармакологической активности препарата Редецил® // Альманах "Ретиноиды". - М.: ЗАО "Ретиноиды", 2010. - Вып. 30. - С.13-23.
5. Патент RU 2036640. - 12.05.1993. - Опубл. Бюлл. №16. - 10.06.95.
6. Патент RU 2135180. - 15.02.1999. - Опубл. Бюлл. №24 - 27.08.99.
7. Патент RU 2004239. - 24.12.1992. - Опубл. Бюлл. №45-46. - 15.12.93.
8. Santos N.C., Figueira-Coelho J., Martins-Silva J., Saldanha C. Multidiscipli-nary utilization of dimethyl sulfoxide: pharmacological, cellular, and molecular aspects // Biochem. Pharmacol. - 2003. - Vol.65, No. 7. - P. - 1035-1041.
9. СанПиН 2.3.2.1293-03. - П.3.4.4.
Комбинированная мазевая композиция для местного применения, стимулирующая регенераторные процессы в коже, на основе ретиноида и метилурацила, содержащая ретинола пальмитат, метилурацил, α-токоферол, воск эмульсионный, масло вазелиновое, глицерин, этанол и воду при следующем соотношении компонентов, мас.%:
| Ретинола пальмитат | 0,5-1,0 |
| Метилурацил | 2,0-3,5 |
| α-токоферол | 0,15-0,2 |
| Воск эмульсионный | 5,0-15,0 |
| Масло вазелиновое | 5,0-15,0 |
| Глицерин | 5,0-15,0 |
| Этанол 95% | 5,0-15,0 |
| Вода дистиллированная | До 100,0 |