Гуманизированные антитела к cd19 и их применение для лечения онкологического, связанного с трансплантацией и аутоиммунного заболевания
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено гуманизированное моноклональное антитело против CD19 человека, полученное из антитела HB12B, и его фрагмент, охарактеризованные через аминокислотные последовательности вариабельных доменов. Также рассмотрены нуклеиновые кислоты, кодирующие полипептиды, содержащие последовательности вариабельных доменов, и клетка, экспрессирующая антитело по изобретению, а также фармацевтическая композиция и способ лечения В-клеточного заболевания или нарушения у человека. Настоящее изобретение может найти дальнейшее применение в лечении различные заболеваний, ассоциированных с CD19, в том числе аутоиммунных заболеваний, и предупреждении или лечении реакции трансплантат-против хозяина (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантатов. 6 н. и 15 з.п. ф-лы, 45 ил., 40 табл., 7 пр.
Реферат
1. Введение
Настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, которые связываются с человеческим антигеном CD19. Настоящее изобретение относится также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19, которые могут опосредовать один или несколько из следующих видов активности: комплементзависимая клеточно-опосредованная цитотоксичность (CDC), антителообусловленная клеточно-зависимая цитотоксичность (ADCC) и запрограммированная гибель клеток (апоптоз). Настоящее изобретение относится также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19 человеческого изотипа IgG1 и/или IgG3, а также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19 человеческого изотипа IgG2 и/или IgG4, которые могут опосредовать у человека ADCC, CDC или апоптоз. Настоящее изобретение относится также к способам лечения В-клеточных нарушений или заболеваний у человека, включая В-клеточные злокачественные состояния, с помощью терапевтических человеческих, гуманизированных или химерных антител к CD19, которые связываются с человеческим антигеном CD19. Настоящее изобретение относится к способам лечения и предупреждения аутоиммунного заболевания, а также лечения и предупреждения реакции «трансплантат-против-хозяина» (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения людей-реципиентов трансплантатов с помощью человеческих, гуманизированных или химерных антител к CD19, которые связываются с человеческим антигеном CD19.
2. Предпосылки создания изобретения
В-клетки экспрессируют на клеточной поверхности широкий набор молекул в процессе своей дифференцировки и пролиферации. Их примерами являются такие маркеры поверхности лейкоцитов, как CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD53, CD72, CD74, CD75, CD77, CD79a, CD79b, CD80, CD81, CD82, CD83, CD84, CD85 и CD86. Эти маркеры, как правило, рассматриваются в качестве мишеней для терапевтических агентов, предназначенных для лечения В-клеточных нарушений или заболеваний, таких как В-клеточные злокачественные состояния, аутоиммунные заболевания и отторжение трансплантата. Можно создавать антитела, которые специфически связываются с ними и некоторые из них прошли оценку в качестве терапевтического агента, предназначенного для лечения заболеваний и нарушений.
Например, установлено, что терапевтические подходы, основанные на применении химерного или меченного с помощью радиоактивной метки моноклонального антитела (МАт) к CD20, т.е. находящейся на клеточной поверхности молекулы, специфической в отношении зрелых В-клеток и их злокачественных копий, являются эффективными для лечения in vivo не-ходжкинской лимфомы (Tedder и др., Immunol. Today 15, 1994, cc.450-454; Press и др., Hematology, 2001, cc.221-240; Kaminski и др., N. Engl. J. Med. 329, 1993, cc.459-465; Weiner, Semin. Oncol. 26, 1999, cc.43-51; Onrust и др., Drugs 58, 1999, cc.79-88; McLaughlin и др., Oncology 12, 1998, cc.1763-1769; Reffn др., Blood 83, 1994, cc.435-445; Mloney и др., Blood 90, 1997, cc.2188-2195; Malone и др., J. Clin. Oncol. 15, 1997, cc.3266-3274; Anderson и др., Biochem. Soc. Transac. 25, 1997, cc.705-708). Установлено, что терапия, основанная на применении моноклональных антител к CD20, обладает в том числе эффективностью в отношении ослабления проявлений ревматоидного артрита, системной красной волчанки, идиопатической тромбоцитопенической пурпуры и гемолитической анемии, а также других опосредуемых иммунной системой заболеваний (Silverman и др., Arthritis Rheum. 48, 2002, cc.1484-1492; Edwards и др., Rheumatology 40, 2001, cc.1-7; De Vita и др., Arthritis Rheumatism 46, 2002, cc.2029-2033; Leandro и др., Ann. Rheum. Dis. 61, 2002, cc.883-888; Leandro и др., Arthritis Rheum. 46, 2001, cc.2673-2677). Антитело к CD20 (IgG1) ритуксан (RITUXAN) с успехом применяют для лечения определенных заболеваний, таких как иммунная тромбоцитопеническая пурпура взрослых, ревматоидный артрит и аутоиммунная гемолитическая анемия (Cured и др., WO 00/67796). Несмотря на эффективность указанных терапий, В-клеточное истощение (истощение популяции В-клеток (элиминация В-клеток)) происходит менее эффективно, когда В-клетки не экспрессируют CD20 или экспрессируют низкие уровни CD20 (например, на поверхности пре-В-клеток или незрелых В-клеток), или когда экспрессия CD20 отсутствует из-за направленной на CD20 иммунотерапии (Smith и др., Oncogene 22, 2003, cc.7359-7368).
В данной области известны мышиные моноклональные антитела к CD19, например HD37 (IgG1, каппа) (фирма DAKO North America, Inc, Карпинтерия, шт.Калифорния), BU12 (Callard и др., J. Immunology, 148(10), 1992, cc.2983-2987), 4G7 (IgG1) (Meeker и др., Hybridoma, 3(4), зима 1984 г., cc.305-320), J4.119 (фирма Beckman Coulter, Крефельд, Германия), В43 (фирма PharMingen, Сан-Диего, шт.Калифорния), SJ25C1 (фирма BD PharMingen, Сан-Диего, шт.Калифорния), FMC63 (IgG2a) (Zola и др., Immunol. Cell. Biol. 69 (РТб), 1991, cc.411-422); Nicholson и др., Mol. Immunol., 34:1157-1165 (1997); Pietersz и др., Cancer Immunol. Immonotherapy, 41, 1995, cc.), 89 В(В4) (IgG1) (фирма Beckman Coulter, Майами, шт.Флорида); Nadler и др., J. Immunol., 131, 1983, cc.244-250), и/или HD237 (IgG2b) (Fourth International Workshop on Human Leukocyte Differentiation Antigens, Vienna, Austria, 1989; и Pezzutto и др., J. Immunol., 138(9), 1987, cc.2793-2799). Антитела к CD19 или их конъюгаты могут также обладать терапевтическим потенциалом на различных созданных на животных моделях В-клеточных нарушений и заболеваний (Falvell и др., Br. J. Hematol. 134(2), 2006, cc.157-170; Vallera и др., din. Cancer Res. 11(21), 2005, cc.7920-7928; Yazawa и др., Proc. Natl. Acad. Sci. USA 102(42), 2005, cc.15178-15183). В частности, применение гуманизированных антител к CD19 описано для лечения В-клеточного заболевания, такого как лимфома, лейкоз или аутоиммунное заболевание (см. Hansen, опубликованная заявка на патент США 2005/0070693).
Несмотря на современные успехи в терапии рака, В-клеточные злокачественные состояния, такие как не-ходжкинские лимфомы В-клеточных подтипов и хронический лимфолейкоз, являются основными заболеваниями, с которыми связана смертность от рака. Таким образом, существует выраженная потребность в дополнительных, улучшенных терапевтических схемах лечения В-клеточных злокачественных состояний.
В настоящее время известно, что как клеточный (опосредуемый Т-клетками), так и гуморальный (антителообусловленный, опосредуемый В-клетками) иммунитет играет важную роль в отторжении трансплантатов. Хотя важная роль опосредуемого Т-клетками иммунитета в отторжении трансплантата хорошо изучена, в настоящее время только начинает проясняться решающая роль гуморального иммунитета в остром и хроническом отторжении. Таким образом, значительная часть успехов, достигнутых в лечении и предупреждении отторжения трансплантата, связана с созданием терапевтических агентов, мишенью которых является Т-клеточная активация. Первое терапевтическое моноклональное антитело, разрешенное FDA для лечения отторжения трансплантата, было мышиное моноклональное антитело ORTHOCLONE-OKT3™ (муромонаб-CD3), к СО3-рецептору Т-клеток. ОКТ3 объединяли с некоторыми другими антилимфоцитарными антителами, включая моноклональные антитела к CD52 CAMPATH™, CAMPATH-1G, САМРАТН-1Н (алемтузумаб), и САМРАТН-1М), и препаратами поликлональных антител к тимоцитам (обозначены как антитимоцитный глобулин, или «ATG», который называют также «тимоглобин» или «тимоглобулин»). Другие Т-клеточные антитела, разрешенные для предупреждения отторжения трансплантата, включают химерное моноклональное антитело SIMULECT™ (базиликсимаб) и гуманизированное моноклональное антитело ZENAPAX™ (даклизумаб), мишенью их обоих является высокоаффинный IL-2-рецептор активированных Т-клеток.
Первоначально считалось, что важность гуморального иммунитета в отторжении трансплантата ограничена гиперострым отторжением, при котором реципиент трансплантата несет антитела к HLA человека-донора перед трансплантацией, что приводит к быстрой деструкции трансплантата в отсутствии эффективной терапевтической схемы подавления антител. В настоящее время стало очевидно, что гуморальный иммунитет является также важным фактором, опосредующим как острое, так и хроническое отторжение. Например, клинические исследования продемонстрировали, что срок жизнеспособности трансплантата у пациентов, в организме которых могут образовываться аллоантитела к антигенам класса I или класса II HLA (обозначенные также как «аллоантитела к антигенам ГКГ (аллоантитела к ГКГ (главный комплекс гистосовместимости)), снижался по сравнению со сроком жизнеспособности трансплантата у пациентов, в организме которых не могли образовываться такие антитела. Клинические и экспериментальные данные свидетельствуют также о том, что другие специфические для донора аллоантитела и аутоантитела представляют собой имеющие решающее значение медиаторы отторжения. Обзор данных современных исследований, подтверждающих роль специфических для донора антител в отторжении аллотрансплантата, представлен у Rifle и др., Transplantation, 79, 2005, cc.14-18. Таким образом, из-за относительно недавнего понимания роли гуморального иммунитета в остром и хроническом отторжении трансплантата, современные терапевтические агенты и стратегии, направленные на гуморальный иммунитет, существенно менее развиты, чем направленные на клеточный иммунитет. Таким образом, в данной области существует необходимость в создании улучшенных реагентов и методов лечения и предупреждения отторжения трансплантата, т.е. реакции «трансплантат-против-хозяина» (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантата.
Аутоиммунные заболевания в целом являются причиной высокого уровня заболеваемости и потери трудоспособности. Оценка данных о встречаемости, собранных с 1965 по 1995 гг., позволила предположить, что примерно у 1,2 миллиона человек может развиться новое аутоиммунное заболевание в следующие пять лет. Jacobsen с соавторами (Clin Immunol. Immunopathol. 84, 1997, с.223) изучили порядка 130 опубликованных исследований и определили, что в 1996 г. 8,5 миллионов человек в Соединенный Штатах (3,2% популяции) страдали по меньшей мере одним из 24 аутоиммунных заболеваний, которые оценивали в этих исследованиях. С учетом основной роли аутоиммунных заболеваний в общественном здравоохранении необходимо создание эффективных и безопасных путей лечения этих многочисленных нарушений. Таким образом, в данной области существует необходимость в улучшенных реагентах и методах лечения аутоиммунного заболевания.
3. Краткое изложение сущности изобретения
Настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, которые связываются с человеческим антигеном CD19, а также к композициям, содержащим эти антитела. Одним из вариантов осуществления настоящего изобретения являются химерные и гуманизированные версии мышиных моноклональных антител к CD19, такие как НВ12А и НВ12В.
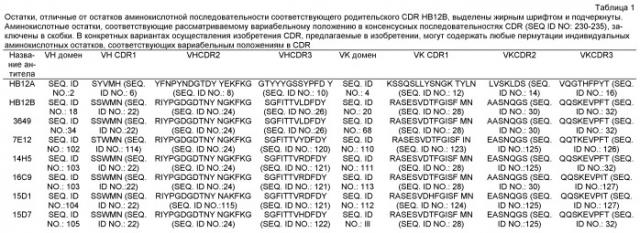
В другом варианте осуществления изобретения антитела к CD19, предлагаемые в изобретении, содержат один, два, три, четыре, пять или все шесть CDR HB12A (клон B410F12-2-A6-C2, депонированный в Американской коллекции типовых культур («АТСС») 11 февраля 2005 г., регистрационный номер АТСС РТА-6580) или НВ12В (клон В43Н12-3-В2-В6, депонированный в Американской коллекции типовых культур («АТСС») 11 февраля 2005 г., регистрационный номер АТСС РТА-6581).
Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи HB12A, определенные по номенклатуре Кэбота, представлены в SEQ ID NO:6, SEQ ID NO:8 и SEQ ID NO:10 соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи HB12A определенные по номенклатуре Кэбота, представлены в SEQ ID NO:12, SEQ ID NO:14 и SEQ ID NO:16, соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи НВ12В, определенные по номенклатуре Кэбота, представлены SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:26 соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи ИВ 12 В, определенные по номенклатуре Кэбота, представлены в SEQ ID NO:28, SEQ ID NO:30 и SEQ ID NO:32 соответственно. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит один, два, три, четыре, пять или шесть CDR, которые имеют аминокислотную последовательность CDR, представленную в таблице 1.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько каркасных участков НВ12А или НВ12В. В одном из вариантов осуществления изобретения антитело, предлагаемое в изобретении, может содержать также каркасные участки (FW) тяжелой и/или легкой цепи из человеческого антитела (например, из последовательности антитела человеческой зародышевой линии, такой как VH3-72, JH4, Vk A10 или Jk4), где человеческие каркасные участки могут содержать одну или несколько мутаций, при которых человеческий остаток FW заменяют на соответствующий остаток, присутствующий в тяжелой или легкой цепи родительского мышиного антитела (например, НВ12А или НВ12В).
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VH-области тяжелой цепи, обозначенной как HB12B-(3-72/JH4) (SEQ ID NO:34). В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит один или несколько CDR, которые имеют аминокислотную последовательность CDR, представленную в таблице 1, и содержит также один или несколько каркасных участков (FW) VH-области тяжелой цепи, обозначенной как HB12B-(3-72/JH4) (SEQ ID NO:34). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4) (SEQ ID NO:52). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4) (SEQ ID NO:52). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, выше, и может содержать также один или несколько каркасных участков VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4), и один или несколько каркасных участков VH-области тяжелой цепи, обозначенной HB12B-(3-72/JH4). В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, выше, и может содержать также один или несколько каркасных участков VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4), и один или несколько каркасных участков VH-области тяжелой цепи, обозначенной как НВ12В-(3-72/JH4).
Например, в одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:36, FW2 содержит аминокислотную последовательность SEQ ID NO:38, FW3 содержит аминокислотную последовательность SEQ ID NO:40 и FW4 содержит аминокислотную последовательность SEQ ID NO:42. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, содержит вариабельную область тяжелой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:36, FW2 содержит аминокислотную последовательность SEQ ID NO:38, FW3 содержит аминокислотную последовательность SEQ ID NO:40 и FW4 содержит аминокислотную последовательность SEQ ID NO:42.
Кроме того, гуманизированное моноклональное антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 сдержит аминокислотную последовательность SEQ ID NO:54; где FW2 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:56, SEQ ID NO:64 и SEQ ID NO:72; где FW3 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:58 и SEQ ID NO:66; и где FW4 содержит аминокислотную последовательность SEQ ID NO:60. В одном из вариантов осуществления изобретения гуманизированное моноклональное антитело к CD19, предлагаемое в изобретении, содержит вариабельную область легкой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:54; где FW2 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:56, SEQ ID NO:64 и SEQ ID NO:72; где FW3 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:58 и SEQ ID NO:66; и где FW4 содержит аминокислотную последовательность SEQ ID NO:60.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать VH, включающую аминокислотную последовательность SEQ ID NO:237, или VL, включающую аминокислотную последовательность SEQ ID NO:238, где антитело связывается с человеческим антигеном CD19. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH, включающую аминокислотную последовательность SEQ ID NO:237, и VL, включающую аминокислотную последовательность SEQ ID NO:238.
В конкретных вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, выбранную из группы, включающей НВ12В VK (SEQ ID NO:20), НВ12В-(A10-Jk4) (SEQ ID NO:52), HB12B-364987 (SEQ ID NO:62), HB12B-3649 (SEQ ID NO:68), HB12B-36 (SEQ ID NO:70), HB12A VK (SEQ ID NO:4), 7E12 VK (SEQ ID NO:110), 14H5 VK(SEQID NO:111), 15D1 VK (SEQ ID NO:112), 16C9 VK(SEQ ID NO:113), 3C3 VK (SEQ ID NO:193), 3E5 VK (SEQ ID NO:194), 3D4 VK (SEQ ID NO:195), 3F1 VK (SEQ ID NO:196), 5B5 VK (SEQ ID NO:197), 6F7 VK (SEQ ID NO:198), 1C11 VK (SEQ ID NO:199), 2B11 VK (SEQ ID NO:200), 2D10 VK (SEQ ID NO:201), 5C11 VK (SEQ ID NO:202), 5D4 VK (SEQ ID NO:203), 6C11 VK (SEQ ID NO:204), 9G7 VK (SEQ ID NO:205), 1H4 VK (SEQ ID NO:206) и 5С4 VK (SEQ ID NO:207).
Конкретными вариантами осуществления настоящего изобретения является также антитело к CD19, которое содержит вариабельную область тяжелой цепи, выбранную из группы, включающей НВ12В VH (SEQ ID NO:18), НВ12В-(3-72/JH4) (SEQ ID NO:34), HB12A VH (SEQ ID NO:2), 7E12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 VH (SEQ ID NO:191),, 3C3 VH (SEQ ID NO:191), 6C11 VH (SEQ ID NO:191), 9G7 (SEQ ID NO:191), 3B4 VH (SEQ ID NO:236), и 3F11 VH (SEQ ID NO:192).
В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит вариабельную область легкой цепи НВ12В-3649 (SEQ ID NO:68) и вариабельную область тяжелой цепи НВ12В-(3-72/JH4) (SEQ ID NO:34). Клон ДНК гуманизированного антитела к HCD19, которое содержит VH HB12B-(3-72/JH4), депонирован в Американской коллекции типовых культур («АТСС») 26 октября 2006 г. Клон ДНК гуманизированного антитела к hCD19, которое содержит VK НВ12В-3649, депонирован в Американской коллекции типовых культур («АТСС») 26 октября 2006 г
В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может связываться с человеческим CD19 с аффинностью, сопоставимой с аффинностью мышиных моноклональных антител НВ12А и/или НВ12В, или с аффинностью, сопоставимой с аффинностью антитела chHB12B, которое содержит НВ12В VH (SEQ ID NO:18) и НВ12В VK (SEQ ID NO:20).
Изобретение относится также к полинуклеотидам, содержащим нуклеотидную последовательность, которая кодирует человеческое, гуманизированное или химерное антитело к CD19, предлагаемое в изобретении, или его фрагменты. Изобретение относится также к полинуклеотидам, которые гибридизуются в строгих или расслабленных условиях гибридизации, которые указаны в настоящем описании, с полинуклеотидами, которые кодируют человеческое, гуманизированное или химерное антитело, специфически связывающееся с человеческим CD19.
Другим вариантом осуществления изобретения является вектор, содержащий одну или несколько нуклеотидных последовательностей, которые кодируют представленное в описании человеческое, гуманизированное или химерное антитело к CD19, или его фрагменты.
Настоящее изобретение относится также в выделенной клетке, которая содержит вектор, где вектор несет одну или несколько нуклеотидных последовательностей, которые кодируют человеческое, гуманизированное или химерное антитело к CD19, предлагаемое в изобретении, или его фрагменты.
Химерные, человеческие и гуманизированные моноклональные антитела к CD19, представленные в описании, включают антитела человеческого изотипа IgG1, IgG2, IgG3 или IgG4.
В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, представленное в описании, опосредует антителообусловленную клеточно-зависимую цитотоксичность (ADCC), комплементзависимую клеточно-обусловленную цитотоксичность (CDC) и/или апоптоз.
Еще в одном варианте осуществления изобретения гуманизированное антитело к CD19, представленное в описании, ингибирует стимулируемую анти-IgM/CpG В-клеточную пролиферацию.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим химерное, человеческое и гуманизированное антитело к CD19.
Еще одним объектом настоящего изобретения является способ лечения В-клеточного злокачественного состояния у человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
Еще одним объектом настоящего изобретения является способ лечения аутоиммунного заболевания или нарушения у человека, заключающийся в том, что человеку, который нуждается в этом, вводят в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
Настоящее изобретение относится также к способу лечения или предупреждения гуморального отторжения у несущего человеческий трансплантат пациента, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
3.1. Определения
В контексте настоящего описания понятия «антитело» и «антитела» (иммуноглобулины) относится к моноклональным антителам (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, человеческие антитела, гуманизированные антитела, несущие участки верблюжьих антител (камелизированные (camelised)) антитела, химерные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, имеющие один домен антитела, доменные антитела, Fab-фрагменты, F(ab')2-фрагменты, фрагменты антител, которые обладают требуемой биологической активностью, связанные дисульфидными мостиками Fv-фрагменты (sdFv) и антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам, предлагаемым в изобретении), внутренние тельца и эпитопсвязывающие фрагменты любого из указанных выше антител. В частности, к антителам относятся молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, т.е. молекул, которые содержат антигенсвязывающий центр. Молекулы иммуноглобулинов могут относится к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
Нативные антитела, как правило, представляют собой гетеротетрамерные гликопротеины массой примерно 150000 Да, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь сцеплена с тяжелой цепью с помощью одной ковалентной дисульфидной связи, однако количество дисульфидных мостиков варьируется между тяжелыми цепями иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь имеет также правильно расположенные внутри цепи дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельную область (VH), за которой следует определенное количество константных областей. Каждая легкая цепь имеет вариабельную область на одном конце (VL) и константную область на другом ее конце; константная область легкой цепи соответствует первой константной области тяжелой цепи, а вариабельная область легкой цепи соответствует вариабельной области тяжелой цепи. Легкие цепи классифицируются как лямбда-цепи или каппа-цепи на основе аминокислотной последовательности константой области легкой цепи. Вариабельную область легкой каппа-цепи можно обозначать также VK. Понятие «вариабельная область» в контексте настоящего описания можно применять также для описания вариабельной области тяжелой цепи или легкой цепи. Конкретные аминокислотные остатки, вероятно, образуют поверхность раздела между вариабельными областями легкой и тяжелой цепи. Такие антитела можно получать из организма любого млекопитающего, включая, но, не ограничиваясь только ими, человека, обезьян, свиней, лошадей, кроликов, собак, кошек, мышей и т.д.
Понятие «вариабельный» отражает тот факт, что определенные участки вариабельных областей значительно отличаются по их последовательности между антителами, и они ответственны за специфичность связывания каждого конкретного антитела с его конкретным антигеном. Однако вариабельность неравномерно распределена в вариабельных областях антител. Она концентрируется в сегментах, которые называют определяющими комплементарность участками (гипервариабельными участками) (CDR), присутствующими в вариабельных областях и легкой цепи, и тяжелой цепи. Более высококонсервативные участки вариабельных областей называют каркасными участкам (FW). Вариабельные области нативных тяжелых и легких цепей все содержат четыре FW-участка, которые главным образом определяют β-складчатую конфигурацию, соединенные тремя CDR, которые образуют петли, соединяющие и в некоторых случаях образующие часть β-складчатой структуры. CDR в каждой цепи поддерживаются в тесной близости связи друг с другом с помощью FW-участков и вместе с CDR другой цепи участвуют в образовании антигенсвязывающего центра антител (см. Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Константные области, как правило, не принимают непосредственного участия в связывании антигенов, но могут влиять на аффинность связывания антигенов и могут обладать различными эффекторными функциями, такими как участие антитела в ADCC, CDC и/или апоптозе.
Понятие «гипервариабельный участок» в контексте настоящего описания относится к аминокислотным остаткам антитела, которые ассоциированы со связыванием с антигеном. Гипервариабельные участки включают аминокислотные остатки из «определяющих комплементарность участков» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельной области легкой цепи и остатки 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) вариабельной области тяжелой цепи; Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (LI), 50-52 (L2) и 91-96 (L3) вариабельной области легкой цепи и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) вариабельной области тяжелой цепи; Chothia и Lesk, J. Mol. Biol., 196, 1987, cc.901-917). Остатки «каркасного участка» или «FW» представляют собой остатки вариабельной области, фланкирующие CDR. Остатки FW присутствуют в химерных, гуманизированных, человеческих, доменных антителах, двойных антителах, антителах фирмы Vaccibody (vaccibody-антитела), линейных антителах и биспецифических антителах.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны за исключением возможных встречающихся в естественных условиях мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными против одной области детерминанты. Кроме того, в отличие от традиционных (поликлональных) препаратов антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте на антигене. Помимо их специфичности, преимуществом моноклональных антител является то, что их можно синтезировать с помощью клеток гибридомы, незагрязненных другими продуцирующими иммуноглобулин клетками. Специалистам в данной области известны другие методы получения, например, моноклональное антитело можно получать с помощью клеток, стабильно или кратковременно трансфектированных генами тяжелых и легких цепей, кодирующими моноклональное антитело.
Прилагательное «моноклональное» указывает на тот факт, что антитело должно быть получено из практически гомогенной популяции антител, при этом не требуется, чтобы оно было создано помощью какого-либо конкретного метода. Понятие «моноклональное» в контексте настоящего описания относится к антителу, которое выведено из клональной популяции клеток, включая любой эукаритический, прокариотический или фаговый клон, но не к методу, с помощью которого антитело сконструировано. Например, моноклональные антитела, применяемые согласно настоящему изобретению, можно создавать с помощью метода гибридом, описанного у Kohler и др., Nature, 256, 1975, с.495, или его можно получать с помощью любого метода рекомбинантной ДНК (см., например, US 4816567), включая выделение из фаговых библиотек антител с помощью методов, которые описаны, например, у Clackson и др., Nature, 352, 1991, cc.624-628 и Marks и др., J. Mol. Biol., 222, 1991, cc.581-597 (1991). Эти методы можно применять для получения моноклональных антител млекопитающих, химерных, гуманизированных, человеческих, доменных антител, двойных антител, антител типа vaccibodies, линейных антител и биспецифических антител.
Понятие «химерные» антитела включает антитела, в которых по меньшей мере одна часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученным из конкретных видов, или принадлежащих к конкретному классу или подклассу антител, и по меньшей мере одна другая часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, полученным из других видов, или принадлежащих другому классу или подклассу антител, включая фрагменты таких антител, в случае, если они обладают требуемой биологической активностью (US 4816567; и Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc.6851-6855). Представляющие интерес химерные антитела в контексте настоящего описания включают «приматизированные» антитела, которые содержат последовательности антигенсвязывающего центра вариабельной области, выведенные из примата кроме человека (например обезьян Старого Света, таких как павиан, макак резус или макак крабоед), и последовательности человеческих константах областей (US 5693780).
«Гуманизированные» формы антител животных, кроме человека (например, мыши), представляют собой химерные антитела, которые включают минимальную последовательность, полученную из иммуноглобулина животного, кроме человека. Основная часть гуманизированных антител представлена человеческими иммуноглобулинами (антитело-реципиент), в которых остатки нативной CDR заменены остатками из соответствующей CDR других видов, кроме человека (антитело-донор), таких как мышь, крыса, кролик или приматы, кроме человека, обладающими требуемой специфичностью, аффинностью и потенциалом. В некоторых случаях остатки FW-участка человеческого иммуноглобулина заменяют соответствующими остатками из других видов, кроме человека. Кроме того, гуманизированные антитела могут включать остатки, которые не присутствуют в антителе-реципиенте или в антителе-доноре. Эти модификации осуществляют с целью дополнительного усовершенствования характеристик антитела. В целом, гуманизированное антитело должно включать практически полностью по меньшей мере одну или несколько вариабельных областей, в которых все или практически все CDR соответствуют CDR указанных иммуноглобулинов других животных, кроме человека, а все или практически все FW соответствуют последовательности иммуноглобулина человека. В определенных вариантах осуществления изобретения гуманизированное антитело необязательно может включать также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Дополнительные более подробные данные см. у Jones и др., Nature, 321, 1986, cc.522-525; Reichmann и др., Nature, 332, 1988, cc.323-329 и у Presta, Curr. Op.Struct. Biol., 2, 1992, cc.593-596.
«Человеческое антитело» может представлять собой антитело, полученное из организма человека, или антитело, полученное из трансгенного организма, который был «сконструирован» для производства специфических человеческих антител в ответ на контрольное заражение антигеном и который можно создавать с помощью любого метода, известного в данной области. При применении определенных методик элементы локусов человеческих тяжелых и легких цепей интродуцируют в линии организмов, выведенных из линий эмбриональных стволовых клеток, которые содержат целенаправленные нарушения эндогенных локусов тяжелой цепи и легкой цепи. Трансгенный организм может синтезировать человеческие антитела, специфические в отношении человеческих антигенов, и организм можно применять для получения секретирующих человеческие антитела гибридом. Человеческое антитело может представлять собой также антитело, в котором тяжелые и легкие цепи кодируются нуклеотидной последовательностью, выведенной из одного или нескольких источников человеческой ДНК. Полностью человеческое антитело можно конструировать также с помощью методов генетической или хромосомной трансфекции, а также с помощью метода фаговой презентации или in vitro с помощью активированных В-клеток, которые все известны в данной области.
Понятие «антителообусловленная клеточно-зависимая цитотоксичность» или «ADCC» относится к опосредуемой клетками реакции, при которой неспецифические цитотоксические клетки (например, естественные клетки-киллеры (NK-клетки), нейтрофилы, макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. В одном из вариантов такие клетки представляют собой человеческие клетки. Не ограничиваясь каким-либо конкретным механизмом действия, эти цитотоксические клетки, которые опосредуют ADCC, как правило, экспрессируют Fc-рецепторы (FcR). Основные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR гематопоэтическими клетками обобщены у Ravetch и Kinet, Annu. Rev. Immunol 9, 1991, cc.457-492. Для оценки ADCC-активности представляющей интерес молекулы можно осуществлять анализ ADCC in vitro, например, описанный в US 5500362 или 5821337. Эффекторные клетки, которые можно применять для таких анализов, включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK-клетки). В другом или дополнительном варианте для оценки ADCC-активности представляющей интерес молекулы можно применять анализ in vivo, например, с использованием в качестве моделей животных, согласно методу, описанному у Clynes и др., PNAS (USA), 95, 1998, cc.652-656.
Понятие «комплементзависимая цитотоксичность» или «CDC» обозначает способность молекулы инициировать активацию комплемента и вызывать лизис клетки-мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с соответствующим ей антигеном. Для оценки активации комплемента можно применять метод анализа CDC, например, описанный у Gazzano-Santoro и др., J. Immunol. Methods, 202, 1996, с.163.
«Эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и обладают эффекторными функциями. Предпочтительно клетки экспрессируют по меньшей мере FcγRI, FCγRII, FcγRIII и/или FcγRIV и обладают ADCC-эффекторным функциями. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK-клетки), моноциты, цитотоксические Т-клетки и нейтрофилы.
Понятия «Fc-рецептор» или «FcR» относятся к рецептору, который связывается с Fc-фрагментом антитела. В одном из вариантов осуществления изобретения FcR имеет нативную последовательность человеческого FcR. Кроме того, в некоторых вариантах осуществления изобретения