Полученная из микроорганизма протеаза усовершенствованного типа, обеспечивающая свертывание молока
Иллюстрации
Показать всеИзобретение относится к области биохимии и биотехнологии. Представлена протеаза, обладающая усовершенствованной молокосвертывающей активностью, содержащая аминокислотную последовательность, по меньшей мере, на 80% идентичую SEQ ID NO: 3, где указанная протеаза имеет, по меньшей мере, одну мутацию, выбранную из группы, состоящей из: (а) замены глутамина, соответствующего глутамину в положении 265 в SEQ ID NO:3, на кислую аминокислоту; и (b) замены глутамина, соответствующего глутамину в положении 266 в SEQ ID NO:3, на кислую аминокислоту. Описаны ДНК, кодирующая указанную протеазу; экспрессионный вектор, содержащий указанную ДНК; и клетка, трансформированная указанным вектором, предназначенная для экспрессии указанной протеазы. Предложен способ получения протеазы, обладающей усовершенствованной молокосвертывающей активностью, включающий культивирование указанной трансформированной клетки в культуральной среде и выделение протеазы из культуральной среды. Изобретение позволяет получить протеазу с улучшенной молокосвертывающей активностью. 5 н. и 11 з.п. ф-лы, 2 ил., 4 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к полученной из микроорганизма протеазе с усовершенствованной активностью в отношении свертывания молока. Протеазу предпочтительно применяют для производства сыра.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В течение длительного времени сычужный фермент из желудка телят применяют в качестве молокосвертывающего фермента для производства сыра. Молокосвертывающая активность сычужного фермента из желудка телят, в основном, связана с химозином, который представляет собой кислую протеазу и обладает сайт-специфической протеолитической активностью в отношении казеина молока с низкой сайт-неспецифической активностью (специфически расщепляет пептидную связь между фенилаланином в положении 105 и метионином в положении 106 в аминокислотной последовательности κ-казеина). Предполагают, что неспецифическая протеолитическая активность приводит к снижению объемов производства сыра и к получению пептида с горьким привкусом в процессе созревания. По этой причине химозин является превосходным молокосвертывающим ферментом.
Однако сокращение убоя телят и увеличение потребности в сыре создали трудности в снабжении сычужным ферментом из желудка телят. В настоящее время молокосвертывающий фермент, получаемый из микроорганизмов, таких как Rhizomucor miehei и Rhizomucor pusillus, и рекомбинантный химозин, получаемый с помощью введения гена химозина теленка в грибы или дрожжи, широко применяют в качестве молокосвертывающих ферментов.
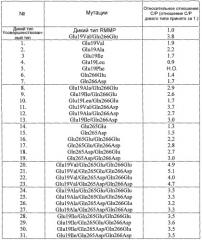
Указанный выше полученный из микроорганизма молокосвертывающий фермент, по сравнению с химозином теленка или рекомбинантным химозином, обладает более высокой неспецифической протеолитической активностью. Проблема заключается в том, что отношение C/P (отношение молокосвертывающей активности к протеолитической активности), являющееся важным свойством молокосвертывающего фермента, остается низким. Для преодоления данного препятствия в Rhizomucor pusillus осуществляли экспрессию и анализ модифицированного гена молокосвертывающего фермента, полученного с помощью сайт-специфического мутагенеза способом генетической инженерии. В данном варианте отношение C/P было улучшено по сравнению с диким типом посредством замены глутаминовой кислоты на аланин в положении 19 в аминокислотной последовательности молокосвертывающего фермента (документ 1, не являющийся патентом).
Однако в связи с тем, что активность модифицированного молокосвертывающего фермента из-за замены аминокислоты уменьшалась приблизительно на 40 процентов, практическое применение данного фермента оказалось затруднительным. Таким образом, желательным является получение из микроорганизма молокосвертывающего фермента, в котором отношение C/P остается высоким, с сохранением или повышением молокосвертывающей активности.
Кроме того, с помощью дикарбоксильного ангидрида была предпринята попытка ацилирования молокосвертывающего фермента, полученного из микроорганизмов, таких так Rhizomucor pusillus и Rhizomucor miehei, для увеличения отношения C/P (патентный документ 1). С помощью данного способа было получено некоторое увеличение; однако это все еще не является удовлетворительным.
[Патентный документ 1] Патент No. 2-18834B, Япония.
[Документ 1, не являющийся патентом] J. Biochem. 129, 791-794, 2001.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение протеазы, пригодной для свертывания молока, активность (далее в настоящем документе также обозначаемая как "неспецифическая активность протеазы") которой, в отношении расщепления пептидной связи, отличной от связи между фенилаланином в положении 105 и метионином в положении 106 в аминокислотной последовательности κ-казеина, остается низкой, а молокосвертывающая активность сохранена или увеличена.
Авторы настоящего изобретения тщательно изучили способы преодоления описанной выше проблемы и среди мутантных штаммов микроорганизмов, продуцирующих молокосвертывающий фермент, выделили продуцирующий молокосвертывающий фермент мутантный штамм с увеличенным отношением C/P, что связано с уменьшением неспецифической активности протеазы; выделили ген молокосвертывающего фермента усовершенствованного типа; определили его нуклеотидную последовательность; осуществили экспрессию гена и измерили молокосвертывающую активность и отношение C/P молокосвертывающего фермента усовершенствованного типа, завершив, таким образом, настоящее изобретение.
Таким образом, настоящее изобретение относится к полученной из микроорганизма протеазе, обладающей молокосвертывающей активностью, с сохраненной или увеличенной молокосвертывающей активностью и увеличенным отношением C/P, а также обеспечивает ДНК, кодирующую данную протеазу, вектор, содержащий ДНК, и трансформированные клетки, в которые вводят вектор.
Одним из аспектов настоящего изобретения является получение протеазы усовершенствованного типа, которая содержит аминокислотную последовательность, которая, по меньшей мере, на 75% идентична SEQ ID NO:3, где указанная протеаза усовершенствованного типа обладает, по меньшей мере, одной мутацией, выбранной из группы, состоящей из:
(A) замены глутамина, соответствующего глутамину в положении 265 в SEQ ID NO:3, на кислую аминокислоту и
(B) замены глутамина в положении 266 в SEQ ID NO:3 на кислую аминокислоту, где указанная протеаза усовершенствованного типа обладает молокосвертывающей активностью.
Другим аспектом настоящего изобретения является получение протеазы усовершенствованного типа, как описано выше, которая выбрана из группы, состоящей из:
(A) белка, содержащего аминокислотную последовательность SEQ ID NO:3 или 43, за исключением того, что глутамин в положении 265 и/или глутамин в положении 266 заменен кислой аминокислотой;
(B) белка, содержащего аминокислотную последовательность SEQ ID NO:3 или 43, за исключением того, что глутамин в положении 265 и/или глутамин в положении 266 заменен(ы) кислой аминокислотой, и не более чем 10 аминокислот (предпочтительно не более чем 5 аминокислот, более предпочтительно не более чем 3 аминокислоты, еще более предпочтительно не более чем 2 аминокислоты) в положениях, отличных от 265 и 266, заменены, делетированы, вставлены или добавлены, и, где указанная протеаза усовершенствованного типа обладает молокосвертывающей активностью.
Другим аспектом настоящего изобретения является получение протеазы усовершенствованного типа, как описано выше, в которой указанная кислая аминокислота является глутаминовой кислотой или аспарагиновой кислотой.
Другим аспектом настоящего изобретения является получение протеазы усовершенствованного типа, как описано выше, в которой глутаминовая кислота в положении 19 заменена валином, аланином, изолейцином или лейцином.
Другим аспектом настоящего изобретения является получение протеазы усовершенствованного типа, как описано выше, в которой треонин в положении 81 заменен глутамином или аспарагиновой кислотой.
Еще одним аспектом настоящего изобретения является получение ДНК, кодирующей протеазу усовершенствованного типа, как описано выше.
Еще одним аспектом настоящего изобретения является получение экспрессионного вектора, содержащего ДНК, как описано выше.
Еще одним аспектом настоящего изобретения является получение трансформированной клетки, в которую вводят описанный выше экспрессионный вектор.
Еще одним аспектом настоящего изобретения является получение трансформированной клетки, как описано выше, где указанная трансформированная клетка представляет собой Saccharomyces cerevisiae.
Еще одним аспектом настоящего изобретения является обеспечение способа получения протеазы усовершенствованного типа, обладающей молокосвертывающей активностью, который включает стадии культивирования указанной выше трансформированной клетки в культуральной среде и сбора протеазы усовершенствованного типа в культуральной среде.
Поскольку молокосвертывающая активность сохранена или улучшена, а отношение C/P остается высоким, ожидают более высокий объем производства сыра при применении протеазы усовершенствованного типа по настоящему изобретению. Кроме того, повышенное отношение C/P, как правило, предполагает уменьшение горького привкуса сыра во время созревания, таким образом, с помощью данного усовершенствованного фермента можно производить сыры более высокого качества.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 показана структура экспрессионного вектора JS4.
На фиг.2 показано выравнивание последовательностей протеазы, полученной из Rhizomucor pusillus (RMPP), и протеазы, полученной из Rhizomucor miehei (RMMP).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение подробно поясняется ниже.
1. Протеаза усовершенствованного типа (молокосвертывающий фермент) по настоящему изобретению
Протеаза усовершенствованного типа по настоящему изобретению содержит аминокислотную последовательность, которая, по меньшей мере, на 75% идентична SEQ ID NO:3 и имеет, по меньшей мере, одну мутацию, выбранную из группы, состоящей из:
(A) замены глутамина, соответствующего глутамину в положении 265 в SEQ ID NO:3, на кислую аминокислоту и
(B) замены глутамина в положении 266 в SEQ ID NO:3 на кислую аминокислоту, обладающую молокосвертывающей активностью.
Примеры указанных выше кислых аминокислот включают глутаминовую кислоту и аспарагиновую кислоту.
Протеаза усовершенствованного типа по настоящему изобретению предпочтительно имеет гомологию не менее чем 90%, более предпочтительно не менее чем 95%, с полной аминокислотной последовательностью SEQ ID NO:3.
В одном из вариантов осуществления изобретения протеазу усовершенствованного типа по настоящему изобретению можно получать при помощи введения мутации(й) в протеазу дикого типа, полученную из Rhizomucor miehei (SEQ ID NO:3). В данном варианте осуществления изобретения протеаза усовершенствованного типа по настоящему изобретению выбрана из группы, состоящей из:
(A) белка, содержащего аминокислотную последовательность SEQ ID NO:3, за исключением того, что глутамин в положении 265 и/или глутамин в положении 266 заменен(ы) на кислую аминокислоту;
(B) белка, содержащего аминокислотную последовательность SEQ ID NO:3, за исключением того, что глутамин в положении 265 и/или глутамин в положении 266 заменен(ы) на кислую аминокислоту, и не более 10 аминокислот в положениях, отличных от положений 265 и 266, заменены, делетированы, вставлены или добавлены, с молокосвертывающей активностью.
На фиг.2 показано выравнивание последовательности протеазы, полученной из Rhizomucor pusillus, и протеазы, полученной из Rhizomucor miehei. В обеих последовательностях аминокислоты в положениях 265 и 266 совпадают, поэтому протеазу усовершенствованного типа по настоящему изобретению также можно получать с помощью введения мутаций в протеазу дикого типа из Rhizomucor pusillus (SEQ ID NO:43). Таким образом, в другом варианте осуществления изобретения протеазой усовершенствованного типа по настоящему изобретению может быть белок, содержащий аминокислотную последовательность SEQ ID NO:43, за исключением того, что глутамин в положении 265 и/или глутамин в положении 266 заменен(ы) на кислую аминокислоту. Кроме того, данная протеаза усовершенствованного типа может содержать другую мутацию (замену, делецию, вставку или добавление не более чем 10 аминокислот), отличную от замены глутамина в положении 265 и/или глутамина в положении 266, в условии сохранения молокосвертывающей активности.
В протеазе усовершенствованного типа по настоящему изобретению глутаминовая кислота в положении 19 и треонин в положении 81 в аминокислотной последовательности SEQ ID NO:3 или 43 могут быть заменены на другие аминокислоты. Глутаминовую кислоту в положении 19 предпочтительно заменяют на валин, аланин, изолейцин или лейцин, в то время как треонин в положении 81 предпочтительно заменяют на глутамин или аспарагиновую кислоту.
По настоящему изобретениию "положение 265", "положение 266", "положение 19" и "положение 81" не обязательно обозначают абсолютное положение от N-конца протеазы, но обозначают относительное положение при сравнении с аминокислотной последовательностью SEQ ID NO:3 или 43. Например, в протеазе, содержащей аминокислотную последовательностью SEQ ID NO:3 или 43, в случае делеции одной аминокислоты в положении ближе к N-концевой области от положения 265 указанное выше положение 265 становится положением 264. Даже в этом случае аминокислота в положении 264, отсчитанная от N-концевого остатка, является аминокислотой в "положении 265" по настоящему изобретению. Абсолютное положение аминокислоты определяют с помощью выравнивания аминокислотной последовательности описываемой протеазы с аминокислотной последовательностью SEQ ID NO:3 или 43. Аминокислота, обозначаемая термином "соответствующая положению", также обозначает аминокислоту в относительном положении по сравнению с аминокислотной последовательностью SEQ ID NO:3 или 43.
SEQ ID NO:3 и SEQ ID NO:43 являются аминокислотными последовательностями зрелой формы протеазы. Протеаза усовершенствованного типа по настоящему изобретению может включать аминокислотную последовательность сигнального пептида, пропептида и так далее.
С помощью способа, описанного в примерах данного описания изобретения, протеазу усовершенствованного типа по настоящему изобретению можно получать из клетки мутантного штамма или из соответствующей культуральной среды с помощью селекции мутантного штамма, который продуцирует протеазу усовершенствованного типа с высоким отношением C/P, из микроорганизма, который продуцирует протеазу дикого типа, обладающую молокосвертывающей активностью с относительно низким отношением C/P, и культивируя мутантный штамм в культуральной среде.
Примеры микроорганизмов, которые продуцируют протеазы дикого типа со сравнительно низким отношением C/P, включают штаммы дикого типа Rhizomucor miehei (ATCC16457), Rhizomucor pusillus (ATCC16458) и штаммы, производные от указанных штаммов. Данные штаммы можно приобрести в американской коллекции типовых культур (ATCC; P.O. Box 1549 Manassas, VA 20108 USA). Протеазу усовершенствованного типа по настоящему изобретению также можно получать с помощью выделения ДНК, кодирующей протеазу усовершенствованного типа из указанного выше мутантного штамма, и экспрессии этой ДНК.
Кроме того, протеазу усовершенствованного типа по настоящему изобретению также можно получать с помощью выделения ДНК, кодирующей аминокислотную последовательность SEQ ID NO:3 или 43, из штаммов дикого типа Rhizomucor miehei (ATCC16457), Rhizomucor pusillus (ATCC16458) или из штаммов, являющихся производными от указанных штаммов, и модификации ДНК путем сайт-специфического мутагенеза таким образом, чтобы ДНК кодировала протеазу усовершенствованного типа по настоящему изобретению, с последующей экспрессией модифицированной ДНК.
Экспрессию указанной выше ДНК можно осуществлять с помощью конструирования экспрессионного вектора, содержащего указанную выше ДНК, и введения его в клетку-хозяина. Хотя клеткой-хозяином может быть как прокариотическая, так и эукариотическая клетки, предпочтительной является эукариотическая клетка. Примерами эукариотических клеток являются дрожжевая клетка, клетка гриба и клетка растений. Дрожжевая клетка является предпочтительной, и клетка Saccharomyces cerevisiae является особенно предпочтительной.
Кроме того, экспрессию указанной выше ДНК можно осуществлять в бесклеточной системе.
Отношение C/P протеазы усовершенствованного типа по настоящему изобретению выше, чем отношение C/P соответствующей протеазы дикого типа (SEQ ID NO:3 или 43). Отношение C/P протеазы усовершенствованного типа по настоящему изобретению предпочтительно не менее чем в 1,2 раза, более предпочтительно не менее чем в 1,5 раза, еще более предпочтительно не менее чем в 2,0 раза превосходит отношение C/P протеазы дикого типа (SEQ ID NO:3 или 43).
Здесь и далее в настоящем документе отношение C/P обозначает [молокосвертывающая активность (MCA)]/[протеазная активность (PA)]. Измерения PA и MCA можно осуществлять способами, указанными далее. Что касается измерения MCA, несмотря на то, что существует Международный Стандартный Способ (описанный в ISO15174, IDF176; первое издание 2002-09-01, Self-imposed Specifications for Food Additives), величину MCA в настоящем описании рассчитывали по способу, указанному далее (здесь и далее в настоящем документе обозначен как способ Meito).
[1] Измерение PA
Казеин, полученный из молока (производство Wako Pure Chemical Industries, Ltd.), растворяют в 0,05M растворе двузамещенного гидрофосфата натрия и доводят pH до 6,0 посредством добавления стандартного раствора соляной кислоты (1 моль/л), так чтобы получить 0,6% раствор казеинового субстрата. Исследуемый образец (0,2 мл), разведенный соответствующим образом, добавляют к 1 мл данного раствора субстрата. Смесь оставляют при 37°C на 10-30 минут для прохождения реакции, которую затем останавливают, добавляя 1 мл раствора, останавливающего реакцию (смешанный раствор, состоящий из 0,11 моль/л трихлоруксусной кислоты, 0,21 моль/л безводного ацетата натрия и 0,33 моль/л уксусной кислоты). Супернатант получают посредством центрифугирования и к 0,4 мл супернатанта добавляют 1 мл 0,55 моль/л безводного карбоната натрия, а затем добавляют 0,2 мл разбавленного в два раза фенольного реагента производства Wako Pure Chemical Industries, Ltd. (реагент Фолина-Чокальтеу). Смесь выдерживают в течение 30 минут при 37°C для прохождения реакции, а затем измеряют поглощение света при 660 нм (длина оптического пути 1 см). Отдельно к 1 мл раствора субстрата добавляют 1 мл раствора, останавливающего реакцию, с последующим добавлением 0,2 мл исследуемого образца. После этого получают смесь с помощью тех же способов и раствор, полученный в результате, используют в качестве контроля. Значение, полученное в результате вычитания поглощения контроля из поглощения исследуемого образца, переводят в количество свободного тирозина для расчета значения PA. Единицами измерения PA являются Ед/мл. Данная 1 Ед обозначает количество фермента, которое вызывает усиление окраски вещества фенольного реагента, эквивалентное содержанию 1 мкМоль тирозина за 1 минуту по способу, указанному выше. Кроме того, получают корреляционное соотношение между количеством тирозина и окраской вещества фенольного реагента с помощью калибровочной кривой тирозина так, как описано ниже.
Калибровочная кривая тирозина
Тирозин, являющийся стандартом (молекулярная масса 181,2, производство Wako Pure Chemical Industries, Ltd.) высушивают при 105°C в течение 3 часов. Затем 0,050 г стандарта точно взвешивают и растворяют в контрольном растворе соляной кислоты (0,2 мол/л) так, чтобы получить ровно 50 мл конечного раствора. 1, 2, 3 и 4 мл этого раствора точно измеряют и к каждому из них добавляют стандартный раствор соляной кислоты (0,2 моль/л) так, чтобы получить объем, равный 100 мл. Точно измеряют два мл каждого раствора. Затем добавляют 5 мл из 0,55 моль/л стандартного раствора карбоната натрия и 1 мл фенольного реагента, разбавленные в два раза. Сразу после этого раствор перемешивают встряхиванием и выдерживают в течение 30 минут при 37±0,5°C. Из полученного раствора отбирают ровно 2 мл полученного раствора и измеряют поглощение A1, A2, A3 и A4 при длине волны 660 нм, а также поглощение контрольного раствора, приготовленного таким же образом. Откладывая значения поглощения A1, A2, A3 и A4 по вертикальной оси и количество тирозина (в мкмоль) в 2 мл каждого раствора по горизонтальной оси, получают калибровочную кривую для определения количества тирозина (в мкмоль) при разнице в поглощении, равной 1.
[2] Способ измерения MCA (способ Meito)
Обезжиренное сухое молоко для применения в качестве субстрата, предпочтительно производства CHR.HANSEN, (10%) растворяют в 0,01M хлориде кальция (pH 6,0). Раствор исследуемого образца (0,5 мл), приготовленный в концентрации, при которой образуются творожистые фрагменты в течение 2-5 минут, предпочтительно за 2 минуты и 30 секунд, добавляют к 5 мл данного субстрата, и эту смесь выдерживают при 35°C. Образование творожистых фрагментов наблюдают при перемешивании смеси стеклянной палочкой. MCA определяют с помощью вычисления: во сколько раз больше субстрата может свернуть единичное количество исследуемого образца в единицу времени по сравнению со значением для стандарта, для которого MCA известно и вычислено таким же образом. Формула для расчета выглядит следующим образом:
MCA (Mu/мл) = S×(Ts×Ws)/(T×W),
Где S - удельная активность молокосвертывающего фермента стандарта (Mu/г);
Ts - время свертывания молока стандартного раствора (секунда);
Ws - количество стандарта в 1 мл стандартного раствора (г);
T - время свертывания молока раствора исследуемого образца (секунда);
W - количество исследуемого образца в 1 мл раствора исследуемого образца (мл).
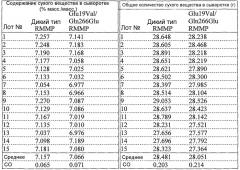
Кроме того, MCA можно рассчитывать в пересчете на единичное количество белка с помощью оценки общего количества белка, содержащегося в исследуемом образце. В примере 13, описанном далее, MCA рассчитывают на 1 мг белка (Mu/мг белка).
Значение MCA, рассчитанное по указанному выше способу, коррелирует со значением MCA, рассчитанным с помощью Международного Стандарта (описанного в ISO 15174, IDF176; первое издание 2002-09-01, Self-imposed Specifications for Food Additives). Эту корреляцию можно представить следующей формулой:
1 единица международного стандарта (IMCU/мл) ~ 1 единица Meito (Mu/мл)/100.
MCA протеазы по настоящему изобретению предпочтительно равно или больше, чем MCA протеазы дикого типа. В случае, когда протеазу по настоящему изобретению и протеазу дикого типа (SEQ ID NO:3 и 43) получают в одинаковых условиях для сравнения MCA, MCA протеазы усовершенствованного типа по настоящему изобретению предпочтительно составляет не менее чем 0,8, более предпочтительно не менее чем в 0,9, еще более предпочтительно не менее чем в 1,0 от значения MCA протеазы дикого типа.
Примеры получения протеазы усовершенствованного типа по настоящему изобретению и протеазы дикого типа в одинаковых условиях включают введение ДНК, кодирующей каждую из протеаз, в одинаковый вектор для генной экспрессии, введение каждого из этих экспрессионных векторов в клетку одинакового штамма в одинаковых условиях и культивирование клеток в одинаковых условиях культивирования для получения клеточной культуры, содержащей раствор протеазы. Полученную культуру можно концентрировать одинаковым образом или очищать одинаковым образом для применения.
2. ДНК, кодирующая протеазу усовершенствованного типа по настоящему изобретению
ДНК по настоящему изобретению является ДНК, кодирующая протеазу усовершенствованного типа по настоящему изобретению. Конкретные примеры ДНК по настоящему изобретению включают ДНК, содержащую нуклеотиды от 208 до 1290 в SEQ ID NO:1, и ДНК, содержащую последовательность, которая гибридизуется с нуклеотидной последовательностью, комплементарной нуклеотидам от 208 до 1290 в SEQ ID NO:1 в строгих условиях; и кодирующую протеазу усовершенствованного типа с описанными выше свойствами. Конкретные примеры ДНК по настоящему изобретению также включают ДНК, содержащую нуклеотидную последовательность SEQ ID NO:42, и ДНК, содержащую последовательность, которая гибридизуется с нуклеотидной последовательностью комплементарной нуклеотидной последовательности SEQ ID NO:42, в строгих условиях; и кодирующую протеазу усовершенствованного типа с описанными выше свойствами. Строгие условия обозначают условия, в которых образуются так называемые специфичные гибриды, в то время как неспецифичные гибриды не образуются. Несмотря на то, что условия варьируются в зависимости от последовательности нуклеотидов или ее длины, примеры условий включают условия, в которых ДНК с высокой гомологией, например, ДНК с гомологией не менее 75%, предпочтительно не менее чем 90%, более предпочтительно не менее чем 95%, взаимно гибридизуются, в то время как ДНК с более низкой гомологией не гибридизуется, или условия гибридизации, являющиеся обычными для отмывки при гибридизации по Саузерну, при 60°C в 1×SSC, 0,1% SDS, предпочтительно 0,1×SSC и при концентрации соли, эквивалентной 0,1% SDS.
ДНК, кодирующую протеазу по настоящему изобретению, можно выделять из мутантного штамма, содержащего указанную выше протеазу усовершенствованного типа, с помощью стандартного способа клонирования генов. Например, ее можно выделить с помощью отбора ДНК из геномной библиотеки указанного выше мутантного штамма с помощью гибридизации с синтетическим олигонуклеотидным зондом на основе нуклеотидной последовательности SEQ ID NO:1 или 42.
Кроме того, ДНК, кодирующую протеазу усовершенствованного типа по настоящему изобретению, можно получать с помощью конструирования праймеров на основе нуклеотидной последовательности известной геномной ДНК или кДНК гена протеазы дикого типа и амплификации ДНК из геномной ДНК библиотеки и библиотеки кДНК указанного выше мутантного штамма с помощью данных праймеров.
ДНК, полученная с помощью введения сайт-направленной мутации в ДНК дикого типа, также включена в ДНК, кодирующую протеазу по настоящему изобретению.
Например, ДНК, кодирующую протеазу усовершенствованного типа по настоящему изобретению, можно легко получать с помощью выделения ДНК, кодирующей аминокислотную последовательность SEQ ID NO:3 из штамма Rhizomucor miehei дикого типа (ATCC16457), или производного от этого штамма и введения в него сайт-направленной мутации. ДНК, кодирующую протеазу усовершенствованного типа по настоящему изобретению, также можно получать с помощью выделения ДНК, кодирующей аминокислотную последовательность SEQ ID NO:43 из штамма Rhizomucor pusillus дикого типа (ATCC16458) или производного от него штамма и введения в него сайт-направленной мутации.
Введение сайт-направленной мутации можно осуществлять способами, известными специалистам в данной области. Например, мутации можно вводить с помощью синтеза праймеров, содержащих сайт расщепления для фермента рестрикции с одной стороны и содержащих сайт мутации с другой стороны, и в результате замещения соответствующей части гена без мутации фрагментом гена с мутацией (способ кассетной мутации).
В качестве способов введения сайт-направленной мутации, например, известные способы включают способ Gapped duplex ("рваный" дуплекс) и способ kunkel. Способ kunkel основан на принципе, при котором ген без мутации клонируют в одноцепочечный фаг; комплементарную цепь синтезируют с использованием в качестве праймера синтетической ДНК, содержащей ошибку спаривания оснований в точке мутации, затем получают новый фаг и реплицированную ДНК, используя в качестве матрицы полученную комплементарную цепь, содержащую мутацию. Сайт-специфический мутагенез можно осуществлять с применением коммерчески доступного набора.
3. Экспрессионный вектор по настоящему изобретению
Для экспрессии протеазы усовершенствованного типа по настоящему изобретению используют экспрессионный вектор по настоящему изобретению. Он может иметь структуру, в которой последовательность промотора, регулирующего экспрессию ДНК, в области 5'-конца примыкает к ДНК, кодирующей протеазу усовершенствованного типа по настоящему изобретению. Кроме того, в области 3'-конца к ДНК может примыкать терминатор.
В случае, когда клеткой-хозяином является E. coli, в качестве указанных выше промоторов можно использовать trp, lac, taq, λPL или подобные им. В случае если клеткой-хозяином являются дрожжи, предпочтительными промоторами являются GAL7, ADH, TPI или PHO5 или подобные им, и среди них GAL7 является предпочтительным, поскольку резко повышает генную экспрессию (Nogi Y. et al. Nucl. Acids Res. 11, 8555-8568 (1983)).
Примеры терминаторов включают TPI, GAPDH и GAL10. Таким образом, экспрессионный вектор по настоящему изобретению можно конструировать с помощью присоединения указанного выше промотора, ДНК, кодирующей протеазу усовершенствованного типа по настоящему изобретению, и указанного выше терминатора по порядку от области, лежащей выше 5'-области по направлению к области, лежащей ниже 3'-области, и вставки полученной конструкции в вектор.
В качестве вектора, способного реплицироваться в дрожжах, можно использовать любой тип плазмиды из так называемых YIp, YRp, YEp и YCp плазмид. С точки зрения числа копий и стабильности предпочтительным является тип YEp. Поскольку эти плазмиды, как правило, содержат ненужные последовательности, предпочтительным является делеция ненужных последовательностей, исходя из соображений стабильности плазмиды или с целью облегчения модификации плазмиды.
В экспрессионный вектор по настоящему изобретению также можно вставлять ген маркера селекции для селекции рекомбинантного или репортерного гена для проверки экспрессии введенного гена. Примеры гена маркера селекции включают гены устойчивости к гигромицину, гены устойчивости к канамицину и гены устойчивости к ампициллину. Примеры репортерного гена включают гены бета-глюкуронидазы (GUS), гены хлорамфеникол ацетилтрансфераза (CAT), гены люциферазы (LUC) и гены GFP. Кроме того, в экспрессионный вектор по настоящему изобретению можно вставлять дополнительную последовательность с целью экспрессии протеазы усовершенствованного типа по настоящему изобретению по секреторному типу или для облегчения очистки экспрессированной протеазы. В этом случае протеаза по настоящему изобретению экспрессируется в виде слитого белка с белком или пептидом, кодируемым дополнительной последовательностью. Примеры дополнительных последовательностей включают нуклеотидную последовательность, кодирующую сигнальный пептид или пропептид, и нуклеотидную последовательность, кодирующую His-tag или GST-tag.
4. Трансформированная клетка по настоящему изобретению
Трансформированной клеткой по настоящему изобретению является клетка, в которую введен экспрессионный вектор по настоящему изобретению, причем эта клетка способна продуцировать протеазу усовершенствованного типа по настоящему изобретению. Несмотря на то, что клетка может быть как прокариотической клеткой, так и эукариотической клеткой, предпочтительной является эукариотическая клетка.
Примеры эукариотических клеток включают дрожжевую клетку, клетку грибов и растительную клетку. Дрожжевая клетка является предпочтительной, и Saccharomyces cerevisiae является особенно предпочтительной.
Примеры Saccharomyces cerevisiae включают штаммы SHY3, D13-1A и MC16.
Способ введения экспрессионного вектора в клетку-хозяина может быть выбран соответствующим образом в зависимости от типа клетки-хозяина. Данные способы являются способами, известными специалистам в данной области. Трансформированную клетку Saccharomyces cerevisiae, например, можно получить следующим способом.
Культуру Saccharomyces cerevisiae, культивируемую в среде для культивирования YPD (1% дрожжевого экстракта (производство Difco), 2% Бактопептона (произведство Difco) и 2% глюкозы) в течение ночи, засевают в соотношении 10% по объему на среду для культивирования YPD и культивируют 4 часа при 30°C. Полученную культуру (1,5 мл) слабо центрифугируют на настольной центрифуге для осаждения клеток. Клетки промывают 0,2M LiSCN (производство Kanto Chemical Co., Inc.) и растворяют в 0,02 мл 1M LiSCN.
После этого смешивают 0,01 мл раствора, содержащего экспрессионный вектор (приблизительно от 1 до 10 мкг), и 0,03 мл 70% PEG 4000, эту смесь затем выдерживают в течение 1 часа при 30°C. Полученную смесь разбавляют посредством добавления 0,14 мл стерильной воды и затем высевают на два планшета SDah (0,67% основы азотного агара для дрожжей без аминокислот, 2% глюкозы, 0,002% аденин сульфата, 0,002% L-гистидина-HCl, 2% агара). После инкубирования при 30°C в течение 2-3 суток можно получать трансформант.
5. Способ получения протеазы усовершенствованного типа, обладающей молокосвертывающей активностью, по настоящему изобретению
Протеазу усовершенствованного типа по настоящему изобретению можно получать с помощью культивирования трансформированных клеток по настоящему изобретению, а в результате экспрессии протеазы усовершенствованного типа по настоящему изобретению в виде слитого белка с сигнальным пептидом для осуществления секретирования, протеаза усовершенствованного типа по настоящему изобретению может накапливаться в среде. В случае, когда используют индуцибельный промотор, индукция предпочтительно осуществляется в среде. Несмотря на то, что способ культивирования трансформированных клеток различается в зависимости от типа клетки, можно использовать стандартные способы.
Ниже описан пример способа культивирования трансформанта Saccharomyces cerevisiae.
Для осуществления пролиферации дрожжевых клеток трансформантов культивируют с помощью встряхивания при 30°C в течение двух суток в 50 мл среды для культивирования YPD в колбе Sakaguchi объемом 500 мл. Культуральную среду центрифугируют при 1000×g в течение 5 минут для осаждения клеток. Затем клетки снова суспендируют в 100 мл культуральной среды YPGal (1% дрожжевого экстракта, 2% бактопептона, 4% галактозы (производство Wako Pure Chemical Industries, Ltd.)), и культивируют во встряхиваемой колбе Sakaguchi объемом 500 мл при 30°C в течение трех суток.
Протеазу, обладающую молокосвертывающей активностью, которая секретируется в среду, можно использовать в том виде, в котором она существует в супернатанте среды, а также можно использовать после концентрирования супернатанта среды. Протеазу, обладающую молокосвертывающей активностью, которая секретируется в среду, можно очищать или частично очищать. Очистку или частичную очистку можно проводить с использованием общего способа очистки белка. Можно использовать, например, способ, включающий хроматографию, такую как ионно-обменная хроматография, гель-фильтрация, высаливание с помощью сульфата аммония или осаждение органическим растворителем.
Очищенный фермент также можно концентрировать лиофилизацией, мембранной ультрафильтрацией, осаждением органическим растворителем или подобными способами.
ПРИМЕРЫ
Далее в настоящем документе настоящее изобретение описано конкретно в качестве примеров, но область техники по настоящему изобретению не ограничена данными приведенными примерами. Также все генетические манипуляции можно осуществлять так, как описано в Molecular Cloning (Cold Spring Harbor Laboratory Press (1989)).
Пример 1
Получение мутантного штамма Rhizomucor miehei, который продуцирует протеазу с увеличенным отношением C/P
Родительский штамм Rhizomucor miehei (CBS182-67 (производный штамм от ATCC16457)), который продуцирует протеазу, подвергали процессу мутагенеза, таким образом получали мутантный штамм, который секретирует протеазу с увеличенным отношением C/P. Детали приведены ниже.
(1) Процесс мутагенеза
Родительский штамм Rhizomucor miehei выращивали на планшетах с солодом (2% экстракта солода, 2% глюкозы, 0,1% пептона, 2% агара) и оставляли на время от 3 суток до 1 недели при 37°C для обеспечения образования спор. Данные споры суспендировали в стерильной воде с помощью устройства для суспендирования из стекла.
К данной суспензии, содержащей споры, добавляли нитрозогуанидин (N-метил-N'-нитро-N-нитрозогуанидин, производимый SIGMA CHEMICAL CO.) до конечной концентрации 200 мкг/мл. Смесь оставляли при комнатной температуре на 5-20 минут, так что коэффициент смертности составил 90%. Подходящее количество данной смеси помещали на планшет с солодом и полученный в результате этого планшет хранили при 37°C. На следующий день каждый кластер полученной небольшой грибной гифы вносили в 8 мл среды для культивирования YPD (1% дрожжевого экстракта, 2% пептона, 2% глюкозы) и супернатант культуры после культивирования при 37°C в течение 4 суток использовали как образец для измерения активности протеазы (PA) и молокосвертывающий активности (MCA). Клетки хранили при -80°C.
(2) Поиск протеазы усовершенствованного типа
В результате измерения MCA и PA с помощью описанного выше способа получили протеазу усовершенствованного типа с PA намного меньше, чем PA родительского штамма, а отношение C/P (MCA/PA) существенно выше в 4,6 раз по сравнению с родительским штаммом.
Пример 2
Выделение гена протеазы из мутантного штамма
(1) Получение хромосомной ДНК мутантного штамма и родительского штамма
Полученный в примере 1 мутантный штамм и родительский штамм выращивали на планшете с солодом и хранили при 37°C в течение от трех суток до одной недели для обеспечения образования спор. Полученные споры суспендировали в стерильной воде с помощью устройства для суспендирования из стекла. Полученную суспензию, содержащую споры, засевали в 20