Способ лазерного слияния бластомеров внутри ранних доимплантационных эмбрионов млекопитающих без нарушения их целостности
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способам слияния эмбриональных клеток, конкретно к лазерному слиянию бластомеров внутри ранних доимплантационных эмбрионов млекопитающих без нарушения их целостности. Предложен способ лазерного слияния бластомеров внутри 4-клеточного мышиного эмбриона без нарушения его целостности, включающий выведение эмбриона на экран монитора и облучение лазерными импульсами визуально выбранной точки на линии плотного контакта бластомеров внутри эмбриона. Слиянию подвергают либо два бластомера внутри 4-клеточного эмбриона с образованием эмбриона из трех клеток, одна из которых тетраплоидная, либо последовательно две пары бластомеров с образованием эмбриона из двух тетраплоидных клеток, либо последовательно три бластомера с образованием эмбриона из двух клеток разного размера: гексаплоидной и интактной диплоидной. Облучение осуществляют последовательностью фемтосекундных лазерных импульсов с длиной волны 800 нм при частоте повторения 80 МГц мощностью 0,06-0,12 Вт и длительностью последовательности 10-30 мс. Для нахождения области наиболее плотного контакта бластомеров внутри эмбриона используют лазерный пинцет, позволяющий перемещать и поворачивать эмбрион на экране монитора. Способ позволяет воздействием фемтосекундного лазерного облучения проводить успешное слияние бластомеров внутри 4-клеточного мышиного эмбриона без нарушения его целостности с получением различных по структуре эмбрионов, содержащих клетки различной плоидности. Изобретение может быть использовано для повышения эффективности реконструирования эмбрионов. 1 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к области биотехнологии, а именно к способам слияния эмбриональных клеток, конкретно к лазерному слиянию бластомеров внутри ранних доимплантационных эмбрионов млекопитающих без нарушения их целостности, и может быть использовано для повышения эффективности реконструирования эмбрионов.
В настоящее время широко известно несколько способов слияния клеток. Первоначально при реконструировании животных клеток использовали химический способ слияния клеток - путем воздействия либо полиэтиленгликолем (Eglitis М.А. Formation of tetraploid mouse blastocysts following blastomere fusion with polyethylene glycol. J. Exp.Zool. 1980, 213(2), 309-313; Spindle A. Polyethylene glycol induced fusion of two-cell mouse embryo blastomeres. Exp.Cell. Res. 1981, 131(2), 465-470), либо инактивированным вирусом Сендай (O'Neill G.T., Speirs S., Kaufman M.H. Sex-chromosome constitution of postimplantation tetraploid mouse embryos. Cytogenet Cell Genet. 1990, 53(4), 191-195). Этот способ имел существенные недостатки, поэтому велись поиски новых более приемлемых способов слияния клеток.
Позднее для слияния растительных и животных клеток был разработан способ, основанный на использовании электрического тока. Принцип способа электростимулируемого слияния клеток основан на создании электрического пробоя, то есть резкого (шокового) увеличения проводимости и проницаемости клеточных мембран в электрическом поле постоянного тока с образованием в них сквозных пор, обеспечивающих слияние цитоплазмы. Электрослияние является весьма популярным методом, и, в частности, было использовано для слияния бластомеров 2-х клеточных эмбрионов животных (см., например, Kubiak J.Z., Tarkowski А.К. Electro fusion of mouse blastomeres. Exp.Cell. Res. 1985 Apr., 157(2), 561-566). Однако метод электрослияния имеет ряд недостатков. Главный из них -невозможность слияния определенных клеток внутри таких многоклеточных структур, как доимплантационные эмбрионы. Кроме того, электрослияние приводит к значительному снижению жизнеспособности реконструированных эмбрионов - повреждающий эффект электрического поля недавно был продемонстрирован на ооцитах, зиготах и 2-х клеточных эмбрионах крыс и мышей (Popova Е., Bader М., Krivokharchenko A. Effects of electric field on early preimplantation development in vitro in mice and rats. Hum. Reprod. 2011, 26(3), 662-670).
Наименее травматичным вмешательством в клетку являются оптические способы воздействия. Одним из первых это предложил и осуществил с помощью сфокусированного ультрафиолетового излучения известный биофизик С.С.Чахотин (Чахотин С.С.Цитология. 1959. Т.1, №6, с.614-626). С появлением лазеров оптические приемы воздействия на клетку получили дальнейшее развитие (Сахаров В.Н. Успехи соврем, биологии. 1972. Т. 73, №2, с.231-249; Liov L. et al. Hum. Reprod. 1996. V.11, p.1273-1280). Однако для слияния эмбриональных клеток лазерные технологии начали применяться лишь недавно. Получены данные успешного лазерного слияния мышиных ооцитов с соматическими кумулюсными клетками (А.К. Шахбазян, А.В. Карменян и др. ДАН, Клет. Биол. 2009, том 429, №4, с.550-553) и позднее бластомеров двухклеточного партеногенетического эмбриона свиней (Kuetemeyer К. et al. J.Biomed. Opt. 2011, 16(8), 088001).
Наиболее близким к предлагаемому способу лазерного слияния бластомеров внутри ранних доимплантационных эмбрионов млекопитающих без нарушения их целостности является способ лазерного слияния двух бластомеров внутри двухклеточного мышиного эмбриона, описанный в работе: Karmenyan A.V., Shakhbazyan А.К., Sviridova-Chailakhyan Т.А., Krivokharchenko A.S., Chiou A.E., Chailakhyan L.M. Use of picosecond infrared laser for micromanipulation of early mammalian embryos. Mol. Reprod. Dev. 2009, 76(10), 975-983 (прототип). В способе-прототипе использовался инвертированный микроскоп "Olympus 1X71" (Япония), сопряженный с лазером Tsunami ("Spectra Physics", США). В данной работе были проведены экспериментальные исследования влияния условий лазерного облучения на эффективность процесса слияния двух бластомеров и на дальнейшую жизнеспособность полученной слитой клетки. Было установлено, что для повышения эффективности слияния лазерный луч необходимо фокусировать на середине линии плотного контакта бластомеров, параметры воздействия лазером Tsunami при этом были выбраны следующие: пикосекундный режим работы с длительностью импульса 2 пс на длине волны 800 нм, частота повторения 80 МГц, мощность излучения от 0.08 до 0.80 Вт, длительность последовательности лазерных импульсов от миллисекунд до секунд.
Способ-прототип позволяет проводить достаточно эффективное слияние двух бластомеров внутри двухклеточного мышиного эмбриона и получать при культивировании in vitro жизнеспособные тетраплоидные бластоцисты, но из-за использования пикосекундного лазера способ-прототип не пригоден для слияния более мелких бластомеров внутри 4-клеточных эмбрионов.
Задачей изобретения является разработка эффективного способа лазерного слияния бластомеров внутри ранних доимплантационных эмбрионов млекопитающих на примере мышиных эмбрионов без нарушения их целостности, который позволит осуществлять слияние двух и трех бластомеров внутри 4-клеточного эмбриона без нарушения его целостности и дальнейшей жизнеспособности.
Решение поставленной задачи достигается предлагаемым способом лазерного слияния бластомеров внутри ранних доимплантационных мышиных эмбрионов без нарушения их целостности, включающим выведение мышиного эмбриона на экран монитора и облучение лазерными импульсами с длиной волны 800 нм при частоте повторения 80 МГц визуально выбранной точки на линии плотного контакта бластомеров внутри мышиного эмбриона, в котором в качестве раннего доимплантационного мышиного эмбриона используют мышиный эмбрион на стадии 4-х клеток, слиянию подвергают либо два бластомера внутри четырехклеточного эмбриона с образованием эмбриона из трех клеток, одна из которых тетраплоидная, либо последовательно две пары бластомеров с образованием эмбриона из двух тетраплоидных клеток, либо последовательно три бластомера с образованием эмбриона из двух клеток разного размера: гексаплоидной и интактной диплоидной, облучение осуществляют последовательностью фемтосекундных лазерных импульсов с мощностью 0,06-0,12 Вт длительностью 10-30 мс и для нахождения области наиболее плотного контакта бластомеров внутри эмбриона используют лазерный пинцет, позволяющий перемещать и поворачивать эмбрион на экране монитора.
Визуально выбираемую точку для облучения лазерным импульсом желательно выбирать на середине линии плотного контакта бластомеров внутри эмбриона.
Получение полиплоидных клеток (бластомеров) при слиянии бластомеров внутри эмбрионов на ранней стадии их развития является важной исследовательской задачей, так как позволяет создавать уникальные модели для изучения влияния различных типов полиплодии на развитие эмбриона.
Слияние бластомеров внутри 4-клеточного эмбриона осложняется уменьшением размера клеток по сравнению с 2-клеточным эмбрионом и объемным характером 4-клеточной структуры эмбриона. При микроманипуляциях с клеткой внутри четырехклеточного эмбриона легко повредить соседние бластомеры, что исключает использование метода электрослияния (будут сливаться все четыре бластомера с образованием нежизнеспособной клетки) и затрудняет лазерное слияние.
Многолетние исследования авторов данного изобретения по использованию лазерных технологий в клеточной инженерии (А.К. Шахбазян и др. ДАН, Клет. Биол. 2009, том 428, №3, с.1-4; А.К. Шахбазян, А.В. Карменян и др. ДАН, Клет. Биол. 2009, том 429, №4, с.550-553; Karmenyan A.V. et al. Mol. Reprod. Dev. 2009, 76(10), p.975-83 и др.) позволили разработать заявляемый способ.
Предлагаемый способ на примере мышиных эмбрионов осуществляют следующим образом.
Мышиные эмбрионы на стадии 4-х клеток либо непосредственно достают из яйцевода, либо культивируют in vitro до стадии 4-х клеток из зиготы или из двухклеточных эмбрионов. Четырехклеточные мышиные эмбрионы помещают в экспериментальную камеру из двух покровных стекол (Свиридова-Чайлахян Т.А. и др. ДАН, 2005. Т. 404, №3, с.422-424). Один из эмбрионов выводят на экран монитора и находят визуально область наиболее плотного контакта двух или трех бластомеров внутри эмбриона, для чего при помощи лазерного пинцета эмбрион поворачивают и перемещают. Для лазерного облучения визуально выбирают точку по возможности ближе к середине линии плотного контакта бластомеров. Для слияния двух или трех бластомеров внутри 4-клеточного эмбриона достаточно однократного облучения выбранной точки последовательностью фемто-секундных лазерных импульсов с длиной волны 800 нм при частоте повторения 80 МГц с мощностью 0,06-0,12 Вт и длительностью последовательности 10-30 мс. Все манипуляции проводят в среде М2.
Успешность слияния, то есть наличие двух или трех ядер в одном полученном при слиянии цитопласте (экспериментальном бластомере), подтверждалась путем окрашивания ядерной ДНК витальным красителем Хекст 33342 и наблюдением флуоресценции в УФ-свете. Жизнеспособность экспериментальных эмбрионов оценивалась культивированием in vitro до стадии бластоцисты, при этом способность эмбрионов со слитыми бластомерами развиваться in vitro до стадии бластоцисты была сопоставима с жизнеспособностью контрольных не обработанных лазером эмбрионов.
На прилагаемых рисунках приведены результаты примеров осуществления заявляемого способа. В экспериментах были использованы самцы мышей СВА в возрасте 3-4 мес и самки C57BL/6 в возрасте 1,5-2,5 мес. Суперовуляцию самок C57BL/6 проводили по стандартной методике путем внутрибрюшинной инъекции гормонов PMSG и hCG ("Sigma") (Karmenyan A.V. at al. Mol. Reprod. Dev. 2009, 76(10), 975-983).
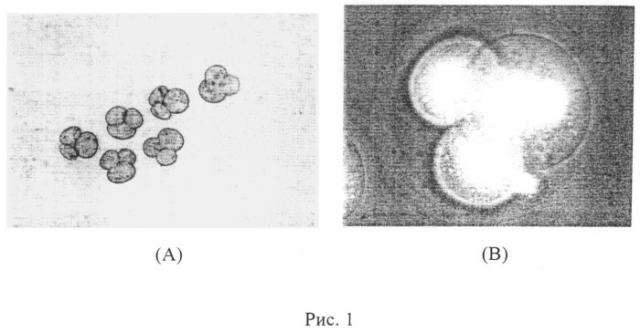
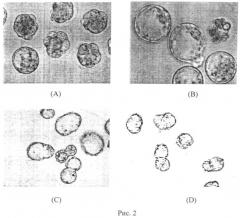
На рис.1 показано слияние двух бластомеров внутри 4-клеточного эмбриона: (А) трехклеточные эмбрионы, полученные при слиянии двух бластомеров внутри 4-клеточного эмбриона; (В) окрашивание ядерной ДНК красителем Хекст 33342 демонстрирует наличие двух ядер в одном цитопласте - в одном из бластомеров полученного трехклеточного эмбриона. Слияние двух бластомеров внутри 4-клеточных эмбрионов, подвергнутых воздействию лазерным облучением, наблюдали в 61,5% (32\52) эмбрионов, и 78,1% (25\32) из них достигли стадий бластоцисты при культивировании. (Из контрольной группы 4-клеточных эмбрионов, не подвергавшихся облучению, стадии бластоцисты достигали 80%). Некоторые из бластоцист вылуплялись из прозрачной оболочки, что подтверждает их высокую жизнеспособность. На рис.2 показано развитие in vitro полученных 3-клеточных эмбрионов с двумя слившимися бластомерами: (А) морулы и ранние бластоцисты; (В) экспандированные бластоцисты; (С) вылупление бластоцист из прозрачной оболочки; (D) вылупляющиеся и вылупившиеся бластоцисты.
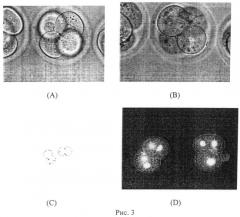
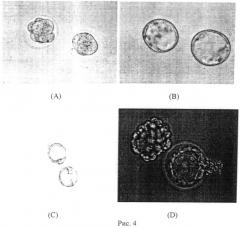
На рис.3 приведены результаты лазерного слияния двух пар бластомеров внутри 4-клеточного эмбриона. Пары бластомеров сливались последовательно с получением 2-клеточных эмбрионов с тетраплоидными бластомерами: (А) слияние первой пары бластомеров; (В) слияние второй пары бластомеров; (С) полученные 2-клеточные эмбрионы; (D) окрашивание красителем Хекст 33342 подтверждает наличие двух ядер в каждом бластомере. Эффективность слияния составила 52.2% (12\23). В результате in vitro культивирования полученных 2-х клеточных эмбрионов 90% (9\10) из них достигали стадии бластоцисты, и некоторые из них вылуплялись из zona pellucida (из прозрачной оболочки): см. на рис.4 - (А) компактные морулы; (В) экспандированные бластоцисты. (С) начало вылупления бластоцист; (D) вылупляющиеся и вылупившиеся бластоцисты.
На рис.5 приведены результаты лазерного слияния трех бластомеров внутри 4-клеточного эмбриона: (А) эмбрион на стадии 4-клеток с видимым контактом между тремя бластомерами; (В) эмбрион с одним нормальным и одним большим бластомером, полученным путем слияния трех бластомеров; (С) окрашивание красителем Хекст 33342 подтверждает наличие трех ядер в большом бластомере. Успешное слияние трех бластомеров внутри 4-клеточного эмбриона наблюдали в 44.4% случаев (8\18), при культивировании in vitro полученных 2-клеточных эмбрионов половина из них (3\6) развились до стадии бластоцисты. На рис.6 показано: (А) начало деления полученных эмбрионов, состоящих из двух клеток разного размера: гексаплоидной (полученной слиянием трех бластомеров) и интактной диплоидной; (В) морулы и ранние бластоцисты; (С) экспандированная и средние бластоцисты.
Таким образом, из приведенных примеров видно, что предлагаемый способ позволяет воздействием фемтосекундного лазерного облучения проводить успешное слияние бластомеров внутри 4-клеточного мышиного эмбриона без повреждения его наружной оболочки и без нарушения его целостности с получением различных по структуре эмбрионов, содержащих клетки различной плоидности. Культивирование in vitro полученных экспериментальных эмбрионов до стадии бластоцисты (вплоть до вылупляющихся и вылупившихся бластоцист) подтверждает их жизнеспособность.
1. Способ лазерного слияния бластомеров внутри ранних доимплантационных мышиных эмбрионов без нарушения их целостности, включающий выведение мышиного эмбриона на экран монитора и облучение лазерными импульсами с длиной волны 800 нм при частоте повторения 80 МГц визуально выбранной точки на линии плотного контакта бластомеров внутри мышиного эмбриона, отличающийся тем, что в качестве раннего доимплантационного мышиного эмбриона используют мышиный эмбрион на стадии 4-х клеток, слиянию подвергают либо два бластомера внутри четырехклеточного эмбриона с образованием эмбриона из трех клеток, одна из которых тетраплоидная, либо последовательно две пары бластомеров с образованием эмбриона из двух тетраплоидных клеток, либо последовательно три бластомера с образованием эмбриона из двух клеток разного размера: гексаплоидной и интактной диплоидной, облучение осуществляют последовательностью фемтосекундных лазерных импульсов с мощностью 0,06-0,12 Вт длительностью 10-30 мс и для нахождения области наиболее плотного контакта бластомеров внутри эмбриона используют лазерный пинцет, позволяющий перемещать и поворачивать эмбрион на экране монитора.
2. Способ по п.1, отличающийся тем, что визуально выбираемую точку для облучения лазерным импульсом выбирают на середине линии плотного контакта бластомеров внутри эмбриона.