Способ моделирования костной кристаллизации при коксартрозе in vitro
Иллюстрации
Показать всеИзобретение относится к области экспериментальной медицины, в частности к области травматологии и ортопедии и конкретно к методам моделирования патологических процессов образования минеральных фаз при костных заболеваниях. Способ включает получение минеральных фаз, составляющих основу неорганического матрикса костной ткани человека в искусственно созданной среде, приближенной к таковой у людей, больных коксартрозом. При этом готовят указанную модельную среду при pH 7,80+0,05. Среда имеет следующий состав: CaCl2 - 1.1766 г/л, Na2HPO4·12H2O - 6.5514 г/л, NaCl - 3.1892 г/л, MgCl2·6H2O - 0.4764 г/л, NaHCO3 - 2.2680 г/л, Na2SO4 - 1.6188 г/л, KCl - 0.3427 г/л. Через 30 дней проводят определение в этой среде гидроксилапатита, близкого по составу к апатиту межклеточного вещества костной ткани больных коксартрозом. Моделирование костной минерализации при коксартрозе in vitro и выявление условий, способствующих осаждению минеральных фаз в суставной синовиальной жидкости человека, позволяет разработать эффективные способы предотвращения и развития данного заболевания. 3 табл., 4 ил.
Реферат
Область техники.
Изобретение относится к области экспериментальной медицине, в частности к области травматологии и ортопедии, и конкретно к методам моделирования патологических процессов образования минеральных фаз при костных заболеваниях.
Уровень техники.
Одно из первых мест по тяжелому течению и последствиям среди заболеваний опорно-двигательной системы человека занимает деформирующий артроз тазобедренного сустава (коксартроз). На его долю приходится от 4% до 20% патологии опоры движения, а частота встречаемости составляет от 15 до 17,8 на 10000 взрослого человека, причем увеличивается с возрастом (Сидоренко О.А. Социально-гигиенические особенности заболеваемости и оценка эффективности больных с патологией крупных суставов: Автореф. Дис. … к.м.н. Новосибирск, 2002, 23 с.; Егоров К.С. Прогнозирование соматического состояния пациентов с коксартрозом до и после эндопротезирования тазобедренного сустава: Автореф. Дисс. …к.м.н. СПб., 2010, 30 с.).
В литературе отсутствует единое мнение о патогенезе дегенеративно-дистрофических изменений при коксартрозе. Исследователи в развитии дегенеративно-дистрофических изменений отводят доминирующую роль разным составляющим тазобедренного сустава: хрящевой ткани (Астапенко М.Г., Баятова В.К. Современное состояние проблемы деформирующего артроза // Ревматология. 1984. №2. С.61.), костной ткани (Sharma L. Local Factors in osteoarthritis // Curr Opin Rheumatol, 2001, V.13, №5, P.44-446; Шацилло О.И. Костно-хрящевая аутопластика в лечении метатуберкулезного коксартроза и асептического некроза головки бедренной кости. Дисс. д.м.н. СПб., 1998, 320 с.), как хрящевой, так и костной тканям (Лунева С.Н. Биохимические изменения в тканях суставов при дегенеративно-дистрофических заболеваниях и способы биологической коррекции. Дисс. … д.б.н. Тюмень: Тюменский гос. университет, 2003, 297 с.), синовиальной жидкости, заполняющей полость сустава (Матвеева Е.Л. Биохимические изменения в синовиальной жидкости при развитии дегенеративно-дистрофических процессов в коленном суставе: Автореф. Дисс. … д.б.н. Тюмень: Тюменский гос. университет, 2007, 24 с.). Незначительно освещен вопрос о состоянии и образовании минеральной и органической компонент межклеточного вещества костной ткани головки бедренной кости при данной патологии.
На сегодняшний день для исследования патогенеза артроза широкое распространение получили способы моделирования клинической картины на животных путем введения внутрисуставной инъекции (патент RU 2117997 С1, МПК G09B 23/28, 17.11.1994; патент RU 2237928 С2, МПК G09B 23/2, 16.12.2002; заявка на изобретение 2002133907 А, МПК G09B 23/28), создания внешней нагрузки на кость в состоянии наркоза (заявка на изобретение RU 2010124506, МПК G09B 23/28 (2006.01), 15.06.2010). Ценность этих способов не вызывает сомнений, однако, они труднодоступны для широкой клинической практики. Недостатком этих моделей является, то, что они созданы в рамках живого организма животных, что не позволяет исследовать патогенез коксартроза на молекулярном уровне структурной организации костной ткани человека (Königsberger Е., Konigsberger L. Biomineralization - Medical Aspects of Solubility / John Wiley & Sons Ltd. The Atrium, Southern Gate, Chichester, West Sussex PO19 8SQ, England, 2006, 312 p. Weiner S., Addadi L., Wagner H.D. Materials design in biology // Materials Science and Engineering C, 2000, V.11, P.1-8), а именно детально изучить процессы преобразования минеральной (гидроксилапатита) и органической (коллагеновой матрицы) компонент межклеточного вещества костного матрикса, сущности фазообразования при костной минерализации, возможных фазовых переходов и химических превращений с учетом различного состояния биологических жидкостей (межклеточной и синовиальной), контактирующих с костной тканью при коксартрозе. Сложность большинства реальных физико-химических процессов не позволяет решить описанные проблемы в in vivo. Их изучение становиться возможным в искусственно созданной модельной системе, приближенной к физиологической среде.
Известен способ моделирования процесса образования зубного камня, образующегося в результате преципитации из слюны фосфатов и карбонатов кальция и магния в органическую матрицу зубного камня, являющуюся ядром образования. Сущность его заключается в выращивании зубного камня путем помещения здорового зуба в искусственно созданной модельной среде, близкой по составу к ротовой жидкости людей, имеющих зубные отложения (патент RU 2007113160 А, МПК G09B 23/28 (2006.01), 09.04.2007). К преимуществам данного способа относится возможность изучения патологических процессов, протекающих в полости рта человека. Это позволяет выявить причины развития и течения заболевания, следовательно, разработать эффективные методы его лечения.
Основными недостатками этой модели является то, что она позволяет исследовать лишь патологические процессы, протекающие в полости рта человека, в частности, при образовании зубного налета и росте зубного камня. Указанные недостатки связаны с тем, что минералообразующей средой в данном случае выступает смешанная слюна, отличающаяся от суставной синовиальной жидкости широким диапазоном значений pH (5,6-7,6), содержанием всех неорганических ионов, а также наличием в составе хлорид- и роданид ионов (Забросаева Л.И., Козлов Н.Б. Биохимия слюны. Омск, 1992, 44 с.).
Существует способ получения биосовместимых материалов для замещения костной ткани в среде синтетической жидкости (SBF), моделирующей состав плазмы крови человека (Jalota S., Bhaduri S.B., Tas A.C. Using a synthetic body fluid (SBF) solution of 27 mM HCO3 - to make bone substitutes more osteointegrative // Materials Science and Engineering, V.28, 2008, P.129-140). По данному способу синтез биоматериалов осуществлялся путем выдерживания коллагеновых губок (коллаген I типа) в растворе близком по составу и содержанию неорганических ионов к плазме крови человека при физиологических значениях температуры 37°C и pH=7,4 в течение 7 дней. При этом стабилизация pH модельного SBF раствора проводилась при помощи буферной смеси трис-гидрокиметил-аминометана и соляной кислоты (Трис-HCl), что также позволило провести эксперимент при постоянной концентрации одного из важных ионов плазмы крови HCO3 - (27 ммоль/л). Способ позволяет получить композиты коллаген-апатит-фосфат кальция (коллаген-Ap-Cap) с наноразмерами частиц и высокой площадью поверхности, что способствует улучшению остеогенеза при замещении костных дефектов в живом организме. К недостаткам его следует отнести отсутствие возможности изучения различных патологических процессов, протекающих в костных тканях при костных заболеваниях. Данный способ не связывал их течение, в частности костную минерализацию при коксартрозе с изменением состава биологической жидкости (например, влияние концентрации сульфат-ионов), а также не моделировал биологическую систему при костных патологиях.
Задачей заявляемого изобретения является разработка способа экспериментального моделирования процесса патологической костной минерализации в суставах при коксартрозе, выявление условий, способствующих осаждению минеральных фаз (отличных по составу от костной ткани) в суставной синовиальной жидкости человека с целью выработки рациональных профилактических, диагностических и лечебно-восстановительных мер по предотвращению и развитию данного заболевания.
Указанный технический результат достигается тем, что в способе моделирования костной минерализации при коксартрозе в in vitro, используя литературные данные по электролитному составу и pH синовиальной жидкости у людей больных коксартрозом и людей, не имеющих костных патологий (контрольная группа) (Матвеева E.Л. Биохимические изменения в синовиальной жидкости при развитии дегенеративно-дистрофических процессов в коленном суставе: Автореф. Дисс. … д.б.н. Тюмень: Тюменский гос. университет, 2007, 24 с.; Кирсанов А.И., Долгодворов А.Ф., Леонтьев В.Г., Горбачева И.А., Романова В.Д.. Величко Л.С., Александров В.В. Концентрация химических элементов в разных биологических средах // Клиническая лабораторная диагностика, 2001, №3, С.16-20), проводят термодинамическую оценку вероятности образования малорастворимых соединений; осаждение которых гипотетически возможно в данной биологической среде при минимальных, средних и максимальных концентрациях ионов в широком интервале близком к физиологическим значениям pH=7,00-8,00, устанавливают достоверные отличия состава и последовательности образующихся минеральных фаз из синовиальной жидкости у людей больных коксартрозом и лиц контрольной группы, выявляют значимые параметры, которые способствуют протеканию минерализации в синовиальной жидкости у людей при данном заболевании, на основании полученных данных создают модельные среды и проводят наблюдение в течение длительного времени. Экспериментальное моделирование выполняют при значениях pH и ионной силе раствора, соответствующих синовиальной жидкости группы здоровых людей (pH=7,40±0,05), и отклонениях в щелочную сторону у лиц больных коксартрозом (pH=7,60±0,05 и pH=7,80±0,05). Модельные среды отличаются друг от друга также содержанием осадкообразующих ионов кальция и неорганического фосфора. Создают три модельные среды следующего состава: 1. CaCl2 - 1.3431 г/л, Na2HPO4·12H2O - 7.4822 г/л, MgCl2·6H2O - 0.4764 г/л, NaHCO3 - 2.2680 г/л, Na2SO4 - 1.6188 г/л, KCl - 0.3427 г/л, NaCl - 2.8798 г/л; 2. CaCl2 - 1.2432 г/л, Na2HPO4·12H2O - 6.9452 г/л, NaCl - 2.8798 г/л, другие вещества как в модельной среде 1; 3. CaCl2 - 1.1766 г/л, Na2HPO4·12H2O - 6.5514 г/л, NaCl - 3.1892 г/л, другие вещества как в модельной среде 1 и 2. Через месяц в модельных системах 1 и 2 образуется плохо окристаллизованный гидроксилапатит с примесями разных неорганических фаз, а в модельной системе 3 - гидроксилапатит, близкий по составу к апатиту межклеточного вещества (матрикса) костной ткани людей больных коксартрозом.
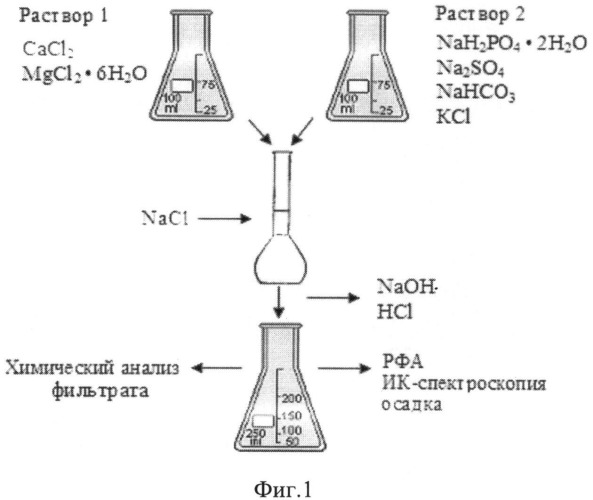
Способ поясняется иллюстрациями:
фигура 1 - схема модельного эксперимента in vitro;
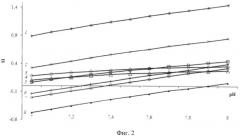
фигура 2 - зависимость индексов пересыщения от рН раствора для средних значений диапазона концентраций синовиальной жидкости малорастворимых соединений: Са10(PO4)6(ОН)2 (1); β - Са3(PO4)2 (2); MgHPO4·3H2O (3); CaHPO4·2H2O (4); Ca4H(PO4)3·2.5 H2O (5); СаСО3 - кальцит (6); CaCO3 - арагонит (7); α - Са3(PO4)2 (8);
фигура 3 - зависимость изменения энергий Гиббса кристаллизации от pH раствора для средних значений диапазона концентраций синовиальной жидкости малорастворимых соединений: Са10(РО4)6(ОН)2 (1); β - Са3(PO4)2 (2); MgHPO4·3H2O (3); CaHPO4·2H2O (4); Са4Н(PO4)3·2.5 H2O (5); CaCO3 - кальцит (6); CaCO3 - арагонит (7); α - Са3(PO4)2 (8);
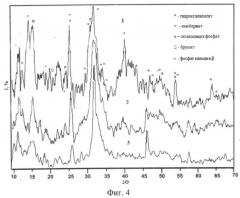
фигура 4 - дифрактограммы образцов, синтезированных при pH=7,4 (1); 7,6 (2); 7,8 (3).
Способ осуществляется следующим образом.
Для оценки возможности образования труднорастворимого соединения из прототипов синовиальной жидкости проведены термодинамические расчеты индексов пересыщения (SI) [Mullin J.W. Crystallization. Butterworth-Heinemann. Oxford, 1993, P.118-122] и изменений энергий Гиббса кристаллизации (ΔG) [Koutsopoulos S. Hydroxyapatite crystallization in the presence of serine, tyrosine and hydroxyproline amino acids with polar side groups / S. Koutsopoulos, E. Dalas // Journal of Crystal Growth, 2000, №216, P.443-449] для малорастворимых вещест, образование которых гипотетически возможно в модельных системах Са10(РО4)6(ОН)2 (гидроксилапатит), β - Са3(РО4)2 (витлокит), Са4Н(РО4)3·2,5Н2О (октакальция фосфат), α - Са3(РО4)2, MgHPO4·3H2O (ньюбериит), MgCO3·3H2O, Mg3(PO4)2, CaSO4, СаНРО4·2Н2О (брушит), СаСО3 (кальцит), СаСО3 (арагонит), Са(Н2РО4)2·Н2О и Са(Н2РО4)2.
Согласно результатам проведенных расчетов установлено, что в исследуемом диапазоне pH в прототипах синовиальной жидкости термодинамически возможно образование следующих соединений (табл.1): Са10(РО4)6(ОН)2, β - Са3(РО4)2, MgHPO4·3H2O, Са4Н(РО4)3·2.5Н2О, СаНРО4·2Н2О, СаСО3 - кальцит, СаСО3 - арагонит, α - Ca3(PO4)2. При этом для каждой системы значения pH начала осаждения твердых фаз различны.
| Таблица 1 | ||||||||||
| Диапазоны значений pH, индексов пересыщения и изменений энергии Гиббса кристаллизации (кДж/моль) образования твердых фаз в модельных растворах при различных концентрациях неорганических ионов, ммоль/л | ||||||||||
| Минимальные | Средние | Максимальные | ||||||||
| № | Соединение | концентрации | концентрации | концентрации | ||||||
| pH | IS | -ΔG | pH | IS | -ΔG | pH | IS | -ΔG | ||
| 1 | Са10(РО4)6(ОН)2 | 7,00-8,00 | 0,80-1,36 | 4,17-7,11 | 7,00-8,00 | 0,89-1,45 | 4,66-7,60 | 7,00 8,00 | 0,95-1,51 | 4,93-7,90 |
| 2 | β-Са3(РО4)2 | 7,00-8,00 | 0,21-0,75 | 1,07-3,90 | 7,00-8,00 | 0,32-0,86 | 1,65-4,48 | 7,00 8,00 | 0,39-0,93 | 2,01 -4,84 |
| 3 | Са4Н(РО4)3·2.5Н2О | 7,10-8,00 | 0,01-0,34 | 0,02-1,8 | 7,00-8,00 | 0,06-0,45 | 0,33-2,33 | 7,00 8,00 | 0,13-0,51 | 0,65 -2,65 |
| MgHPO4-3H2O | 7,00-8,00 | 0,07-0,24 | 0,36-1,28 | 7,00-8,00 | 0,18-0,36 | 0,95-1,88 | 7,00 -8,00 | 0,25 -0,42 | 1,3-2,22 | |
| 4 | ||||||||||
| CaHPO42H2O | 7,15-8,00 | 0,01-0,14 | 0,01-7,10 | 7,00-8,00 | 0,10-0,28 | 0,52-1,44 | 7,00 -8,00 | 0,19 -0,36 | 0,97-1,90 | |
| 5 | ||||||||||
| СаСО3 (кальцит) | 7,33-8.00 | 0,01-0,36 | 0,02-1,88 | 7,26-8.00 | 0,01-0,40 | 0,006 -2.07 | 7,21 -8,00 | 0,01 -0,43 | 0,02-2,23 | |
| 6 | ||||||||||
| СаСО3 (арагонит) | 7,45-8,00 | 7,45-0,30 | 0,02-1,53 | 7,38-8,00 | 0,01-0,33 | 0,01-1,73 | 7,33 -8,00 | 0,01 -0,36 | 0,02-1,89 | |
| 7 | ||||||||||
| α-Са3(РО4)2 | - | - | - | 7,89-8,00 | 0,01-0,06 | 0,01-0,30 | 7,75 -8,00 | 0,01 -0,13 | 0,02-6,60 | |
| 8 |
Для наглядного сопоставления индексов пересыщения и изменений энергий Гиббса кристаллизации для трех модельных систем при соответствующих значениях pH=7,4; pH=7,6 и pH=7,8 в рамках единого координатного пространства строились графические функциональные зависимости вида SI=ƒ(pH) и ΔG=ƒ(pH) (фиг.2, 3). Установлено, что наибольшая термодинамическая вероятность образования в прототипах синовиальной жидкости характерна для гидроксилапатита, который является основным компонентом межклеточного вещества костной ткани человека. Величины термодинамических параметров (SI и ΔG) данной малорастворимой фазы отличаются от других в 1,6 и более раз, что в большей степени проявляется при большем значении pH=7,8 (табл.1).
Из данных фиг.2 и фиг.3 следует, что в модельных условиях устойчивой фазой является витлокит β-Са3(PO4)2, который в костной минерализации выступает фазой-предшественником образования гидрокислапатита. При этом осаждение α-Са3(PO4)2 и карбонатов кальция маловероятно, остальные соединения обладают промежуточной устойчивостью и степень их участия в формировании неорганической компоненты межклеточного матрикса костной ткани зависит от концентрации осадкообразующих ионов, ионной силы, кислотности моделируемой среды.
При pH=7,40±0,05 модельного раствора термодинамическая вероятность образования убывает в ряду MgHPO4·3H2O>Са4Н(PO4)3·2.5H2O>CaHPO4-2H2O и аналогична для всего рассматриваемого диапазона концентраций (табл.2). Это указывает, на то, что при данном значении pH среды влиянием ионной силы можно пренебречь.
| Таблица 2 | ||||||||||
| Значения индексов пересыщения труднорастворимых соединений модельных растворов при различных значениях pH и минимальных (1), средних (2), максимальных (3) концентрациях неорганических ионов, ммоль/л | ||||||||||
| № | pH | 7,4 | 7,6 | 7,8 | ||||||
| Концентрации∗ | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| 1 | Са10(PO4)6(ОН)2 | 1,04 | 1,14 | 1,2 | 1,15 | 1,25 | 1,31 | 1,26 | 1.35 | 1,41 |
| 2 | β-Са3(PO4)2 | 0,45 | 0,56 | 0,63 | 0,55 | 0,66 | 0,73 | 0,65 | 0,76 | 0,83 |
| 3 | Са4Н(PO4)3·2,5 H2O | 0,14 | 0,24 | 0,3 | 0,21 | 0,31 | 0,38 | 0,28 | 0,38 | 0,44 |
| 4 | MgHPO4·3H2O | 0,17 | 0,28 | 0,35 | 0,2 | 0,32 | 0,38 | 0,23 | 0,34 | 0,41 |
| 5 | CaHPO4·2H2O | 0,06 | 0,2 | 0,29 | 0,09 | 0,23 | 0,32 | 0,12 | 0,26 | 0,35 |
| 6 | СаСО3 (кальцит) | 0,05 | 0,08 | 0,11 | 0,15 | 0,19 | 0,22 | 0,26 | 0,29 | 0,32 |
| 7 | СаСО3 (арагонит) | -0,02 | 0,02 | 0,05 | 0,09 | 0,12 | 0,16 | 0,19 | 0,23 | 0,26 |
| 8 | α-Са3(PO4)2 | -0,35 | -0,24 | -0,17 | -0,25 | -0,14 | -0,07 | -0,15 | -0,04 | 0,03 |
С увеличением pH растворов наибольшую термодинамическую устойчивость приобретают фазы, в анионах которых отсутствуют или присутствуют в меньших количествах ионы водорода. Так, при минимальных концентрациях ионов pH=7,60±0,05 фазой предшествующей осаждению ньюбериита является октакальция фосфат, а ньюбериита - брушит: Са4Н(PO4)3·2.5H2O>MgHPO4·3H2O>CaHPO4·2H2O. При pH=7,80±0,05 данная закономерность прослеживается более четко.
С увеличением концентраций ионов в обоих случаях, возрастают силы межионного отталкивания, что приводит к уменьшению коэффициентов активностей и возрастанию вероятности образования наиболее растворимой и термодинамически неустойчивой фазы. Вслед за осаждением Са4Н(PO4)3·2.5H2O отмечается последовательное образование соединений, растворимость которых уменьшается в ряду: MgHPO4·3H2O>CaHPO4·2H2O (табл.2, фиг.2).
Можно предположить, что ключевыми параметрами, которые могут способствовать минерализации в суставной синовиальной жидкости при коксартрозе и, следовательно, развитию данного заболевания являются повышение pH, ионной силы и концентрации осадкообразующих ионов. В этом случае создаются оптимальные условия для образования гидроксилапатита - основной минеральной компоненты межклеточного матрикса костных тканей человека.
Таким образом, установлены факторы, способствующие отклонению параметров синовиальной жидкости от нормы и образованию минеральных фаз в костной ткани суставов с участием этой биологической среды.
Далее для подтверждения результатов термодинамических расчетных осуществили постановку модельного эксперимента. Модельными системами являлись прототипы синовиальной жидкости со средним значением концентраций неорганических ионов при трех значениях pH, соответствующих группе здоровых людей (pH=7,4) и пациентов больных коксартрозом (pH=7,6 и pH=7,8).
Для приготовления модельных растворов использовались соли марки ч.д.а, х.ч. и дистиллированная вода. Соли и их количество подбирались таким образом, чтобы концентрации их ионов в растворе и ионная сила были максимально приближены к данным параметрам моделируемой системы, а именно синовиальной жидкости. При этом полученная ионная сила отличалась от исходного значения не более чем на 0,03. Для каждой серии экспериментов подготовлены растворы, содержащие катионы и анионы, при совместном присутствии которых в данных условиях не образуются малорастворимые соединения (рабочий раствор 1 и 2, фиг.1). После смешения эквивалентных объемов растворов в мерной колбе проводили корректировку достижения заданных значений ионной силы добавлением определенной массы навески кристаллического NaCl и доводили дистиллированной водой до метки. Полученный раствор с pH=7,50±0,05 переливали в коническую колбу с притертой пробкой и корректировали pH до требуемых физиологических значений путем добавления 20%-ного раствора NaOH или концентрированной HCl. С целью предотвращения уменьшения концентрации в растворе карбонат ионов (за счет гидролиза в кислой среде), необходимое количество NaHCO3 добавляли при рН 5,5-6,0. Колбы с готовыми растворами состава: 1. CaCl2 - 1.3431 г/л, Na2HPO4 12H2O - 7.4822 г/л, MgCl2 6H2O - 0.4764 г/л, NaHCO3 - 2.2680 г/л, Na2SO4 - 1.6188 г/л, KCl - 0.3427 г/л, NaCl - 2.8798 г/л; 2. CaCl2 - 1.2432 г/л, Na2HPO4·12H2O - 6.9452 г/л, NaCl - 2.8798 г/л, другие вещества как в модельной среде 1; 3. CaCl2 -1.1766 г/л. Na2HPO4·12H2O - 6.5514 г/л, NaCl - 3.1892 г/л, другие вещества, как в модельной среде 1 и 2.
Закрывали пробками и оставляли для кристаллизации при комнатной температуре на 30 суток.
Для установления фазового и химического состава полученных твердых фаз были использованы методы рентгенофазового анализа (РФА), ИК-спектроскопии и методы химического анализа. Количественное определение катионов и анионов в твердой фазе осуществлялось методом остаточных концентраций по разности начальных и конечных концентраций осадкообразующих ионов в модельном растворе, где анализировалось содержание ионов Са2+, Mg2+ и неорганического фосфора. Определение концентраций Са2+ и Mg2+ осуществлялось согласно РД 52.24.403-2007 [РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титриметрическим методом с трилоном Б], а неорганического фосфора - на основании ГОСТ 18309-72 [ГОСТ 18309-72. Вода питьевая. Метод определения содержания полифосфатов].
Анализ твердых фаз, полученных в ходе моделирования при средних электролитных концентрациях и физиологических значениях pH синовиальной жидкости, подтверждает данные термодинамических расчетов. На рентгенограммах образцов (фиг.4) основной минеральной компонентой является термодинамически стабильная фаза - гидроксилапатит.
При pH=7,4 отмечается присутствие примесных малорастворимых соединений: Са4Н(PO4)3·2.5H2O, MgHPO4·3H2O, CaHPO4·2H2O, β - Са3(PO4)2. С ростом pH их содержание уменьшается и при рН=7,8±0,05 кристаллической составляющей осадков выступает гидроксилапатит. Поэтому можно предположить, что помимо β - Са3(PO4)2, участвующего в костной минерализации фазами-предшественниками образования гидроксилапатита при коксартрозе, могут выступать такие фосфаты кальция, как октакальций фосфат и брушит. Карбонаты кальция на дифрактограммах отсутствуют, причинами чего могут являться небольшие индексы пересыщения этих соединений и малая термодинамическая устойчивость. Данные карбонаты могут выступать источником ионизированных ионов C O 3 2 − замещающих тетраэдры P O 4 3 − в структуре апатита кости [Ньюман У., Ньюман М. Минеральный обмен кости / Перевод с англ. О.Я. Терещенко, Л.Т. Туточкиной. Под ред. Н.Н.Демина. М.: Иностранная литература, 1961, 270 с.], что возможно приводит к снижению кристалличности гидроксилапатита при коксартрозе и отрицательно сказывается на физико-химических свойствах костной ткани головки бедренной кости.
Обработка данных химического анализа показала (табл.3), что наиболее близким к стехиометрическому (Са/Р=1,67) является осадок, кристаллизация которого проходила при pH=7,80±0,05. Данная величина pH соответствует крайнему значению кислотности синовиальной жидкости при коксартрозе.
| Таблица 3 | ||||||||
| Остаточные концентрации и состав твердых фаз при моделировании средних концентраций неорганических ионов и физиологических значений pH синовиальной жидкости человека | ||||||||
| № | pH | Исходные соотношения | Определено в растворе, ммоль/л | Соотношения для твердых фаз | ||||
| Ca/Р | Mg/Ca | Ca2+ | Mg2+ | P O 4 3 − | Ca/Р | Mg/Ca | ||
| 1 | 7,40 | 1,75 | 0,09 | 0,70 | 0,15 | 2,53 | 1,88 | 0,08 |
| 2 | 7,60 | 1,75 | 0,10 | 0,50 | 0,50 | 2,15 | 1,87 | 0,06 |
| 3 | 7,80 | 1,75 | 0,10 | 0,50 | 1,00 | 1,57 | 1,82 | 0,01 |
Коэффициент Ca/Р полученного соединения минимальный, a Mg/Ca меньше по сравнению с другими в 6-8 раз. Это указывает, на то, что практически все ионы магния остались в растворе и не участвовали в образовании твердой фазы. При этом величина атомного соотношения Ca и Р осадка соответствует значению коэффициента Ca/Р, полученного нами при исследовании костных тканей людей больных кокартрозом, т.е. предложенная модельная система позволяет воспроизвести условия, при которых происходит минерализация с участием синовиальной жидкости человека.
Таким образом, заявляемый способ позволяет в модельных условиях выявить параметры, которые при отклонении от нормы приводят к минерализации в костных тканях сустава с участием синовиальной жидкости, и создать модельную систему, с помощью которой можно изучать эффективность воздействия лекарственных препаратов для профилактики и лечения коксартроза.
Способ моделирования процессов костной минерализации, происходящих при коксартрозе ин витро, включающий получение минеральных фаз, составляющих основу неорганического матрикса костной ткани человека в искусственно созданной среде, приближенной к таковой у людей, больных коксартрозом, при этом готовят указанную модельную среду при pH 7,80+0,05 и среда имеет следующий состав: CaCl2 - 1,1766 г/л, Na2HPO4·12H2O - 6,5514 г/л, NaCl - 3,1892 г/л, MgCl2·H2O - 0,4764 г/л, NaHCO3 - 2,2680 г/л, Na2SO4 - 1,6188 г/л, KCl - 0,3427 г/л; через 30 дней проводят определение в этой среде гидроксилапатита, близкого по составу к апатиту межклеточного вещества костной ткани больных коксартрозом.